基于Box-Behnken响应面法优化生乳汤水提取工艺研究*
2022-11-11谭建伟李兰兰朱玉蓉虎亚光
谭建伟,张 睿,李兰兰,朱玉蓉,代 伟,杨 涛,虎亚光
(甘肃省妇幼保健院,甘肃 兰州 730050)
产后缺乳是指妇女产后乳汁量甚少或全无,不能满足婴儿喂养需求,是临床常见疾病,发病率为20%~30%[1]。母乳是婴幼儿最理想的天然食品,母乳喂养可促进婴幼儿生长发育,降低母婴患病风险,改善母婴健康状况[2]。目前我国产后4个月纯母乳喂养率为16%~34.4%,远低于WHO要求的80%。据统计,产后1个月及以后母乳喂养失败因乳量不足约占34.39%[3],防治产后缺乳对提高母乳喂养率具有重要意义。
中医认为导致产后乳汁不足或全无的主要病机为乳汁生化不足或乳络不畅,常见病因有气血虚弱、肝郁气滞及痰湿壅阻等[4-6],治疗产后缺乳以扶正、理血为主,常用中药为当归、王不留行、黄芪、川芎及漏芦[7]。生乳汤主要组成为炙黄芪、漏芦、当归、桔梗、通草、炒王不留行、炙甘草、党参等,诸药合用具有益气养血、通络、疏肝解郁的功效[8-12]。经临床应用发现,生乳汤可有效治疗产后缺乳,缓解产妇泌乳不足的问题。但目前尚未建立生乳汤的提取优化方案及质量控制方法。因此,本研究优化组方提取方法,最大限度提取其有效成分。
1 仪器与材料
1.1 主要仪器Thermo Ultimate 3000型高效液相色谱仪(美国赛默飞公司);SQP型电子分析天平(德国赛多利斯仪器有限公司);TWCL-T型调温磁力加热器(上海予申仪器有限公司);EMS-30型恒温水浴锅(上海乔月电子有限公司);CQ50型超声波清洗机(上海乔跃电子有限公司);202A-00型电热鼓风干燥箱(上海一恒科学仪器有限公司)。
1.2 材料 生地黄(批号:191127)、桔梗(批号:200201)、通草(批号:200405)、炙甘草(批号:200818)、炙黄芪(批号:200705)均购自甘肃康乐药业有限责任公司;漏芦(批号:19061105)、炒王不留行(批号:20010202)均购自兰州安泰堂中药饮片有限公司;党参(批号:200801)购自甘肃和润医药集团有限公司。上述中药材由甘肃省中医院主任中药师李喜香鉴定均为正品。槲皮素标准品(批号:Q111273,纯度≥98.5%)购自上海阿拉丁生化科技股份有限公司;甘草酸标准品(批号:A0810AS,纯度≥98%)购自美仑生物有限公司;色谱纯乙腈(批号:JA107230)购自Merck Millipore公司;色谱纯甲醇(批号:1147507)购自Merck Millipore公司;其余试剂为分析纯;实验用水为超纯水。
2 方法与结果
2.1 槲皮素和甘草酸含量测定
2.1.1 色谱条件 色谱柱:Thermo C18(4.6 mm×150 mm,2.6 μm);流动相为乙腈-0.05 mol/L磷酸盐缓冲液(pH值=3.2),采用梯度洗脱程序:0~5 min,30%乙腈;5~7 min,30%乙腈→50%乙腈;7~9 min,50%乙腈→30%乙腈;流速为1.0 mL/min;柱温为30℃;紫外检测波长为256 nm;进样量为20 μL。
2.1.2 溶液的制备
2.1.2.1 混合对照品溶液的制备 精密称取槲皮素标准品5.44 mg、甘草酸标准品25.15 mg,加甲醇溶解稀释至10 mL,制成每毫升含有槲皮素0.544 mg、甘草酸2.515 mg的混合对照品溶液。混合对照品紫外全波长扫描见图1。

图1 紫外全波长扫描图
2.1.2.2 供试品溶液的制备 按处方比例称取药材,采用水煎法进行提取,提取液烘干得到干浸膏。精密称取200 mg干浸膏,加入5 mL盐酸-甲醇溶液(体积比为1∶4)充分溶解,超声处理15 min后,60℃水浴1 h。取100 μL上清液,甲醇稀释至1 mL,经0.22 μm微孔滤膜过滤后,取续滤液作为供试品溶液。
2.1.2.3 阴性对照品溶液的制备 分别称取除炙黄芪、甘草外的生乳汤组方中其他药材,经水煎提取后,按照“2.1.2.2”项方法制备缺少槲皮素、甘草酸的阴性对照品溶液。
2.1.3 系统适用性试验 分别精密吸取混合对照品溶液、供试品溶液及阴性对照品溶液各20 μL,依次按照“2.1.1”项色谱条件进样测定,记录液相色谱图。阴性对照品在相应色谱峰处无干扰吸收峰,槲皮素、甘草酸的理论塔板数均大于3 000,对应色谱峰的分离度均大于1.5。(见图2)

图2 HPLC图
2.1.4 线性关系考察 取“2.1.2.1”项下的混合对照品溶液1 mL,用甲醇稀释至不同浓度梯度,经0.22 μm微孔滤膜过滤后,取续滤液20 μL,按照“2.1.1”项色谱条件进样分析,以浓度为横坐标(X),对应的高效液相色谱峰面积为纵坐标(Y),绘制标准曲线,进行回归分析,结果表明槲皮素在0.27~43.52 μg,甘草酸在1.01~201.20 μg范围内线性关系良好。

表1 线性关系考察结果
2.1.5 精密度试验 精密吸取“2.1.2.2”项下的供试品溶液,按“2.1.1”项下色谱条件,重复进样6次,测定槲皮素和甘草酸峰面积值,结果峰面积RSD分别为1.90%、1.72%。表明仪器的精密度良好。
2.1.6 稳定性试验 取同一供试品溶液,分别在配制后0、2、4、6、8、24 h,按“2.1.1”项下色谱条件,重复进样6次,测定槲皮素和甘草酸峰面积值,结果峰面积RSD分别为2.08%、1.75%。表明供试品溶液的稳定性良好。
2.1.7 重复性试验 取同一批次干浸膏,按照“2.1.2.2”项制备6份供试品溶液,按“2.1.1”项下色谱条件,重复进样6次,测定槲皮素和甘草酸峰面积值,结果峰面积RSD分别为1.79%、1.63%。表明该测定方法重复性良好。
2.1.8 加样回收率试验 取同一批已知含量的干浸膏6份,分别加入干浸膏中槲皮素、甘草酸含量的80%、100%、120%的对照品溶液,按“2.1.2.2”项制备,按“2.1.1”项下色谱条件测定槲皮素和甘草酸的含量,以测定量(测得量-样品中的量)与加入量的比值计算回收率。结果槲皮素和甘草酸的平均回收率分别为101.50%、101.17%,RSD分别为1.81%、1.94%,表明该方法准确度良好。(见表2)

表2 加样回收率试验结果 (n=6)
2.2 单因素试验考察 前期预试验考察不同提取条件下,组方内多个化合物的含量变化,考察发现不同液料比、提取时间及提取次数对槲皮素提取效果的影响较大,因此,选择槲皮素作为指标性成分进行单因素试验,从而获取各因素适宜的提取区间。
2.2.1 液料比对槲皮素含量的影响 按处方比例称取药材,在提取时间为1 h,提取次数为2次的条件下,考察液料比为8∶1、12∶1、16∶1、20∶1、24∶1对槲皮素含量的影响,平行重复3次。按“2.1.2.2”项下方法制备供试品溶液,采用“2.1.1”项下色谱条件测定槲皮素含量。结果随着液料比的增加,槲皮素含量也逐渐增加,当液料比为20∶1时,达到最大槲皮素含量。液料比继续增加至24∶1时,槲皮素含量有所下降,因此,选择液料比为16∶1、20∶1、24∶1进行Box-behnken试验。(见图3A)
2.2.2 提取时间对槲皮素含量的影响 按处方比例称取药材,在液料比为16∶1,提取次数为2次的条件下,考察提取时间0.5、1.0、2.0 h对槲皮素含量的影响,平行重复3次。按“2.1.2.2”项下方法制备供试品溶液,采用“2.1.1”项下色谱条件测定槲皮素含量。结果槲皮素含量随时间延长而提高,最高点在提取时间为1 h时,之后槲皮素含量随时间延长而降低。该结果可能与长时间高温提取环境下,槲皮素的化学结构稳定性降低有关。因此,选择提取时间为0.5、1.0、1.5 h进行Boxbehnken试验。(见图3B)
2.2.3 提取次数对槲皮素含量的影响 按处方比例称取药材,在液料比为16∶1,提取时间为1 h的条件下,考察提取1、2、3次生乳汤对槲皮素含量的影响,平行重复3次。按“2.1.2.2”项下方法制备供试品溶液,采用“2.1.1”项下色谱条件测定槲皮素含量。结果提取次数增加至2次时,槲皮素含量亦随之增加,当提取次数达到3次时,结果提示槲皮素的含量并未持续增加,可能与槲皮素化学稳定性差、易被氧化降解有关[13]。因此,选择提取次数1、2、3次进行Box-behnken试验。(见图3C)

图3 液料比(A)、提取时间(B)及提取次数(C)对槲皮素含量的影响
2.3 Box-Behnken响应面试验考察
2.3.1 方案设计 根据单因素试验结果,选择液料比(A)、提取时间(B)及提取次数(C)为影响因素,以槲皮素、甘草酸提取率的综合评分为指标,综合评分=槲皮素提取率/槲皮素最高提取率×0.714×100+甘草酸提取率/甘草酸最高提取率×0.286×100[生乳汤组方中含炙黄芪15 g,甘草6 g,按照药材质量比重计算加权比例,槲皮素为0.714(15/21),甘草酸为0.286(6/21)],采用Box-Behnken响应面法对数据进行分析和评价,优化生乳汤的工艺条件。设计因素与水平见表3,Box-Behnken结果见表4。

表3 Box-Behnken设计因素水平

表4 Box-Behnken响应面设计及结果
2.3.2 模型拟合及分析 采用Design Expert 12.0软件对试验数据进行拟合分析,得到多元回归方程如下:Y=91.29-3.84A-0.003 9B+5.61C-6.09AB-0.4101AC+9.03BC-17.86A2-11.83B2-9.75C2。对拟合模型进行方差分析,结果见表5。实验设计的3个因素对生乳汤中槲皮素和甘草酸提取率综合评分的影响排序为C>A>B。拟合模型的P=0.035 6<0.05,差异有统计学意义,表明该响应面模型的拟合性较好,实验预测误差较小。由表5可知,二次项中A2和B2均呈显著性影响(P<0.05),其余一次项与二次项因素对生乳汤中槲皮素和甘草酸提取率的影响差异无统计学意义,该拟合模型提示,考察因素与响应值之间未呈现简单的线性关系。多元回归方程失拟项P=0.157 7>0.05,提示模型失拟不显著,模型具有较好的可信度,建立该拟合模型能够有效地进行生乳汤提取工艺的优化分析及预测。
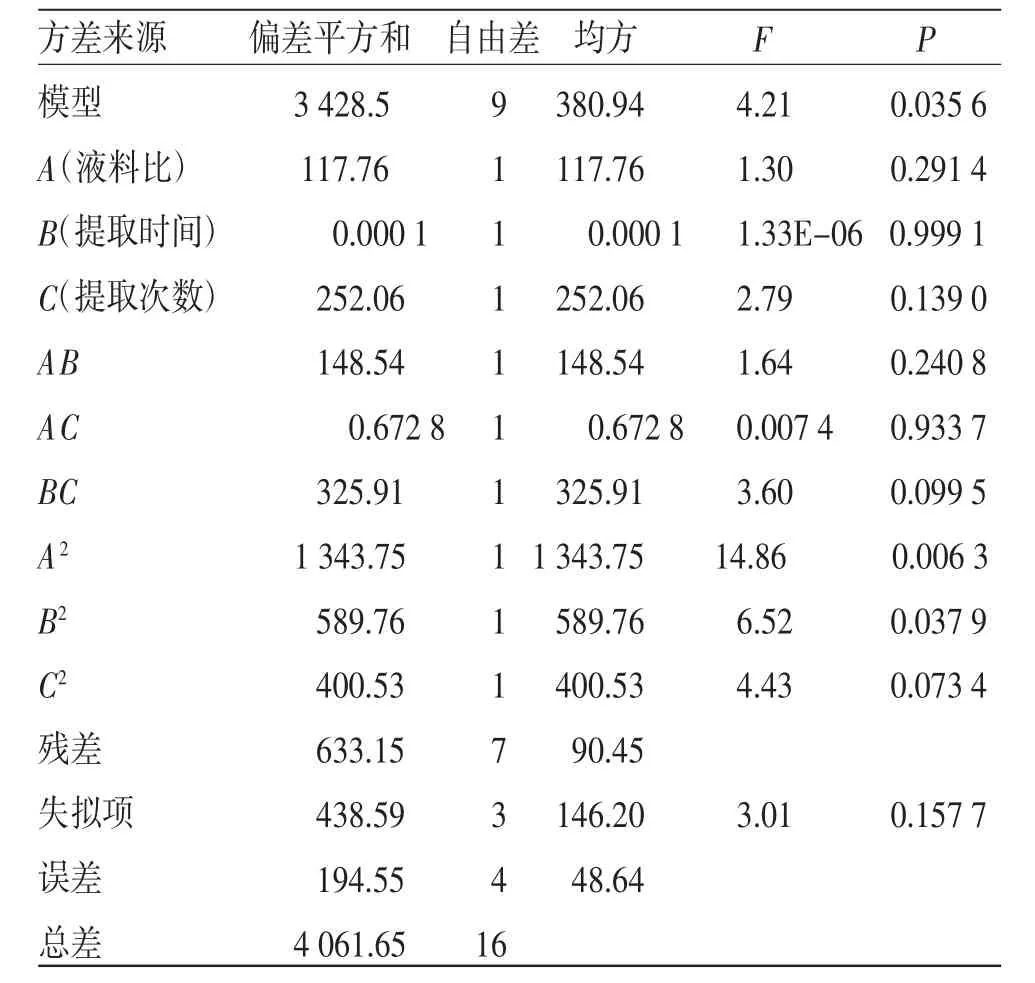
表5 二次回归模型方差分析
2.3.3 响应面分析 通过Design Expert 12.0软件绘制各指标与响应值交互项的响应面图,可直观评价各因素对生乳汤中槲皮素和甘草酸提取率的影响。结果显示,随着各因素的增加槲皮素和甘草酸提取率均呈现先增加后逐渐减少的趋势。因素C提取次数的曲面较陡峭,提示提取次数对槲皮素和甘草酸提取率影响较明显,这与二次回归模型中的方差分析结果一致。(见图4~6)2.3.4验证试验 根据模型拟合方程,预测分析得到的最优提取方案为液料比为19.434:1,提取时间为1.089 h,提取次数为2.373次。考虑到实际提取时的可操作性,故将生乳汤的提取方案修正为液料比为20∶1,提取时间为1 h,提取次数为2次。为验证该拟合模型预测的准确性,按照修正后的方案提取生乳汤中槲皮素和甘草酸,重复进行3次试验,并测定提取液中槲皮素和甘草酸含量。结果显示,槲皮素和甘草酸的平均提取率分别为7.15%、4.10%,RSD分别为0.85%、1.27%,提示前期建立的响应面拟合模型预测性准确,选取的生乳汤优化提取工艺具有良好的可行性及重复性。
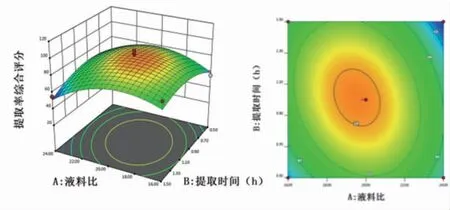
图4 液料比与提取时间的交互作用响应面及等高线图
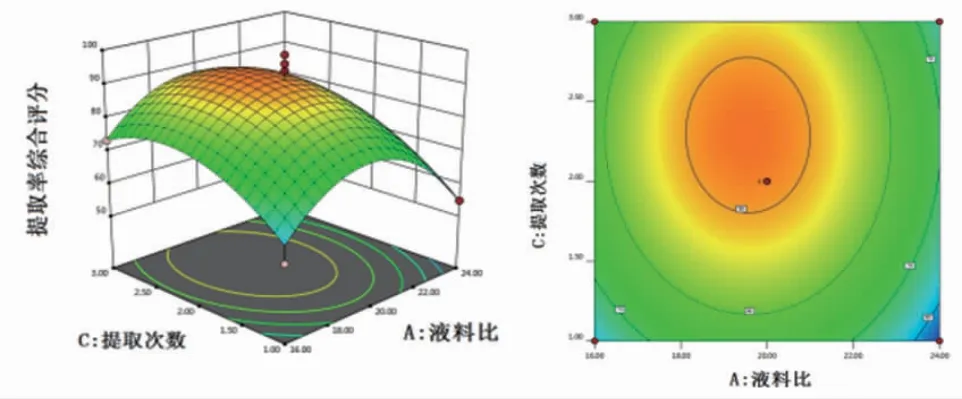
图5 液料比与提取次数的交互作用响应面及等高线图
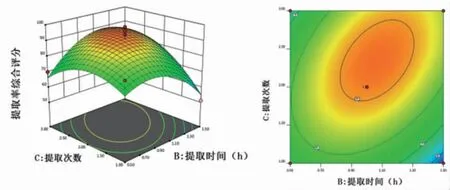
图6 提取时间与提取次数的交互作用响应面及等高线图
3 讨 论
3.1 色谱条件优化 本研究采用HPLC法对生乳汤中炙黄芪、甘草的有效成分槲皮素和甘草酸进行含量测定。在200~400 nm范围内对混合对照品溶液进行紫外光全波长扫描,结果提示混合对照品溶液在256 nm处有最大紫外吸收,故选择该波长测定生乳汤中槲皮素和甘草酸含量。以乙腈-水作流动相时,槲皮素和甘草酸峰形拖尾严重,分离度较差,换用0.05 mol/L磷酸盐缓冲液后,槲皮素和甘草酸样品色谱峰无拖尾,分离度较好,可有效优化槲皮素和甘草酸峰形。本试验通过梯度洗脱方式,既能保证槲皮素和甘草酸有较好的分离度,又可缩短样品检测的保留时间,提高高效液相色谱法的检测效率。
3.2 评价指标 槲皮素黄酮类化合物,可通过调控GSH水平,提高机体的抗氧化能力,亦可作用于白细胞并通过细胞信号通路中的蛋白激酶和磷酸酶,发挥抗炎及免疫调节的作用[14]。黄芪、甘草、漏芦及桔梗中均含有槲皮素[14-17],以槲皮素为评价指标可以体现多味药材有效成分的提取率。甘草的化学成分主要有三萜皂苷类(如甘草酸、甘草次酸等)、黄酮类(如甘草苷、甘草苷元等)[18],具有抗病毒、抗肿瘤、抗炎、免疫调节等作用,其中皂苷类化合物是甘草中重要的成分之一。网络药理学研究表明,甘草可调节催乳素信号通路,参与乳房发育、乳蛋白合成及维持乳汁分泌[19-20]。故本研究以槲皮素和甘草酸作为定量指标,评价生乳汤的水提取工艺[21-23]。3.3 提取工艺优化 本研究在单因素试验的基础上,采用非线性拟合的Box-Behnken响应面法对多个因素进行拟合分析,充分考虑液料比、提取时间及提取次数对槲皮素和甘草酸提取率的影响,建立拟合模型对生乳汤的提取工艺进行了优化,有效提高了提取工艺的准确性。验证结果表明,本提取工艺简便、快捷,结果稳定、可靠,为生乳汤的广泛应用与开发提供了理论和实验依据,也为含有同类成分的中药制剂提供定量检测参考。
