丹参酚酸A对脑缺血大鼠神经功能及热休克蛋白基因表达的影响
2022-11-11周丽娜
周丽娜,辛 欢,杨 敏,方 芳,张 艺
(武汉市第一医院 武汉市中西医结合医院,湖北 武汉 430030)
再灌注损伤为导致缺血性脑卒中病情加重甚至死亡的重要原因,其发生与炎性反应、兴奋性氨基酸、钙超载以及氧自由基生成关系密切[1]。故而临床通常使用抗炎、抑制血小板聚集以及降血脂等药物对脑缺血再灌注损伤进行治疗[2]。中医学将缺血性脑卒中再灌注损伤归为“中风病”的诊疗范畴,中医学认为本病的病机主要为风、火、痰、瘀、气、虚六端,致瘀血阻于脑络,发为本病,故治疗中常以“活血通络”为治疗原则,治疗效果常较为理想[3]。丹参酚酸A提取自具有“活血通络”作用的中药丹参,其不仅具有抗血小板聚集的作用,同时具有抗动脉粥样硬化的作用,在缺血性脑卒中再灌注损伤的治疗中具有良好的应用效果[4]。热休克蛋白(HSP)是因缺血、缺氧、损伤等应激刺激而诱导产生的应激性蛋白,HSP70为HSP中最主要的一种[5]。脑缺血以后机体会产生相应的应激反应,进而促进HSP70在脑中的分布和表达,另外,HSP70还具有脑细胞保护功效,可以增强脑细胞对缺氧、缺血的耐受性,降低致死性的损伤[6]。目前临床上对于丹参酚酸A干预缺血再灌注损伤的作用机制尚未清楚。有研究显示,丹参酚酸A具有抑制炎症反应的作用,进而对相关症状进行缓解[7]。有研究认为,丹参酚酸A可降低脑卒中患者炎症反应以及血液黏度,改善患者相关症状[8]。也有研究显示[9],丹参酚酸A可对HSP的表达产生影响。故本文探讨丹参酚酸A对脑缺血大鼠神经功能及热休克蛋白基因表达的影响,试探讨其脑保护机制。
1 材料与方法
1.1 实验动物 选取80只健康清洁级成年雄性SD大鼠,体重200~220 g,自由摄食饮水,购于南京君科生物工程有限公司。
1.2 实验仪器及试剂 低温高速离心机(Eppendorf 5427 R)购于Eppendorf 中国有限公司;紫外分光光度计(DR6000)购于HACH;酶联免疫吸附仪(M266494)购于北京若水合科技有限公司;恒温培养箱(ZHS-100 M)购于上海喆图科学仪器有限公司;轮转式石蜡切片机(ERM3000)购于常州市郝思琳医用仪器有限公司;高压蒸汽消毒锅(LS-50 HD)购于滨江医疗。胶质源性神经营养因子(GDNF)、脑源性神经营养因子(BDNF)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化物歧化酶(SOD)试剂盒购于南京建成生物技术公司;氯化三苯四氮唑(TTC)购于美国Sigma公司;HSP-70抗体试剂盒、HSP-70 mRNA原位杂交检测试剂盒购于北京百奥莱博科技有限公司。
1.3 实验方法
1.3.1 实验分组及造模方法[10]:选用80只健康成年雄性SD大鼠作为研究对象,通过线栓法制备动脉缺血再灌注损伤模型,按照随机数字表法将其分为假手术组、模型组、低剂量组(10 mg/kg丹参酚酸A)和高剂量组(30 mg/kg丹参酚酸A)四组,每组20只。采用45 mg/kg的戊巴比妥钠(2%)对大鼠进行腹腔麻醉,在其颈部正中位置进行切口处理,将颈内动脉(ICA)、颈外动脉(ECA)、左侧颈总动脉进行分离。将ECA起始端、CCA近心端结扎后,通过夹子将翼腭动脉进行短暂夹闭,以此来防止误插,再将线栓插入到CCA中,插入的深度从分叉部位计算为(18±0.5)mm。拉线栓使线头退至颈外动脉为再灌注的处理方法。维持术中的肛肠温度为(37±0.5)℃,再灌注72 h,缺血时间为2 h。在再灌注后2 h及缺血期间保持大鼠体温在(37±0.5)℃。丹参酚酸A高剂量和低剂量组在术后60 min、1 d、2 d,分别将30 mg/kg和10 mg/kg的丹参酚酸A通过腹腔注射的方式给药。模型组和假手术组给予等量的0.9%氯化钠溶液处理。建模成功的标志为大鼠手术麻醉清醒后出现提尾时向一侧转圈、站立不稳、左侧肢体瘫痪。
1.3.2 术后24 h 脑梗死体积测定[11]:每组随机选择5只大鼠,断头处死进行取脑,将低位脑干、小脑、嗅球弃去,将其置于-20 ℃冰箱进行20 min的冷冻处理,在距离额极3 mm的位置进行切片处理,每片的厚度为2 mm,之后将其置于含有1%氯化三苯基四氮唑(TTC)的水溶液中,在37 ℃条件下进行30 min的孵育处理。此时缺血区域逐渐转变成白色,有正常血供的脑组织逐渐转换成红色。染色后采用10%的甲醛溶液进行24 h的避光保存处理,拍照后,梗死面积采用病理图像分析仪进行测定。根据公式V=(A1+A2+A3+A4+A5)t/2对梗死的体积进行计算,其中A为梗死面积,t为切片的厚度。
1.3.3 神经行为学评分标准[12]:采用 Longa评分法对苏醒6 h以后的大鼠随机抽取5只进行神经功能评分,其中昏迷或者不能自己行走的为4分;向右侧倾倒者为3分;向右侧旋转为2分;右侧前肢不能完全伸直为1分;无神经缺损症状为0分。当大鼠出现提前死亡、呼吸困难或处死后有蛛网膜下腔出血者均弃用。
1.3.4 脑组织相关因子水平测定:再灌注72 h后,于各组分别随机抽取5只大鼠,麻醉后,断头处死取脑,将低位脑干、小脑、嗅球弃去,将其置于-20 ℃冰箱进行20 min的冷冻处理,将脑组织进行离心处理,制备成10%的脑匀浆。应用酶联免疫吸附法对GDNF及BDNF水平进行测定;应用硫代巴比妥法对MDA水平进行测定;应用DTNB法对GSH-Px水平进行测定;应用黄嘌呤氧化酶法对SOD水平进行测定。
1.3.5 脑组织石蜡切片的制备:分别在灌注24、48、72 h后给予大鼠再次麻醉,经过PBS(含4%多聚甲醛)灌注固定后,将脑组织取出,以视交叉和其位置向后4 mm位置,按照这两点进行冠状切片处理,之后常规脱水、浸蜡、包埋,再进行连续的冠状石蜡切片,片厚为5 μm。
1.3.6 原位杂交法检测HSP70 mRNA[13]:将上述切片进行常规脱蜡、水化处理,通过原位杂交试剂盒对大鼠脑组织中的HSP70 mRNA进行测定,当胞核或者胞浆为棕色颗粒时,即为阳性染色。以PBS代替核探针,作为阴性对照,其他步骤同上。最后将阳性细胞进行统计,并通过高倍显微镜(×400)对其进行观察,随机选择5个不重叠的视野,进行阳性细胞平均值的计算。
1.3.7 免疫组化法检测HSP70蛋白[14]:DAB、SP试剂盒、一抗HSP70多克隆抗体均由北京百奥莱博科技有限公司提供。上述切片进行常规脱蜡、水化处理,将第一抗体加入其中,之后通过常规SP法进行切片的染色处理,显色通过DAB进行,蒸馏水冲洗、脱水、透明、封片处理,当胞核或者胞浆为棕色颗粒时,即为阳性染色。一抗采用山羊血清或者PBS代替,作为阴性对照,其他步骤同上。最后将阳性细胞进行统计,通过高倍显微镜(×400)对其进行观察,随机选择5个不重叠的视野,通过Image-Pro Plus 6.0图像分析软件测定各个视野下的光密度值,取平均值。
1.4 统计学方法 采用SPSS 20.0统计学软件分析数据。计量资料以均数±标准差表示,用t检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠造模24 h后脑梗死体积比较 见表1。低剂量组、高剂量组大鼠脑梗死体积均低于模型组,且高剂量组脑梗死体积明显更低(P<0.05)。

表1 各组大鼠造模24 h后脑梗死体积比较(mm3)
2.2 各组大鼠造模72 h后脑组织细胞因子水平比较 见表2。模型组、低剂量组、高剂量组大鼠脑组织BDNF、GDNF水平均明显高于假手术组,且模型组、低剂量组、高剂量组脑组织BDNF、GDNF水平呈现逐渐升高的趋势,经比较差异具有统计学意义(P<0.05)。模型组、低剂量组、高剂量组大鼠脑组织SOD、GSH-Px水平低于假手术组,MDA水平高于假手术组,且模型组、低剂量组、高剂量组脑组织SOD、GSH-Px水平呈现逐渐升高趋势,MDA水平呈现逐渐降低趋势,经比较差异具有统计学意义(P<0.05)。

表2 各组大鼠造模72 h后脑组织细胞因子水平比较
2.3 各组大鼠不同时间点神经行为学评分比较 见表3。实验24、48、72 h后,低剂量组、高剂量组大鼠神经行为学评分均低于模型组,差异具有统计学意义(P<0.05),且高剂量组大鼠神经行为学评分明显低于低剂量组(P<0.05)。

表3 各组大鼠不同时间点神经行为学评分比较(分)
2.4 各组大鼠不同时间点缺血皮层内HSP70 mRNA表达比较 见表4(图1)。实验24、48、72 h后, 模型组、低剂量组、高剂量组大鼠缺血皮层内HSP70 mRNA阳性细胞计数均明显高于假手术组,差异具有统计学意义(P<0.05);且模型组、低剂量组、高剂量组三组大鼠缺血皮层内HSP70 mRNA阳性细胞计数呈现逐渐升高的趋势,经比较差异具有统计学意义(P<0.05)。

表4 各组大鼠不同时间点缺血皮层内HSP70 mRNA阳性细胞计数比较(个)

A:模型组;B:低剂量组;C:高剂量组;D:假手术组
2.5 各组大鼠不同时间点缺血皮层内HSP70蛋白表达比较 见表5(图2)。实验24、48、72 h后, 模型组、低剂量组、高剂量组大鼠脑组织缺血皮层内HSP70蛋白表达OD值均明显高于假手术组,经比较差异具有统计学意义(P<0.05);且模型组、低剂量组、高剂量组大鼠缺血皮层内HSP70蛋白表达OD值呈现逐渐升高的趋势,组间比较差异均具有统计学意义(P<0.05)。
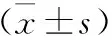
表5 各组大鼠不同时间点缺血皮层内HSP70蛋白表达OD值比较
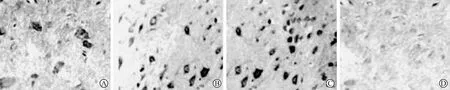
A:模型组;B:低剂量组;C:高剂量组;D:假手术组
3 讨 论
根据缺血性脑梗死再灌注损伤患者的临床症状,本病应归为中医学“中风病”的诊疗范畴,中医学对本病最早的阐述可追溯至《黄帝内经》,而《诸病源候论》则将本病的病因病机总结为“中风者,风气中于人也”,认为本病的发生与外邪侵袭相关,而随着对本病认识的深入,后世医家提出了“五志过极、蒙蔽心神”“痰湿内生,痰瘀阻络”“元气亏虚、脑窍失养”等多种学说,并进行辨证应用中医药疗法进行治疗,均取得了良好的治疗效果[15]。自由基学说是脑缺血再灌注损伤的机制之一,其认为在脑部缺血以后,大脑通过一氧化氮合成酶途径、超氧化酶和白细胞及血小板表面NADPH氧化酶途径、花生四烯酸途径、黄嘌呤氧化酶途径合成大量自由基,从而损伤脑细胞,造成再灌注损伤[16]。
研究显示[17],人体内细胞可以通过非酶系统以及酶系统实现自我抗氧化的效果。GSH-Px和SOD是人体抗氧化酶系统中的重要物质,其中GSH-Px是特异性过氧化氢分解催化酶,可促进还原型谷胱甘肽转化为氧化型谷胱甘肽,致使自由基向无毒的羟基转化,从而达到抑制氧化物损伤的效果,保护细胞。SOD是抗氧化系统的重要组成部分,可清除体内的超氧阴离子自由基,促使其发生歧化作用,进而对自由基损伤产生抑制效果,为监测自由基清除能力的重要指标[18]。MDA则为脂质过氧化反应产物,其不仅可与脂质发生交联反应,同时也可促使脂质向高分子聚合物转化,并在细胞内沉积和溶酶消解,当上述高分子聚合物浓度较高时,就会对细胞的DNA结构产生损伤,诱导细胞发生凋亡[19]。本研究各组脑组织SOD、GSH-Px及MDA水平结果提示,经丹参酚酸A干预后,不仅大鼠体内的氧自由基可得到有效地清除,同时缺血再灌注性细胞损伤也可得到明显控制。有研究显示[20],给予大鼠1个月的丹参酚酸盐喂养以后,其肾脏组织的SOD活性显著升高,自由基含量降低,肾功能得到显著改善。Wang等[21]研究显示,丹参酚酸盐可以对羟自由基进行有效清除。Sun 等[22]研究显示,丹参酚酸盐可以对黄嘌呤氧化酶/黄嘌呤系统产生的铁离子依赖羟自由基和氧自由基进行有效清除。机体内自由基被有效清除后,GSH-Px和SOD的消耗量大大降低,其活性相应增加,脑组织抗自由基损伤能力增加。
本研究所用的丹参酸酚A提取自中药丹参,丹参具有“活血通络,通经止痛”的功效,常与桃仁、红花、三七、川芎等药配伍,可用于冠心病、脑梗死、关节肿痛、月经不调等疾病的治疗,具有良好的应用效果[23]。丹参多酚酸为丹参主要有效成分,属水溶性的有机酸类化合物,具有降低脑梗死水肿面积的作用,可有效对脑组织神经功能进行保护[24]。本研究结果显示,高剂量组大鼠脑组织BDNF、GDNF水平明显较高。这是由于BDNF、GDNF是重要的神经营养因子,在神经元的生长和分化中具有重要的作用。而神经元抗缺血损伤的能力与脑组织中的BDNF、GDNF变化关系较为密切,而给予大鼠外源性的BDNF、GDNF同样可以发挥保护缺血性脑组织的功效。动物实验研究结果显示[25],BDNF、GDNF具有减少脑缺血后梗死面积的功效,有助于修复大鼠受损的神经元。上述结果也证实了高水平表达的BDNF、GDNF可以减少神经元的凋亡,减轻缺血性脑组织损伤,也是自身的一种保护机制。这种机制可能与下述因素关系密切:①钙超载的降低,促进神经元突触的生长和发芽;②对兴奋性氨基酸毒性作用的拮抗效果;③对自由基的清除作用,进而引发神经细胞凋亡的抑制。正常情况下,脑组织内的HSP含量相对较低。当出现脑部缺血时,HSP-70会在变性蛋白的诱导下增加合成量,进而增强脑细胞对缺氧、缺血的耐受性。有研究显示[26],HSP-70不仅可在大脑缺血早期保护脑组织细胞免受损伤,在缺血后期对细胞修复的作用也较为显著。本文免疫组化和原位杂交结果显示,高剂量的丹参酚酸A可以促进HSP-70蛋白的表达。这可能与丹参酚酸A消除自由基的特性有关,可以较好地减少神经细胞损伤,减轻能量消耗,促进HSP-70蛋白基因的表达。
综上所述,丹参酚酸A可以有效地对脑缺血再灌注损伤大鼠的自由基进行清除,减少梗死面积,增加HSP70蛋白基因的表达,具有缺血脑保护作用。
