CypD敲除对衰老小鼠代谢状态及铁死亡的影响
2022-11-10刘凯王建宁
刘凯,王建宁
1山东大学齐鲁医学院,山东济南 250033;2山东第一医科大学第一附属医院(山东省千佛山医院)泌尿外科,山东济南 250033
肥胖、糖尿病等代谢性疾病的发病率随着年龄的增长逐渐升高,给社会经济造成巨大负担。代谢性疾病发病机制复杂,线粒体功能紊乱是其发生发展的重要机制。CypD是线粒体通透性转换孔的重要元件,其表达量增加会导致线粒体通透性转换孔过度开放,导致线粒体水肿,影响线粒体功能,从而导致细胞整体氧化应激增加[1]。研究显示,CypD与代谢性疾病和衰老密切相关:CypD在代谢相关脂肪性肝病中表达升高[2];CypD敲除会延长小鼠的寿命[3];CypD敲除会改善衰老小鼠的阿尔茨海默病[4]。铁死亡是新近发现的一种细胞死亡方式,其特征是铁依赖性脂质过氧化物累积到致死水平[5]。铁死亡在衰老机体中增加,导致衰老细胞的高氧化应激状态从而促进衰老[6]。并且,铁死亡也参与并促进了代谢性疾病的发生发展[7]。目前尚无研究报道CypD对衰老小鼠代谢状态的影响以及CypD敲除是否会改变衰老小鼠的铁死亡。为进一步深入探讨,2019年8月—2021年12月,本研究观察了CypD敲除对衰老小鼠能量代谢和糖代谢的影响,同时观察了CypD敲除对衰老小鼠代谢器官(肝脏和肌肉)铁死亡水平的影响。
1 材料与方法
1.1 材料SPF级6周龄的雄性CypD全身敲除小鼠和同窝野生型对照(C57BL/6),均来自山东省千佛山医院中心试验室动物实验中心(SPF级)。饲料购自北京科澳协力饲料有限公司,基因型鉴定试剂购自天根生化科技有限公司,引物合成自北京六合华大基因科技有限公司,重组人胰岛素注射液(40 U/mL)购自江苏万邦生化医药股份有限公司,丙酮酸钠购自Sigma-Aldrich,普鲁士蓝染色试剂盒购自北京索莱宝科技公司,Gpx4抗体购自Abcam公司,Gapdh抗体及Western blotting二抗购自Proteintech公司。
1.2 动物分组及处理方法将CypD敲除小鼠和同窝野生型对照分别命名为CypD KO组和对照组,各10只,两组小鼠喂养前体质量没有差异,具有可比性。在SPF环境里普通饲料喂养14个月后,每组各有2只自然死亡,对存活的小鼠分别进行各种代谢状态观察和铁死亡指标检测。
1.3 小鼠代谢状态观察
1.3.1 体质量和饮食喂养14个月后,记录CypD KO组和对照组各8只小鼠最终体质量和每周的进食量。
1.3.2 呼吸交换率(RER)、产热和活动度随机取CypD KO组和对照组各4只小鼠,将小鼠提前在代谢笼(一种特殊设计的为采集实验动物各种排泄物质的密封式饲养笼)适应24 h后开始记录数据,首先记录小鼠的体质量和去脂体质量,输入代谢笼分析系统以获得体质量校正后的数据。利用曲线图和曲线下面积(AUC)分别展示整体和黑暗期、光照期的RER、产热、活动度数据。
1.3.3 糖代谢指标
1.3.3.1 空腹血糖检测CypD KO组和对照组各取8只小鼠,在干净笼子里禁食18 h,在安静状态剪掉1~2 mm尾端后轻轻挤压小鼠尾巴,挤出一滴血用血糖仪检测基础血糖值。
1.3.3.2 糖耐量试验CypD KO组和对照组各取8只小鼠,在干净笼子里禁食18 h,称量体质量后按照2 g葡萄糖/kg体质量的标准腹腔注射20%的葡萄糖溶液,记录小鼠0、30、60、90、120 min的血糖值。
1.3.3.3 胰岛素敏感性试验CypD KO组和对照组各取6只小鼠,在干净笼子里禁食2 h,按照每20 g体质量注射200 μL胰岛素的量进行腹腔注射,记录小鼠0、15、30、60、90 min的血糖值。
1.3.3.4 丙酮酸耐量试验CypD KO组和对照组各取6只小鼠,在干净笼子里禁食8 h,按照2 g葡萄糖/kg体质量的标准腹腔注射20%的丙酮酸钠溶液,记录0、30、60、90 min的血糖值。
1.4 铁死亡指标检测
1.4.1 普鲁士蓝染色CypD KO组和对照组小鼠麻醉后,眼球取血,随后两组各取3只小鼠的肝脏,4%多聚甲醛固定、脱水、石蜡包埋后制作肝脏的石蜡切片,按照说明书,切片脱蜡至水后放入Perls stain染色30 min,蒸馏水充分冲洗后,用伊红染液淡染细胞核15 s,自来水冲洗5 s后脱水、透明、封固。油镜(×100倍)下拍照观察。
1.4.2 Gpx4蛋白检测采用Western blotting法。CypD KO组和对照组小鼠麻醉后,眼球取血,随后各取8只小鼠的肝脏、右侧腓肠肌组织,置于-80℃冰箱冻存。提取小鼠肝脏、肌肉组织蛋白,BCA法测蛋白水平。配制12%的分离胶,电泳、转膜后5%牛奶室温封闭1 h,一抗Gpx4(1∶1 000)及内参Gapdh(1∶7 500)摇床4℃孵育过夜;次日TBST洗膜后二抗室温孵育1 h,化学发光法显影分析。
1.5 统计学方法采用SPSS22.0统计软件。计量资料以±s表示,组间比较采用独立样本t检验或重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组基本情况、体质量和进食量比较存活的两组小鼠外观差异不明显,都表现出衰老小鼠的特征。CypD KO组小鼠体质量为(29.38±1.32)g低于对照组(31.86±1.21)g(P<0.05);CypD KO组小鼠每周进食量为(17.3±0.97)g,与对照组(18.24±1.00)g相比差异无统计学意义(P>0.05)。
2.2 两组RER、产热和活动度比较两组代谢笼数据都呈现有规律的昼夜节律。RER AUC比较,黑暗期CypD KO组高于对照组(P<0.05),光照期两组没有统计学差异(P>0.05);产热AUC比较,光照期CypD KO组高于对照组(P<0.05),黑暗期两组没有统计学差异(P>0.05);活动度AUC比较,黑暗期和光照期两组均没有统计学差异(P>0.05)。代谢笼3 d光照期和黑暗期不同时段RER、产热和活动度曲线和AUC比较分别见图1~3和表1。
表1 两组3 d光照期和黑暗期不同时段RER、产热和活动度AUC比较(±s)

表1 两组3 d光照期和黑暗期不同时段RER、产热和活动度AUC比较(±s)
注:与对照组相比,*P<0.05。
组别对照组光照期黑暗期CypD KO组光照期黑暗期n 4 4 RER 产热(kJ)活动度(cnts/h)68.91±0.79 71.34±0.80 1 075±33.22 1 280±47.87 87 170±4 167 210 900±38 230 68 030±11 120 115 000±20 800 69.6±2.40 75.61±1.38*1 214±19.19*1 363±25.89

图1 两组3 d光照期和黑暗期不同时段RER曲线比较

图2 两组3 d光照期和黑暗期不同时段产热曲线比较

图3 两组3 d光照期和黑暗期不同时段活动度曲线比较
2.3 两组糖代谢指标比较
2.3.1 糖耐量比较CypD KO组糖耐量AUC为(759.9±178.4)mmol/(L·min),低于对照组[(1 347±94.57)mmol/(L·min)](P<0.01)。CypD KO组0、30、90、120 min血糖值低于对照组(P均<0.05)。见图4。

图4 两组糖耐量不同时点血糖值比较
2.3.2 胰岛素敏感性比较CypD KO组胰岛素敏感性AUC为(436.4±73.85)mmol/(L·min),低于对照 组[(657.5±46.16)mmol/(L·min)](P<0.01)。CypD KO组0、15、30、90 min血糖值低于对照组(P均<0.05)。见图5。

图5 两组胰岛素敏感性不同时点血糖值比较
2.3.3 丙酮酸耐量比较CypD KO组丙酮酸耐量AUC为(471.8±38.67)mmol/(L·min),低于对照组[(625.5±17.18)mmol/(L·min)](P<0.01)。CypD KO组0、30、60 min血糖值低于对照组(P均<0.05)。见图6。

图6 两组丙酮酸耐量不同时点血糖值比较
2.4 两组肝脏铁死亡指标比较
2.4.1 肝脏普鲁士蓝染色比较对照组衰老小鼠铁沉积比较严重,染色结果为密集的点状伴随块状的铁沉积,而CypD KO组的铁沉积为细小的颗粒状且无团块。见图7。
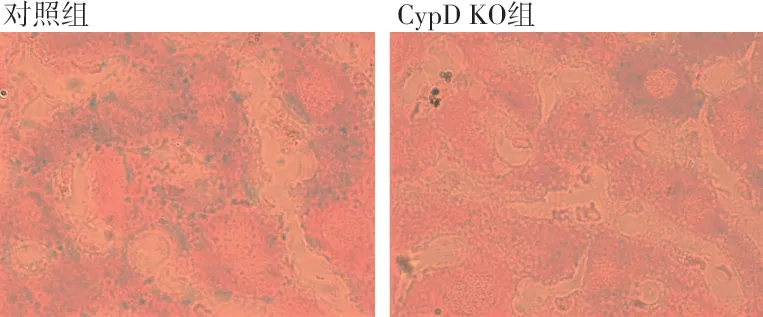
图7 肝脏普鲁士蓝染色结果(×100倍)
2.4.2 Gpx4蛋白检测比较CypD KO组肝脏组织Gpx4的相对表达量为1.10±0.058,高于对照组的0.90±0.029(P<0.05)。CypD KO组肌肉组织Gpx4的相对表达量为1.07±0.15,低于对照组的1.12±0.13,两组比较差异无统计学意义(P>0.05)。见图8。

图8 肝脏组织和肌肉组织Gpx4的Western blotting法检测显示条带
3 讨论
衰老是代谢性疾病的重要因素之一,利用衰老小鼠模型可以观察各种因素对衰老状态下代谢指标的影响。线粒体功能障碍是多种疾病的重要发病机制,已有研究显示线粒体功能紊乱与衰老具有密切联系,衰老会导致线粒体通透性转换孔开放增加,进而出现水肿、功能障碍,最终产生大量活性氧中介物(ROS),导致细胞整体的氧化应激水平增加[8]。CypD作为线粒体通透性转换孔的重要元件,其表达量增加会导致线粒体通透性转换孔过度开放;CypD敲低或者敲除的模型中线粒体通透性转换孔开放减少,细胞整体的氧化应激水平也会随之降低。铁死亡是以铁依赖的脂质过氧化为特征[9],线粒体在铁死亡的发生发展中也发挥了重要作用。
本研究显示,CypD敲除小鼠(CypD KO组)体质量较野生型衰老小鼠(对照组)低,但每周进食量无统计学差异,推测是CypD敲除小鼠能量消耗更多导致。代谢笼是测量动物能量收支的实验方法,其中,RER是二氧化碳产生量和耗氧量的比值,反映的是供能所消耗的底物情况。如果机体100%消耗碳水化合物供能,RER=1;如果机体100%消耗脂类供能,RER=0.7。因为饮食的复合性,所以RER应在0.7~1.0范围内。胰岛素的改变会影响RER的变化。胰岛素分泌增加,一方面促进糖的摄取和利用,糖作为底物供能比增加;另一方面促进脂质储存,脂质作为底物供能比降低,两方面均使RER升高。哺乳动物90%的O2消耗供能在线粒体发生,所以富含线粒体的器官组织所占比例及其中线粒体的数量、供能均会影响产热。本研究代谢笼显示CypD KO组光照期产热高于对照组,由于两组小鼠开始喂养时体质量无显著差异,这可以解释两组小鼠饮食量无差异但CypD KO组小鼠体质量降低的现象,推测产热的改变可能是因为CypD的改变影响了衰老小鼠产热的重要细胞器——线粒体的功能,进一步推测产热的重要器官——肝脏和肌肉(肌肉、肝脏富含线粒体[10])可能存在差异。此外,代谢笼提示CypD KO组黑暗期活动度低于对照组但无统计学差异,推测黑暗期由于对照组活动量的增加导致两组产热无统计学差异。但是,为什么CypD KO组小鼠黑暗期活动量不及对照组还需要研究,一个推测是衰老导致大脑氧化应激增加从而导致对照组小鼠表现出焦虑的症状。CypD KO组小鼠黑暗期RER高于对照组,说明CypD敲除的衰老小鼠以糖作为底物的比例高于对照组衰老小鼠。因此,CypD敲除在衰老小鼠中通过影响线粒体功能可以导致能量产生的底物利用和产热的改变,具体机制还需要基础实验的支持。
空腹血糖、糖耐量检测可以反映胰岛素分泌情况;胰岛素敏感性可以反映外周组织对胰岛素的响应情况;丙酮酸耐量试验可以反映出饥饿状态下肝脏糖异生能力。本研究中CypD KO组糖代谢明显改善:胰岛素分泌状态优于对照组,肌肉和肝脏对葡萄糖的利用良好以及肝脏糖异生弱于对照组。但是,糖代谢试验中未以年轻小鼠做对照,而且糖耐量试验在30 min时,CypD KO组小鼠血糖升高不理想且组内数据有一定差异(30 min血糖数据组内方差较大),因此不能得出CypD敲除的衰老小鼠糖代谢正常的结论。
肝脏在血糖调节中发挥重要作用,而且肝脏是内源性糖产出的最主要器官,其次是肾脏。此外,葡萄糖的清除主要依赖肝脏和骨骼肌等。丙酮酸耐量试验提示CypD KO组衰老小鼠饥饿状态下肝脏糖异生能力弱于对照组衰老小鼠,提示空腹血糖的差异有可能是因为CypD敲除影响了肝脏糖异生能力。因此,研究肝脏的改变有助于发现CypD KO组小鼠血糖改变的机制。铁死亡作为新近出现的细胞死亡方式,其过程涉及氨基酸代谢、糖代谢和脂代谢,是几大代谢过程的交汇[11]。机体铁代谢的异常导致各个器官的铁死亡水平升高。其中,肝脏是机体铁调控的枢纽。肝脏通过分泌hepcidin调控各个器官的铁的转运和代谢[12]。文献报道铁死亡参与了能量代谢异常的发生,例如糖尿病[13];另外,铁死亡和衰老有密切联系,铁死亡参与神经退行性疾病的发生发展[14]。普鲁士蓝染色可以观察铁在组织中的沉积状况,肝脏切片的普鲁士蓝染色显示野生型衰老小鼠存在大量密集的铁沉积颗粒。Gpx4是观察铁死亡的核心指标[15]。Gpx4通过还原谷胱甘肽过氧化物从而抑制铁死亡[16]。本研究结果显示,CypD KO组肝脏Gpx4表达高于对照组;而肌肉的Gpx4改变不明显。提示,CypD敲除除缓解衰老导致的线粒体功能紊乱以外,还会抑制铁死亡。进一步提示与肌肉组织相比,肝脏在CypD敲除的衰老小鼠糖代谢改变中发挥了主要作用。但是,确凿的证据需要利用肝脏CypD特敲的衰老小鼠模型证实。由于肝脏通过分泌肝铁调素在全身铁代谢中发挥核心作用,推测CypD敲除对肝脏的影响将导致全身铁代谢的改变。肝脏糖代谢的改变与铁死亡的关系需要进一步实验的证实。
综上所述,CypD敲除可以改善衰老造成的体质量增加、产热降低、底物构成比以及糖代谢异常,而且可以降低能量和糖代谢的重要器官——肝脏中的铁死亡水平。以上研究为改善衰老的代谢状况提供了新的思路,由于已有成熟的铁死亡抑制剂和激动剂以及CypD的抑制剂,因此可以通过减轻铁死亡或抑制CypD的表达从而达到改善代谢的目的。
利益冲突所有作者声明不存在利益冲突
作者贡献声明刘凯:实验研究、数据收集与整理、论文撰写;王建宁:论文修订与指导
