雪茄茄芯烟叶工业二次发酵过程中细菌与真菌群落多样性变化分析
2022-11-10郑霖霖赵亮蔡兴华陈震柴志顺时向东
郑霖霖,赵亮,蔡兴华,陈震,柴志顺,时向东*
雪茄烟专栏
雪茄茄芯烟叶工业二次发酵过程中细菌与真菌群落多样性变化分析
郑霖霖1,赵亮2,蔡兴华2,陈震2,柴志顺3,时向东1*
1 河南农业大学烟草行业烟草栽培重点实验室,郑州市金水区文化路95号 450000;2 浙江中烟工业有限责任公司技术中心,杭州市西湖区科海路118号 310024;3 四川中烟工业有限责任公司长城雪茄烟厂,什邡市蓥华山路南段128号 618400
【目的】为分析茄芯烟叶在二次发酵过程中细菌和真菌群落多样性及菌群动态变化规律。【方法】以德雪三号初次发酵烟叶为试验材料,采用细菌16S rDNA和真菌ITS1的Illumina MiSeq高通量测序技术,分析烟叶二次发酵0、5、10、15和20 d时细菌和真菌群落结构及丰度信息。【结果】发酵0 d时细菌群落Chao1、ACE和Shannon指数最高,分别为423.38、424.40和4.67;发酵10 d时真菌群落Chao1和ACE指数最高,分别为85.82、89.49。基于门水平,随着发酵时间的增加,细菌从以变形菌门(Proteobacteria)为优势转变为以厚壁菌门(Firmicutes)为主,真菌主要优势菌门为子囊菌门(Ascomycota),相对丰度在71.61%~98.16%之间。基于属水平,葡萄球菌属()为整个发酵过程中的主要优势细菌属,在发酵15 d时相对丰度最大(91.25%);次要优势细菌属由假单胞菌属()、马赛菌属()等转变为芽孢杆菌属()、土地芽孢杆菌属();曲霉属()为真菌绝对优势菌属,平均丰度达到87.40%。LEfSe分析结果表明,21种细菌在属水平上有显著性差异,6种真菌在科水平上有显著性差异。【结论】茄芯烟叶在二次发酵过程中细菌和真菌群落的丰富度和多样性随着发酵时间的增加总体呈降低趋势。在属水平上,不同发酵时间茄芯烟叶细菌和真菌群落组成结构相似,相对丰度有明显差异,和为二次发酵过程中的主要优势菌属。
茄芯烟叶;发酵时间;细菌多样性;真菌多样性;高通量测序
传统手卷雪茄烟由茄衣、茄套和茄芯烟叶组成,其中茄芯烟叶占比最高,主要影响雪茄烟抽吸过程中的吃味和香气[1]。茄芯烟叶品质可通过发酵得到明显改善,初次发酵后的茄芯烟叶香气透发性不足、杂气较为明显,需通过二次发酵进一步分解与转化烟叶中的内含物质,以提高烟叶综合品质及工业可用性[2]。
研究发现细菌和真菌在雪茄烟叶发酵过程中具有重要作用[3],不仅能降解烟叶中的糖类化合物、蛋白质和烟碱等物质,还能为烟叶中某些香气物质提供重要前体物质,是推动烟叶发酵、改善烟叶吸食品质的重要微生物[4]。因此明确茄芯烟叶在二次发酵过程中细菌和真菌群落结构及动态变化对提高烟叶品质具有重要作用。传统分离培养技术是直接对微生物进行分离与纯化,现已广泛应用于烟叶微生物研究。张晓娟[5]、杜佳[6]等对发酵过程中茄衣烟叶的微生物进行分离鉴定,发现烟叶中细菌为绝对优势菌群,其数量随着发酵时间的增加逐渐减少,且所有细菌均为芽孢杆菌属()。然而传统分离培养技术只能分离和培养部分菌株,无法全面反映烟叶中微生物群落的真实结构[7]。随着分子生物技术的快速发展,高通量测序技术基于其全面、快速、无需培养等特点已在烟叶微生物多样性的研究中得到广泛应用[8]。如周家喜等[9]对不同产地不同陈化时间的烤烟烟叶进行高通量分子测序,发现烤烟烟叶的主要优势真菌属是红酵母属()、耐干霉菌属()。张鸽等[10]通过研究茄衣烟叶发酵过程中的细菌群落结构,发现主要细菌属为棒状杆菌属()、葡萄球菌属()、不动杆菌属()、假单胞菌属()、等。叶长文等[11]对雪茄烟产品中细菌和真菌群落结构及其多样性进行研究,发现雪茄烟产品的优势细菌属为、、,优势真菌属为曲霉属()。
大量研究表明烟叶细菌和真菌群落结构组成及多样性与烟叶产区、用途、发酵时间等密切相关。然而,前人多对雪茄烟叶在不同产区、不同发酵时期的细菌群落结构变化进行研究,且主要针对茄衣烟叶,对茄芯烟叶在二次发酵过程中细菌和真菌群落结构的变化还缺乏系统的研究。因此,本研究采用Illunina MiSeq高通量测序技术分析茄芯烟叶在二次发酵过程中细菌和真菌群落结构的动态变化规律及优势菌群,为后续探究细菌和真菌群落与茄芯烟叶品质之间的关系,筛选优势功能菌奠定理论基础。
1 材料与方法
1.1 样品采集
试验于2021年在河南农业大学雪茄研究所进行,试验材料取自四川长城雪茄烟厂库存的2020年经过初次发酵的茄芯中部烟叶,品种为德雪三号。试验前先将烟叶回潮至含水率26%~28%,将回潮后的烟叶置于自封袋中,放置于Binder恒温恒湿箱中进行人工发酵。发酵条件:温度45℃,相对湿度80%,发酵时间20 d。于发酵0、5、10、15、20 d时采集样品,每次取样50 g,每个样品重复3次,样品采集后迅速置于液氮中冷冻,之后于-80℃超低温冰箱中保藏。
1.2 DNA提取与Illumina MiSeq高通量测序
采用E.Z.N.A.®soil试剂盒(美国OMEGA公司,货号:D5625-01)对样品基因组DNA进行提取。对细菌16S rDNA的V5-V7区和真菌的ITS1可变区进行扩增,细菌扩增引物为799F(5’-AACMGGATTAG ATACCCKG-3’)和1193R(5’-ACGTCATCCCCACCTT CC515F-3’);真菌扩增引物为ITS1F(5’-CTTGGTCA TTTAGAGGAAGTAA-3’)和(ITS25’-GCTGCGTTC TTCATCGATGC-3’)。使用Tru Seq Nano DNA LT Library Prep Kit试剂盒进行文库构建,并使用Illumina MiSeq测序仪进行基因测序(广州基迪奥生物科技有限公司)。
1.3 数据处理与统计分析
将有效数据在97%水平上聚类成操作分类单元(Operational Taxonomic Unit,OTU),利用细菌Silva和真菌Unite分类学数据库对OTU进行物种注释分析,利用Qiime软件(Version 1.9.1)计算Chao1、ACE和Shannon指数。利用R软件(Version 2.2.1)绘制稀释曲线图、物种维恩(Venn)图。LEfSe(Line discriminant analysis effect size)是一种基于线性判别分析效应量的分析方法,其本质是筛选关键的生物标记物[12],通过LEfSe软件分析不同样本组间的差异物种。
2 结果与分析
2.1 测序数据合理性分析
随机抽取测序序列构建稀释性曲线,由图1可知,随着测序深度的增加,茄芯烟叶中细菌和真菌OTU数量逐渐增加,当达到一定序列数时,OTU数趋于饱和,表明此时样品测序数据量已经足够大,测序结果可以反映茄芯烟叶在不同发酵时期下绝大多数细菌和真菌菌群信息。

图1 茄芯烟叶二次发酵过程中细菌(A)和真菌(B)稀释性曲线
2.2 茄芯烟叶二次发酵过程中细菌和真菌群落多样性分析
2.2.1 Alpha多样性分析
由表1、2可知,二次发酵过程中茄芯烟叶的测序覆盖率均大于99.95%,表明实验数据可真实反映烟叶的细菌和真菌物种丰度及多样性。由表1可知,细菌群落Chao1、ACE和Shannon指数在发酵0 d时最高,分别为423.38、424.40和4.67,表明此时茄芯烟叶中细菌群落丰富度和多样性最高。随着发酵时间的增加,Chao1和ACE指数逐渐降低,在发酵20 d时数值最低,分别为180.60和183.08,说明在二次发酵过程中茄芯烟叶细菌群落丰富度逐渐降低。Shannon指数随着发酵时间的增加则呈现先降低后增加的趋势,于发酵15 d时数值最低,为1.36,表明茄芯烟叶在二次发酵过程中细菌群落多样性整体上呈降低趋势,发酵20 d时物种种类略有增加。
由表2可知,茄芯烟叶真菌群落的Chao1和ACE指数在发酵10 d时最高,分别为85.82、89.49,表明此时茄芯烟叶真菌群落丰富度最高。Shannon指数在发酵5 d时最高(1.86),表明此时茄芯烟叶真菌群落多样性最高。由表1、2可知,茄芯烟叶二次发酵过程中真菌群落的Chao1、ACE和Shannon指数数值整体上低于细菌,表明茄芯烟叶在二次发酵过程中细菌群落的种类及数量明显多于真菌。
表1 茄芯烟叶二次发酵过程中细菌Alpha多样性指数

Tab.1 Alpha diversity indexes of bacteria in cigar core leaves during secondary fermentation
表2 茄芯烟叶二次发酵过程中真菌Alpha多样性指数
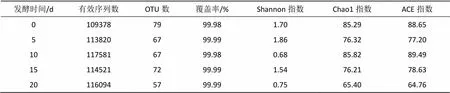
Tab.2 Alpha diversity indexes of fungi in cigar core leaves during secondary fermentation
2.2.2 OTU分析
茄芯烟叶在二次发酵过程中细菌和真菌群落检测到的共有和独有OTU数如图2所示。由图2A可知,茄芯烟叶在整个发酵过程中细菌共有OTU数为106个。发酵0 d时,烟叶中特有OTU数为213个,随着发酵时间的增加,烟叶中特有OTU数逐渐降低,在发酵20 d时,特有OTU数降低为11个。由图2B可知,茄芯烟叶在整个发酵过程中真菌共有OTU数为33个。发酵0 d时,烟叶中特有OTU数为19个,随着发酵时间的延长,烟叶中真菌特有OTU数分别为12、13、11和6,整体上呈下降趋势,与细菌变化趋势基本相同。其中细菌特有OTU数在整个发酵过程中存在明显差异,真菌特有OTU数在发酵前、后有明显差异。表明在二次发酵过程中茄芯烟叶细菌群落变化较大,真菌群落在二次发酵前、后的变化较大。

图2 茄芯烟叶二次发酵过程中细菌(A)和真菌(B)OTU分布Venn图
2.3 茄芯烟叶二次发酵过程中细菌和真菌群落组成分析
2.3.1 细菌群落结构分析
茄芯烟叶在二次发酵过程中细菌群落的相对丰度分布结果如图3所示。由图3A可知,在门水平上,烟叶二次发酵过程中检测到的优势菌门(平均相对丰度大于1%)有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)等。其中Firmicutes和Proteobacteria在二次发酵过程中占据主导地位。发酵0 d时,茄芯烟叶中Firmicutes和Proteobacteria的相对丰度分别为25.32%、66.35%。随着发酵时间的增加,Firmicutes的相对丰度呈现增加的趋势;Proteobacteria则相反,相对丰度逐渐降低。发酵20 d时,茄芯烟叶中Firmicutes和Proteobacteria的相对丰度分别为98.80%、1.06%。Bacteroidetes和放线菌门(Actinobacteria)相对丰度随着发酵时间的增加整体上呈降低趋势。
由图3B可知,在属水平上,茄芯烟叶二次发酵过程中检测到的优势菌属(平均相对丰度大于1%)有、、马赛菌属()、等。在茄芯烟叶二次发酵过程中占据主导地位,其相对丰度总体呈增长趋势,在发酵15 d时最高,丰度为91.25%,与发酵前相比增幅为47.48%。在发酵0 d时的相对丰度最高,为10.39%,随着发酵时间的增加,其相对丰度迅速下降直至0.04%,表明的细菌较少或基本没有参与烟叶发酵。在发酵5 d时的相对丰度最大(13.62%),之后迅速下降直至发酵结束,发酵20 d时其相对丰度降低至0.04%。和土地芽孢杆菌属()在发酵0~15 d时相对丰度较低且无明显变化,发酵20 d时迅速增加,分别为16.22%和10.55%,与发酵0 d时相比增幅分别为15.55%、10.41%。
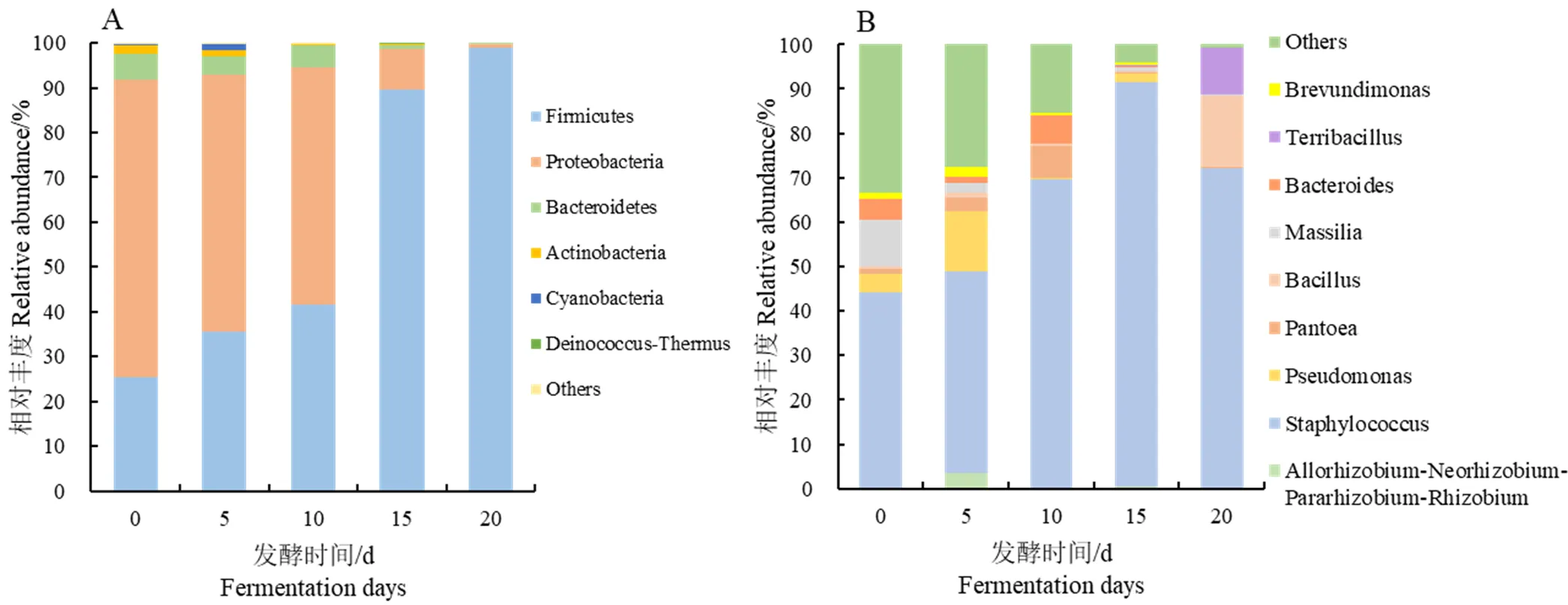
图3 茄芯烟叶二次发酵过程中细菌群落基于门水平(A)和属水平(B)的相对丰度
2.3.2 真菌群落结构分析
茄芯烟叶在二次发酵过程中真菌群落结构的分布如图4所示。由图4A可知,在门水平上,烟叶发酵过程中检测到的优势菌门(平均相对丰度>0.1%)为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。Ascomycota为茄芯烟叶二次发酵过程中的绝对优势菌门,相对丰度在71.61%~98.16%之间,表明Ascomycota在茄芯烟叶二次发酵过程中起重要作用。Basidiomycota随着发酵时间的增加,相对丰度整体上呈降低趋势,在发酵5 d时相对丰度最高(28.39%)。
由图4B可知,在属水平上,茄芯烟叶在二次发酵过程中检测到的优势真菌属(平均相对丰度>0.1%)有、节担菌属()、链格孢属()等。其中在二次发酵过程中占绝对优势,其相对丰度均在85.00%以上(5 d除外)。为发酵5 d时的次优势菌属,相对丰度为28.36%,明显高于其他发酵时间,发酵20 d时相对丰度最低(1.79%)。与匍柄霉属()在发酵过程中的相对丰度皆呈波动变化,其波动范围分别在0.42%~4.46%、0.14%~2.02%之间。由图3B、4B可知,基于属水平上,茄芯烟叶在二次发酵过程中的细菌种类明显高于真菌。

图4 茄芯烟叶二次发酵过程中真菌群落基于门水平(A)和属水平(B)的相对丰度
2.4 二次发酵过程中茄芯烟叶细菌和真菌群落LEfSe分析
采用LEfSe(以LDA值>2且<0.05作为差异筛选阈值)分析茄芯烟叶在不同发酵时期下细菌和真菌群落由门至属(或种)分类级别的差异显著性。由图5A可知,在属水平上,发酵0 d时茄芯烟叶中细菌丰度差异显著的物种有8种,主要是鞘脂单胞菌属()、短小杆菌属()等;在发酵5 d时有5种,其中包括、甲基杆菌属()等;泛菌属()为发酵10 d的差异显著菌属;发酵15 d时为、螯合球菌属()等。发酵20 d时烟叶中存在显著差异的细菌为。
由图5B可知,茄芯烟叶二次发酵过程中的标志性真菌均来自Basidiomycota和Ascomycota。基于科分类水平上,发酵0~15 d之间茄芯烟叶的标志性真菌群落存在显著性差异,发酵20 d时无显著差异。发酵0 d时亚隔孢壳科(Didymellaceae)、Symbiotaphrin- aceae为差异显著菌科;发酵5 d时,银耳科(Tremellaceae)、Symmetrosporaceae为差异显著菌科;肉座菌科(Hypocreaceae)、叶点霉科(Phyllostictaceae)分别在发酵10 d、15 d时起关键性作用。

图5 茄芯烟叶不同发酵时期细菌(A)和真菌(B)群落LEfSe分析
3 讨论
本研究以四川德雪三号初次发酵茄芯烟叶为试验材料,分析茄芯烟叶在二次发酵过程中细菌和真菌群落多样性及种群结构。Alpha多样性结果表明,茄芯烟叶在二次发酵过程中细菌群落丰富度与多样性差别较大,发酵前烟叶细菌群落多样性与丰富度明显高于发酵后,而真菌群落的丰富度与多样性差别较小,随发酵时间的增加整体上呈降低趋势。同一发酵时间下,细菌群落的丰富度与多样性明显高于真菌群落,表明细菌在茄芯烟叶二次发酵过程中起主导作用。
在二次发酵过程中茄芯烟叶的细菌群落结构较为复杂。在门水平上,随着发酵时间的增加,茄芯烟叶中的主要优势菌门由变形菌门转变为厚壁菌门,这与周家喜等[13]对烟叶不同陈化时间下的优势菌门研究结果一致。拟杆菌门、放线菌门等主要富集在发酵前期,发酵后期的相对丰度较低。在属水平上,葡萄球菌属为二次发酵过程中的绝对优势菌属,且随着发酵时间的增加整体呈升高趋势。发酵前期的次优势菌属为假单胞菌属、马赛菌属等,发酵末期的次优势菌属为芽孢杆菌属、土地芽孢杆菌属等,这与张鸽等[14]对茄衣发酵过程中优势菌属的研究结果有所差异,可能与不同产区烟叶本身素质以及发酵温度等有关。研究发现,葡萄球菌可以快速代谢烟叶中的还原糖、苹果酸和柠檬酸等,这些有机酸等是影响烟草吸食品质的重要化学成分之一[15-16]。芽孢杆菌可以降解烟叶中的蛋白质、淀粉等大分子物质,将硝酸盐还原为亚硝酸盐等[17-18]。茄芯烟叶在二次发酵过程中真菌群落结构较为单一,子囊菌门和曲霉属为绝对优势菌群,这与叶长文等[11]采用高通量测序技术对雪茄烟中真菌优势菌群的研究结果一致。除此之外,担子菌门、节菌属、链格孢霉属等为发酵过程中的次优势菌群。研究发现,曲霉菌具有隔绝空气、抑制有害菌生长、改善烟叶品质等功能[19-21]。如米曲霉和黑曲霉用于烟叶发酵可降低烟叶中的淀粉含量[22];曲霉属菌株SZ14用于烟叶发酵后可增加烟叶中有机酸和石油醚提取物的含量,显著提高烟叶感官质量等[23]。曲霉同样是引起烟叶霉变的关键菌属,因此在二次发酵过程中需要合理设置温湿度以及烟叶含水率等以控制曲霉属的繁殖,减少烟叶霉变[24]。茄芯烟叶在二次发酵过程中细菌和真菌群落结构的变化可能与烟叶pH、化学成分含量、含水率等密切相关[25-26],有研究表明细菌和真菌主要依靠烟叶有机物中的能量和碳源进行生长[27];烟叶含水率较低会影响烟叶内含物质的转化,进而影响细菌和真菌群落的种类和丰度。除此之外,可能是因为烟叶中部分细菌或真菌难以适应人工发酵条件,且菌群之间存在竞争关系,导致菌群的生长受到抑制[28]。
本研究对茄芯烟叶在二次发酵过程中细菌和真菌群落结构多样性进行了分析,明确了二次发酵过程中的主要优势菌群,为分离筛选优势功能菌株提供理论依据。下一步将结合茄芯烟叶在发酵过程中内在品质和感官质量等变化,深入挖掘细菌和真菌在二次发酵过程中的具体作用,探索其作用机理,进一步改善茄芯烟叶发酵工艺,以提升茄芯烟叶品质。
4 结论
本研究通过高通量测序技术对茄芯烟叶二次发酵过程中细菌和真菌群落多样性变化进行了分析。结果表明,茄芯烟叶在二次发酵过程中共检测出细菌18门314属,真菌5门79属,其中细菌群落多样性高于真菌,随着发酵时间的增加,细菌和真菌群落多样性和丰富度整体上呈降低趋势。在属水平上,不同发酵时间茄芯烟叶细菌和真菌群落组成结构相似,相对丰度含量有明显差异。整个发酵过程中的主要优势细菌属为葡萄球菌属,次优势细菌属由假单胞菌属、马赛菌属等逐渐演变为芽孢杆菌属、土地芽孢杆菌属。曲霉属为绝对优势真菌属,相对丰度随着发酵时间的增加整体上呈上升趋势。该结论为后续优势功能菌的分离筛选及探究细菌和真菌群落演替机理提供科学依据。
[1] 陈栋,李猛,王荣浩,等. 国产雪茄茄芯烟叶研究进展[J]. 扬州大学学报(农业与生命科学版),2019, 40(1): 83-90.
CHEN Dong, LI Meng, WANG Ronghao, et al. Progress of the domestic cigar filler tobacco[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2019, 40(1): 83-90.
[2] 郭文龙,丁松爽,刘路路,等. 翻堆对初次发酵过程中雪茄茄芯烟叶质量变化的影响[J]. 南方农业学报,2021, 52(2): 365-373.
GUO Wenlong, DING Songshuang, LIU Lulu, et al. Effects of pile turning on the quality change of cigar core tobacco leaf during primary fermentation[J]. Journal of Southern Agriculture, 2021, 52(2): 365-373.
[3] Reid J J, Mckinstry D W, Haley D E. Studies on the ferment of tobacco Ⅰ. the microflora of cured and fermenting cigar-leaf tobacco[J]. Pennsylvania Agricultural Experiment Station Bulletin, 1937, 356: 1-17.
[4] 赵铭钦,李芳芳. 微生物和酶学技术在烟草发酵中的应用及展望[J]. 中国农学通报,2007(1): 314-318.
ZHAO Mingqin, LI Fangfang. The application and prospect of the technology of Microbe and enzyme during tobacco leaf fermentation [J]. Chinese Agricultural Science Bulletin, 2007(1): 314-318.
[5] 张晓娟. 雪茄外包皮烟人工发酵工艺及叶表微生物区系研究[D].郑州:河南农业大学, 2006.
ZHANG Xiaojuan. Studies on artificial fermentation and microflora on leaf surface of cigar-wrapper tobacco[D]. Henan Agricultural University, 2006.
[6] 杜佳,张晓娟,吴钢,等. 雪茄茄衣人工发酵过程中叶面微生物区系研究[J]. 生物技术进展,2016, 6(03): 188-192, 230.
DU Jia, ZHANG Xiaojuan, WU Gang, et al. Studies on leaf surface microflora of cigar-wrapper during artificial fermentation[J]. Current Biotechnology, 2016, 6(03): 188-192, 230.
[7] 许文涛,郭星,罗云波,等. 微生物菌群多样性分析方法的研究进展[J]. 食品科学, 2009, 30(7): 258-265.
XU Wentao, GUO Xing, LUO Yunbo, et al. Research progress on analysis methods of diversity of microbial flora[J]. Food Science, 2009, 30(7): 258-265.
[8] 宁亚丽,吴跃,何嫱,等. 基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J]. 食品科学, 2019, 40(16):107-114.
NING Yali, WU Yue, HE Qiang, et al. Analysis of microbial community diversity in Chinese Korean traditional rice wine and Its starter culture using high-throughput sequencing[J]. Food Science, 2019, 40(16): 107-114.
[9] 周家喜,喻理飞,张晓敏,等. 仓储烟叶表面真菌群落组成分析[J]. 菌物学报, 2018, 37(4): 434-443.
ZHOU Jiaxi, YU Lifei, ZHANG Xiaomin, et al. Analysis of fungal community composition on the stored tobacco surfaces[J]. Mycosystema, 2018, 37(4): 434-443.
[10] 张鸽,梁开朝,辛玉华,等. 基于高通量测序和传统分离研究雪茄外包皮表面细菌多样性及演替[J]. 应用与环境生物学报, 2018,24(4): 783-788.
ZHANG Ge, LIANG Kaichao, XIN Yuhua, et al. Diversity and succession of bacteria during the fermentation of a cigar wrapper using high throughput sequencing technology and traditional isolation[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(4): 783-788.
[11] 叶长文,李璐,贺琛,等. 基于高通量测序的雪茄烟微生物群落结构和多样性分析[J]. 烟草科技,2021, 54(8): 1-9.
YE Changwen, LI Lu, HE Chen, et al. Structure and diversity analysis of microbial communities in cigar products by high-throughput sequencing technology[J]. Tobacco Science & Technology, 2021, 54(8): 1-9.
[12] Segata N, Izard J, Waldron L, Gevers D, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 201,12(6):60.
[13] 周家喜,喻理飞,张健,等. 烟叶陈化过程细菌群落演替特征[J]. 生态学报,2018, 38(21): 7739-7748.
ZHOU Jiaxi, YU Lifei, ZHANG Jian, et al. Study on the characteristics of bacterial community succession in tobacco aging[J]. Acta Ecologica Sinica, 2018, 38(21): 7739-7748.
[14] 张鸽,李志豪,邓帅军,等. 海南H382雪茄烟叶不同发酵周期细菌群落多样性表征及演替分析[J]. 中国烟草学报,2021, 27(2): 117-126.
ZHANG Ge, LI Zhihao, DENG Shuaijun, et al. Characterization and succession analysis of bacterial community diversity in different fermentation cycles of Hainan H382 cigar leaf[J]. Acta Tabacaria Sinica, 2021, 27(2): 117-126.
[15] Di G M, Paolino M, Silvestro D, et al. Microbial community structure and dynamics of dark fire-cured tobacco fermentation. Applied and Environmental Microbiology, 2007, 73(3): 825-837.
[16] 全琳,谭方利,郭瑞,等. 烟草有机酸研究进展[J]. 江西农业学报, 2010, 22(11): 68-72.
QUAN Lin, TAN Fangli, GUO Rui, et al. Research progress in organic acids in tobacco[J]. Acta Agriculturae Jiangxi, 2010, 22(11): 68-72.
[17] 冯志珍,陈太春,胡喜怀,等. 烟叶表面高效降解蛋白质芽孢杆菌的分离筛选及其鉴定[J]. 中国烟草学报,2012, 18(1): 101- 105.
FENG Zhizhen, CHEN Taichun, HU Xihuai, et al. Solation, screen and identification ofwith high proteolytic activity from tobacco leaf surfaces[J]. Acta Tabacaria Sinica, 2012, 18(1): 101-105.
[18] Fisher M T, Bennett C B, Hayes A, et al. Sources of and technical approaches for the abatement of tobacco specific nitrosamine formation in moist smokeless tobacco products[J]. Food & Chemical Toxicology, 2012, 50(3-4): 942-948.
[19] Nunes C, Coimbra M A, Saraiva J, et al. Study of the volatile components of a candied plum and estimation of their contribution to the aroma[J]. Food Chemistry, 2008, 111(4): 897-905.
[20] 谢佳伟,彭小祠,陈小巧,等. 云烟87内生真菌多样性及其促生作用评估[J]. 云南农业大学学报(自然科学),2021, 36(6): 1000-1008.
XIE Jiawei, PENG Xiaoci, CHEN Xiaoqiao, et al. Diversity of endophytic fungi from Yunyan87 and evaluation of growth- promoting[J]. Journal of Yunnan Agricultural University (Natural Science), 2021, 36(6): 1000-1008.
[21] 徐洁,张修国,张天宇,等. 微生物真菌菌剂对烟叶品质的影响[J]. 西南农业大学学报(自然科学版),2005(2): 163-168, 172.
XU Jie, ZHANG Xiuguo, ZHANG Tianyu. Improving tobacco quality by epiphyte agents[J]. Journal of Southwest University (Natural Science Edition), 2005(2): 163-168, 172.
[22] 覃明娟,陈森林,赵强忠,等. 植物乳杆菌在改善各产区烟叶品质中的应用[J]. 食品与机械,2020, 36(5): 199-204, 226.
QIN Mingjuan, CHEN Senlin, ZHAO Qiangzhong, et al. Application ofimproving the quality of tobacco leaves from different regions[J]. Food&Machinery, 2020, 36(5): 199-204, 226.
[23] 高文霞,程祖锌,王峰吉. 烤烟有益真菌菌株的筛选与鉴定[J].中国烟草学报,2011, 17(5): 90-95.
GAO Wenxia, CHENG Zuxin, WANG Fengji. Identification and evaluation of beneficial fungal strains for improving quality of flue-cured tobacco[J]. Acta Tabacaria Sinica, 2011, 17(5): 90–95.
[24] 张真娜,张桂治,陈进家,等. 醇化过程中烤烟烟叶表面可培养真菌的多样性[J]. 烟草科技,2018, 51(12): 23-30.
ZHANG Zhenna, ZHANG Guizhi, CHEN Jinjia, et al. Diversity of culturable fungi on surface of tobacco leaves during aging[J]. Tobacco Science & Technology, 2018, 51(12): 23-30.
[25] 浦绍占,马永凯,刘敏,等. 玉溪地区自然陈化烟叶表面可培养细菌多样性研究[J]. 中国微生态学杂志,2016, 28(8): 920-925.
PU Shaozhan, MA Yongkai, LIU Min, et al. Diversity of culturable bacteria on the surface of naturally aged tobacco leaves in Yuxi region[J]. Chinese Journal of Microecology, 2016, 28(8): 920-925.
[26] 牟丹,周家喜,张鑫,等. 烟叶陈化过程可培养微生物的生态功能[J]. 微生物学通报,2020, 47(2): 362-369.
MOU Dan, ZHOU Jiaxi, ZHANG Xin, et al. Ecological function of culturable microorganisms during tobacco leaf aging[J]. Microbiology China, 2020, 47(2): 362-369.
[27] 田丽君,荊永锋,郑卜凡,等. 浏阳洞库陈化烟叶微生物多样性分析[J]. 中国烟草学报,2022, 28(01): 98-107.
TIAN Lijun, JING Yongfeng, ZHENG Bufan, et al. Analysis of microbial diversity of aged tobacco leaves in Liuyang Cave[J]. Acta Tabacaria Sinica, 2022, 28(01): 98-107.
[28] HUANG Kuo, JIANG Qipeng, LIU Lihua, et al. Exploring the key microbial changes in the rhizosphere that affect the occurrence of tobacco root-knot nematodes[J]. AMB Express,2020, 10(1).
Analysis of bacterial and fungal community diversity during industrial secondary fermentation of cigar core tobacco leaves
ZHENG Linlin1, ZHAO Liang2, CAI Xinghua2, CHEN Zhen2, CHAI Zhishun3, SHI Xiangdong1*
1 Laboratory of Tobacco Cultivation for Tobacco Industry, Henan Agricultural University, Zhengzhou 450000C, China;2 Technology Center of China Tobacco Zhejiang Industrial Co., Ltd., Hangzhou 310024, China;3 Greatwall Cigar Factory, China Tobacco Sichuan Industrial Co., Ltd., Shifang 618400, China
[] This study aims to analyze the bacterial and fungal community diversity and the dynamic change of bacterial community during the secondary fermentation process of cigar core tobacco leaves. [] Taking the primary fermentation of tobacco leaves of Dexue No.3 as the test material, the bacterial and fungal community structure and abundance information of bacterial and fungal during secondary fermentation at 0, 5, 10, 15 and 20 days were analyzed by the Illumina MiSeq high-throughput sequencing technology. [] The results showed that the abundance and diversity of bacterial and fungal communities during the secondary fermentation process of cigar core tobacco leaves were generally decreased. The bacterial communities Chao1, ACE and Shannon indices were the highest at 0d of fermentation, which were 423.38, 424.40 and 4.67, respectively. The Chao1 index and ACE index of fungal communities were the highest at 10d of fermentation, which were 85.82 and 89.49, respectively. In the phylum level, with the increase of fermentation time, the dominant bacteria phylum changed from Proteobacteria to Firmicutes. Ascomycota was the main dominant fungal phylum, with the relative abundance ranging between 71.61% and 98.16%. In the level of genera,was the main dominant genus, and the relative abundance showed an overall upward trend with the increase of fermentation time, and the abundance was the largest (91.25%) at 15d; Secondary dominant bacteria were transformed from,toand;was an absolute dominant fungus with an average abundance of 87.40%. The results of LEfSe analysis showed that 21 species of bacteria had significant differences at the genus level and 6 species of fungi had significant differences at the family level. [] The number and types of bacteria and fungi during the secondary fermentation process of cigar core tobacco leaves decreased. At the genus level, the composition of bacterial and fungal communities in cigar core tobacco at different fermentation times was similar, the relative abundance was obviously different, andandwere the main dominant bacteria in the secondary fermentation process.
cigar core tobacco leaves; fermentation time; bacterial diversity; fungal diversity; high-throughput sequencing
. Email:yancaoshixd@163.com
郑霖霖,赵亮,蔡兴华,等. 雪茄茄芯烟叶工业二次发酵过程中细菌与真菌群落多样性变化分析[J]. 中国烟草学报,2022,28(5).
ZHENG Linlin, ZHAO Liang, CAI Xinghua, et al. Analysis of bacterial and fungal community diversity during industrial secondary fermentation of cigar core tobacco leaves[J]. Acta Tabacaria Sinica, 2022,28(5).
10.16472/j.chinatobacco. 2022.T0035
浙江中烟工业有限责任公司科技项目“雪茄茄芯烟叶微生物发酵技术研究”(QG/ZY-SK-005/06);四川中烟工业有限责任公司中式雪茄“醇甜香”品类构建重大专项项目(ctx201902)
郑霖霖(1998—),硕士研究生,主要研究雪茄烟调制与发酵方向,Email:zhenglinlin7544@163.com
时向东(1966—),Email:yancaoshixd@163.com
2022-02-25;
2022-06-21
