基于代谢组学分析青枯病烟田土壤代谢标志物
2022-11-10王瑞谭军樊俊向必坤
王瑞,谭军,樊俊,向必坤
基于代谢组学分析青枯病烟田土壤代谢标志物
王瑞*,谭军,樊俊,向必坤
湖北省烟草公司恩施州公司,湖北省恩施市施州大道119号 445000
【目的】分析青枯病烟田和健康烟田土壤代谢物组成的差异,筛选青枯病烟田土壤代谢标志物。【方法】以青枯病烟田和健康烟田的烟株根围土壤为研究对象,采用非靶向代谢组学LC-MS/MS分析技术,对3个时期(未发病、发病中期、发病后期)土壤代谢物组成进行研究。【结果】(1)在未发病时、发病中期和发病后期,青枯病烟田和健康烟田土壤代谢物有显著差异的代谢物分别为115种、159种和105种。(2)3个时期共同差异代谢物有63种,其中正离子模式代谢物有49种,负离子模式代谢物有14种。49种正离子模式代谢物可以聚为2个大类和7个小类。(3)筛选出8种代谢标志物,分别为环巴胺(Cyclopamine)、麦芽四糖(Maltotetraose)、麦黄酮(Tricine)、凯林(Khellin)、6-(alpha-D-glucosaminyl)-1D-myo-inositol、茄啶(Solanidine)、贝磷地尔(belfosdil)、硅雄酮(Silandrone)。【结论】青枯病烟田和健康烟田土壤代谢物组成上存在较大差异,筛选出8种代谢标志物可为判别土壤感烟草青枯病状况提供一定参考。
烟草青枯病;根围土壤;非靶向代谢组学;代谢标志物
烟草青枯病是由青枯劳尔氏菌()引起的土传细菌性病害,是烟草主要毁灭性病害之一,给烟叶生产造成巨大的经济损失[1]。土壤病害抑制性是指土壤在病原体存在、易感宿主植物和有利气候条件下也能抑制病害严重发生的能力[2]。在烟叶生产实践中发现一些土壤虽然连作多年,却能够抑制烟草青枯病的发生[3]。针对这种土壤抑制病害的生物和非生物因子方面研究很多,特别是近年来随着宏基因组学技术发展和应用,使人们更加深入了解调控病害的微生物物种、群落结构以及功能基因等[4-9]。但是,目前对土壤抑制病害的机制依然不是很清楚,破译这种机制仍然具有很大挑战性。
代谢组学(Metabolomics)是对生物或细胞在特定生理期内全部低分子量(<1000 Da)代谢产物同时进行定性和定量分析的新兴学科[10]。代谢组学是更接近于表型的组学,是转录组学和蛋白质组学的延伸,能够更直接、更准确地反映生物体的生理状态。通过对代谢物分析,可以揭示土壤以及与土壤生态系统表型相关的微生物、植物等生物体生理状态[11],进一步鉴别不同土壤微生物群落特征[12],反映微生物基因组与环境的相互作用从而提出了一种评估土壤健康的新方法[13]。继宏基因组学之后,代谢组学成为进一步研究土壤抑制病害功能机制的重要方法之一[13]。然而,应用代谢组学技术开展土壤抑制青枯病方面研究还是一个空白。
植物根围土壤中分布着大量的微生物,根围微生物和植物互生互利,植物为根围微生物提供碳源、氮源及其他营养物质,根围微生物帮助植物更好地吸收土壤中的矿质营养并提供大量促进植物生长的激素等物质,同时由于占据有效生态位,也具有有效防御病原菌侵害等作用[14]。微生物的代谢物、根系分泌物以及一些过程产物等在根围大量汇集,相互影响、相互作用。有研究表明,烟株感染病原体后,根系分泌物也会发生改变,进而影响土壤微生物和化学性状[15]。用苯并噻唑硫酮对感染青枯病烟株进行灌根处理,根围土壤细菌群落结构发生改变,有益菌相对丰度增加,从而起到防控青枯病的作用[16]。因此,根围土壤代谢物受到土壤条件、作物生长以及病原侵染等多种因素的影响,是植物和土壤生物组合对生物和非生物因子的响应。本研究采用非靶向代谢组学方法分析青枯病和健康烟田烟株根围土壤差异代谢物,探讨判别青枯病烟田土壤代谢标志物,为评估植烟土壤健康提供新的思路。
1 材料与方法
1.1 试验地概况
试验地位于湖北省恩施土家族苗族自治州宣恩县椒园镇凉风村,29.97°N,109.38°E,海拔750 m。该区域属于亚热带湿润气候,年降雨量为1400~1500 mm,年平均气温为16.5℃。选择两块地形地貌相同、土壤类型一致(碳酸盐山地黄棕壤土)的相邻烟田。据调查,两块烟田均连续种植烤烟近10年,其中一块基本无土传病害,作为健康烟田(代号JKT);另一块烟田近5年来均在成熟期爆发青枯病,作为发病烟田(代号FBT)。两块烟田基础肥力基本一致,但健康烟田土壤pH 值比发病烟田高0.85个单位,见表1。2019年4月25日在两块烟田移栽烤烟,品种为云烟87,除不进行根茎部病害防治外,其它均按当地标准化生产规程进行操作。
表1 土壤基础肥力状况
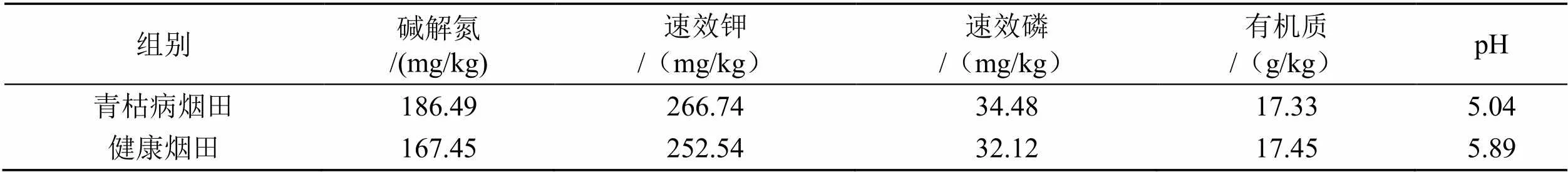
Tab.1 Soil foundation fertility
1.2 试验设计
6月25日进行第1次取样。此时两块烟田均开始进入成熟期,大田表现正常一致。将此阶段作为未发病时期,分别用FBT1和JKT1表示。两块烟田各自选取5株生长一致烟株进行挂牌标记,并进行第1次根围土壤取样。
7月2日,发病烟田普遍表现出青枯病症状,标记的5株烟株开始出现半边萎蔫现象,而健康烟田的烟株普遍生长发育正常。按照代谢组学研究需要,每块烟田补充1株样本进行挂牌标记。7月9日进行第2次取样。发病烟田标记的6株烟株一侧明显萎蔫,但茎杆未见黑色条斑。健康烟田标记的6株烟生长发育正常。此阶段作为发病中期,分别用FBT2和JKT2表示。
7月23日进行第3次取样。发病烟田标记的6株烟整株枯萎,茎杆见明显黑色条斑,根部变黑腐烂。健康烟田除1株在取土样时发现存在根系发黑状况,其它5株均正常。此阶段作为发病后期,分别用FBT3和JKT3表示。
1.3 根围土壤样品的采集与处理
围绕标记烟株均匀选取距茎秆20 cm处4个点,从垄体表面向下打20 cm深孔取土样,去除表层10 cm土壤,混合均匀,过20目土壤筛,去除植物根、动物残体以及其他杂质,取1 g左右土壤,装入5 mL离心管,并用封口膜封口,液氮速冻15 min,-80℃保存。每次打孔取样后,将多余土壤均匀回填,尽量减少对烟株干扰,3次取样打孔位置不重复。
1.4 土壤代谢物提取
取100 mg土壤样本,置入EP管中,加入500 μL含0.1%甲酸的80%甲醇水溶液,涡旋震荡,沐浴静置5 min,15000 r/min,4℃离心10 min,取一定量的上清加质谱级水稀释至甲醇含量为53%,并置入离心管中,15000 r/min,4℃离心10 min,收集上清,进样LC-MS进行分析。
从每个实验样本中取等体积样本混匀作为QC样本。进样前的QC用于监测进样前仪器状态及平衡色谱-质谱系统。每10个样本中间插入1个QC,用于评价整个实验过程中系统稳定性并进行样本相关性分析。
空白对照(blank样本)为含0.1%甲酸的53%甲醇水溶液代替实验样本,前处理过程与实验样本相同。
1.5 LC-MS/MS检测代谢谱
LC-MS/MS分析采用Thermo Vanquish超高效液相色谱系统,联用Thermo QE系列质谱,由北京诺禾致源科技股份有限公司分析。将样品注入色谱柱 (100 mm×2.1 mm,1.9 μm),采用16 min线性梯度,流速为0.3 mL/min。正离子模式的洗脱液为洗脱液A(0.1%甲酸水溶液)和洗脱液B(甲醇)。负离子模式的洗脱液为洗脱液A(5 mmol/L醋酸铵,pH 9.0)和洗脱液B(甲醇)。溶剂梯度设置如下:2% B,1.5 min;100% B,12.0 min;100% B,14.0 min;2% B,14.1 min;2% B,17.0 min。Thermo QE质谱仪在正负极性模式下工作,喷雾电压为3.2 kV,毛细管温度为320℃,鞘气流速为35 arb,辅助气体流速为10 arb。
1.6 代谢物的鉴定
将下机数据(.raw)文件导入CD搜库软件中,进行保留时间、质荷比等参数的简单筛选,然后对不同样品根据保留时间偏差0.2 min和质量偏差5 ppm进行峰对齐,使鉴定更准确。随后根据设置的质量偏差5 ppm,信号强度偏差30%,信噪比3、最小信号强度100000,加和离子等信息进行峰提取,同时对峰面积进行定量,再整合目标离子,然后通过分子离子峰和碎片离子进行分子式的预测并与mzCloud、mzVault和Masslist数据库进行比对,用blank样本去除背景离子,得到样本的原始定量值,并用QC1样本进行标准化,具体为:样本代谢物原始定量值/(样本代谢物定量值总和/QC1样本代谢物定量值总和)。
2 结果
2.1 主成分分析
各样品能够鉴定出的代谢物种类均为894种,其中正离子模式下有700种,负离子模式下有194种。对3个时期的发病土(FBT)和健康土(JKT)两组样品分别进行主成分分析(Principal Component Analysis,PCA)(图1)。从图1可以看出,在未发病时期,无论正、负离子模式下,两组样本均处于各自的95%的置信区间内,病田土和健康土显著区分。在发病中期,正离子模式下两组样本虽有一定交集,但基本能够区分开来;负离子模式下,两组样本均处于各自的95%的置信区间内,病田土和健康土显著区分。在发病后期,无论正、负离子模式下,两组样本互相交集,尤其是负离子模式下,病田土和健康土不能明显区分。

注:图中横坐标PC1和纵坐标PC2分别表示排名第一和第二的主成分的得分。不同颜色的散点表示不同组的样本,数字是各样本在定量表格中的位置编号,椭圆为95%的置信区间。
2.2 差异代谢物多组比较Venn图分析
图2是3个测定时期感病土壤和健康土壤有显著差异的代谢物及其它们之间共有和特有差异代谢物的Venn图。在正离子模式下,未发病时、发病中期和发病后期病田土和健康土壤之间有显著差异的代谢物分别有115种、159种和105种,3个时期共有的显著差异代谢物有49种。在负离子模式下,未发病时、发病中期和发病后期病田土和健康土壤之间有显著差异的代谢物分别有40种、46种和32种,3个时期共有的显著差异代谢物有14种。在两种模式下,差异代谢物数量均表现出随着发病程度推进先增大后下降的趋势。正离子模式下的49种共有差异代谢物和负离子模式下14种共有差异代谢物在未发病、发病中期以及发病后期均一直存在,这些代谢物可能是病田土和健康土差异的主要代谢标志物。
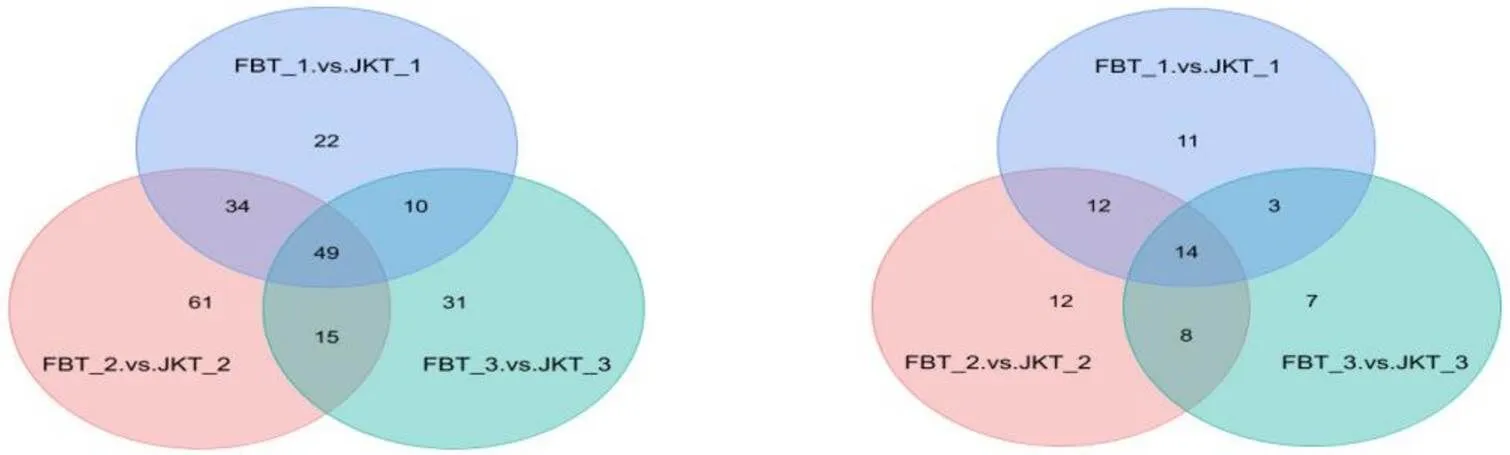
图2 三个时期差异代谢物多组比较Venn图(左图框为正离子模式;右图框为负离子模式)
2.3 差异代谢物火山图分析
图3是3个时期两组样本差异代谢物火山图。从图3可以看出,无论是在正离子模式下还是在负离子模式下,各时期病田土较健康土上调的差异代谢物比下调的代谢物都要多,特别是负离子模式下这种差异愈加明显。从表2可以看出,在正离子模式下,在未发病时、发病中期和发病后期病田土较健康土上调的差异的代谢物分别为81种、138种和74种,而下调的差异代谢物分别为34种、21种和31种。在负离子模式下,在未发病时、发病中期和发病后期病田土较健康土上调的差异的代谢物分别为39种、41种和24种,而下调的差异代谢物分别为1种、5种和8种。

注:横坐标表示代谢物在不同分组中的表达倍数变化(log2FoldChange),纵坐标表示差异显著性水平(-log10p-value),火山图中每个点代表一个代谢物,显著上调(发病土较健康土定量值高)的代谢物用红色点表示,显著下调(发病土较健康土定量值低)的代谢物用绿色点表示,圆点的大小代表VIP值。设定log2(FC)阈值为> 1.5,且P< 0.05。
表2 代谢物差异分析结果

Tab.2 Analysis results of differentially expressed metabolite
2.4 共同差异代谢物聚类热图分析
图4是3个时期共同差异代谢物聚类热图。在正离子模式下,虽然49种共同差异代谢物在3个时期上调或下调差异程度不同,但趋势同步。49种代谢物可聚分为两大类:一类为发病土较健康土下调的,有13种(图中a);另一类为上调的,有36种(图中b)。13种下调代谢物可聚分为3类:第一类有4种(图中c),主要表现为在健康组中前期丰度低而后期高;第二类有3种(图中d),主要表现为在健康组中各时期丰度比较均衡;第三类有6种(图中e),主要表现为在健康组中前期丰度高而后期丰度低。36种上调代谢物可聚分为4类:第一类有9种(图中f),主要表现为在发病组中前期丰度高而后期丰度低;第二类有10种(图中g),主要表现为在发病组中中期丰度高而前、后期丰度低;第三类14种(图中h),主要表现为在发病组中各时期丰度比较均衡;第四类有3种(图中i),主要表现为在发病组中前、后期丰度高而中期丰度低。在负离子模式下,虽然14种共同差异代谢物在3个时期上调或下调差异程度不同,但趋势同步,发病土较健康土均为上调,没有下调。

图4 共同差异代谢物聚类热图(上图框为正离子模式;下图框为负离子模式)
2.5 代谢标志物筛选
假设感青枯病土壤和健康土壤差异代谢标志物具备3个条件:一是各个时期均有显著差异,即3个时期的共同差异物;二是在烟株发育各个时期的丰度比较恒定;三是健康组和发病组的差异在各个时期比较恒定。满足第1个条件共有63种,其中正离子模式有49种,负离子模式有14种(见图2)。满足前两个条件的有21种,在正离子模式下有17种(见图4中d和h),在负离子模式下有4种(图4)。表3列出21种代谢物名称和反映各时期差异表达倍数变化(log2 FoldChange)、值。从表3可以看出,除编码为Com_1668_pos代谢物外,其他20种代谢物在3个时期差异表达倍数变化较为恒定。从差异的显著水平来看,3个时期差异均达到极显著水平(<0.01)的代谢物只有8种,分别为Cyclopamine(环巴胺,编号Com_4208_pos)、Maltotetraose (麦芽四糖,编号Com_ 1698_pos)、Tricine(麦黄酮,编号Com_3695_pos)、Khellin(凯林,编号为Com_2806_pos)、6-(alpha- D-glucosaminyl)-1D-myo-inositol (编号为Com_3101_ pos)、Solanidine(茄啶,编号为Com_3152_pos)、belfosdil(贝磷地尔,编号Com_3513_pos、Silandrone(硅雄酮,编号为Com_563_neg)。这8种代谢物基本可以同时满足我们假设的3种条件,可作为感青枯病土壤代谢标志物。表4列出了8种代谢物在3个时期健康土和发病土中相对表达量,从表4可以看出,8种代谢物在健康土和发病土中相对表达量差异非常明显,除Cyclopamine(环巴胺)外,其它7种物质均是感烟草青枯病土壤较健康土壤上调。8种代谢物在3个时期相对表达量变化幅度较小,比较恒定。
表3 21种共同差异代谢物在三个时期差异表达倍数和值

Tab.3 The differential expression fold value and P value of 21 common differentially expressed metabolites in three stages
续表3

身份编号ID化合物名称Name_des指标时期 未发病发病中期发病后期 Com_3152_posSolanidinelog2FC2.712.642.00 P值<0.01<0.01<0.01 Com_3513_posbelfosdillog2FC2.312.272.33 P值<0.01<0.01<0.01 Com_596_negVS1150000log2FC2.042.172.31 P值<0.010.017<0.01 Com_10_negPalmitoleic acidlog2FC2.142.111.93 P值<0.010.0110.013 Com_563_negSilandronelog2FC2.262.211.94 P值<0.01<0.01<0.01 Com_465_negPregnane-3,20-dionelog2FC2.352.352.04 P值<0.010.0110.016
表4 8种差异代谢物在三个时期相对表达量

Tab.4 The relative expression of 8 differentially expressed metabolites in three stages
3 讨论
有研究表明,烟草长期连作后根系分泌的化感自毒物质逐渐积累是诱导烟草青枯病发生的重要因素之一[17-18]。然而,根际分泌物本身含量较低、成分复杂,对其收集、分离和鉴定仍然采用传统方法,与植物大田生长状况有很大脱离,而且绝大多数根系分泌物会直接作为底物被微生物利用,其组成和含量随土壤性质的变化差异很大,从而导致对根系分泌物的研究工作困难很大[19-20]。本研究将894种代谢物与已报道的烟株根系分泌物[21-22]进行比较,只有少量相同的物质。根际土壤代谢物是根际土壤微生态有益微生物、土传病原体以及宿主相互作用结果,根系分泌物进入根际土壤后,在微生物的作用下会很快地转化,不会以根系代谢物形式进行积累。总体看来,感烟草青枯病土壤较健康土壤上调代谢物比下调代谢物种类要多,特别是在负离子代谢物更加明显,这与李丽等[23]对西洋参感根腐病土壤和健康土壤差异代谢物比较分析后得出的规律基本一致。可能的原因是上调代谢物的积累促进青枯病发生,或者是根际土壤在青枯劳尔氏菌()、宿主和其它微生物的共同作用下产生了更多上调代谢物。
Margarita Ros等[13]对抑制小叶莴苣腐霉菌土壤进行的代谢组学分析表明,抑制性土壤、中间性和非抑制性土壤之间均存在分离。本研究中,本研究基于代谢物质的相对丰度进行主成分分析(PCA),可以看出,即使烟株未表现出发病症状,发病烟田和健康烟田根围土壤代谢物就存在显著差异,反而在发病后期两类土壤代谢物差异缩小。可能的原因是:本研究选取的健康土是相对的,并不是完全抑病,在生长后期少数烟株表现出根系发黑、腐烂状况,也受到青枯病原菌的感染。感病烟株根际土壤代谢物的趋同使两类土壤聚类互相交错,不能明显分离开来。这也可以解释在发病后期两类土壤显著差异代谢物的种类从205种下降到137种的原因。
筛选差异代谢物是代谢组学研究中最基本的工作,一般是将对照组和试验组全部代谢物质进行比对,寻找丰度改变有统计意义的代谢物。Helen L. Hayden等[11]首次应用非靶向代谢组学方法来区分抑制谷类作物立枯病土壤和非抑制性土壤,并推论大果桉醛(macrocarpal)是抑制病害的生物标志物。李丽等[23]在西洋参感根腐病土壤和健康土壤之间找到了13种差异代谢物。在高度复杂的土壤生态系统中,代谢物时刻在发生改变,筛选某一时间点差异代谢物作为生物标志物(Biomaker)是以往研究中的不足之处。本研究中,本研究比较3个时期感青枯病土壤和健康土壤代谢物相对丰度,找到63种代谢物始终存在显著差异,即共同差异代谢物。通过对63种共同差异代谢物进行聚类,大概描绘了烟草青枯病土壤和健康土壤代谢物的差异图谱。为进一步缩小代谢标志物范围,本研究又提出了两个筛选条件:一是在3个时期的相对丰度比较恒定,即不能忽高忽低,变化太大(见图4和表3);二是健康组和发病组的差异在三时期比较恒定,即三个时期两组差异倍数和显著水平比较一致(见表2和表3)。由此筛选出8种代谢标志物,分别为Cyclopamine(环巴胺)、Maltotetraose(麦芽四糖)、Tricine(麦黄酮)、Khellin(凯林)、6-(alpha-D- glucosaminyl)-1D-myo-inositol、Solanidine(茄啶)、belfosdil (贝磷地尔)、Silandrone(硅雄酮)。
上述8种代谢标志物中,正离子模式下有7种,负离子模式下有1种。感烟草青枯病土壤较健康土壤上调代谢物有7种,下调代谢物有1种。8种代谢标志物在KEGG数据库能够进行功能和分类注释的有两种,一种是Khellin(凯林),其与植物次生代谢产物的生物合成代谢途径有关。凯林(Khellin)在伞形科植物阿密茴中大量存在,感青枯病土壤是否更适合伞形科植物的生长有待进一步考察。另一种是Solanidine(茄啶),其与萜类和多酮类化合物的代谢途径有关。Solanidine(茄啶)属于糖苷生物碱,在茄科和一些百合科植物中存在,具有抗拒病原微生物侵袭从而保护植物的作用[24]。其在感烟草青枯病土壤中表达量增高,可能是因为属于茄科烟草作物受到青枯劳尔氏菌(Ralstonia solanacearum)侵染后的应激反应,产生了较多量的Solanidine(茄啶)。环巴胺(Cyclopamine)是唯一的下调代谢物,人们首次从藜芦属植物山藜芦中分离得到一种异甾体类生物碱,目前文献报道仅限于抑制肿瘤细胞方面研究[25],未见与植物病害、土壤微生物相关联研究。至于其在抑制青枯病土壤中含量会增高的原因有待进一步探索。麦芽四糖(saltotetraose)属麦芽低聚糖中的直链麦芽低聚糖;麦黄酮(Tricine)是一种多酚类物质,这两类物质也具有抗拒病原微生物侵袭从而保护植物的作用[26]。贝磷地尔(belfosdil)是一种抗高血压药物,硅雄酮为长效和强效同化激素,能促进体内蛋白合成的功能,这两类物质与植物、土壤之间有什么联系目前还不清楚。
4 结论
青枯病烟田和健康烟田土壤代谢物组成上存在明显差异。在未发病时、发病中期和发病后期,健康烟株和感病烟株根际土壤代谢物有显著差异的代谢物分别为115种、159种和105种,3个时期共同差异代谢物有63种。根据差异代谢物的各时期相对丰度稳定性和差异恒定性,筛选出8种代谢标志物,分别为环巴胺(Cyclopamine)、麦芽四糖(Maltotetraose)、麦黄酮(Tricine)、凯林(Khellin)、6-(alpha-D-glucosaminyl)-1D-myo-inositol、茄啶(Solanidine)、贝磷地尔(belfosdil)、硅雄酮(Silandrone)。这8种代谢标志物可为判别土壤感烟草青枯病状况提供一定参考。
[1] 施河丽,向必坤,谭军,等. 烟草青枯病发病烟株根际土壤细菌群落分析[J]. 中国烟草学报,2018, 24(5):57-59.
SHI Heli, XIANG Bikun, TAN Jun, et al. Analysis of bacterial community in rhizosphere soil of tobacco plant infected by bacterial wilt disease[J]. Acta Tabacaria Sinica, 2018, 24(5): 57-59.
[2] Baker K, Cook R J. Biological Control of Plant Pathogens[M]. San Francisco:W.H. Freeman, 1974:433.
[3] 王瑞,邓建强,谭军. 连作条件下的植烟土壤保育与修复[J]. 中国烟草科学,2016, 37(2):83-87.
WANG Rui, DENG Jianqiang, TAN Jun. Ecological protection and remediation of tobacco-Growing soils in continuous cropping regions[J]. Chinese Tobacco Science,2016,37(2):83-87.
[4] 谭军,王昌军,孟贵星,等. 恩施植烟土壤理化性状对烟草青枯病发生影响的初步分析[J]. 中国烟草科学,2012, 33(6):93-96.
TAN Jun, WANG Changjun, MENG Guixing, et al. Effects of soil physical and chemical properties on tobacco bacterial wilt in Enshi[J]. Chinese Tobacco Science, 2012, 33(6): 93-96.
[5] Xiaojiao Liu, Shuting Zhang, Qipeng Jiang, et al. Using community analysis to explore bacterial indicators for disease suppression of tobacco bacterial wilt[J]. Scientific Reports, 2016, 6: 36773.
[6] Hongchun ZHANG, Rui WANG, Shu Chen, et al. Microbial taxa and functional genes shift in degraded soil with bacterial wilt[J]. Scientific Reports, 2017, 7: 39911.
[7] Penton, C R, Gupta V V S R, Tiedje J M, et al. Fungal community structure in disease suppressive soils assessed by 28S LSUgene sequencing[J]. PLoS One, 2014. 9(4): 93893.
[8] Hayden, H L, Savin K W, Wadeson J, et al. Comparative metatranscriptomics of wheat rhizosphere microbiomes in disease suppressive and non-suppressive soils forAG8[J]. Frontiers in Microbiol, 2018, 9: 859.
[9] Yaru Ding, Yulan Chen,Zhengquan Lin, et al. Differences in Soil microbial community composition between suppressive and root rot-conducive in tobacco Fields[J]. Current Microbiology, 2021, 1-10.
[10] Jeremy K. Nicholson, John C. Lindon. Metabolomics[J]. Nature, 2008, 455, 1054-1056.
[11] Hayden Helen L, Rochfort Simone J, Ezernieks Vilnis, et al. Metabolomics approaches for the discrimination of disease suppressive soils forAG8 in cereal crops using 1H NMR a n d LC-MS [J]. Science of The Total Environment, 2019, 651(1): 1627-1638.
[12] Abram F. Systems-based approaches to unravel multi-species microbial community functioning[J]. Computational and Structural Biotechnology Journal. 2015, 13, 24-32.
[13] Margarita Rosa, Maria Almagrob, Juan Antonio Fernándezc, et al. Approaches for the discrimination of suppressive soils forirregulare disease[J]. Applied Soil Ecology, 2020, 147.
[14] 何小丽. 白玉兰根围细菌及菌根真菌遗传多样性分析[J]. 浙江农业科学,2021, 62(4): 737-740.
HE Xiaoli. Analiysis on community structure of bacteria and mycorrhizal fungi inrhizosphere[J]. Zhejiang Agricultural Science, 2021, 62(4): 737-740.
[15] Raaijmakers J M, Paulitz T C, Steinberg C, et al. The rhizosphere: a playground and battlefield for soilborne pathogens and beneficial microorganisms[J]. Plant and soil, 2009,321(1-2): 341-361.
[16] 向立刚,汪汉成,郭华,等. 基于盆栽试验的苯并噻唑硫酮对感染青枯病烟株根围土壤细菌群落结构的影响[J]. 烟草科技,2020, 53(10): 1-9.
XIANGLigang, WANG Hancheng, GUO Hua, et al. Effects of 3-methylbenzothiazole-2-thione on community structure of bacteria in rhizospheric soil of tobacco plants infected by bacterial wilt[J]. Tobacco Science & Technology, 2020, 53(10): 1-9.
[17] Li Shili, Xu C, Wang J, et al. Cinnamic, myristic and fumaric acids in tobacco root exudates induce the infection of plants by[J]. Plant and Soil, 2017, 412(1-2): 381-395.
[18] 李石力. 有机酸类根系分泌物影响烟草青枯病发生的机制研究[D]. 重庆:西南大学,2017.
LI Shili. The mechanism research of tobacco bacterial wilt influenced by organic acid from root exudates[D]. Chongqing: Southwest University, 2017.
[19] 李汛,段增强. 植物根系分泌物的研究方法[J]. 基因组学与应用生物学,2013, 32(4): 540-547.
LI Xun,DUAN Zengqiang.Progress on the research methods for root exudates[J]. Genomics and Applied Biology, 2013, 32(4): 540-547.
[20] Vives-Peris V, Ollas C D, Gomez-Cadenas A, et al., Root exudates: from plant to rhizosphere and beyond[J]. Plant Cell Rep, 2020, 39(1): 3-17.
[21] 陈冬梅,杨宇虹,晋艳,等. 连作烤烟根际土壤自毒物质成分分析[J]. 草业科学,2011, 28(10): 1766-1769.
CHEN Dongmei, YANG Yuhong, JIN Yan, et al. Constituents of autotoxic chemical from rhizosphere soil under flue-cured tobacco continuous cropping[J]. Pratacultural Science, 2011, 28(10): 1766- 1769.
[22] 刘艳霞,沈宏,李想,等. 烟草青枯病劳尔氏菌与拮抗菌对根系分泌物的竞争作用[J]. 微生物学报,2020, 60(2): 333-348.
LIU Yanxia, SHEN Hong, LI Xiang, et al. Competitive use of plant root exudates bycausing tobacco bacterial wilt and its antagonistic bacterium LX4[J]. Acta Microbiologica Sinica, 2020, 60(2): 333-348.
[23] 李丽,蒋景龙. 基于代谢组学分析根腐病西洋参根际土壤特异代谢物. [N/OL]. 分子植物育种. http://kns.cnki.net/kcms/detail/ 46. 1068.S.20200911.0844.002.html
LI Li, JIANG Jinglong. Analysis of specific metabolites in rhizosphere soil of panax quinquefolius L. with Root Rot Diseases Based on Metabolomics[N/OL]. Molecular Plant Breeding. http:// kns.cnki.net/kcms/detail/46.1068.S.20200911.0844.002.html
[24] 赵雪淞,李盛钰,何大俊,等. 马铃薯糖苷生物碱抗真菌活性构效关系研究[J]. 食品工业科技,2013, 34(6): 159-162.
ZHAO Xuesong, LI Shengyu, HE Dajun, et al. Structure-antifungal activity relationships of potato glycoalkaloids[J]. Science and Technology of Food Industry, 2013, 34(6): 159-162.
[25] 郭修晗,郑晓红,王世盛, 等. 藜芦胺类似物的合成及体外抗肿瘤活性研究[J]. 精细化工,2015, 32(11): 1266-1230.
GUO Xiuhan,ZHENG Xiaohong,WANG Shisheng, et al. Synthesis of veratramine analogs and evaluation of their antiproliferative activities on cancer cell in vitro[J]. FINE CHEMICALS, 2015, 32(11): 1266-1230.
[26] Moheb A, Grondin M, Ibrahim RK, et al. Winter wheat hull ( husk) is a valuable source for tricin, a potential selective cytotoxic agent[J]. Food Chemistry, 2013, 138(2-3): 931-937.
Analysis of metabolic markers in soil with tobacco bacterial wilt based on metabolomics
WANG Rui, TAN Jun, FAN Jun, XIANG Bikun
Enshi Tobacco Company of Hubei Province, No.119, Shizhou Road, Enshi, 445000, Hubei, China
[] This study aims to analyze difference of soil metabolites composition between healthy tobacco field and field with bacterial wilt, and screen metabolic markers. [] By taking the rhizosphere soil of diseased plants and healthy plants as the research object and using LC-MS / MS analyzing technology of nontargeted metabonomics, the metabolites composition in rhizosphere soil in three periods was studied. [] (1) There were 115, 159 and 105 metabolites significantly different between healthy tobacco field and field with bacterial wilt at non-onset, middle onset and late onset stages, respectively. (2) There were 63 common differential metabolites in the three stages, including 49 positive and 14 negative metabolites. The 49 positive metabolites could b be clustered into two groups and seven subgroups. (3) A total of 8 metabolic markers were screened, including cyclopamine, maltotetraose, Tricine, khelin, 6 - (alpha-d- glucosaminyl) - 1D myo inositol, solanidine, belfosdil and silandrone. [] There were significant different in the composition of rhizosphere soil metabolites between healthy and diseased tobacco plants. The 8 metabolic markers screened out could provide support for the identification of soil infection with tobacco bacterial wilt.
tobacco bacterial wilt, rhizosphere soil, non-targeted metabonomics, metabolic markers
. Email:wangrui2999@126.com
王瑞,谭军,樊俊,等. 基于代谢组学分析青枯病烟田土壤代谢标志物[J]. 中国烟草学报,2022,28(5).
WANG Rui, TAN Jun, FAN Jun, et al. Analysis of metabolic markers in soil with tobaccobacterial wilt based on metabolomics[J]. Acta Tabacaria Sinica, 2022,28(5).
10.16472/j.chinatobacco. 2021.028
中国烟草总公司重大科技项目“防控烟草青枯病微生物菌群的构建及其产品创制”(合同号:110202101054(LS-14))、中国烟草总公司湖北省公司重点科技项目“土壤培养组学研究及其在烟草青枯病防控上的应用”(合同号:027Y2019-010)
王瑞(1975—),博士,研究员,主要研究方向:土壤环境与微生物工程,Tel:13597809575,Email:wangrui2999@126.com
2021-02-18;
2022-07-01
