烟草硝酸盐转运蛋白NtNRT1.5基因的克隆及功能分析
2022-11-10轩栋栋尹卓然康俊喻奇伟连文力罗勇丁永乐贾宏昉
轩栋栋,尹卓然,康俊,喻奇伟,连文力,罗勇,丁永乐*,贾宏昉
生物技术
烟草硝酸盐转运蛋白基因的克隆及功能分析
轩栋栋1,尹卓然1,康俊2,喻奇伟2,连文力3,罗勇1,丁永乐1*,贾宏昉1
1 河南农业大学烟草学院,河南郑州 450002;2 贵州省烟草公司毕节市公司,贵州毕节 551700;3 厦门大学生命科学学院,福建厦门 361000
【背景和目的】低亲和硝酸盐转运蛋白NRT1家族基因在植物吸收和转运硝态氮过程中发挥重要作用,为研究烟草NRT1家族基因在烟草氮素利用中的作用。【方法】从栽培烟草品种K326中克隆获得的全长cDNA序列,利用生物信息分析、qRT-PCR技术和转基因技术系统分析基因的序列特征、表达模式及在提高烟草氮素利用效率方面的功能。【结果】全长序列包含1800 bp开放阅读框、编码599个氨基酸,编码的蛋白质具有NRT基因家族的共有结构特征,与拟南芥相似性达到59.28%。亚细胞定位结果表明NtNRT1.5蛋白定位在细胞膜上,其启动子中包含多个与硝酸盐(A(C/G)TCA)、胁迫(MYB)、根系特异表达(ROOT MOTIF BOX)相关的响应元件。表达模式分析结果表明主要在根部表达,其次是衰老叶片和茎,新叶基本不表达;低氮抑制其在根系中的表达,说明主要负责正常条件下的硝酸盐的吸收;低氮条件下,过表达显著提高了转基因烟株的氮素利用率。【结论】基因在烟草氮素的吸收和转运上行使重要功能,通过提高过表达烟草的氮素利用率,增加植株的生物量。本研究为后期培育烟草氮高效利用新品种提供了理论依据。
烟草;;基因克隆;硝酸盐转运
硝态氮和铵态氮是植物的两种最重要的氮素来源,烟草是喜硝态氮植物,烟草从土壤中吸收硝态氮主要通过硝酸盐转运蛋白完成[1-2]。目前,在高等植物中已发现两种硝酸盐转运系统:低亲和运输系统(LATS)和高亲和运输系统(HATS)[3]。这两种硝酸盐转运系统在烟草中分别由NRT1和NRT2家族基因进行编码和调控,在不同硝态氮浓度下发挥作用,影响硝酸根离子(NO3-)的吸收和转运[4-5]。因此对硝酸盐转运蛋白的研究有助于提高作物的氮素利用率。
目前,已在多种高等植物中克隆得到NRT1家族基因,如拟南芥、油菜、苜蓿、番茄和水稻等[6-8],研究发现该家族基因除受到NO3-的调控,还受盐、干旱、温度等非生物胁迫的影响[9-15]。拟南芥的基因主要负责对叶片中的硝酸盐进行再分配,在叶柄和叶脉表达[16];主要调控硝酸盐地下部向地上部的长距离运输[17];主要通过调控硝酸盐向母体的运输从而影响胚的早期发育[18];在叶片韧皮部的薄壁细胞中表达介导衰老叶片中硝酸盐的再利用[19]。Liu等报道了烟草和基因,但并未深入研究[20]。本研究前期根据NCBI数据库比对结果预测烟草中的NRT1家族成员有10个左右,从栽培烟草K326中克隆了烟草NRT1家族基因中的基因,初步对其生物信息学、亚细胞定位、表达模式和功能进行了研究,为进一步研究该基因的功能和利用基因改良烟草品种在氮素吸收和调控等方面提供理论依据。
1 材料与方法
1.1 供试材料与生长条件
1.1.1 供试材料
供试材料为烟草品种K326和基因过表达的K326转基因烟草。过表达材料是利用烟草根部cDNA为模板,通过设计的全长序列引物(-OX)扩增目的基因,然后经过酶切、回收,将目的基因连接在带有强启动子35S的pBWA(V)HS-GUS载体上,通过农杆菌介导转化烟草[21],最终获得13个过量表达的烟草株系,进一步通过qRT-PCR分析筛选了5个过量表达较好的烟草转基因株系(命名为OX1、OX2、OX3、OX4、OX5),室内繁种收取T0代种子,再加代获得T2代纯合植株用于本研究。
1.1.2 生长条件
挑选均匀饱满的种子进行消毒灭菌处理(75%(v/v)乙醇溶液消毒30 s,10%(v/v)次氯酸钠溶液中消毒7 min,无菌水洗涤6次),再将种子播种在海绵育苗盘中培养7 d催芽(使用蒸馏水暗培养)[22],人工智能培养箱中培养21 d(白天28℃,14 h,晚上22℃,10 h,每24 h循环;湿度60%),1~2 d使用蒸馏水培养,3~5 d(约长至2片子叶)使用1/4 Hoagland 营养液培养,5~7 d使用1/2 Hoagland营养液培养,7~14 d使用Hoagland营养液培养。
1.2 NtNRT1.5基因的克隆
根据绒毛烟草的全长基因序列(XM_033655011.1)设计引物(-OX),以栽培品种K326的根部cDNA为模板进行PCR扩增(扩增条件为:94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 2 min,35个循环,72℃5 min)。将扩增目的片段连接在中间载体pMD19-T(TaKaRa公司)上,送Invitrogen生物公司测序验证[23]。
表1 引物序列

Tab.1 Primer sequences
注:下划线标记处为酶切位点。
Note:The underlined markindicates the enzyme digestion site.
1.3 生物信息学分析
利用NCBI软件的ORFfinder(https://www.ncbi. nlm.nih.gov/orffinder/)进行基因序列的蛋白翻译;利用DNAMAN进行核苷酸序列比对;利用GEMA6.0进行氨基酸序列比对;利用ScanProsite(https:// prosite.expasy.org/scanprosite/)网站对蛋白特性进行预测;利用ExPASY提供的TMHMM Server(https:// services.healthtech.dtu.dk/service.php)进行跨膜结构域分析;利用PLANTCARE(http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)在线工具进行启动子序列元件分析。
1.4 亚细胞定位分析
设计特异引物(-YXB),扩增得到PCR产物,将PCR产物连接到pBWA(V)HS- GLosgfp载体上,将构建好的载体转化到大肠杆菌DH5a中,取阳性克隆测序验证。采用注射法将表达载体pBWA(V)HS-NtNRT1.5-GLosgfp导入烟草表皮细胞,并于22℃培养箱中培养30~60 h,在烟草表皮细胞中利用激光共聚焦显微镜观察荧光蛋白的位置。以pBWA(V)HS-GLosgfp空载体作为对照。
1.5 NtNRT1.5基因表达模式分析
培养70 d的烟株采用正常供氮(HN:5 mmol/L NO3-)和低氮(LN:0.25 mmol/L NO3-)处理7 d,分别使用Eastep® Super Total RNA Extraction Kit(上海普洛麦格生物产品有限公司)提取样品根、茎、新叶和老叶(新叶为完全展开的叶片从上往下数第2片,老叶为完全展开的叶片从上往下数第7片)的总RNA,测定所提总RNA的OD260/280值,并用1.2%琼脂糖凝胶电泳检测其完整性,使用HiScript® III 1st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒(南京诺唯赞生物技术有限公司)进行反转录,反转录后作为qRT-PCR反应的模板。引物(qRT-)设计采用Primer Premier 5.0软件。qRT-PCR反应按照Taq Pro Universal SYBR qPCR Master Mix荧光定量试剂盒(南京诺唯赞生物技术有限公司)说明书进行,3次重复,内参基因为烟草组成型表达基因(NCBI登录号:L18908.1)。数据用2-△△Ct法处理,分析基因在烟草各个组织中的相对表达量。
1.6 NtNRT1.5基因功能分析
1.6.1 烟草表型观察及生物量统计
将萌发的野生型和过表达转化株系种子用Hoagland营养液培养28 d,正常供氮(HN:5 mmol/L NO3-)和低氮(LN:0.25 mmol/L NO3-)处理7 d后,观察60株烟苗的整体表型,并记录单株生物量,测定单株氮素积累量并计算氮素利用率。
1.6.2 烟草单株氮素积累量和氮素利用率的测定
每个处理选取10株烟苗,将叶片杀青烘干,作为待测样品。烟叶的总氮含量测定参照国家烟草行业标准YC/T161—2002[24]。烟叶的氮素积累量和氮素利用效率计算方法:烟叶氮素积累量(mg/株)=烟叶总氮含量(mg/g)×叶干重(g/株);烟叶氮素利用效率(Nitrogen utilization efficiency,NUE单位:mg DW/mg N)=叶片干物质重/烟叶氮素积累量[25]。
1.7 统计分析
使用t检验比较两个样本组,结果用平均值和相应的标准误差表示。使用IBM SPSS Statistics 软件版本21(IBM)进行统计分析。图片使用Origin2019(Origin Labinv,Northampton,MA,USA)软件绘制。
2 结果与分析
2.1 NtNRT1.5基因的克隆和序列分析
如图1所示,克隆所得的烟草基因序列长度为1800 bp,可编码599个氨基酸,与绒毛烟草相差2个氨基酸(该基因序列在NCBI上未发布),包括57个酸性氨基酸(AspGlu)残基,53个碱性氨基酸(ArgLys)残基。该基因编码的蛋白质分子量66386.71 Da,理论等电点为6.29,不稳定性指数(Ⅱ)为27.59,属于比较稳定的蛋白,与硝酸盐转运蛋白NRT1家族基因的蛋白特征相符。

图1 NtNRT1.5基因克隆
Blast序列比对分析结果表明(图2),本研究克隆所得的基因与烟草NRT1家族基因的同源性为32.64%,与拟南芥NRT1家族基因同源性高达49.27%,其中与基因的相似性高达59.28%,与桑树()、樱桃李()相似性高达60.03%。表明该cDNA序列为烟草NRT1家族基因的一员,将该基因命名为。

注:拟南芥AtNRT1.1(NP_563899.1),烟草NtNRT1.1s(AB102805.1),烟草NtNRT1.2s(AB102807.1),拟南芥AtNRT1.2(NP 564978.1),樱桃李PdNRT1.5(XP_034202431.1),拟南芥AtNRT1.8(OAO98110.1),拟南芥AtNRT1.5(XP_002893724.1),桑树MnNRT1.5(XP_010098931.1),拟南芥AtNRT1.6(CAA0245793.1),拟南芥AtNRT1.7(OAP15036.1),烟草NtNRT1.7(XP_016472647.1)。
2.2 NtNRT1.5生物信息学分析
2.2.1编码蛋白的跨膜结构域分析
蛋白跨膜结构分析结果表明(图3),编码蛋白包括6个N端的跨膜区朝向细胞内,以及5个C端的跨膜区朝向细胞外;12个疏水的跨膜区域由一个带电荷的中央亲水环分隔成2组。表明编码蛋白是膜整合蛋白,与NRT1家族共有的结构特征相一致。

图3 NtNRT1.5蛋白跨膜结构域分析
2.2.2同源性分析与功能预测
基因序列与部分高等植物中已知的NRT1家族基因的序列结果如图4所示,从系统发育树可看出,与的亲缘关系较近,推测其生理功能与接近。

图4 NtNRT1.5的同源性分析
2.2.3启动子分析
将基因启动子序列利用PLANTCARE程序对进行motif分析,发现很多与组织特异表达相关的启动子元件(图5),例如赤霉素响应元件GARE-motif、生长素应答相关的AuxRR-core、胁迫诱导相关的MYB、根系特异表达元件ROOT MOTIF BOX,还有可能与氮信号介导相关的DOFCOREZM (AAAG)和GATABOX(GATA),硝酸盐调控有关的A(C/G)TCA。启动子分析结果表明,可能仅在根部高表达,且表达量受硝酸盐和非生物胁迫诱导增强表达。
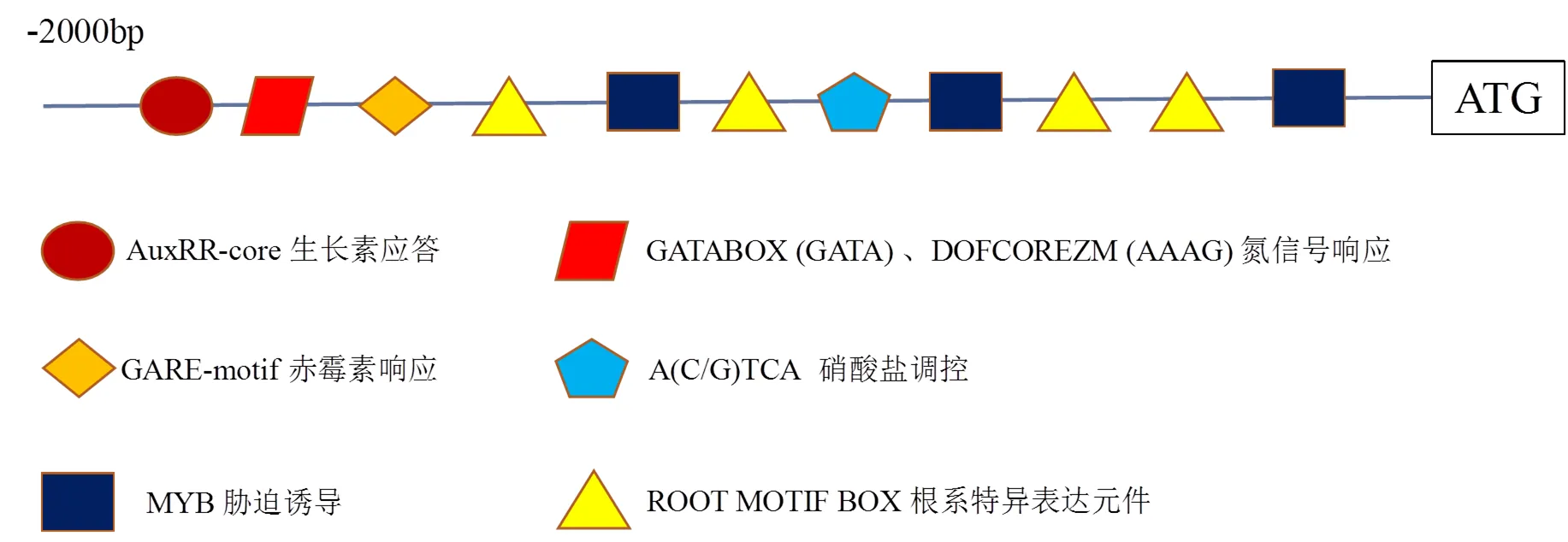
图5 NtNRT1.5启动子克隆及分析
2.3 NtNRT1.5蛋白的烟草表皮细胞亚细胞定位
基因表达蛋白在细胞中分布的检测结果表明(图6),该融合蛋白仅分布在细胞膜上。与NRT1家族基因编码蛋白多在细胞膜上表达的研究结果相一致,表明NtNRT1.5蛋白可能是硝酸盐转运蛋白。

图6 pBWA(V)HS-NtNRT1.5-GLosgfp蛋白在烟草表皮细胞中的亚细胞定位检测
2.4 NtNRT1.5表达特性及功能分析
2.4.1 不同氮素浓度下的组织表达特性分析
不同氮素浓度下基因的时空表达检测结果表明(图7),基因在根、茎和老叶均有表达,其中根部表达量最高,而新叶基本不表达。这与启动子分析中该基因根系特异表达的结果相一致。低氮条件下,基因在根部的表达量显著降低,表明表达量受硝酸盐调控;此外,低氮可以增加基因在茎和新叶的表达量,降低在老叶中的表达量,暗示也参与了硝酸盐从老叶到新叶的转运过程。

注:HN:正常供氮(5 mmol/L NO3-);LN:低氮(0.25 mmol/L NO3-);*和**分别表示在P<0.05 和P<0.01 水平差异显著,下同。
2.4.2 不同氮素浓度对转基因烟草生物量表型、氮素积累量及转化率的影响
为了研究的功能,通过转基因技术获得了13个过量表达的烟草株系,转基因烟草在不同氮素浓度下的表型、单株生物量、单株氮素积累量以及氮素转化率检测结果表明,在正常供氮条件下,过表达烟株与野生型(WT)烟草对比,生物量、氮素积累量和氮素利用率稍有提高。在低氮条件下,烟株长势明显较好,生物量更高,氮素积累量和氮素利用率显著提高(图8B,C,D)。这表明对烟草氮素的吸收和转运发挥着重要的作用。
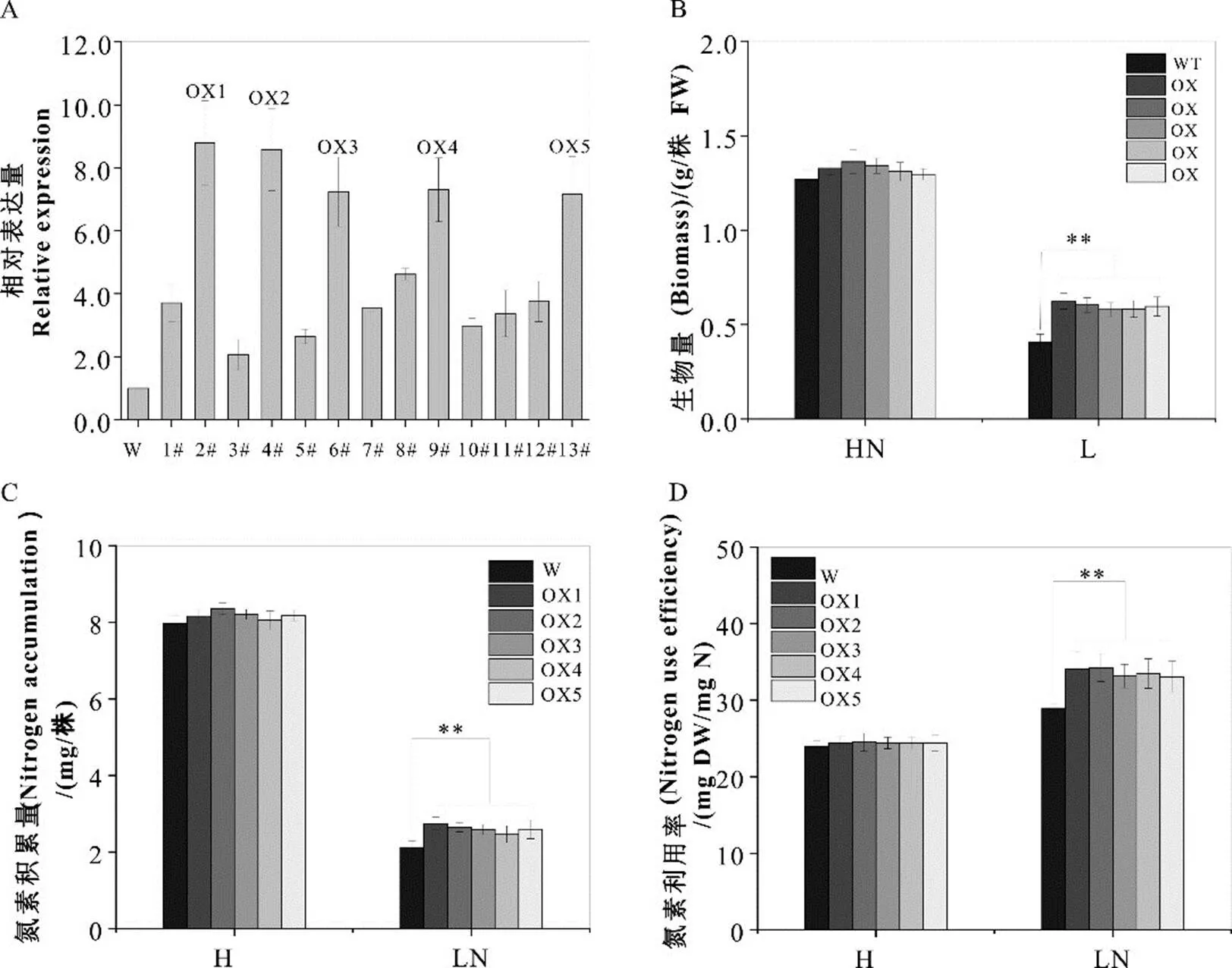
图8 不同氮素浓度对NtNRT1.5转基因烟草生物量表型、氮素积累量及转化率的影响
3 结论与讨论
本研究从普通烟草(K326)中克隆出一个新的烟草硝酸盐转运蛋白基因(命名为),该基因编码的蛋白质具有NRT家族基因的共有结构特征,亚细胞定位结果表明该蛋白是一个膜蛋白,与拟南芥NRT1家族同源性达到了49.27%。其中与基因的同源性最高,达到59.28%。进一步分析烟草基因的表达特征发现该基因主要在根部表达,且表达量受硝酸盐的诱导增强表达,表明该基因主要负责高浓度硝酸盐的吸收;过量表达可以显著提高烟草在低氮胁迫下的氮素利用效率。
植物低亲和硝酸盐转运蛋白基因家族成员一般含有450~600个氨基酸、12个跨膜区、在第6、7跨膜区之间由亲水环相连。本研究发现基因编码的蛋白与已报道的拟南芥和烟草等高等植物硝酸盐转运蛋白结构上具有高度的同源性,功能结构域高度保守,具有典型的低亲和转运蛋白家族成员特征,属于低亲和硝酸盐转运蛋白(NRT1)。系统进化树分析结果表明该基因与拟南芥中的基因的关系最近,可能主要负责硝酸盐的从地下部向地上部的转移,这与本研究的基因组织表达特征相一致。亚细胞定位的分析结果确定了基因编码蛋白在细胞膜上发挥分子功能,表明NtNRT1.5蛋白可能具有吸收和转运硝酸盐的功能。Lin等研究表明拟南芥根部的基因受硝酸盐调控表达量增加[15],本研究结果表明基因主要在根部表达,基因启动子中包含大量的Root motif box(ATATT)。本研究发现基因整体上受硝酸盐诱导增强表达,这与启动子分析中发现与氮信号相关的GATABOX(GATA)和DOFCOREZM(AAAG),硝酸盐调控有关的A(C/G)TCA的结果一致。本研究结果表明基因在烟草氮素的吸收和转运上行使重要功能。WATANABE S等研究表明参与植株生长发育过程中与非生物胁迫的互作[9],这与基因在盐胁迫作用下高表达的分析结果一致。Meng等研究表明可能参与钾元素吸收与利用[26],因此推测可能发挥类似作用,后期将进一步研究基因在硝酸盐吸收和钾素吸收过程中的功能。
目前关于烟草硝酸盐转运蛋白功能及调控机制的研究还很少。本研究通过对烟草低亲和硝酸盐转运蛋白家族成员基因进行克隆、亚细胞定位和表达分析,并通过转基因技术验证了其功能,为进一步通过分子改良研究烟草的氮高效利用新品种提供理论依据。
[1] 张合琼,张汉马,梁永书,等. 植物硝酸盐转运蛋白研究进展[J].植物生理学报,2016,052(2): 141-149.
ZHANG Heqiong, ZHANG Hanma, LIANG Yongshu, et al. Research progress of nitrate in plant transport mechanism[J]. Plant Physiology Journal, 2016, 52 (2): 141-149.
[2] LAURENCE L, PASCAL T, MARC L, et al. Molecular and functional regulation of two NO3– uptake systems by N-and C-status ofplants[J]. The Plant Journal,1999,18(5).
[3] 许金兰,谢小东,冯爽,等. 烟草硝酸盐转运蛋白基因的克隆及表达分析[J]. 烟草科技,2013(7):68-71, 79.
XU Jinlan,XIE Xiaodong,FENG Shuang,et al. Cloning and expression analysis of nitrate transporter gene () from[J]. Tobacco Science & Technology, 2013(7): 68-71, 79.
[4] Huang NC, Liu KH, Lo HJ, et al. Cloning and functional characterization of annitrate transporter gene that encodes a constitutive component of low-affinity uptake[J]. Plant Cell, 1999, 11(8):1381-1392.
[5] FAN X R, NAZ M, FAN X R, et al. Plant nitrate transporters: from gene function to application.[J]. Journal of experimental botany, 2017, 68(10).
[6] 冯素花. 茶树硝酸根转运蛋白、和基因的克隆与表达[D]. 北京:中国农业科学院,2014.
FENG Suhua. Cloning and expressing of the nitrogen transporter gene,andin tea plant[D]. Chinese Academy of Agricultural Sciences, 2014.
[7] 黄俊芳. 小麦硝酸盐转运蛋白基因的克隆与功能解析[D]. 太原:山西大学,2019.
HUANG Junfang. Cloning and functional analysis of nitrate transporter genein wheat[D].Shanxi University, 2019.
[8] 冯慧敏,陆宏,王汉卿,等. 水稻硝酸盐转运蛋白基因在氮素积累和转运中的功能研究[J]. 中国水稻科学, 2017, 31(5): 457-464.
FENG Huimin, LU Hong, WANG Hanqing, et al. Function analyses of rice nitrate transporter genein nitrogen accumulation and transport [J]. Chinese Journal of Rice Science, 2017,31(5):457-464.
[9] WATANABE S, TAKAHASHI N, KANNO Y, et al. TheNRT1/PTR FAMILY protein NPF7.3/NRT1.5 is an indole-3-butyric acid transporter involved in root gravitropism.[J]. Proceedings of the National Academy of Sciences of the United States of America,2020,117(49)
[10] ENVIRONMENTAL B. Study data from lanzhou university update knowledge of environmental botany (From the xerophyte zygophyllum xanthoxylum modulates salt and drought tolerance by regulating No3-, Na+and K+transport)[J]. Ecology Environment & Conservation, 2020.
[11] JIAN S F, LUO J S, LIAO Q, et al. NRT1.1 Regulates nitrate allocation and cadmium tolerance in arabidopsis.[J]. Frontiers in plant science, 2019,10.
[12] Cui YN, Li XT, Yuan JZ, et al. Nitrate transporterplays an essential role in regulating phosphate deficiency responses in Arabidopsis BIOCHEM BIOPH RES CO, 2019, 508(314).
[13] LI H, YU M, DU X Q, et al. NRT1.5/NPF7.3 functions as a Proton-Coupled H+/K+antiporter for K+loading into the xylem in.[J]. The Plant cell, 2017, 29(8).
[14] CHEN C Z, LV X F, LI J Y, et al.is another essential component in the regulation of nitrate reallocation and stress tolerance[J]. Plant Physiology, 2012,159(4).
[15] LIN S H, KUO H F, CANIVENC G, et al. Mutation of thenitrate transporter causes defective root-to-shoot nitrate transport[J]. The Plant Cell, 2008, 20(9).
[16] CHIU C C, LIN C S, HSIA A P, et al. Mutation of a nitrate transporter, AtNRT1:4, results in a reduced petiole nitrate content and altered leaf development.[J]. Plant & cell physiology, 2004, 45(9).
[17] LIN S H, KUO H F, CANIVENC G, et al. Mutation of thenitrate transporter causes defective root-to- shoot nitrate transport. Plant Cell, 2008.
[18] ALMAGRO A, LIN S H, YI F T. Characterization of thenitrate transporter NRT1.6 reveals a role of nitrate in early embryo development[J]. The Plant Cell, 2009, 20:3289-3299.
[19] FAN S C, LIN C S, HSU P K, et al. Thenitrate transporter, expressed in phloem, is responsible for source-to-sink remobilization of nitrate.[J]. Plant Cell, 2009, 21(9):2750-61.
[20] Liu Laihua, Fan Tengfei,. Coding-sequence identification and transcriptional profiling of nine amts and four nrts from tobacco revealed their differential regulation by developmental stages, nitrogen nutrition, and photoperiod[J]. Frontiers in Plant Science,2018,9:
[21] Bates L S, Waldren R P, Teare I D. Rapid determination of free proline for water-stress studies[J]. Plant Soil, 1973, 39(1): 205-207.
[22] Song Z P, Luo Y, Wang W F, et al. NtMYB12 positively regulates flavonol biosynthesis and enhances tolerance to low Pi stress in[J]. Frontiers in Plant Science, 2019, 10: 1683-1695.
[23] 康乐,张丽,张磊,等. 普通烟草钙依赖蛋白激酶的基因克隆及表达分析[J]. 中国烟草科学,2013, 34(3): 48-54.
KANG Le, ZHANG Li, ZHANG Lei, et al. Cloning and expression of calcium-dependent protein kinase 15 () in[J]. CHINESE TOBACCO SCIENCE, 2013, 34(3): 48-54.
[24] YC/T 161—2002烟草及烟草制品总氮的测定连续流动法[S].
YC/T 161-2002Tobacco and tobacco products - Determination of total nitrogen - continuous flow method[S].
[25] 冯雨晴,李亚飞,史宏志,等. 不同浓度钼酸钠对白肋烟苗期碳氮代谢和硝酸盐含量的影响[J]. 烟草科技,2019,52(12):1-9.
FENG Yuqing, LI Yafei, SHI Hongzhi, et al. Effects of sodium molybdate concentrations on carbon and nitrogen metabolismand nitrate content in seedlings of burley tobacco[J].Tobacco Science & Technology,2019,52(12):1-9.
[26] MENG S, PENG JS, HE YN, et al.mediates the suppression of nitratestarvation-induced leaf senescence by modulating foliar potassium level.[J]. Molecular plant,2016,9(3).
Cloning and functional analysis of nitrate transportergene in
XUAN Dongdong1, YIN Zhuoran1, KANG Jun2, YU Qiwei2, LIAN Wenli3, LUO Yong1, DING Yongle1*, JIA Hongfang1
1 Tobacco College, Henan Agricultural University, Zhengzhou 450002, China;2 Guizhou Bijie Municipal Tobacco Company, Guizhou University, Bijie 551700, China;3 School of Life Sciences, Xiamen University, Xiamen 361000, China
[] Low-affinity nitrate transporter NRT1 family genes play an important role in the absorption and transport of nitrate nitrogen in plants. []was cloned from cultivated tobacco variety K326. The bioinformation analysis, qRT-PCR and transgenic technology were used to systematically analyze the sequence characteristics, expression pattern ofand its function in improving nitrogen use efficiency of tobacco. []full-length sequence contains 1800bp open reading frame and encodes 599 amino acids. The encoded protein has the common structural characteristics of NRT gene family, which is 59.28% similar to that of arabidopsis. Subcellular localization showed thatprotein is located on the cell membrane, and its promoter contains multiple response elements related to nitrate(A(C/G)TCA), stress (MYB) and root motif box. Expression pattern analysis showed thatwas mainly expressed in roots, followed by senescent leaves and stems, but not in new leaves. Low nitrogen inhibited its expression in roots, indicating thatis mainly responsible for nitrate absorption under normal conditions. Under low nitrogen condition,overexpression ofsignificantly increased the nitrogen use efficiency of transgenic tobacco plants. []gene plays an important role in the absorption and transport of nitrogen in tobacco. It can increase the plant biomass by improving the nitrogen utilization rate of overexpressed tobacco. This study provides a theoretical basis for cultivating new varieties of tobacco with high nitrogen utilization in the later stage.
;; gene cloning; nitrate transport
. Email:dyle6037@henau.edu.cn
轩栋栋,尹卓然,康俊,等. 烟草硝酸盐转运蛋白NtNRT1.5基因的克隆及功能分析[J]. 中国烟草学报,2022,28(5).
XUAN Dongdong,YIN Zhuoran, KANG Jun, et al. Cloning and functional analysis of nitrate transporter NtNRT1.5 gene in Nicotiana tabacum[J]. Acta Tabacaria Sinica, 2022, 28(5).
10.16472/j.chinatobacco.2021.T0223
农业农村部烟草生物学与加工重点实验室开放课题“烟草NtNRT1.5参与硝酸盐吸收和转运的功能研究”(201802);河南省科技攻关项目“利用NtNRT2.5基因提高烟草氮素利用效率的研究”(202102110008);河南高校青年骨干教师培养计划(2019GGJS043)
轩栋栋(1997—),硕士研究生,研究方向为植物营养生理及分子生物学,Email:xuandong97@163.com
丁永乐(1964—),Email:dyle6037@henau.edu.cn
2021-12-01;
2022-04-22
