乌鳢源维氏气单胞菌的分离鉴定及其生物学特性研究
2022-11-10王晓磊谭劭雯李子雁温际富刘学美姜彤彤隋智海
王晓磊,谭劭雯,李子雁,温际富,刘学美,姜彤彤,隋智海*
(1.临沂大学教育学院,山东 临沂 276000;2.菲律宾克里斯汀大学国际学院,菲律 宾马尼拉 1004;3.临沂大学生命科学学院,山东 临沂 276000;4.齐鲁制药集团有限公司,山东 济南 250000;5.临沂市河东区农业农村局,山东 临沂 276034)
乌鳢(Channa argus),又称“黑鱼”“生鱼”,属鳢亚目,鳢科,鳢属,是一种重要的淡水经济鱼类,主要分布在亚洲和非洲,我国年产量可达50万t[1-2]。但随着养殖密度的不断提高,养殖环境被破坏,导致乌鳢病害频发,制约养殖业的健康发展[3-4]。常见的乌鳢细菌性疾病主要是由诺卡氏菌属(Nocardia)引发的诺卡氏菌病[5],由气单胞菌属(Aeromonas)引起的坏死性筋膜炎败血症[6],由爱德华氏菌属(Edwardsiella)引起的爱德华氏菌病[7]等。目前,病害防治主要以化学药物为主,而药物的大量使用,会加速病原菌产生耐药性,成为超级细菌,危害养殖业和生态环境的发展[8-9]。
维氏气单胞菌(Aeromonas veronii)是一种革兰阴性菌,属气单胞菌科,气单胞菌属,兼性厌氧菌,广泛分布在自然界中[10-11]。维氏气单胞菌具有较强的环境适应力,可感染宿主范围较广,包括淡水鱼、两栖动物、鸟类、哺乳动物等[12-13],目前,已从患病的鲫、罗非鱼、虹鳟、鲤等中分离并鉴定,成为威胁鱼类养殖业的病原菌之一[14-16]。在维氏气单胞菌感染发病过程中,其毒力因子如:气溶素、丝氨酸蛋白酶、细胞毒性肠毒素、细胞毒性肠毒素和黏附因子,发挥着重要作用[17-18]。因此,随着分离株日趋多样化,确定临床维氏气单胞菌分离株毒力相关因素,对了解其发病机理和流行病学至关重要[19]。
现从患病乌鳢肝脏、脾脏和肾脏等组织混合样品中,分离并纯化出一株优势菌株,采用革兰染色、16S rRNA和gyrB基因鉴定、生理生化试验等多种方法,确认此优势菌株是维氏气单胞菌。通过最适温度和最适pH值测定、药敏试验和毒力基因扩增分析,进一步了解评估其环境适应力、耐药特性及其致病机制,拟为维氏气单胞菌感染的预防和治疗提供科学指导。
1 材料与方法
1.1 试验材料
2021年4月,从山东省临沂市某乌鳢养殖场取濒临死亡的乌鳢,装入无菌袋,放置冰盒中,2 h内运至临沂大学生命科学院食品质量与加工实验室。
1.2 细菌分离、纯化及其形态观察
在无菌条件下,用75%乙醇棉球对乌鳢体表消毒,解剖后剪取部分肝脏、脾脏和肾脏,置于500 μL无菌PBS溶液中,用低速研磨器(北京天根生化科技有限公司)研磨成组织悬液,采用PBS溶液10倍稀释,涂布在LB固体培养基上,置于30℃中培养24 h,观察菌落生长情况。选取优势菌落再次划线接种于LB固体平板上纯化,30℃培养24 h,观察菌落形态特征。
1.3 革兰染色
按照革兰染色液试剂盒(青岛海博生物技术有限公司)说明书,从LB固体培养基上挑取单菌落于蒸馏水中混匀,均匀涂布在载玻片上,经结晶紫初染、碘液媒染、95%乙醇脱色和番红复染,干燥后置于光学显微镜下,用油镜观察其形态特征。
1.4 16S rRNA、gyrB基因序列扩增与系统发育分析
按照细菌基因组DNA提取试剂盒(天根生化科技有限公司,北京)说明书,LB液体培养细菌16 h,经离心后,提取其基因组DNA。随后,以其为模板,利用16S rRNA的通用引物27F/1492F和gyrB的引物对gyrB-F/gyrB-R分别扩增16S rRNA和gyrB基因,引物序列见表1[20-21]。PCR反应体系为:2×Taq Master Mix 25μL,上下游引物各2.5 μL,ddH2O 19 μL,DNA模板1 μL。PCR反应程序为:94℃预变性10 min;95℃变性30 s,60℃退火30 s,72℃延伸60~90 s,共30个循环;72℃延伸10 min。经1.2%琼脂糖凝胶电泳检测质量,送至生工生物工程(上海)股份有限公司测序。

表1 引物序列
经NCBI在线BLAST完成序列同源性分析,选取部分16S rRNA和gyrB基因序列,利用MEGA-X软件采用邻接法(Neighbor-Joining Method)构建系统进化树,分析序列同源性。

续表
1.5 生理生化特性鉴定
按照微量生化反应管(青岛海博生物技术有限公司)说明书,从LB固体平板上刮取菌落,于PBS中混匀,测定菌液在600 nm处的吸光值(OD600),并调至约0.2(0.5麦氏浊度),将50 μL细菌悬液接种至各类微量生化反应管,于30或42℃培养24 h,观察并记录反应管颜色变化,参照说明书鉴定细菌生理生化特性。
1.6 最适温度和最适pH值测定
将细菌接种至LB液体培养基中,过夜培养,5 000 r/min离心,PBS重悬,按照1%接种量转接至新鲜的液体LB中,分别置于25,30,37和40℃摇床中培养48 h,每个温度设置3个重复,每隔2 h测定OD600值,取平均值作为最终结果。以培养时间为横坐标,OD600值为纵坐标,绘制生长曲线,确定最适温度。随后按照1%的接种量,分别转接至pH值为5,6,7和8的新鲜液体LB中,置于37℃摇床中培养48 h,每个pH值设置3个重复,每隔2 h测定吸光值OD600,取平均值作为最终结果。绘制生长曲线,确定最适pH值。
1.7 药物敏感性试验
采用Kirby-Bauer纸片扩散法,测定细菌药物敏感性。用37℃震荡液体过夜培养细菌,用无菌PBS稀释至0.5麦氏标准浊度,涂布100 μL菌液于LB平板,贴上药敏纸片(杭州微生物试剂有限公司产品),置于37°C恒温培养24 h后,测量抑菌圈直径(mm),重复3次,取平均值。根据产品说明书,判定分离菌株的耐药程度。
1.8 毒力基因检测
以细菌基因组DNA为模板,参照文献[23]合成引物(表1),由生工生物工程(上海)股份有限公司合成,分别扩增检测细胞毒性肠毒素基因(act)、菌溶素基因(aer)、脂肪酶基因(lip)、丝氨酸蛋白酶基因(ser)、热不稳定肠毒素基因(alt)、热稳定肠毒素基因(ast)和鞭毛蛋白基因(fla)和弹性蛋白酶基因(ahyB)等8种维氏气单胞菌毒力基因。反应程序:94℃预变性10 min;94℃变性30 s、退火温度(表1)30 s、72℃延伸20~30 s,30个循环;72℃延伸10 min。扩增产物经1.2%琼脂糖凝胶电泳检测并观察结果。随后,PCR产物送至生工生物工程(上海)股份有限公司测序,经NCBI的Blastn比对,鉴定其序列是否正确,以确定菌株的毒力基因。
2 结果与分析
2.1 病原菌菌落形态及革兰染色
从乌鳢病变内脏组织中分离得到一株优势菌株(暂命名为WL-3)。将WL-3接种在LB固体培养基上,37℃过夜培养,可形成圆形、中间隆起、边缘整齐、表面光滑湿润且半透明的淡黄色菌落[图1(a)]。经革兰染色,WL-3在油镜下呈现红色、短杆状、两端钝圆的特征,是一种革兰阴性菌[图1(b)]。
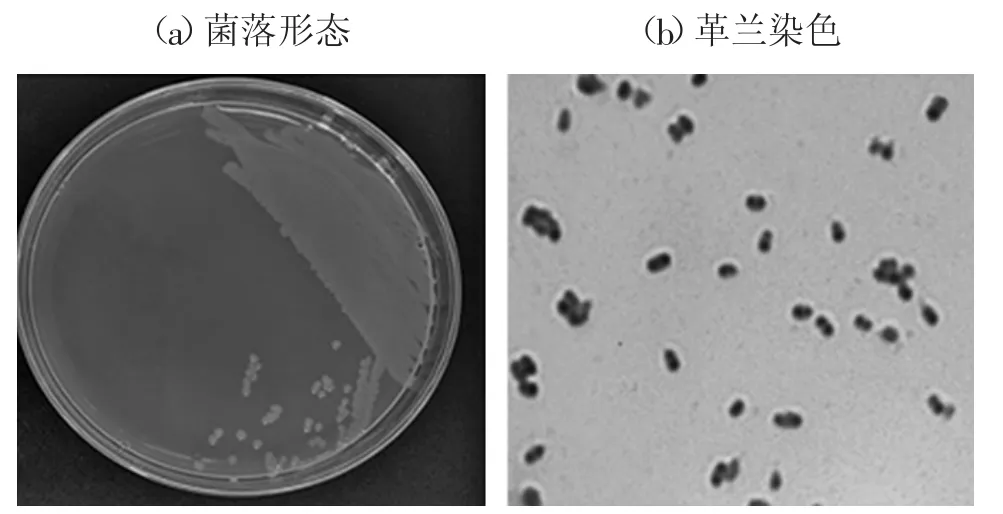
图1 菌株WL-3
2.2 16S rRNA和gyrB序列分析及系统发育分析
以WL-3基因组DNA为模板,利用引物对27F/1492F和gyrB-3F/gyrB-14R分别扩增16S rRNA和gyrB基因,结果见图2(a)(b)。由图2可见,16S rRNA扩增条带大小约为1 500 bp,gyrB扩增条带大小约为1 100 bp,均与预期目的片段大小一致。
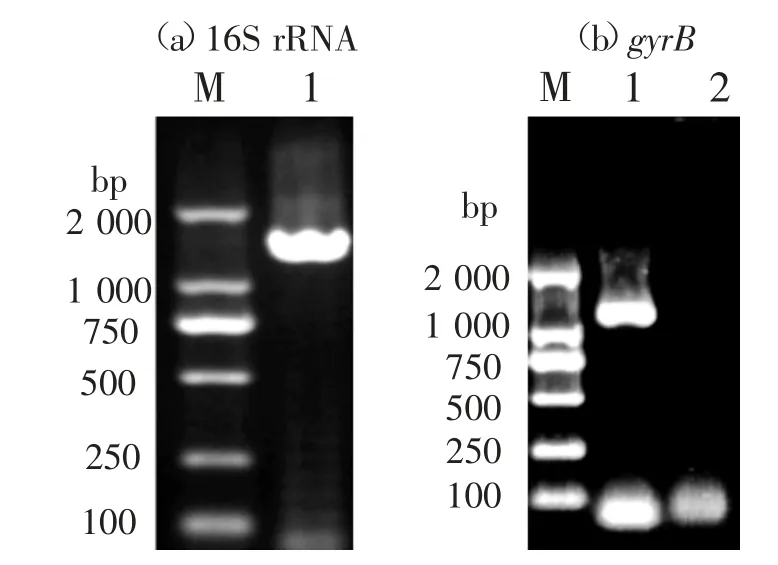
图2 基因PCR扩增
16S rRNA和gyrB基因序列经NCBI的Blastn比对分析见图3(a)(b)。由图3可见,均显示菌株WL-3与维氏气单胞菌的相似度最高,分别为99.70%(16S rRNA)和99.81%(gyrB)。从中选取部分同源性较高的同属菌株序列,利用Mega-X构建NJ系统进化树,显示菌株WL-3与维氏气单胞菌自然聚在一支中。
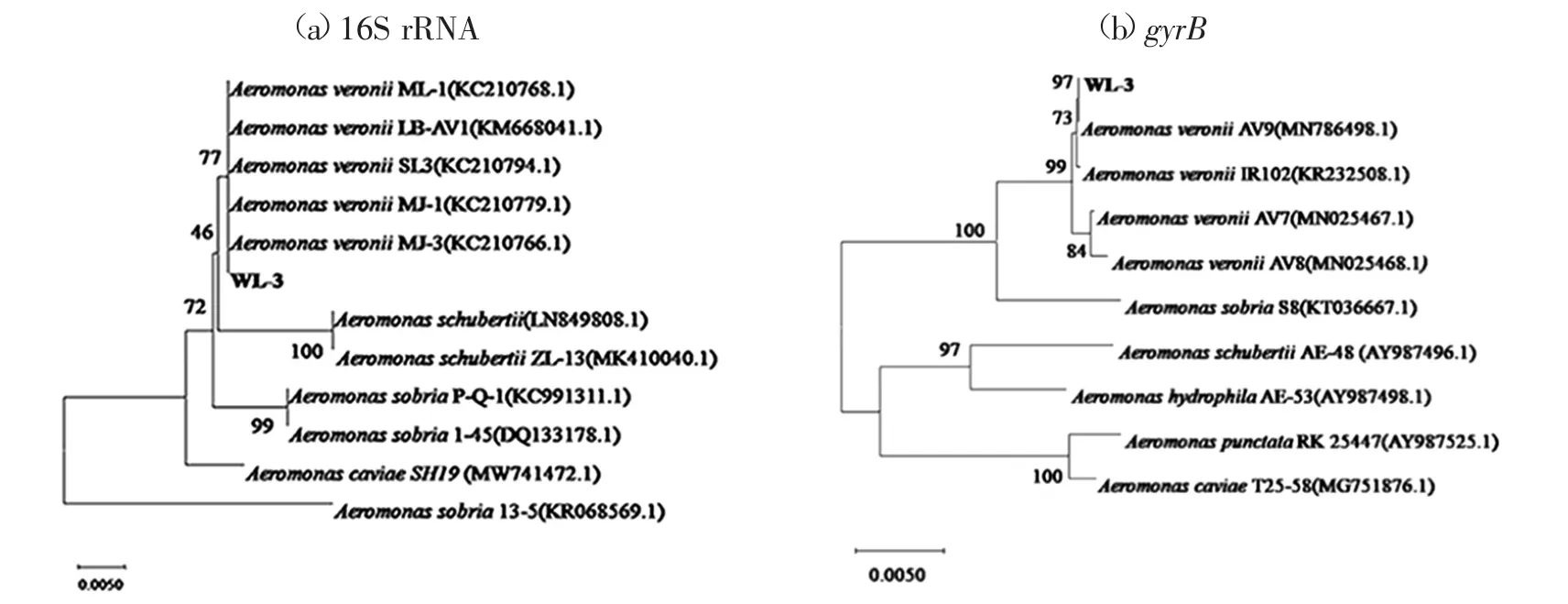
图3 基因序列的系统发育进化树
2.3 生理生化特性
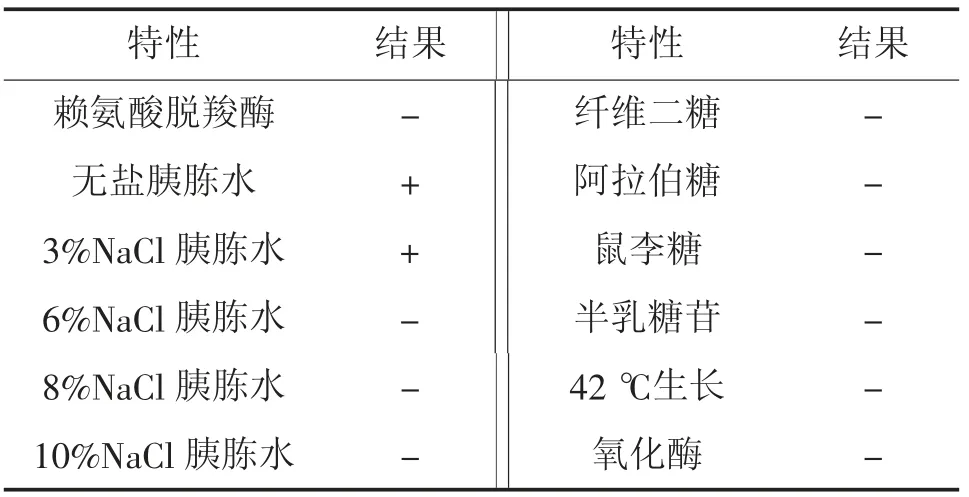
生理生化鉴定结果见表2。由表2可见,菌株WL-3可利用葡萄糖、蔗糖、甘露糖、甘露醇和乳糖等5种碳源;精氨酸双水解酶、V-P试验等2项指标均呈阳性反应;在无盐和3%NaCl胰胨水中生长;但纤维二糖、阿拉伯糖、鼠李糖、尿素酶、明胶酶、氧化酶、鸟氨酸脱羧酶、赖氨酸脱羧酶、6%~10%NaCl胰胨水、42℃生长等13项试验结果为阴性。
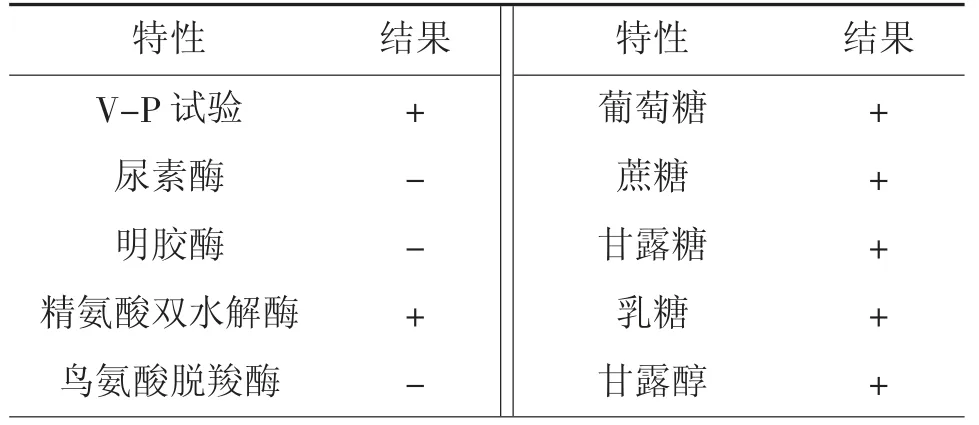
表2 菌株WL-3的生理生化特性①
续表
2.4 药敏试验结果
用药敏纸片法测定菌株WL-3对30种抗生素的敏感性,结果见表3。由表3可见,该菌对氨苄西林、多西环素、卡那霉素、红霉素、四环素、复方新诺明等12种药物有较强耐药性;对庆大霉素、环丙沙星等2种抗生素中度敏感;对头孢唑啉、头孢氨苄、头孢拉定、头孢呋辛、丁胺卡那、新霉素、氯霉素、氧氟沙星等16种抗生素高度敏感。结合临床用药原则,可考虑适当使用硫酸新霉素粉(水产用)来进行防治。
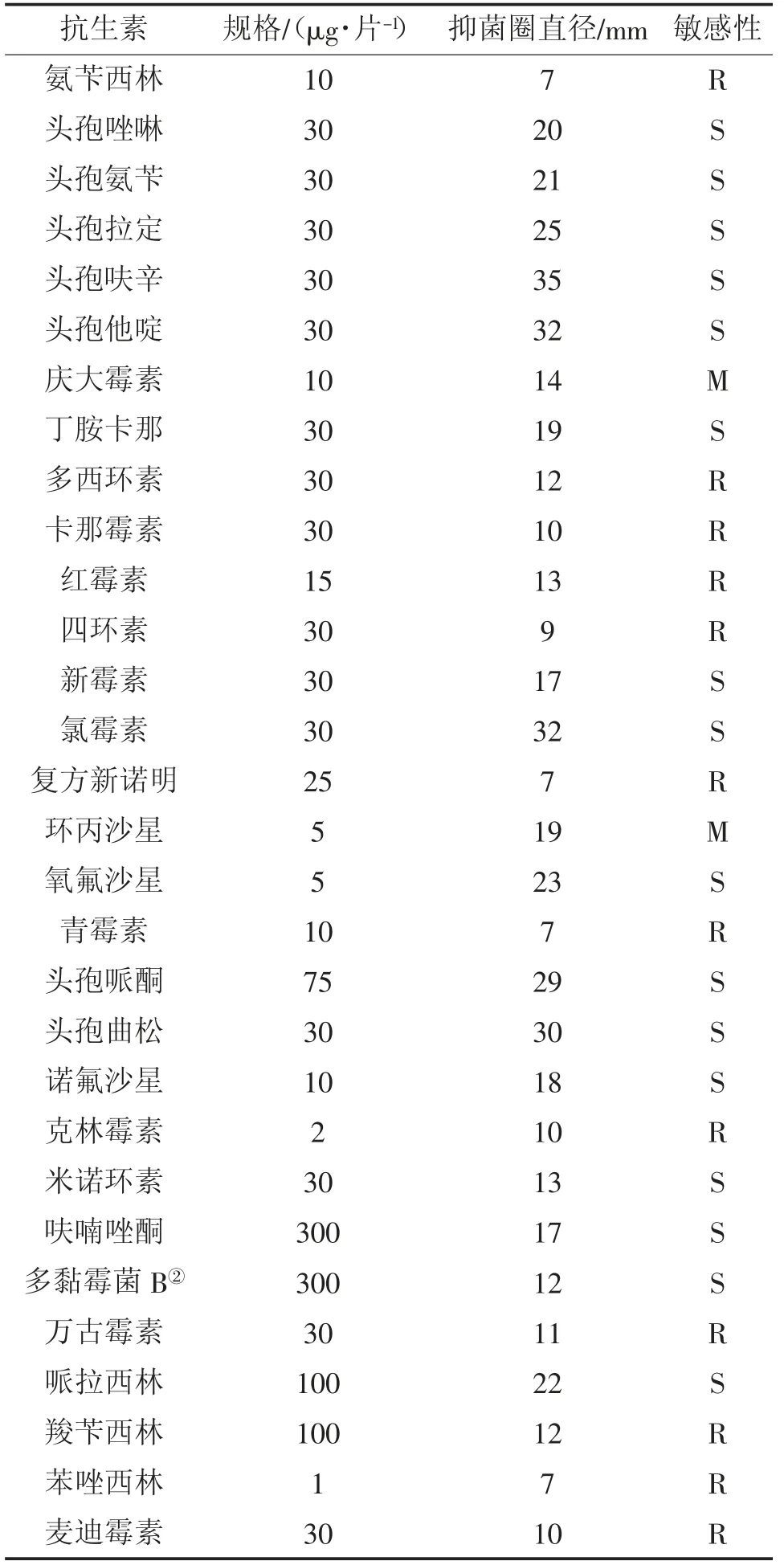
表3 分离菌株WL-3药敏试验结果①
2.5 部分毒力基因检测
菌株WL-3的毒力基因扩增PCR产物,经1.2%琼脂糖凝胶电泳检测,结果见图4。由图4可见,aer、alt、ahyB、act可以扩增出单一条带,与预期大小一致,而lip、ser、ast、fla没有扩增条带。随后对目的条带进行测序,经Blastn比对,其序列与肠毒素、脂肪酶、蛋白酶以及血溶素基因相似度达到100%,表明该菌株携带了多种毒力基因。
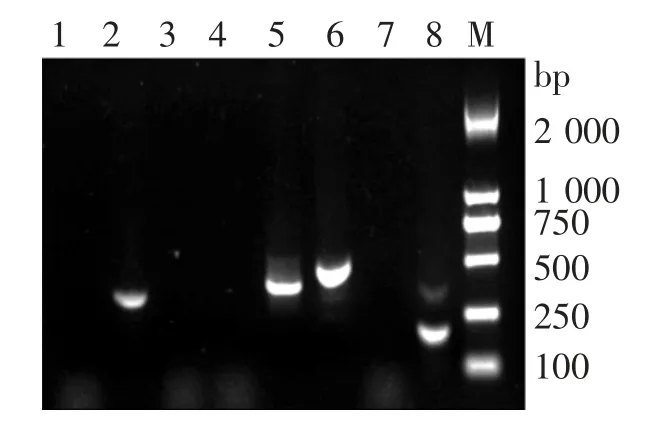
图4 分离菌毒力基因PCR扩增结果
2.6 最适温度和最适pH值测定
菌株WL-3在不同的温度和pH值下的生长情况见图5。由图5可见,25~37℃时,菌株WL-3均能生长,最适温度是37℃,42℃时不能生长;pH值为5~8时,均能生长,最适pH值为7。
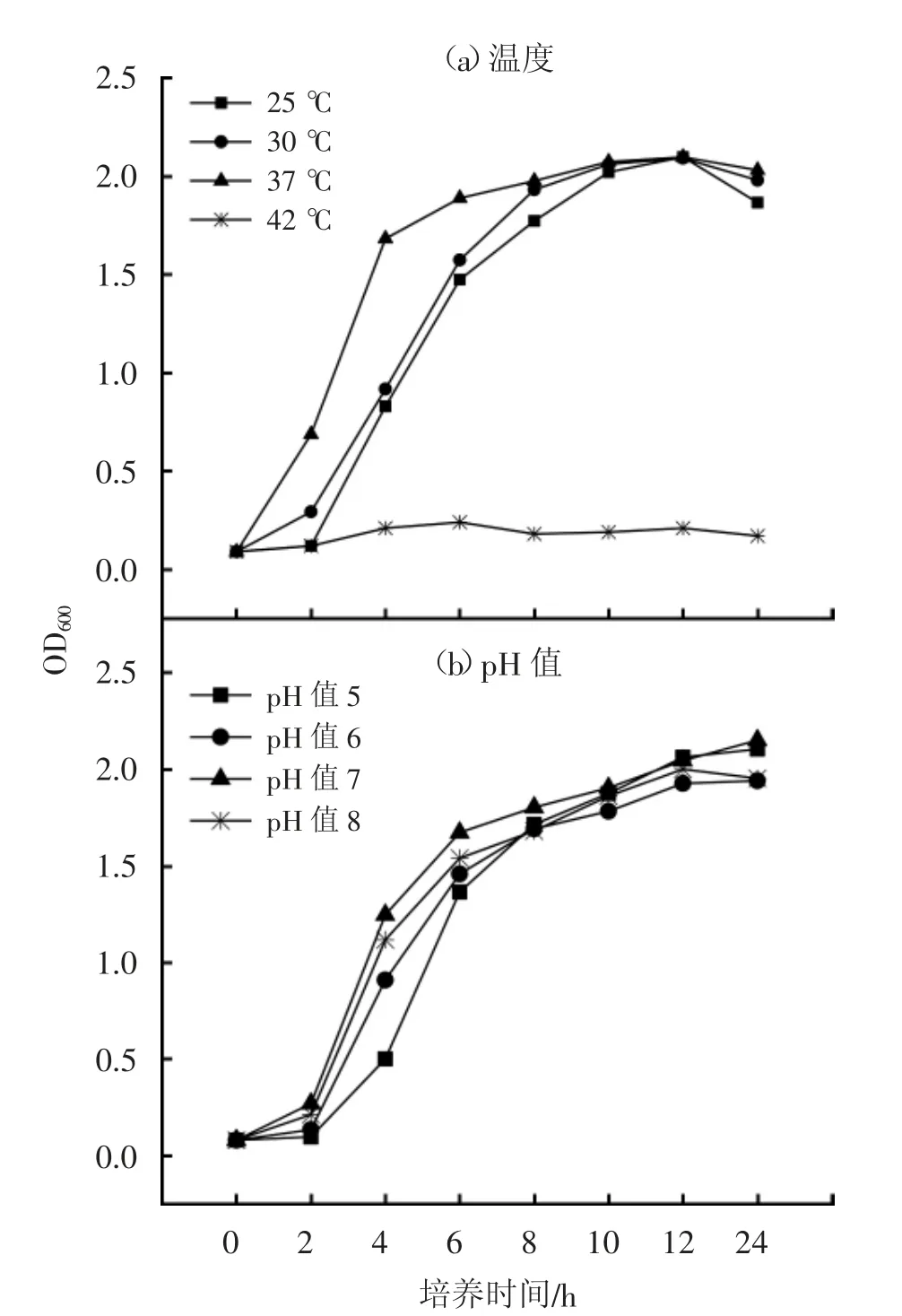
图5 分离菌株WL-3在不同温度和pH值生长曲线的测定
3 讨论
3.1 病原菌的分离和鉴定
截至目前,已从患病乌鳢中分离得到不同种类病原菌,如杀鱼爱德华氏菌、嗜水气单胞菌、维氏气单胞菌等[23-26],其中,维氏气单胞菌是一种人、兽、鱼共患病原菌,广泛分布在自然界中,既可感染鱼类、引发败血病和溃疡综合征等,也可以感染人类、引发败血症和胃肠炎等症状[27]。
针对临沂市某乌鳢养殖场暴发皮肤溃烂病,从患病乌鳢体内分离纯化得到一株优势的革兰阴性菌株WL-3,其生理生化特性与草鱼源维氏气单胞菌16-1、鲫源维氏气单胞菌CFJY-623和维氏气单胞菌ATCC 35624既相似,又不同[22,28]。虽然生理生化特征分析在细菌鉴定中十分常用,但也存在难度较高且准确性低的缺陷,需要结合分子鉴定法[29]。16SrRNA和gyrB均为保守基因,存在于所有细菌中,是区别细菌种属关系最有效和最精确的方法之一[30]。经Blast比对和系统发育树分析,菌株WL-3的16SrRNA和gyrB基因序列与已知的维氏气单胞菌同源性最高,并且与维氏气单胞菌聚在一支中。因此,鉴定此分离菌株为维氏气单胞菌WL-3。
3.2 致病性与致病机理
气单胞菌毒力因子,如生物活性因子、黏附因子、水解酶和肠毒素等,与其致病性息息相关,也是评估其潜在致病性的良好指标之一[31]。菌株WL-3的毒力基因检测显示,其携带了aer、alt、ahyB、act等4种毒力基因,分别编码菌溶素、热不稳定肠毒素、弹性蛋白酶和细胞毒性肠毒素。菌溶素通过与糖基磷脂酰肌醇锚定蛋白结合,破坏宿主的细胞膜,引发细胞凋亡[32]。弹性蛋白酶通过破坏和降解宿主免疫蛋白,加速其感染和定植[33]。肠毒素具有溶解红细胞、破坏组织细胞系、在结扎肠环模型中引起液体分泌反应等生物学活性功能[34]。菌株携带毒力因子多少与致病性强弱有一定相关性,说明该菌株具有潜在致病性,但毒力基因与其致病机理的关系还需进一步研究。生长曲线测定显示,该菌株可以在不同的温度、pH值和NaCl浓度(≤3%)下生长,具有较强的环境适应能力,这与维氏气单胞菌CFJY-623相似[22]。这些结果有助于了解气单胞菌的发病机制和流行病学特征,继而评估感染引发病害的风险。
3.3 病害的预防及控制方法
目前治疗皮肤溃烂病、烂鳃病、出血症等鱼类疾病的主要方法仍然是使用抗菌药物。经药敏试验发现,维氏气单胞菌WL-3对氨苄西林、多西环素、卡纳环素、红霉素、四环素等多种药物有较强抗性,但对头孢氨苄、头孢唑啉、头孢拉定、头孢呋辛、头孢他啶、丁胺卡那、新霉素、氯霉素等药物敏感。可根据水产用药规定,选择合适的敏感药物,如硫酸新霉素粉(水产用)进行相应的治疗。
