miRNA-335通过抑制HDAC3改善帕金森病的炎症反应研究
2022-11-10陈绪才纪雪晴倪芳芳
陈绪才,王 益,纪雪晴,倪芳芳
(句容市人民医院 神经内科,江苏 句容 212400)
0 引言
帕金森病(PD)是65岁以上成年人中第二常见的神经退行性疾病。帕金森病的特征症状,如静止性震颤、运动迟缓、姿势不稳和步态失衡,被认为是黑质致密部(SNpc)大部分多巴胺(DA)神经元进行性退化的结果,导致纹状体DA信号的丢失[1]。帕金森病的病理特征是α-突触核蛋白在路易体包涵体中的显著积聚[2]。此外,帕金森病的特点是T细胞的渗透和小胶质细胞及星形胶质细胞的堆积,以及与胶质细胞的形态和功能的改变有关[3]。
虽然PD和其他神经退行性疾病相关的免疫反应已被研究多年,但鲜见广泛研究,尤其是从分子角度的研究。此外,神经退行性病变的免疫反应,包括PD,通常只被认为是次要的和不重要的。然而,有证据表明,炎症可能具有比最初认为的更大的功能。有证据表明,激活的小胶质细胞的存在对DA神经元有益,但大多数研究结果都得出了神经炎症实际上对SNpc神经元有害的结论。研究表明,激活的小胶质细胞可以产生和释放大量有害化合物,如活性氧、活性氮、促炎前列腺素和细胞因子[4]。
microRNA(miRNA)作为一种非编码RNA,通过翻译抑制、直接或间接调控以及转录后降解来调节基因表达,miRNA被认为是与某些疾病进展相关的潜在治疗靶点,包括PD[5]。体外和体内证据都表明,miRNA通路是中脑DA能神经元分化所特有的。越来越多的证据表明,包括miR-133b,miR-7/miR-153,miR-205,miR-132和miR-494在内的多种miRNA参与了PD疾病进展的调节[6]。
6-羟多巴胺(6-OHDA)是一种能导致多巴胺神经元死亡的神经毒素,常用来建立体内和体外的帕金森病实验模型[7-8]。在本研究中,采用6-OHDA诱导大鼠嗜铬细胞瘤细胞(PC12)建立PD体外模型,探索miRNA-335是否通过介导其靶基因组蛋白脱乙酰酶3(HDAC3)的水平影响PD的炎症损伤。
1 材料与方法
1.1 材料
PC12细胞系购自上海宾穗生物科技有限公司,6-OHDA购自上海泽叶生物科技有限公司,F-12K培养基、胎牛血清、CCK-8试剂盒购自南京森贝伽生物科技有限公司;白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)Elisa试剂盒购自南京建成生物工程研究所;miRNA-335引物[9]的序列由生工生物工程(上海)股份有限公司合成;HDAC3和核转录因子-κB(NF-κB)一抗购自Cell Signaling公司。
1.2 方法
将PC12在含有10%质量分数胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的 F-12K 培养基中,于37 ℃,5%体积分数CO2培养箱中培养48 h。然后,将细胞分成4组,分别为空白组、模型组(100 μmol/L 6-OHDA)、pre-miRNA-335组(100 μmol/L 6-OHDA+30 nmol/L miRNA-335前体寡核苷酸)和anti-miRNA-335组(100 μmol/L 6-OHDA+30 nmol/L miRNA-335抑制剂),继续培养24 h。
1.3 细胞活力及炎症因子的测定
按照试剂盒说明书,采用CCK-8法测定各组的细胞活力,并按照试剂盒说明书测定各组上清液中IL-1β和TNF-α的水平。
1.4 miRNA-335及HDAC3和NF-κB表达的测定
采用实时定量PCR测定各组miRNA-335的表达水平,采用Western blot测定各组HDAC3和NF-κB的蛋白表达水平[10]。
1.5 统计学处理
所有数据均以平均值(mean)±标准误(s)表示,采用SPSS 22.0统计软件进行统计分析,组间比较采用单因素方差分析和Tukey’s post-hoc检验,P<0.05被认为具有统计学意义。
2 结果
2.1 6-OHDA对miRNA-335表达的影响
与空白组相比,6-OHDA处理后,miRNA-335表达水平显著降低;且转染miRNA-335前体寡核苷酸组(不用6-OHDA处理)与空白组相比,miRNA-335表达水平显著升高,而转染miRNA-335抑制剂组(不用6-OHDA处理)与空白组相比,miRNA-335表达水平显著降低,这表明细胞转染实验成功,如图1所示。
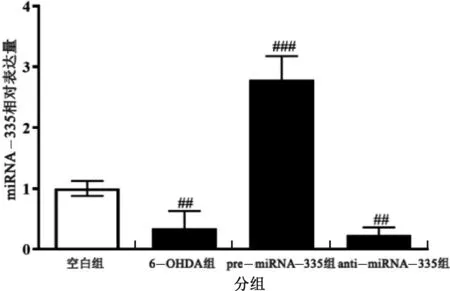
图1 6-OHDA对miRNA-335表达的影响注:数据结果用mean±s表示,n=5;与空白组比较,“##”表示P<0.01,“###”表示P<0.001。
2.2 miRNA-335对6-OHDA诱导后PC12细胞活力及炎症因子的影响
与空白组相比,模型组细胞活力显著下降、IL-1β和TNF-α表达显著升高,而pre-miRNA-335组(采用6-OHDA处理)与模型组相比,细胞活力显著升高,而IL-1β和TNF-α表达显著降低,且anti-miRNA-335组(采用6-OHDA处理)与空白组和模型组相比,细胞活力均显著下降、IL-1β和TNF-α表达均显著升高,如图2所示。

图2 miRNA-335对6-OHDA诱导后PC12细胞活力、IL-1β和TNF-α水平的影响注:数据结果用mean±s表示,n=5;与空白组比较,“##”表示P<0.01,“###”表示P<0.001;与模型组比较,“*”表示P <0.05,“**”表示P < 0.01,“***”表示P < 0.001。
2.3 miRNA-335对6-OHDA诱导后PC12细胞HDAC3和NF-κB蛋白表达的影响
与空白组相比,模型组HDAC3和NF-κB蛋白表达显著上升,而pre-miRNA-335组(采用6-OHDA处理)与模型组相比,HDAC3和NF-κB蛋白表达显著降低,且anti-miRNA-335组(采用6-OHDA处理)与空白组和模型组相比,HDAC3和NF-κB蛋白表达均显著升高,如图3所示。
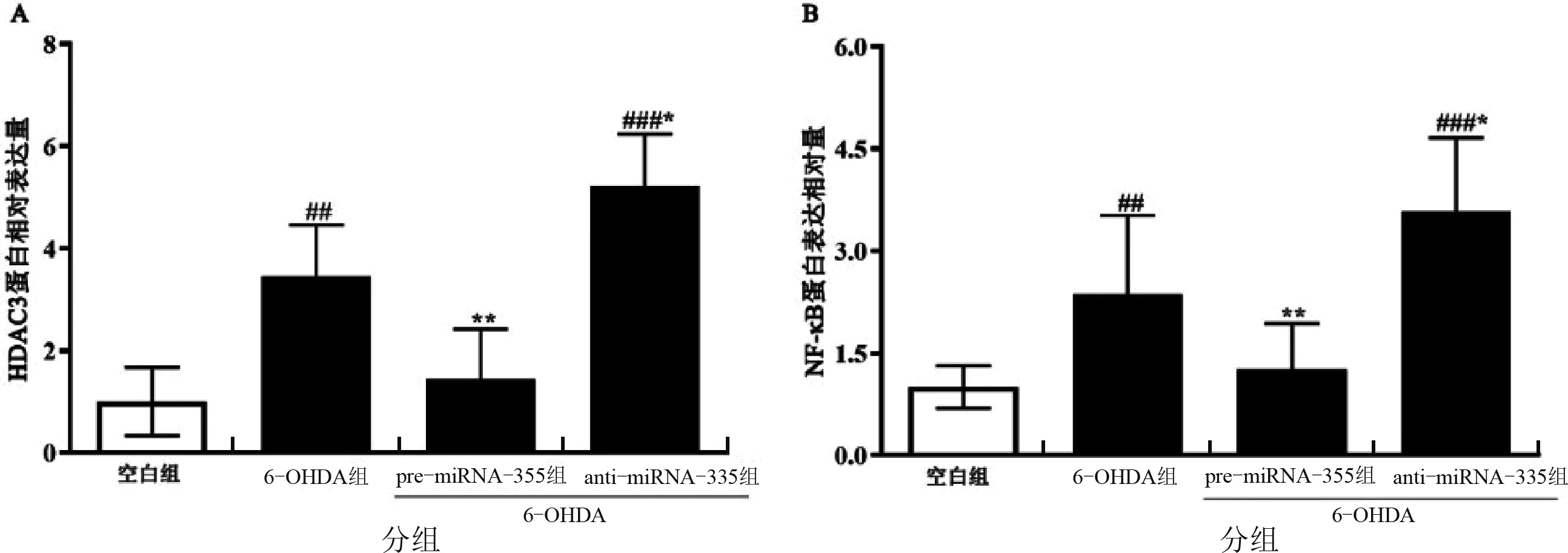
图3 miRNA-335对6-OHDA诱导后PC12细胞HDAC3和NF-κB蛋白表达的影响注:数据结果用mean±s表示,n=4;与空白组比较,“##”表示P<0.01,“###”表示P<0.001;与模型组比较,“*”表示P <0.05,“**”表示P < 0.01。
3 讨论
miRNA是转录后基因表达调节因子,在神经元可塑性、发育和疾病中发挥关键作用[11],作为小的内源性非编码RNA分子,miRNA在包括PD在内的各种疾病的发生和发展中发挥着关键作用。中脑DA能神经元中,miR-133b抑制垂体同源框3转录因子(Pitx3)的表达,Pitx3缺乏会导致黑质纹状体DA的选择性损失[12]。α-突触核蛋白在PD发病机制中起重要作用,虽然点突变体与PD相关,但α-突触核蛋白水平升高也会导致PD发展,miR-7调节内源性α-突触核蛋白水平,其对突触核蛋白表达的抑制保护免受氧化应激介导的细胞死亡[13]。
有研究表明海马组织中的HDAC3抑制通过控制小胶质细胞激活、增强树突棘密度和降低 APP/PS1小鼠的Aβ负荷有效缓解空间记忆缺陷[14]。在较早的一项研究中对miRNA表达谱的调查显示,miRNA-335在阿尔兹海默症(AD)患者的皮质灰质和白质中下调[15],且miRNA-335的上调可减少细胞凋亡,而miRNA-335的敲低可放大炎症介质(包括IL-1β和TNF-α)的水平[16]。据报道,HDAC3通过调控NF-κB p65脱乙酰化而促进炎症的发生发展[17]。而最近的证据表明,活化的小胶质细胞能够对SNpc的DA神经元造成自身损害,主要通过促炎细胞因子如IL-1β的上调和释放,最终导致NF-κB的激活[18]。
本研究发现,6-OHDA处理后,PC12细胞活力、miRNA-335水平显著下降,而炎症因子、HDAC3和NF-κB蛋白水平显著升高,而当miRNA-335过表达时,可以显著改善上述异常表达的指标,而敲低miRNA-335表达时,可以加剧上述指标的异常。
4 结语
综上所述,miRNA-335可能通过靶基因HDAC3调控NF-κB的表达,从而调控炎症因子的表达,进而改善PD的炎症反应。
