可可毛色二孢拮抗菌的鉴定及发酵条件优化
2022-11-09刘双龙杨德洁牛晓庆杨福孙覃伟权
刘双龙,杨德洁,牛晓庆,杨福孙,覃伟权*
(1中国热带农业科学院椰子研究所/海南省院士创新平台/海南省槟榔产业工程研究中心,海南文昌 571339;2海南大学热带作物学院,海南海口 570228)
0 引言
【研究意义】可可毛色二孢菌(Lasiodiplodia theobromae)广泛存在于热带和亚热带地区,是具有多型性、多寄主的土传真菌,可在500多种植物上寄生,且表现出不同的症状(Yildiz et al.,2014)。谢红辉等(2016a,2016b)发现可可毛色二孢菌可感染桑树根部引起桑树根腐病。任亚峰等(2019)研究表明可可毛色二孢可引起茶树叶斑病。唐中发等(2021)发现可可毛色二孢可引起菠萝叶斑病。本研究中的目标菌株可可毛色二孢菌分离自槟榔根部,是引起槟榔根腐病的病原之一,此类病害目前已成为影响海南陵水、万宁和崖城等槟榔主产区槟榔生产的主要障碍之一,可导致槟榔植株叶片黄化、枯死,10~20树龄的结果树因发生此类病害而大量死亡(李增平等,2006)。生物防治具有绿色、安全、有效等优点,因此,筛选对可可毛色二孢菌及其他槟榔根腐病菌具有拮抗作用的菌株,对槟榔抗病研究及槟榔产业的可持续发展均具有重要意义。【前人研究进展】目前对可可毛色二孢菌的防治研究多集中于化学药剂的筛选。戴利铭等(2018)通过菌丝生长速率法测定了多菌灵、丙环唑、甲基硫菌灵、苯醚甲环唑和异菌脲等10种杀菌剂对可可毛色二孢菌的毒力,发现多菌灵对可可毛色二孢菌的防治效果最好。欧阳林海(2020)通过试验得出在槟榔根腐病发病初期用15%食盐水施于槟榔树基部,或用70%甲基托布津1000倍液每隔15 d从基部施用1次,连续2~3次后对槟榔根腐病有较好的防治效果。石金巧等(2021)采用菌丝生长速率法测定了0.3%四霉素AS、5%己唑·四霉素ME、29%吡萘·嘧菌酯SC和36%喹啉·戊唑醇SC等11种药剂对可可毛色二孢菌的抑菌活性,发现29%吡萘·嘧菌酯SC和36%喹啉·戊唑醇SC对可可毛色二孢菌的抑制效果最强。虽然化学药剂对病害具有很好的防治效果,但极易使致病菌产生抗药性;同时,过度使用化学农药迫使土壤中的有益微生物数量骤减,削弱了土壤自身的修复能力,实施生物防治是解决这些问题的主要选择(马成涛等,2007)。关于可可毛色二孢菌的生物防治有学者进行了相关探索。谢红辉等(2015,2016a,2016b)通过平板对峙法、孢子萌发法和田间小区试验,发现解淀粉芽孢杆菌对可可毛色二孢菌的抑菌率达73.3%,病原菌孢子在解淀粉芽孢杆菌培养液中不能萌发,生防菌田间防治效果为67.94%;采用生长速率法和载玻片孢子萌发法测定H.11648剑麻叶汁对可可毛色二孢菌的抑制作用,发现H.11648剑麻叶汁能显著抑制桑根腐病病菌可可毛色二孢菌的菌丝生长和孢子萌发。邹东霞等(2018)通过菌丝生长速率法测定了不同培养条件下白僵菌S1-7发酵液对可可毛色二孢菌的抑制作用,发现白僵菌S1-7在温度为28℃,培养时间20 d,pH 7.0~8.0,培养基中葡萄糖、蛋白胨和酵母粉含量分别为40、20、20 g/L时对可可毛色二孢菌的生长抑制最强。包兴涛(2019)采用菌丝生长速率法测定了含1,3,4-噁二唑的砜类化合物对可可毛色二孢菌的抑制活性,发现化合物1(甲磺酰菌唑)的抑菌活性最好。目前,关于槟榔内生菌的分离研究较少。韩丹丹等(2017)分离得到1株槟榔内生细菌BLG1,发现其抑菌谱较广,对水稻纹枯病的盆栽试验防效达67.05%。宋薇薇等(2017)通过组织块分离法从槟榔树的根、叶和花中共分离得到47株内生真菌,分属于8个属。【本研究切入点】生物防治具有诸多优点,是病害防治研究的热点之一。目前关于可可毛色二孢菌的拮抗菌株报道较少,且大多处于实验室阶段,有效生防菌株匮乏。【拟解决的关键问题】以发病槟榔园健康槟榔根组织及根际土壤为材料,采用组织匀浆法和平板稀释梯度培养法分别分离槟榔根组织内生细菌和根际土壤中的细菌,运用平板对峙法对可可毛色二孢菌的生防菌株进行筛选,并测定生防菌株菌液对槟榔根部病害病原菌可可毛色二孢菌、尖孢镰刀菌和奇异根串珠霉菌的抑制作用;通过盆栽防效试验验证生防菌株的防治效果;采用单因素变化试验对生防菌株的培养条件进行优化,以期得到对可可毛色二孢菌等槟榔常见根部病害病原菌具有显著防治效果的生防菌株,以进一步丰富槟榔根腐病生物防治的菌种资源,为槟榔根部病害生防菌剂的开发提供菌种及指导。
1 材料与方法
1.1 试验材料
1.1.1 供试材料供试样本为健康槟榔植株根部组织和根际土壤,采自海南保亭、琼海、万宁3地发病槟榔园,每园区随机选取3株健康槟榔树,每棵树采集3个不同方位的根样及土样,并立即用无菌聚乙烯密封袋密封,放入冰盒带回实验室进行处理。供试槟榔根部病原真菌:可可毛色二孢菌、尖孢镰刀菌(Fusarium oxysporum)和奇异根串珠霉菌(Thielaviopsis paradoxa)由中国热带农业科学院椰子研究所植物保护中心分离保存。试验所用槟榔苗热研1号由中国热带农业科学院椰子研究所基地提供。
1.1.2 供试培养基PDA、NYBD、LB、NA和豆芽汁培养基按常规方法配制(杨亚男等,2017;何明川等,2021)。细菌生理生化测定试剂购自青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒(50T)及PCR相关试剂均购自北京索莱宝科技有限公司。
1.2 拮抗菌的分离、筛选及鉴定
1.2.1 样品细菌的分离纯化采用组织匀浆法(刘波等,2011)和平板稀释梯度培养法(邢鹏飞,2017)分别分离根组织内生细菌及根际土壤中的细菌。用自来水将根清洗干净后用去离子水冲洗3遍,在无菌条件下,用75%酒精表面消毒30 s,去离子水冲洗3次,用无菌滤纸吸干水分,后用2.6%次氯酸钠表面消毒90 s;再用去离子水清洗3~4次,用无菌滤纸吸干水分,将最后一次清洗组织块的无菌水用移液枪吸取少量滴入NA培养基观察有无菌落长出(易天凤等,2019),将消毒后的根组织进行研磨;最后将根际土壤和根研磨液分别稀释10-1~10-5等5个梯度悬液,每个浓度吸取50μL涂布在NA培养基上进行分离,挑取单菌落采用平板划线法进行纯化,将纯化后的菌株用甘油冷冻保藏法进行保存。
1.2.2 可可毛色二孢菌拮抗细菌的筛选采用平板对峙法进行拮抗细菌筛选。以可可毛色二孢菌为供试靶标菌,用直径5 mm的打孔器分别在培养1 d的细菌平板和培养5 d的病原真菌平板上打孔,获得同质等量的菌块。将病原真菌菌块置于直径为90 mm的PDA培养基中心,同时在距平皿中心22.5 mm处的圆周上均匀放置3块细菌菌块,设置不放置细菌菌块的平板为对照,各设3个重复,于28℃培养2 d后测量细菌及病原菌两接种点连线上病原菌的菌落半径,计算抑制率(朱海云等,2021)。选取拮抗效果最好的菌株进行后续试验。
1.2.3 拮抗菌种子液制备及菌液对槟榔根部3种病原真菌的抑制作用挑取拮抗菌株单菌落于装有100 mL LB液体培养基的250 mL锥形瓶中,置于恒温摇床28℃下180 r/min振荡培养24 h作为种子液备用。
采用滤纸片抑菌法进行菌液抑菌作用测定:在超净工作台中将无菌滤纸片在拮抗菌种子液中浸泡30 s,用无菌镊子夹取滤纸片,置于直径为90 mm的PDA培养基中心,其余操作方法同1.2.2。
1.3 拮抗细菌鉴定
1.3.1 形态学观察将拮抗菌株接种至NA培养基上,32℃培养24 h,观察菌落的形态、大小、边缘、透明度等特征,并在光学显微镜下观察拮抗菌株形态。1.3.2生理生化特征采用细菌生理生化试剂进行拮抗菌株的生理生化特性检测,检测方法严格按照说明书进行,参照《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)对菌株进行鉴定。
1.3.3 拮抗菌株种属鉴定采用细菌基因组DNA提取试剂盒提取拮抗菌DNA,以拮抗菌株的基因组DNA为模板,采用细菌通用引物27F:5′-AGAGTTTG ATCCTGGCTCAG-3′/1492R:5′-CTACGGCTACCT TGTTACGA-3′进行PCR扩增。PCR反应体系50.0μL:2×TaqPCR Mix 25.0μL,上、下游引物各1.5μL,DNA模板1.0μL,ddH2O 21.0μL;扩增程序:95℃预变性5 min;94℃30 s,58℃30 s,72℃1 min,进行35个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序。将测序结果在NCBI进行序列比对。利用MEGA 7.0采用邻接法(Neighbor-joining,NJ)构建系统发育进化树。
1.4 拮抗菌发酵条件优化
1.4.1 拮抗菌最佳培养基组分筛选最佳碳源、氮源及无机盐的筛选参照杨亚男(2017)和何明川等(2021)的方法,以豆芽汁为基础培养基,分别加入2%的麦芽糖、乳糖、葡萄糖、蔗糖和淀粉进行最佳碳源筛选;分别加入1%的氯化铵、酵母浸粉、牛肉膏、甘氨酸和蛋白胨进行最佳氮源筛选;分别加入0.3%的MgSO4·7H2O、CaCO3、K2HPO4和KH2PO4进行最佳无机盐筛选。每处理3次重复。根据碳源、氮源及无机盐单因素试验结果,设置3因素3水平正交试验,对其最佳用量进行优化,以确定最佳培养基组分配方。
1.4.2 拮抗菌培养条件优化参照何明川等(2021)的方法,按照1.4.1优化结果配制培养基,通过单因素试验进行培养条件优化。转速设120、150、180、210和240 r/min;培养温度设24、28、32和36℃;培养曲线测定分别在0~12 h内每隔2 h测量1次,12~24 h每隔4 h测量1次,此外在36、48、60和72 h分别测量1次;pH设4、6、7、8和10;初始接种量分别加入2%、4%、6%、8%和10%种子液进行测定。振荡培养,测量菌液在600 nm波长时的OD值,确定拮抗菌浓度,进而得到最佳培养条件。每组试验设3次重复。
1.5 室内防效试验
1.5.1 拮抗菌株悬浮液制备挑取拮抗菌株单菌落于装有100 mL NYBD液体培养基的250 mL锥形瓶中,置于恒温摇床28℃下180 r/min振荡培养24 h后得到拮抗菌菌悬液,采用平板菌落计数法调节菌悬液浓度至109CFU/mL。
1.5.2 盆栽防效试验选取长势基本一致的热研1号槟榔苗移栽至装有灭菌土∶蛭石=1∶1的花盆中,缓苗15 d左右,采用伤根灌注法(刘斯晗等,2021)向试验组和对照组每盆分别接种孢子浓度为107CFU/mL的可可毛色二孢菌孢子液200 mL,接种病原菌10 d后,用浓度为109CFU/mL的拮抗菌菌悬液对槟榔苗进行灌根处理,每株苗接种拮抗菌液200 mL,同时对照组每株淋入无菌NYBD培养基200 mL。每组5次重复。定期观察槟榔幼苗感病与生长情况,计算幼苗发病率(赵晓霞等,2019)。
1.6 统计分析
试验数据采用SPSS 22.0进行单因素方差分析,使用Duncan’s新复极差法进行显著性检验,使用GraphPad prim 8.0.2作图。
2 结果与分析
2.1 拮抗菌的分离和筛选结果
从采集的槟榔根组织和根际土壤样本中共分离到248株细菌。通过平板对峙法筛选,得到5株对可可毛色二孢菌具有拮抗作用的菌株,且5株拮抗菌的抑菌率均在60.00%以上,其中菌株wrj-2-5的抑制率最高,为74.07%,抑菌带宽度达8.50 mm,表明菌株wrj-2-5对可可毛色二孢菌具有较好的抑制作用(图1和表1)。选取菌株wrj-2-5进行后续试验。

表1 5株拮抗菌株对可可毛色二孢菌的抑制作用Table 1 Bacteriostasis of 5 antagonistic bacterial strains on L.theobromae
2.2 拮抗菌wrj-2-5菌液对3种槟榔根部病原菌的抑制作用
菌株wrj-2-5菌液对3种槟榔根部病原菌可可毛色二孢菌、尖孢镰刀菌和奇异根串珠霉菌均有较好的抑制作用,抑制率均在70.00%以上(表2)。

表2 拮抗菌wrj-2-5菌液对可可毛色二孢菌、尖孢镰刀菌和奇异根串珠霉菌的抑制作用Table 2 Bacteriostasis of antagonistic bacteria solution wrj-2-5 on L.theobromae,F.oxysporum and T.paradoxa
2.3 拮抗菌株鉴定
2.3.1 菌株wrj-2-5形态学及生理生化特征将菌株wrj-2-5接种至NA培养基上,32℃培养24 h后生长良好,菌落形态近圆形,边缘较整齐,为淡黄色,表面突起,平滑,干燥;菌体呈短杆状,大小约0.8~1.0 μm×1.0~1.5μm。为革兰氏阴性菌,能水解明胶,但不能水解淀粉,不能利用甘露醇、硫化氢,V-P反应为阴性等,对照《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001),初步将菌株wrj-2-5归为假单胞菌属(Pseudomonas)(图2、表3)。
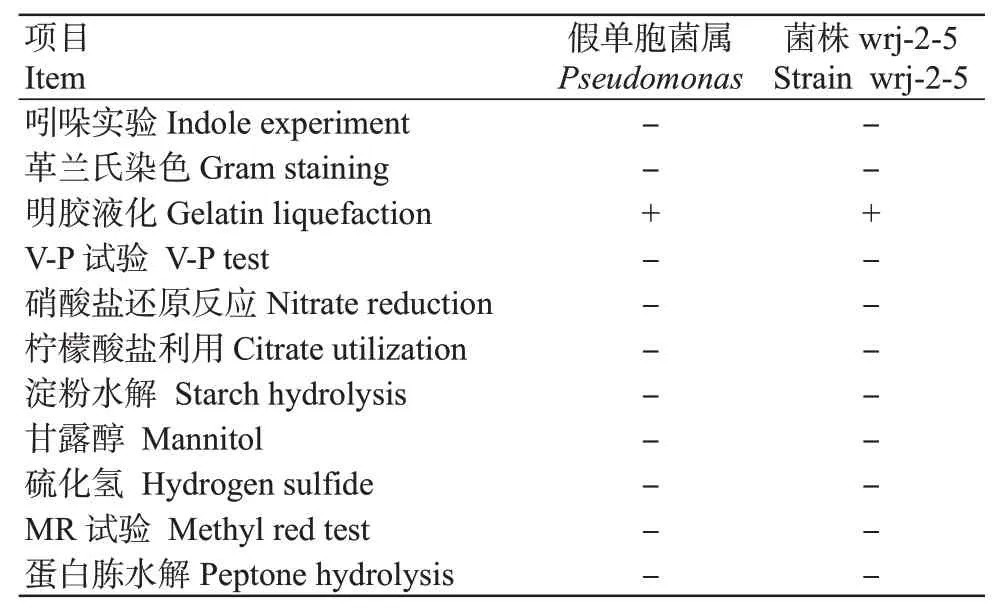
表3 拮抗菌株wrj-2-5的生理生化特性Table 3 Physiological and biochemical characteristics of antagonistic bacterial strain wrj-2-5
2.3.2 菌株wrj-2-5 16S rDNA序列分析结果由16S rDNA测序结果得出扩增后的菌株wrj-2-5序列长度为1439 bp,将测序结果通过BLAST程序与GenBank中序列进行比对分析,选取13个同源性较高的菌株序列,并以Azorhizophilus paspail(LN874287.1)为外群,用MEGA 7.0的NJ法构建菌株wrj-2-5系统发育进化树。由图3可知,菌株wrj-2-5的16S rDNA序列与铜绿假单胞菌(P.aeruginosaHF572851.1)处于同一分支,遗传距离最近,相似性达98%。结合菌株形态学观察和生理生化检测结果,将菌株wrj-2-5鉴定为铜绿假单胞菌。
2.4 菌株wrj-2-5发酵条件优化结果
2.4.1 不同碳源对菌株wrj-2-5生长的影响由图4可知,菌株wrj-2-5在5种碳源中均可生长,但当以葡萄糖为碳源时生长最佳,菌液OD600达3.47,显著高于其他碳源处理(P<0.05,下同)。因此,菌株wrj-2-5生长的最佳碳源为葡萄糖。
2.4.2 不同氮源对菌株wrj-2-5生长的影响由图5可知,菌株wrj-2-5在5种氮源中均可生长,但当以酵母浸粉为氮源时生长最佳,菌液OD600达2.82,其次为牛肉膏和蛋白胨处理,三者间菌液OD600差异不显著(P>0.05,下同)。因此,菌株wrj-2-5生长的最佳氮源为酵母浸粉。
2.4.3 不同无机盐对菌株wrj-2-5生长的影响由图6可知,菌株wrj-2-5在4种无机盐中均可较好地生长,且不同无机盐处理的菌液OD600差异不显著,其中以MgSO4·7H2O为无机盐时菌株wrj-2-5生长最佳,菌液OD600达2.03。因此,菌株wrj-2-5生长的最佳无机盐为MgSO4·7H2O。
2.4.4 菌株wrj-2-5培养基组分正交试验结果以葡萄糖、酵母浸粉和MgSO4·7H2O为因素的正交试验结果(表4)显示,RC>RB>RA,根据表中K值大小,得出最佳培养基组合为1.5%葡萄糖、1.5%酵母浸粉、0.2%MgSO4·7H2O,即优化培养基配方为葡萄糖1.5 g、酵母浸粉1.5 g、MgSO4·7H2O 0.2 g、水100 mL。

表4 葡萄糖、酵母浸粉和MgSO4·7H2O正交试验结果Table 4 Orthogonal test results of glucose,yeast extract and MgSO4·7H2O
2.4.5 不同培养条件对菌株wrj-2-5生长的影响以优化的培养基配方为基础培养基,通过单因素试验进行最佳培养条件筛选,依次研究不同转速、温度、时间、pH、接种量对菌株wrj-2-5生长的影响。结果显示,菌株wrj-2-5的最适转速240 r/min(图7-A)、最适温度28℃(图7-B)、最适种子液接种量8%(图7-C)、最适初始pH 6(图7-D)、最适培养时间36 h(图7-E)。
2.5 盆栽试验验证
盆栽试验观察发现,对照组有3株植株叶片叶尖首先发黄随后干枯,主根维管束变黑腐烂,长势普遍较弱,最后整株枯死,发病率为60.00%;试验组幼苗整体长势较好(图8)。由于槟榔根腐病未进行过分级,不能得出其防治效果,因此本研究用对照组和试验组的发病率来表示生防菌对病害的防效。由对照组和试验组的根腐病发病率得出菌株wrj-2-5对由可可毛色二孢菌引起的根腐病具有较好的防治效果。
3 讨论
本研究筛选到的生防菌株wrj-2-5为槟榔根内生菌。内生菌是指其生活史的一定阶段或全部阶段定殖于植物器官、组织内部以及细胞间隙的微生物。植物内生菌长期与植物共生在一起,已形成多种防病作用机制,不同内生菌的防病机制可能有所不同,大体分为产生次生代谢物、诱导宿主植物产生抗性、与病原菌竞争3种作用机制,且3种作用机制可以相互转化(宋薇薇等,2018;韦俊宏等,2019;蒋晶晶等,2020)。研究表明,从大豆内生解淀粉芽孢杆菌(Bacillus amyloliquefaciens)TF28中分离得到1种分子量为1057 u的抗菌肽伊枯草菌素A,不仅能抑制水稻恶苗病菌(F.nwnilifornu)的菌丝生长及孢子萌发,还能抑制灰葡萄孢菌(Botrytis cinerea)和尖孢镰刀菌等其他病原菌的生长(Zhang et al.,2012)。组织分离法(宋薇薇等,2017)和组织匀浆法(刘波等,2011)是内生菌传统分离的主要方法,是筛选有益菌株如拮抗菌的最佳选择(张晨智,2018)。前期研究发现,槟榔根内生细菌分离更适合采用组织匀浆法。内生菌作为潜在生防资源和外援基因载体在农业生产中具有广阔的应用前景,已成为农业专家研究的焦点(胡桂萍等,2010)。槟榔根腐病是槟榔极易发生的病害,主要以叶尖变黄、根茎腐烂变色为主,是由多种病原引起的真菌性病害(李增平等,2006)。本研究对其中一种病原可可毛色二孢菌进行拮抗菌筛选,得到1株拮抗效果好的菌株wrj-2-5,并发现菌株wrj-2-5对槟榔其他根腐病病原也有较好的抑制作用,该菌株经鉴定为铜绿假单胞菌,在拮抗菌生理生化测定中硝酸盐还原和柠檬酸盐利用与黄妙容等(2017)测定的结果存在差异,可能是由于菌株生长的环境、分离的部位及菌株的进化等原因造成,但本研究结果基本符合《常见细菌系统鉴定手册》(东秀珠和蔡妙英,2001)中假单胞菌属的特性。
铜绿假单胞菌作为生防菌株的研究时间较短(蒋海霞等,2015),目前发现其产生的吩嗪-1-羧酸、吩嗪-1-酰胺、藤黄绿脓菌素、3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺、L-2-氨基-4-甲氧基-反式-3-丁烯酸和鼠李糖脂等一系列次生代谢物质均有较强的抑菌作用(Bano and Musarrat,2003;Sulochana et al.,2014)。铜绿假单胞菌除具有抗病作用外,还有一定的促生作用:代谢产生铁载体,通过特异的转运系统将铁元素转移至体内,供植物生长(蒋海霞等,2015)。已有报道铜绿假单胞菌菌液对烟草青枯病的防治效果为60%,且优于农用链霉素的防效(胡军华等,2009),对番茄枯萎病防效达81%(郝晓娟等,2011);钟小燕等(2009)报道假单胞菌次生代谢物质对香蕉枯萎病有较好的抑制作用。本研究从健康槟榔根中分离筛选到的铜绿假单胞菌菌株wrj-2-5对3种槟榔根部病原菌可可毛色二孢菌、尖孢镰刀菌和奇异根串珠霉菌的抑制率达70.00%以上,通过盆栽试验发现菌株wrj-2-5对根腐病有较好的防治效果,研究结果为可可毛色二孢菌的生物防治提供了参考依据。
铜绿假单胞菌在生长过程中能产生多种抑菌物质,在外界营养和发酵均适宜的条件下,其产生的抑菌物质通常更丰富(叶云峰等,2011)。对培养基和发酵条件进行优化能提高生物农药制剂的抑菌效果,节约生产成本(力治刚,2016)。因此,本研究采用单因素变化试验等进行了菌株wrj-2-5的最佳发酵培养基配方筛选与发酵条件优化。本研究菌株wrj-2-5的最佳发酵条件与韩志雪等(2019)对铜绿假单胞菌MEW079的优化结果相比,在单因素试验确定最佳碳源和发酵的最佳转速时,菌株wrj-2-5生长的最佳碳源是葡萄糖,而菌株MEW079生长的最佳碳源是蔗糖,菌株wrj-2-5发酵时的最佳转速是240 r/min,而菌株MEW079发酵时的最佳转速为150 r/min,其他发酵条件则基本相似,2株铜绿假单胞菌最佳发酵条件存在差异的原因可能是由于菌株来源、生境、用途等不同所造成,后续应再次验证。本研究结果为铜绿假单胞菌的生物防治提供了更多的参考及依据,下一步将加强菌株wrj-2-5次生代谢产物分离等方面的研究。
4 结论
经鉴定菌株wrj-2-5为铜绿假单胞菌,其对可可毛色二孢菌、尖孢镰刀菌和奇异根串珠霉菌均有较好的抑制作用,对由可可毛色二孢菌引起的槟榔根腐病有较好的防治效果,可作为研制槟榔根腐病生防菌剂的候选菌株资源。
