基于大孔吸附树脂的微生物制药分离纯化技术
2022-11-08王园鞠立逵
王园,鞠立逵
(兰州理工大学,甘肃 兰州 730050)
目前,我国生物制药行业最大的瓶颈就是如何从多样化的发酵液中提取出高纯度的微生物活性物质,由于发酵液中具有超多成分不明且极其复杂的微生物生理活性物质,并且具有很多次级代谢物质,所以在进行微生物制药时,发酵液的分离纯化过程是最重要的环节,也可以称作发酵液的后处理,而我国经过长时间的科研证明分离纯化的过程所需要的费用成本极高,所以实现微生物分离纯化的经济性与有效性成为当下研究热点。近年来,我国有众多学者探讨了微生物的分离纯化技术,文献[1]通过PDA 培养基划线技术,实现了霉变微生物的精准及快速分离纯化;文献[2]通过硫酸铵分级分离技术,实现了耐热性较好的尖孢镰刀菌M1 的有效分离纯化;文献[3]通过多种技术组合的方法,实现了噬菌体的有效分离纯化;文献[4]通过膜分离技术,实现了甘草酸提取液的低成本分离纯化;文献[5]研究了尿素包合技术、分子蒸馏技术等时下常见的α-亚麻酸分离纯化技术,并总结了相关原理和优缺点,为后续科研提供参考。但是上述几种方法进行分离纯化的效果不佳。本文借阅相关参考资料,通过大孔吸附树脂对微生物制药分离纯化技术进行了深入分析。
1 实验准备与方法
1.1 实验材料及仪器设备
大孔吸附树脂[6]是近年来发展十分迅速的有机吸附剂,它的结构特别,为大孔网状,并且此树脂中没有交换基因,所以深受食品、医药等领域的喜爱。所以本文利用大孔吸附树脂于兰州理工大学的生物实验室进行了8 种微生物药品的分离纯化实验,本次实验选取的这8 种微生物药品包括:头孢氨苄、金担子素A 和莫能菌素为代表的β-内酰胺类抗生素、多肽类抗生素和聚醚类抗生素,本次实验中分别按顺序标记为A、B、C;由罗红霉素、柔红霉素和卡那霉素为代表的大环内酯类抗生素、蒽环类抗生素和氨基糖苷类抗生素,本次实验中分别按顺序标记为D、E、F;还有由SMTP-3 以及青霉素为代表的含氮杂环类抗生素和多烯类抗生素,本次试验中分别按顺序标记为G、H。
本次实验所用到的仪器包括:电子天平AG245;恒温振荡器KO2525S;高效液相色谱仪AGILENT1260;高效液相色谱(HPLC);真空烘箱DN50;超声波清洗器KQ-250DE;层析柱25×200 mm;50 mL 和100 mL 的具塞锥形瓶;50 mL 和100 mL 的烧杯;10 mL 的高型称量瓶;15 mL 的扁形称量瓶。
1.2 实验方法及过程
实验前将这8 种微生物药物分别准确称取55 mL的浓度为10 mg/ mL 的发酵液,放入KO2525S 恒温振荡器中震荡6 h,震荡完毕再静置1 h。实验开始首先需要在各微生物发酵液[7]的不同发酵阶段分别加入大孔吸附树脂,大孔吸附树脂的多次添加是为了实现发酵液的纯化。发酵起始阶段于灭菌前的培养基内直接添加大孔吸附树脂[8],由于各微生物药物的性质不同,不可以使用相同的大孔吸附树脂及洗脱剂进行分离纯化,那么本次选取的8 种微生物药物中实际添加大孔吸附树脂情况如表1所示。
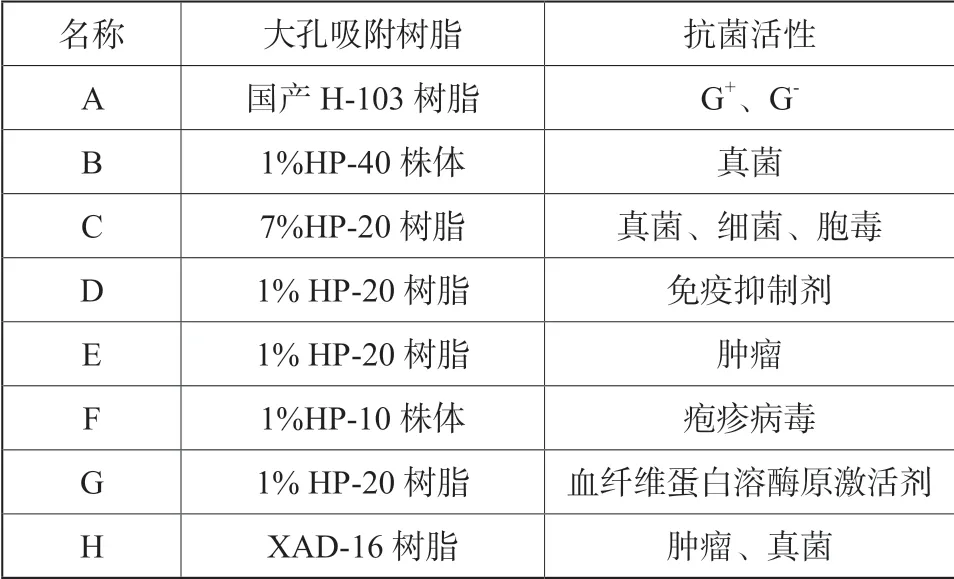
表1 大孔吸附树脂实际添加情况Tab.1 Actual addition of macroporous adsorption resin
发酵初始阶段加入大孔吸附树脂,可以确定这8 类药物分离纯化出的活性物质在细胞内外的分布情况。当发酵进行24 h,再以同样的方法在各培养基中再次添加大孔吸附树脂[9],此次添加可以提升药物纯化后产物的稳定性,并且可以提高纯化产量。当发酵终止后,以相同方法直接于培养基的上清液中分别加入不同的大孔吸附树脂,添加完毕后搅拌溶液并放置12 h,然后对此溶液进行提取操作,获得提取液。由于各活性物质的性质不同,同样不可以使用相同的溶剂对提取液进行洗脱,表2 为各活性物质中添加去杂质溶剂和洗脱剂的实际情况。
本次实验通过多次加入大孔吸附树脂,来获取各微生物药物的提取液;再根据提取液中各活性物质的实际情况,分别用表2所示不同的去杂质溶剂和洗脱剂,进行梯度洗脱;最后将洗脱液进行真空浓缩,通过制备性HPLC 纯化获取微生物单品。

表2 去杂质溶剂和洗脱剂实际添加情况Tab.2 Actual addition of de impurity solvent and eluent
2 实验结果与讨论
为了在微生物制药分离纯化实验中,使大孔吸附树脂提取效果达到最佳,首先需要讨论出提取时间与提取温度对提取量的影响,然后基于最佳提取时间和提取温度分析大孔吸附树脂的动态吸附与解吸效果,并获取微生物药品的活性物质纯度。以本次实验中的聚醚类抗生素分离纯化获取腐霉素为例。
2.1 提取量与提取时间的关系
实验过程中记录了不同提取时间与腐霉素提取量的关系,如图1所示。

图1 提取时间对腐霉素提取量的影响Fig.1 Effect of extraction time on extraction amount of Pythium
从图1 可以看出,随着提取时间的增长,腐霉素的提取量也逐渐变多,但是提取量增加的程度逐渐变缓。这是因为大孔吸附树脂的作用机理是物理性吸附,其本质是发酵液中的物质表面分子的高度不同且受力不等,大孔吸附树脂的多孔性结构就可以对此物质进行筛选,形成了表面的吸附现象,但随着吸附物质容量的增加,孔表的疏水性逐渐降低,所以随着时间的增加,大孔吸附树脂对腐霉素的提取能力逐渐降低,腐霉素提取量的增长程度逐渐变缓。而且由于大孔吸附树脂的物理吸附及筛选原理,使其分离纯化效果较其他方法稳定性更高、提取速度更快、提取容量更大等。但是当提取时间增加到150 min 时,由于大孔吸附树脂的吸附能力已达到完全,所以腐霉素的提取量不会再随时间变化而变化。由此可以证明,采取大孔吸附树脂进行微生物制药分离纯化时,将提取时间控制在150 min 效果最好。
2.2 提取量与提取温度的关系
实验过程中记录了不同提取温度下提取量的变化,如图2所示。
由图2 可知,在0~30℃的温度下进行腐霉素的提取,提取的含量会随着温度升高而增加,并且提取量增加的程度逐渐急剧上升。这是由于大孔吸附树脂孔表的疏水性随温度提高而增加,所以随着温度的提高,大孔吸附树脂对腐霉素的提取能力逐渐提升,腐霉素提取量的增长程度逐渐变陡;当温度控制在30~40℃时,孔表的疏水性已经到达最大值,此时大孔吸附树脂的提取能力也最佳,所以此时腐霉素提取量不会随着温度的提高而变化;当温度继续升高,在40℃以上时,孔表的疏水性受高温影响而下降,此时大孔吸附树脂的提取能力也降低,所以此时腐霉素提取量随温度的提高而减少。由此可以证明,在利用大孔吸附树脂进行微生物制药分离纯化时,提取温度控制在30~40℃范围内提取效果最佳。
2.3 大孔吸附树脂的动态吸附与解吸效果
本次实验参考文献[10],设计大孔树脂的吸附率、吸附量、解吸率、解析量的公式如式(1)~(4)所示。
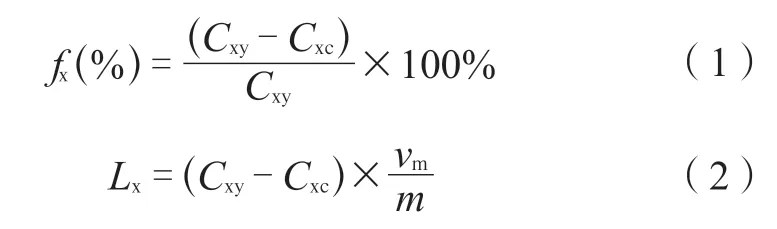
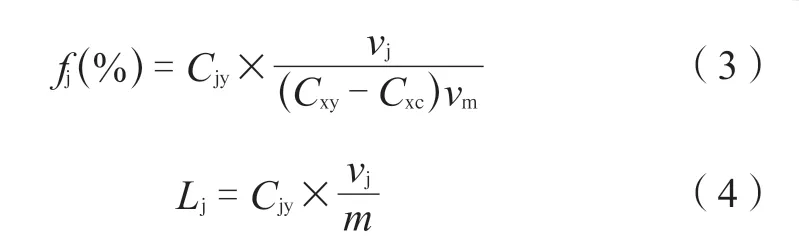
式中fx(%)——大孔吸附树脂的吸附率数据;
Cxy——聚醚类抗生素的原始发酵液浓度数据;
Cxc——聚醚类抗生素的发酵液分离纯化后的残液浓度数据;
Lx——大孔吸附树脂的吸附量数据;
vm——实验使用的聚醚类抗生素的溶液体积;
m——实验消耗的大孔吸附树脂的干重质量数据;
fj(%)——解吸率数据;
Lj——解吸量数据;
Cjy——实验使用的解吸液中聚醚类抗生素浓度;
vj——实验使用的解吸液总体积。
本次实验通过湿法装柱技术,将树脂床体积为50 mL 的大孔吸附树脂装入层析柱,然后以5 BV/h的流速,处理12 倍树脂床体积(12 BV)的物料液,每吸附1 倍树脂床体积的物料液,就将此时的流出液收集起来,然后利用公式(1)、(2)测算出里面的腐霉素浓度,那么流出液的腐霉素浓度与上样液的体积变化如图3所示。
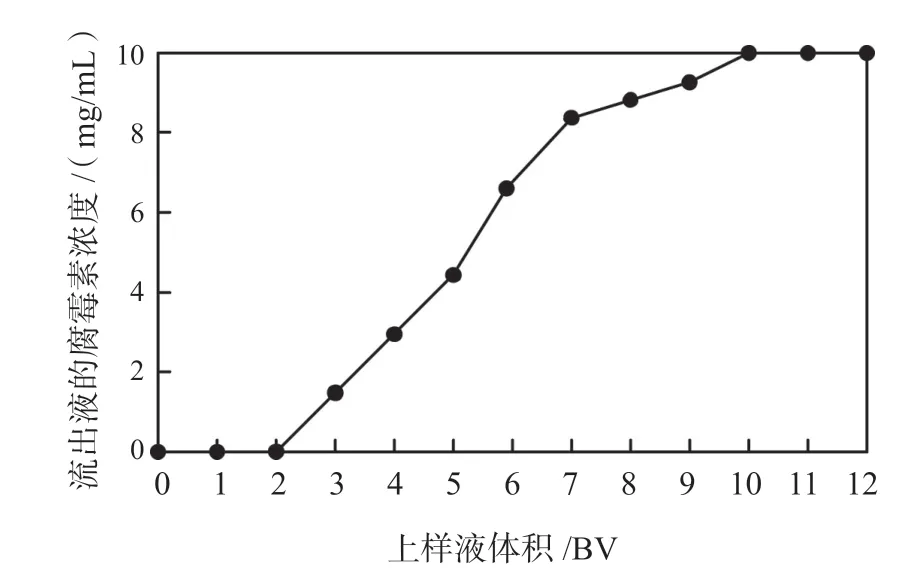
图3 大孔吸附树脂的动态吸附效果Fig.3 Dynamic adsorption effect of macroporous adsorption resin
由图3 可知,大孔吸附树脂在吸附此浓度的聚醚类抗生素发酵液时,当树床体积为2 BV 时开始发生泄漏现象,并且当树脂吸附12 BV 时就处于饱和状态,流出液中的腐霉素浓度曲线在6 BV 前上升较快,7 BV 开始上升较为平缓,这说明了吸附柱中大孔吸附树脂被吸附腐霉素浓度是从上到下递增的,大孔树脂的吸附性能必须在饱和状态下才可以完全发挥。吸附试验之后,需要用蒸馏水进行清洗去杂质,然后再分别用1 BV、2 BV、3 BV、4 BV、5 BV、6 BV 的50%甲醇溶液进行洗脱,然后利用公式(3)、(4)测算出每次流出液中洗脱出的腐霉素容量,那么流出液洗脱出的腐霉素质量与洗脱剂总容量的关系如图4所示。洗脱率较高,所以在进行基于大孔吸附树脂的微生物制药分离纯化实验时,需要使用100% 的甲醇溶液作为洗脱剂。但表3 中这5 种浓度的甲醇洗脱剂,其获取的腐霉素纯度均较高,最高可达98.99%,所以基于大孔吸附树脂的微生物制药分离纯化技术,可以获得纯度较高的活性物质。
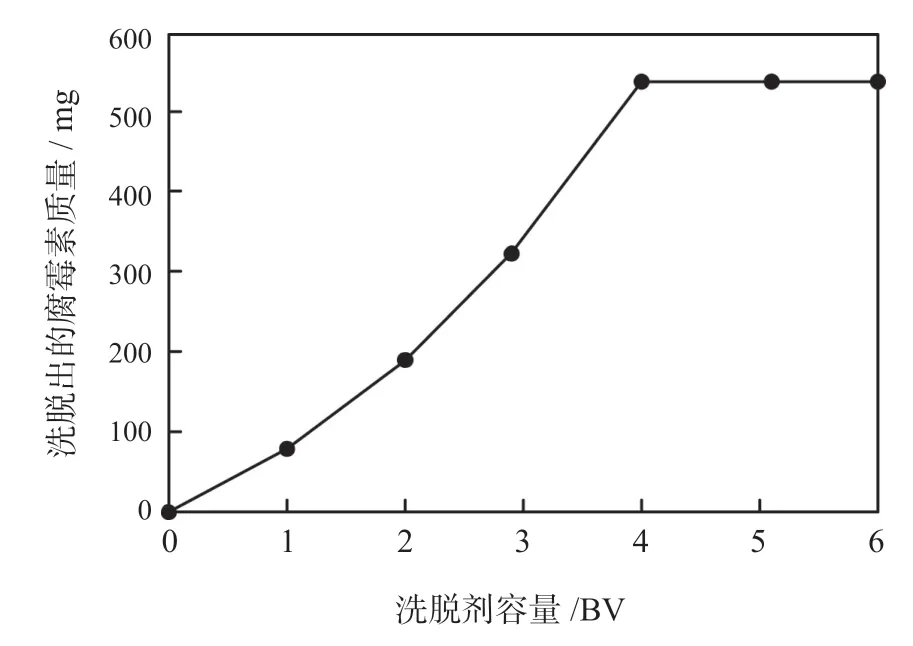
图4 大孔吸附树脂的洗脱曲线图Fig.4 Elution curve of macroporous adsorption resin
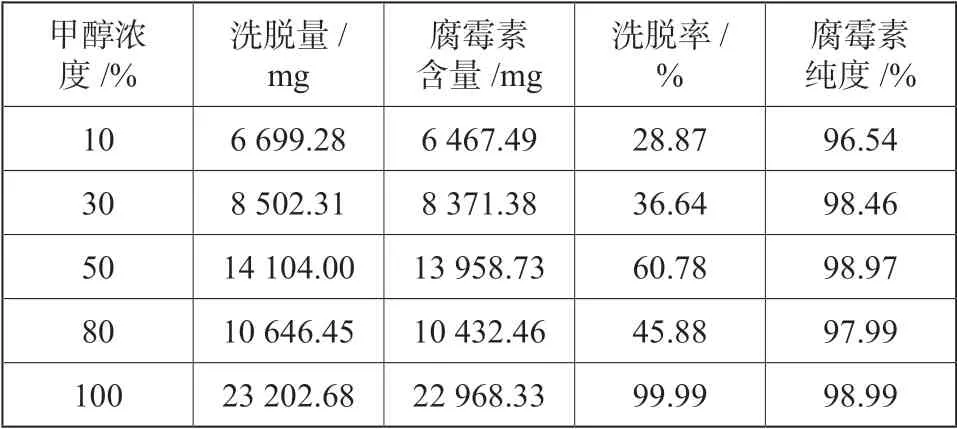
表3 大孔树脂分离纯化效果Tab.3 Separation and purification effect of macroporous resin
由图4 可知,随着甲醇洗脱剂的容量增加,腐霉素的解析量也随之提高,洗脱剂体积在4 BV 以前,洗脱出的腐霉素质量几乎呈直线上升状态,当洗脱剂体积大于4 BV 时,洗脱出的腐霉素质量已经不变,这种情况下增加洗脱剂容量毫无意义,所以基于对成本费用的考虑,本次实验使用4 BV 的洗脱剂就可以将腐霉素全部洗脱出来。
2.4 腐霉素的提取纯度
不只是提取时间与提取温度会影响大孔树脂的分离纯化效果,还存在上样速度、上样浓度等影响条件,但只要采取合适的上样条件,就会对大孔树脂的分离纯化效果有利。本次实验基于上次讨论的相关实验条件下,按照文中1.2 的试验方法及过程获取到510 mL 聚醚类抗生素提取物,并且此提取物中腐霉素含量是45.5mg/mL,上样浓度是329 mg/mL,上样质量是49.8g,先进行水洗去杂质操作后,再利用4 BV 的10%、30%、50%、80%、100%的甲醇洗脱剂分别进行洗脱操作,各梯度以5 BV/h 的速度进行洗脱,然后将洗脱得到的溶液进行真空浓缩回收并冻干后,测算里面腐霉素的含量,结果如表3所示。
考虑微生物药品分离纯化的经济性以及环保性,本次实验选取无副作用且残留较少的甲醇溶液,作为实验洗脱剂。由表3 可知,10%、30%与80%的甲醇溶液的洗脱率较低,而50%与100%的甲醇溶液
3 结束语
据相关资料统计,微生物制药工程中发酵液的分离纯化所需费用非常高,促进微生物制药的经济性发展至关重要。而大孔吸附树脂诞生后,由于其成本低、易再生等特点,在生物制药的分离纯化工程中被广泛使用。并且通过本文微生物药品分离纯化实验的结论,验证了大孔吸附树脂提取活性物质的经济性与高效性,使用4 BV 的洗脱剂就可以将腐霉素全部洗脱出来,进行基于大孔吸附树脂的微生物制药分离纯化实验时,需要使用100% 的甲醇溶液作为洗脱剂。基于大孔吸附树脂的微生物制药分离纯化技术,可以获得纯度较高的活性物质。
