薄膜过滤法对5种中药注射液进行无菌检查的探讨
2022-11-08王超之马帅付亚冰高新贞
王超之,马帅,付亚冰,高新贞
(1.淄博市食品药品检验研究院,山东 淄博 255086;2.淄博高新技术产业开发区生物医药研究院,山东 淄博 255086)
近年来,中药注射液的安全性受到越来越多的关注[1],本文用来试验的几种注射液其中也有相关不良反应的报道[2-4],某批次生脉注射液临床患者使用时出现过寒战、发热的不良反应[5],可能是微生物代谢产生的热原物质引起[6]。生产工艺的无菌保证水平需要通过对药品的无菌检查来确定。注射剂生产过程的无菌检查是保障注射剂质量和安全的重要手段,查阅文献,未检索到参麦、热毒宁、血必净、痰热清和生脉这5 种中药注射液按照《中国药典》2020 版四部进行无菌检查方法验证的文献。本试验通过无菌检查的方法适用性研究,建立这5 种中药注射液的无菌检查方法。
1 仪器与材料
1.1 仪器
BMJ-250 霉菌培养箱(上海博迅实业公司医疗设备厂),MJX-250B-Z 霉菌培养箱(上海博迅实业公司医疗设备厂),LMQ.C 立式灭菌器(山东新华医疗设备股份有限公司),BSC-1300IIB2 生物安全柜(苏州安泰空气技术有限公司),HTY-601 集菌仪(杭州泰林生物技术设备有限公司),DGB330 薄膜过滤器(浙江泰林生物技术股份有限公司)。
1.2 样品
共检验5 个品种10 个厂家29 批次的样品,详细信息见表1。
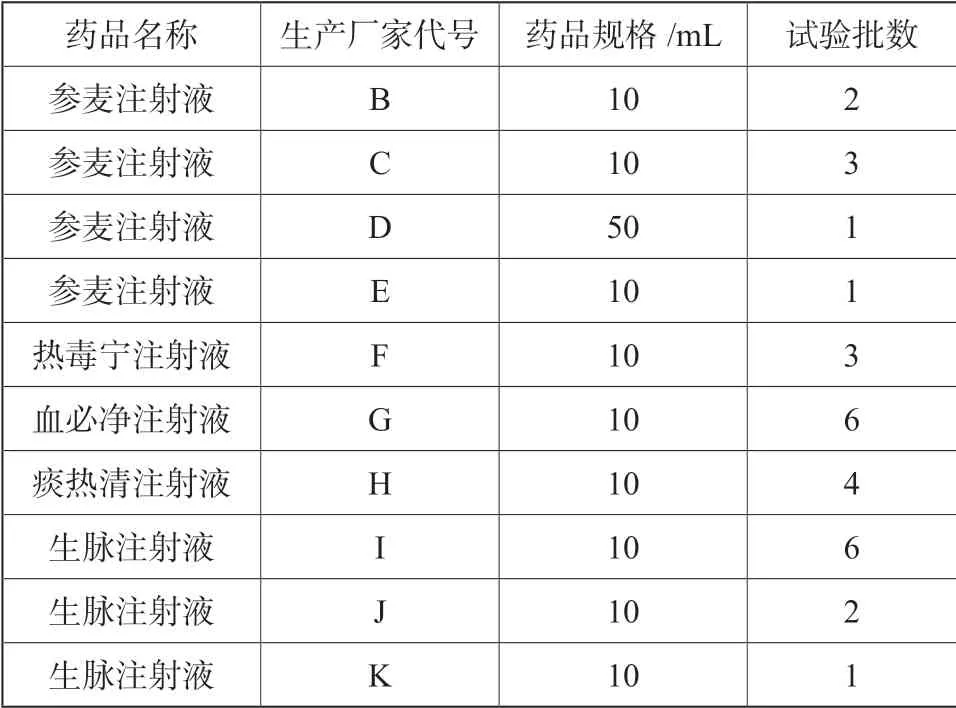
表1 试验样品Tab.1 Sample information
1.3 菌种
金黄色葡萄球菌(Staphylococcus Aureus)[CMCC(B)26 003],枯草芽孢杆菌(Bacillus Subtilis)[CMCC(B)63 501],生孢梭菌(Clostridium Sporogenes)[CMCC(B)64 941],大肠埃希菌(Escherichia Coli)[CMCC(B)44 102].白色念珠菌(Candida Albicans)[CMCC(F)93 001]、黑曲霉(Aspergillus Niger)[CMCC(F)98 003].以上菌种均购自山东省食品药品检验研究院。
1.4 冲洗液与培养基
硫乙醇酸盐流体培养基(批号:7321210918-1,上海诺迪生物科技有限公司),胰酪大豆胨液体培养基(批号:7137210814-1,上海诺迪生物科技有限公司),胰酪大豆胨琼脂培养基(批号:1105565,广东环凯微生物科技有限公司),沙氏葡萄糖液体培养基(批号:190417,北京陆桥技术股份有限公司),沙氏葡萄糖琼脂培养基(批号:1104575,广东环凯微生物科技有限公司)0.9 % 无菌氯化钠溶液(批号:7C21041703 12,山东齐都药业有限公司)。根据《中国药典》2020年版四部要求检查,培养基的适用性、灵敏度和无菌性均符合要求。
2 方法与结果
2.1 菌液制备
接种金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌的新鲜培养物至胰酪大豆胨液体培养基中,接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35 ℃培养 18~24 h;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,20~25 ℃培养 2~3天,上述培养物用0.9%无菌氯化钠溶液制成适宜浓度菌悬液。接种黑曲霉至沙氏葡萄糖琼脂斜面培养基上,20~25 ℃培养5~7 天,加入适量含0.05%(mL/ mL)聚山梨酯80 的0.9%无菌氯化钠溶液,将孢子洗脱。然后,采用适宜的方法吸出孢子悬液至无菌试管内,用含0.05%(mL/mL)聚山梨酯80 的0.9%无菌氯化钠溶液制成适宜浓度的孢子悬液[7]。菌液计数结果见表2。
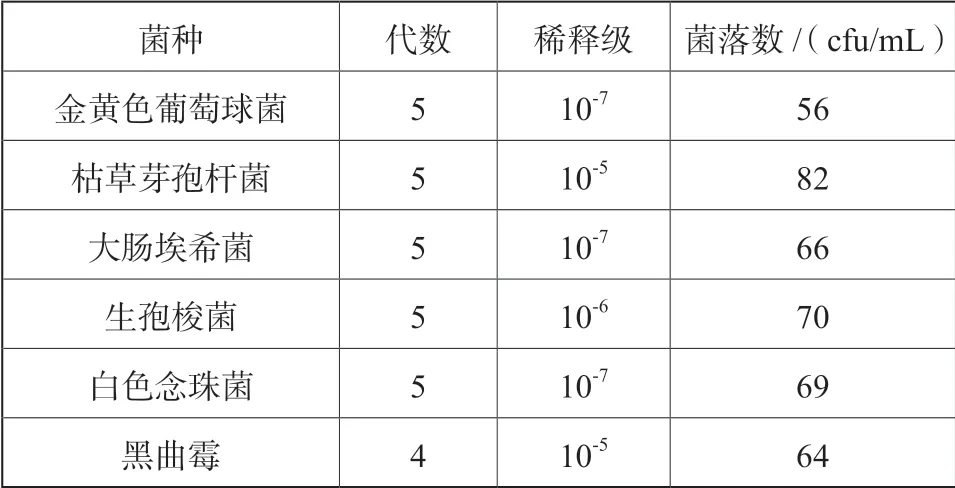
表2 菌落计数结果Tab.2 Results of colony enumeration
2.2 方法适用性
2.2.1 试验组
按规定量取每种注射液,照薄膜过滤法不冲洗或用0.9%无菌氯化钠溶液冲洗100 mL,将硫乙醇酸盐流体培养基100 mL 分别加入3 个滤筒,再分别加入小于 100 cfu 的金黄色葡萄球菌、大肠埃希菌、生孢梭菌菌液; 将胰酪大豆胨液体培养基100 mL 加入其余3 个滤筒,然后分别加入小于100 cfu 的枯草芽孢杆菌、白色念珠菌、黑曲霉菌液,作为试验组。将加入金黄色葡萄球菌、大肠埃希菌、生孢梭菌的过滤器在30~35 ℃培养,逐日观察; 将加入枯草芽孢杆菌、白色念珠菌、黑曲霉的过滤器在20~25 ℃培养,逐日观察。结果见表3。
2.2.2 阳性对照组
另取过滤器,滤筒内不加样品,加入与试验组等体积的相同培养基和等量的菌液,其余操作同试验组。结果见表3。
2.2.3 阴性对照组
另取过滤器,加入与试验组等体积的相同培养基,其余操作同试验组。结果见表3。
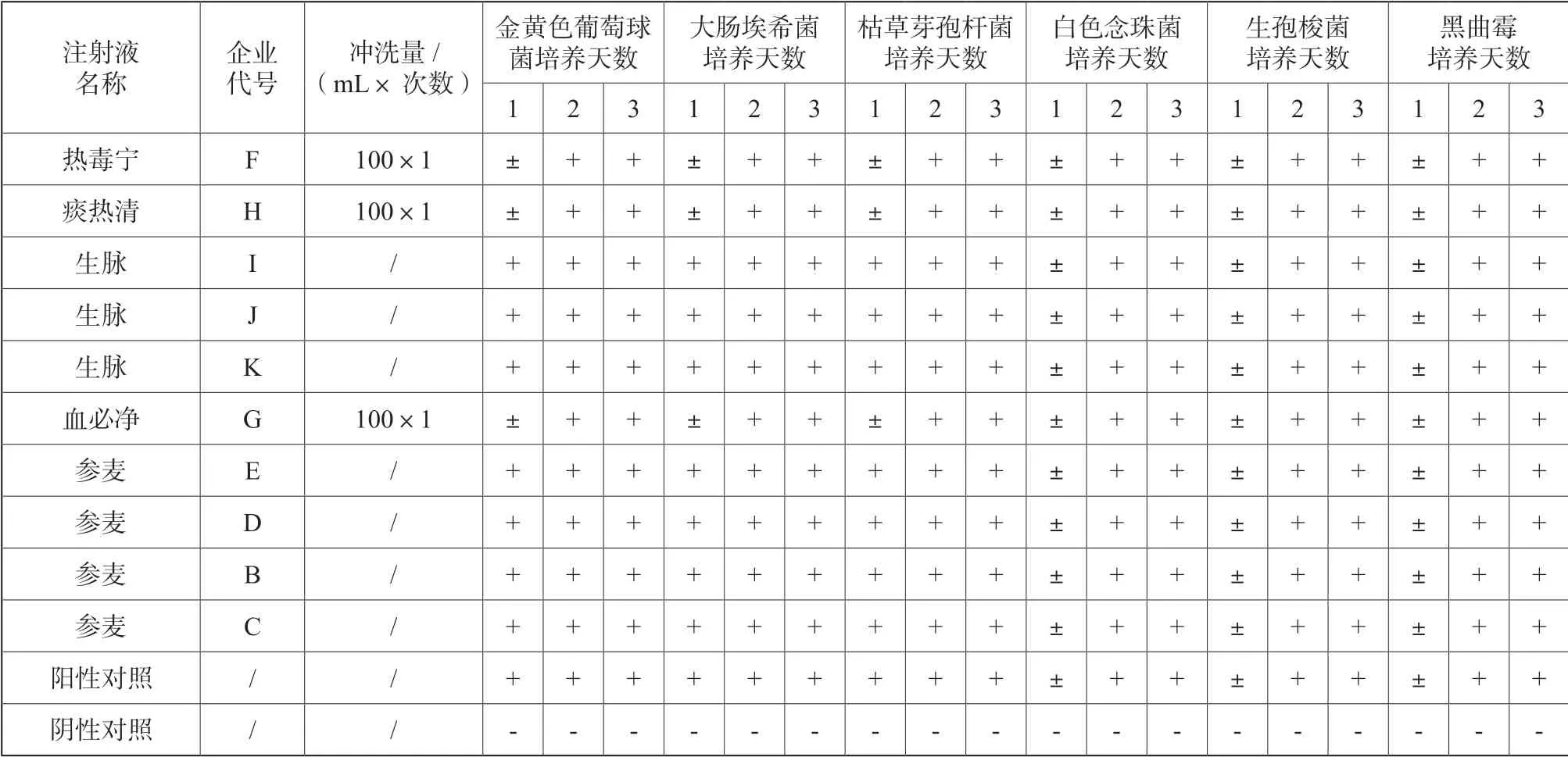
表3 方法适用性结果Tab.3 Results of method applicability
2.3 供试品无菌检查
按上述方法适用性试验结果对29 批次样品进行检查。按照药典要求最低检验数量每批次均取15 支样品,用薄膜过滤法分装于3 个滤筒,用金黄色葡萄球菌作为阳性对照菌。同时做阴性对照试验。试验结果表明在14 天内供试样品均未见菌落出现,符合《中国药典》2020 版规定。
由于样品存在污染不均一的情况,给无菌检查带来局限性[8]。根据数理统计的原理,提高检验数量可提高检出率,按照药典要求最低检验数量的2 倍,即每批次取30 支样品按上述无菌检查法进行检查,试验表明所有样品的无菌检查结果均符合《中国药典》2020 版的规定。
3 结论与讨论
5 种中药注射液均可采用薄膜过滤法进行无菌检查,由于注射液成分不同,其抑菌能力也不同,因此冲洗液用量不同。有的品种药液颜色较深,如不冲洗则会影响结果的观察。综合考虑以上因素,最终确定参麦和生脉注射液不需冲洗,热毒宁、痰热清和血必净注射液用0.9%无菌氯化钠溶液冲洗滤膜。加大取样量1 倍进行检验,提高了无菌检查的检出概率,用此方法检验所有批次样品均合格,说明对药品生产过程的控制尤其是无菌控制水平已较高。
从企业索取得10 份方法适用性资料分析,同品种不同企业间的方法不尽相同,冲洗液用量和种类也存在差异;F 企业的热毒宁注射液企业未使用冲洗液,但其产品药液颜色较深,影响结果观察,用冲洗液冲洗后既可以消除抑菌性也使培养基颜色变浅,使结果更准确;有的验证资料步骤繁琐,如生脉注射液不需冲洗,J 企业用冲洗液冲洗滤膜,容易导致样品污染出现假阳性结果。
根据本文试验结果,同品种且执行相同标准的中药注射液可采用相同的无菌检查方法,这样便于制定更统一详细的执行标准,也有利于中药的质量控制。本试验通过方法适用性研究为5 种中药注射液生产企业无菌检查的方法适用性提供改进的依据,保证检验结果的真实可靠。
