水产品中苯甲酸快速检测试纸条的制备
2022-11-08刘丽环陈纯黄藤波曹涛李广鹏李森
刘丽环,陈纯,黄藤波,曹涛*,李广鹏,李森
(1. 深圳市亿腾检测科技有限公司,广东 深圳 518100;2.广东省检迅检测科技有限公司,广东东莞 523843;3.深圳市深业航天食品与环境检测科技有限公司,广东 深圳 510100;4.深圳市汇知科技有限公司,广东 深圳 518101)
苯甲酸也称安息香酸,属于芳香族酸,白色固体,微溶于水,其抗菌活性主要来源于未离解酸[1,2]。苯甲酸主要用作食品添加剂,具有抑制食品中微生物繁殖、防止食品腐败与变质、保持食品新鲜的作用,苯甲酸及其钠盐均是常用防腐剂之一[3-5]。有研究表明,苯甲酸不会在体内蓄积,但过量添加苯甲酸可能对人体产生毒副作用[6],苯甲酸能破坏细胞膜有序结构,使膜的功能发生紊乱,扰乱细胞内的各种平衡机制[7]。过量的苯甲酸钠可能会引起腹泻、腹痛和心跳加快等症状[8]。国家标准GB2760-2014《食品添加剂使用标准》对允许使用的食品添加剂的名称、分类、使用范围、使用剂量等都做了明确的说明,规定了苯甲酸及钠盐在22种不同食品中限量标准,限量范围在0.2~2 g/kg不等[9]。
免疫分析方法是利用抗原抗体特异性结合来设计实验,实现对目标分析物的高灵敏、高特异性检测的一种方法。近年来,基于抗原抗体也发展了几种方法用于检测食品中的苯甲酸。其中尤为突出的有荧光偏振免疫分析法和酶联免疫吸附法[10]。虽然基于荧光偏振的方法具有较好的性能,然而该方法需要使用荧光标记的抗原,且需要荧光偏振仪,导致检测成本较高。而对于酶联免疫的方法,样品中基质的干扰对检测结果的影响较大,且需要受过专门训练的人进行操作。本文将利用抗原抗体特异性识别的原理,建立一种基于胶体金的免疫层析试纸条用于对食品中的快速、半定量检测。由于抗体高的特异性及层析试纸条的分离原理,该方法对水产品鱼虾仅需要几步简单处理且便捷、快速、不需要使用昂贵的仪器、无需专业人士操作。因此该方法适用于对食品中苯甲酸的现场筛查。
1 材料和仪器
1.1 主要试剂与材料
氯金酸(AR)、柠檬酸三钠(AR)、吐温(tween)-20(CP)、蔗糖(AR)、聚乙二醇 20000(AR)、叠氮钠(AR)、苯甲酸、苯乙酸、苯酚、苯磺酸、苯丙氨酸购自国药集团化学试剂有限公司;牛血清蛋白(BSA)(BR)、羊抗鼠IgG由美国SIGMA公司分装;样品杯、吸水纸、样品垫、PVC 底板和硝酸纤维素膜(Millipore 135)购自美国Millipore;超纯水由Milli-Q 超纯水系统制备
1.2 主要仪器设备
冷冻离心机购自美国eppendorf;M3 basic涡旋仪和Topolino磁力搅拌购自德国IKA;TP-213 电子天平购自美国DENVER Instrument;DHG-9140A 电热恒温干燥箱购自上海精宏实验设备有限公司;XYZ3060喷金划膜仪购自美国BioDot;可编程切条机购自杭州峰航科技有限公司;DF-101S恒温加热器购自巩义市予华仪器有限责任公司;冻干机购自美国Labconc;高效液相色谱仪够自日本岛津。
2 试验方法
2.1 胶体金溶液的制备
所有制备的胶体金的玻璃器皿在制备前均需要经酸处理。将所有玻璃器皿用超纯水洗净之后,加入王水涮洗并浸泡2小时,随后冲洗干净,烘干备用。
根据文献采用以下配方制备胶体金[11]。在250 mL圆底烧瓶中加入100 mL 0.1%的氯金酸溶液,在转速为300 rpm的条件下加热至溶液沸腾,加入质量分数为2 mL 1%的柠檬酸三钠溶液,保持温度为在100℃左右10分钟,然后移除加热及搅拌,自然冷却至室温。制备好的胶体金保存于4℃下。
2.2 胶体金的表征
取胶体金于400~700 nm可见光区域扫描其吸光度,并据此判断其尺寸范围。
2.3 胶体金抗体的标记
2.3.1 最佳标记 pH 的确定
在1.5 mL EP管中加入1 mL胶体金溶液,然后分别加入1 mol/L K2CO3溶液调节不同pH(7.5、8、8.5、9),然后在反应体系加入6 μL浓度为的苯甲酸抗体,混合均匀后静置4小时,然后10000 rpm离心10分钟,取上清液紫外测试。以其OD530值为纵坐标,pH为横坐标,其吸收最大的pH为最佳pH。
2.3.2 胶体金最佳标记蛋白量的确定
在1.5 mL EP管中加入1 mL胶体金溶液,加入1 mol/L K2CO3条件pH 9.0,将纯化后的抗体(1.0 mg/mL)分别取5 uL、10 uL、15 uL、20 uL加入反应体系中,混合均匀后静置4小时,然后10000 rpm离心10分钟。去除上清液,并加入1 mL复溶溶液,于涡旋仪上2500 rpm涡旋30秒,观察上清液及沉淀。出现最少沉淀的为最佳标记条件,若有数个同等条件,则加入蛋白最少量的条件为最佳标记量。
2.3.3 复溶溶液的确定
选 择1 mol/L pH为7.5及8的Tris溶 液,加入0.5%及1%的不同活性剂(BSA, PEG8000,PEG2000,蔗糖,Tween 20)备用。在标记并离心的胶体金沉淀中加入1 mL重悬液,涡旋仪2500 rpm上涡旋30秒,观察上清液及沉淀,沉淀最少,分散时间最短的重悬液为最佳。
2.3.4 标记备用液
综合2.3.1至2.3.3,确认最优条件后,取50 mL胶体金,在涡旋条件下按最佳条件调节pH及标记加入抗体量,静置4小时,并加入终浓度为1%的BSA,涡旋均匀后放入4℃避光保存。
2.4 标记抗体、二抗浓度的选择
抗体标记量及二抗的浓度决定了试纸条的灵敏度。在抗原浓度一定时,胶体金中标记抗体量越少,T线越难显色即越易消带,试纸条的灵敏度越高;反之灵敏度越低。C线的二抗起着参比作用,应根据要求T线的灵敏度来确定。其三者需要比对搭配达到最佳效果。
包被抗原及二抗浓度的选择:取不同量的包被抗原及二抗,喷涂于试纸条上,加入不同含量的苯甲酸进行层析,并根据C线、T线的亮度对比和读数判断其合适浓度。在检测限附近,其读数为0.9~1.1,并且具有较好梯度为宜。
2.5 试纸条的组装
我们选取了流速为80 s/4 cm的硝酸纤维素(NC)膜、样品垫、吸水纸、底板,按照图1的方式搭配起来。

图1 试纸条的组装
2.6 水产品(鱼、虾)的前处理
组织样(虾要去掉头和壳后彻底清洗干净,鱼要去鳞后洗净)应当避光冷藏保存。取切碎的一定量的组织样本,用均质器均质;称取2 g均质于15 mL离心管中;用微量移液器加入4.0 mL乙酸乙酯,然后加入4.0 mL NaOH于15 mL离心管中。剧烈振荡3 min后,室温下4000 r/min离心5 min;用微量移液器移取3 mL上清于15 mL离心管中,用微量移液器加入1.0 mL正己烷,上下颠倒6次,室温4000 r/min离心1 min,用微量移液器移取离心管刻度1.0 ~3.0 mL之间的液体(大约2.0 mL)到新的5mL离心管中,再加入MG氧化剂瓶内的下层黄色液体0.1 mL,混合均匀1分钟后,65℃加热条件下,用空气吹干;用微量移液器向吹干的离心管中加入300 μL复溶液,用微量移液器冲洗溶解试管内壁上残留物;静置2分钟;吸取待检样品溶液100 μL于金标微孔中,用小滴管吹打完全溶解孔内红色物质,等待反应5分钟。
2.7 试纸条性能测试
2.7.1 试纸条灵敏度测试
取苯甲酸标准品,以购买并经高效液相确认为未含苯甲酸草鱼作为基质,加入不同浓度下进行加标实验。所有检测会经过肉眼判断及读数仪读数判定。若T线颜色深度比C线更强,结果为阴性,此时读数仪读数应为1.1以上;若T线颜色深度与C线相当或叫C线弱,则结果为阳性,测试读数仪读数为1.1以下。当T线颜色与C线相当,读数仪读数为0.9~1.1时,其苯甲酸浓度为检测限浓度。若在检测中发现C线无颜色,测试纸条已失效。实验平行进行3次。
2.7.2 试纸条假阳性率、假阴性率测试
取阴性草鱼待检样品溶液200 μL,添加苯甲酸标准品至不同浓度进行加标实验。所有检测经过肉眼及读数仪读数判定,判定标准同上。
2.7.3 试纸条兼容性测试
选取鲫鱼、对虾待检样品溶液,添加苯甲酸标准品至不同浓度进行加标实验,所有检测经过肉眼及读数仪读数判定,判定标准同上。
2.7.4 试纸条交叉反应率测试
选取一个经确认为阴性的草鱼待检样品,分别添加1 mg/L苯甲酸为及10倍量的结构类似物为进行加标实验,结果通过肉眼及读数仪进行读数判定,判定标准同上。
2.7.5 试纸条重复性测试
选取一个经质谱确认为阴性的草鱼待检样品,分别添加苯甲酸为4 mg/L进行加标实验,结果通过肉眼及读数仪进行读数判定,判定标准同上。观察结果稳定性及读数稳定性。
2.7.6 试纸条稳定性测试
试纸条在37℃、50℃分别放置制定天数,选取一个经质谱确认为阴性的草鱼待检样品,分别添加苯甲酸为1 mg/L进行加标实验,结果通过肉眼及读数仪进行读数判定,判定标准同上。观察结果稳定性及读数稳定性。
2.7.7 试纸条与高效液相色谱法的比对
目前,国标采用高效液相色谱进行测定,要确定试纸条的准确性,需要与国标进行比对。在进行液相色谱测试前,需使用苯甲酸标准溶液进行标曲绘制,然后再进行样品测试。
3 结果与讨论
3.1 胶体金的表征
胶体金的尺寸与其颜色相关,尺寸不同,呈现的颜色也不同。尺寸在5~20 nm之间,波长为520 nm,颜色为酒红色;尺寸在20~40 nm之间,波长为530 nm,颜色为深红色;尺寸在60 nm时,溶液主要波长为600 nm,颜色为蓝紫色。
如图2,我们制得的胶体金的紫外图谱最大吸收峰为529 nm,颜色为深红色。根据文献,其尺寸为20~40 nm。

图2 胶体金的紫外吸收光谱
3.2 最佳标记pH的确定
pH对蛋白在胶体金上的标记具有重要影响,当pH不合适时容易造成”死金”现象,即胶体金颜色变灰褐色,如图3。pH从左到右分别为7.5、8.0、8.5、9.0。由图3中可知最佳标记的pH为8.5及9.0。测试其波长在529 nm的吸收值,可见在pH为9.0时,其吸收值最大,说明溶液中的胶体金含量最多,此条件下标记最稳定。

图3 左:pH从左到右分别为7.5,8.0,8.5及9.0 右:不同pH的胶体金吸光度
3.3 最佳抗体蛋白标记量的确定
抗体纯化后浓度稀释为1 mg/mL,在调节至pH为9的1 mL胶体金中分别加入5 μL、10 μL、15 μL、20 μL。稳定后观察现象,结果如图4。当抗体含量逐渐增大,胶体金的颜色出现变化。含量为5 μL、10 μL、15 μL时,胶体金的颜色变化不明显,当抗体含量为20 μL时,胶体金颜色变为灰褐色,即出现死金现象,说明抗体的量过大,使得胶体金团聚,因此抗体标记量不应超过15 μL。随后再将加入5~15 μL抗体的胶体金试管10000 rpm离心10分钟,去除上清液,并加入1 mL重悬液(使用1% tween 20)涡旋,比较溶液颜色。结果如下图4,可见当抗体为15 μL时,胶体金溶液未能完全分散,说明蛋白量过多,而5 μL和10 μL的胶体金可完全重新分散,因此标记量合适。考虑到节约成本的关系,我们最终确定最佳抗体标记量为5 μg/mL。

图4 抗体蛋白标记量(从左到右抗体加入量分别为5 μL,10 μL及15 μL)
3.4 复溶液的确定
复溶液的合适选择可以使得标记后胶体金得到最大程度的回收。往离心后的胶体金沉淀中加入等体积不同复溶液,涡旋后比较不同复溶液中胶体金的分散情况,当所需时间最短,沉淀最少,且无”挂壁”现象(即胶体金黏附于管壁)的为最佳复溶液。比较含量为0.5%~1%的含BSA,PEG8000,PEG2000,蔗糖及Tween 20的pH为9.0的0.5 M Tris 复溶液,效果最佳的为0.5%及1%的Tween 20。因此选用0.5%的Tween 20 pH为9.0的0.5M Tris为复溶液。
综合3.2到3.4,可知胶体金标记的最佳条件为pH为9.0,抗体标记含量为5 μL,复溶液为0.5%的Tween 20 pH为9的0.5 M Tris。
3.5 标记抗体、包被抗原及二抗浓度确定
因试纸条采用比色法,当T线与C线相当或T线比C线颜色弱时,则结果为阳性;当T线比C线深时,结果为阴性。在包被抗原浓度一定时,当二抗浓度越高,C线约亮,结果可能阴性偏高;当标记抗体浓度越高,T线越亮,其阳性结果越难呈现。而当标记抗体的量一定时,包被抗原浓度越高,T线越亮。因此标记抗体、包被抗原浓度及二抗标记浓度决定了试纸条的灵敏度,需要根据目标的检测限配合来调。
本次调试,希望苯甲酸能够将检测限调至1 mg/L。因此,加标浓度选取0.5~4 mg/L。根据之前的筛选,选取最低标记量的5 μL抗体标记于胶体金。
首先,需要筛选合适的包被抗原。目前知道的包被抗原有对氨苯甲酸戊二醛-BSA,对氨苯甲酸N2-BSA,对氨苯甲酸环乳及对羟基苯甲酸-BSA。先选取二抗10 μL、标记抗体10 μL、包被抗原均取5 μL,在试纸条上层析。结果如图5,可知对羟基苯甲酸-BSA显色条带最明显,因此优选为包被抗原。

图5 包被抗原选择图
其次,调整加标条件。选取二抗10 μL,包被抗原选取对羟基苯甲酸-BSA(浓度为1 mg/mL)5 μL。抗体为5 μL,加标分别为0.5 mg/L、1.0 mg/L、4.0 mg/L,结果如图5所示,其C线过亮,T线较弱。因此,需要将二抗浓度降低,并调高T线浓度。因此将二抗调至5 μL,抗体浓度分别为4 μL及8 μL。结果如图6。在标记抗体浓度为6 μL时,加标4 mg/L,T线条带亮度依然较高,因此依然需要配合C线进行调节。但从效果看,已经接近需求范围。
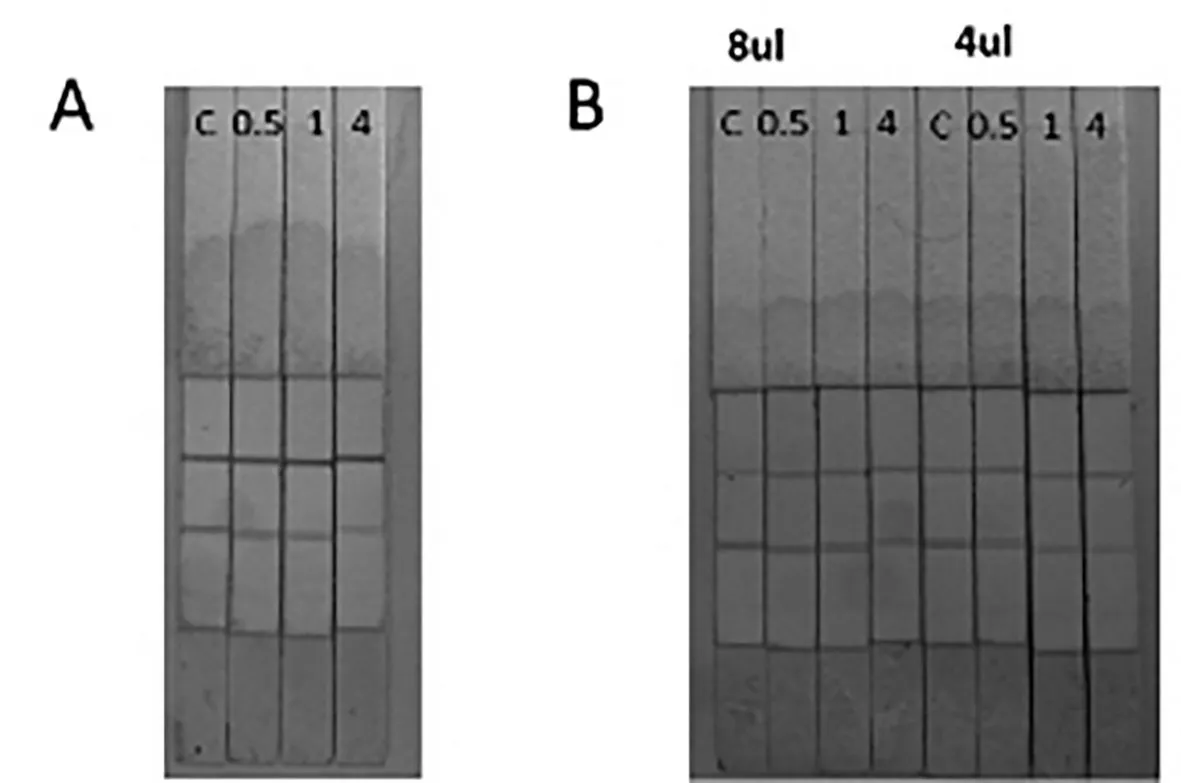
图6 不同添加量T线及C线效果
为了更准确地调试试纸条条件,采用读数仪对试纸条结果进行判读,当读数为0.9~1.1时,为弱阳性;小于0.9时为强阳性,大于1.1时为阴性。图7 A、B及C,C线分别为5 μL、8 μL、10 μL,记抗体分别为6 μL、7 μL及7 μL。比较3图中可见当加标量为1 mg/L时,图B和图C中数值为1.33和0.67,因此理想加标量应该落在两者间。调节条件C线为9 μL,T线为7 μL,得图D,当加标量为1 mg/L时,数值为0.96,落在检出限判读区间。因此确定C线(二抗喷涂量)为9.0 μL,T线(包被抗原喷涂量)为7.0 μL,而胶体金标记抗体量为5.0 μL。确定此条件后,我们进行了小量制备,喷涂2000份测试量进行试纸条性能试验。

图7 不同添加量T线及C线效果及读数
3.6 试纸条性能测试
3.6.1 试纸条灵敏度测试
首先我们进行了加标实验。取阴性草鱼样品,分别按下表加入苯甲酸进行免疫层析测试。所有实验平行进行50次。
根据表1,可见试纸条在加标量为1.0 mg/L时均可以报阳,报阳率100%。因此,其灵敏度可达到目标设定的1.0 mg/L。

表1 苯甲酸试纸条灵敏度测试
3.6.2 试纸条假阳性率,假隐形率测试
取阴性草鱼样品溶液100 μL,分别按下表加入苯甲酸进行免疫层析测试。所有实验平行进行10次。
根据表2,可见试纸条在加标量为1.0 mg/L及更高时均可以报阳,报阳率100%,加标量为0.5 mg/L时均显示阴性,报阴率100%。因此,其假阳性率及假阴性率均为0%。

表2 苯甲酸试纸条假阳性率及假阴性率测试
3.6.3 试纸条交叉反应率测试
试纸条的交叉反应率可以反映试纸条的特异性。取苯甲酸类似物甲苯、苯酚、苯乙酸、苯丙氨酸、苯磺酸,其加标量为苯甲酸的10倍,进行测试,所有测试平行10次。结果见表3。
根据表3,所有类似物在10 mg/L时试纸条均没报阳,只有苯甲酸呈阳性,因此无交叉反应。

表3 苯甲酸试纸条交叉反应率测试
3.6.4 试纸条重复性测试
取阴性草鱼检样品溶液100 μL,按表4添加苯甲酸,共测试30次,观察判读结果。
根据表4,试纸条重现性100%,重复性良好。

表4 苯甲酸试纸条重复性测试
此外,分别购买另外2个鱼类样品(鲫鱼、鲢鱼)和1个虾类样品(对虾),每批次取10个样品,分别为阴性样本及1.0 mg/L添加,进行重复性检测。
结果如表5所示,在不同类别水产品中,试纸条均能检出1.0 mg/L苯甲酸,未添加样品均报阴性,因此试纸条重复性优良。

表5 不同类别水产品苯甲酸重复性检测结果
3.6.5 试纸条稳定性测试
将试纸条分别置于37℃及50℃条件下,对其检测性能进行跟踪。在不同时间抽取装置对样品进行检测,每次检验阴性及阳性样品各5个。结果如下:
从表6可看出,苯甲酸试纸条在37℃可以至少存放35天,50℃可以存放6天左右,拥有足够的稳定性。

表6 苯甲酸试纸条稳定性检测结果
3.6.6 试纸条与高效液相色谱法检测结果比对
目前国标是使用高效液相色谱法(GB 5009.28-2016)。在测试前,先绘制标曲。分别往阴性草鱼中加入苯甲酸含量为0.5 mg/L、1.0 mg/L、2.5 mg/L、4.0 mg/L及5.0 mg/L,并进行HPLC测试。结果如图8,回归方程为Y=56749.57X+247216.42(R2=0.99899),线性良好,复合要求。接着进行苯甲酸样品测试,添加样品为1 mg/L及阴性样品,分别进行高效液相色谱及试纸条测试,平行重复5次,结果如表7所示,可知试纸条与液相色谱对比具有同样的检出性。
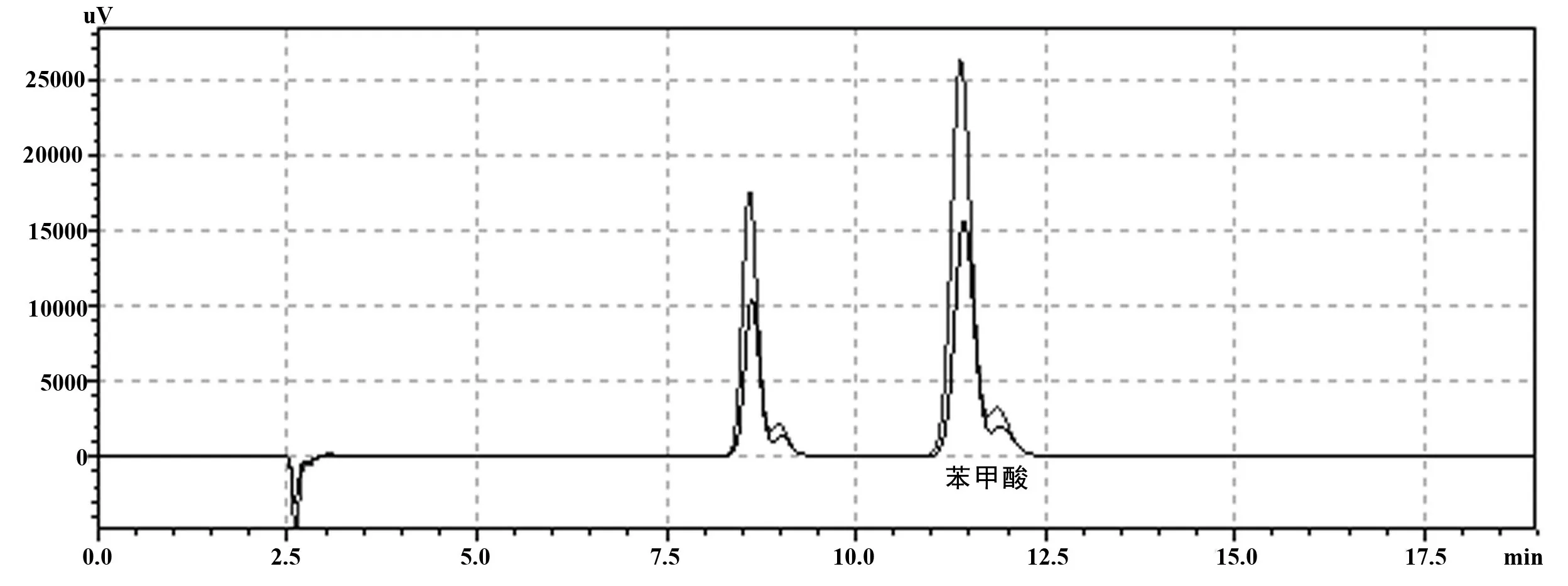
图8 苯甲酸高效液相色谱标准曲线及其图谱

表7 苯甲酸试纸条与高效液相色谱检测结果比对
4 结论
实验选择柠檬酸三钠还原制备胶体金,制备的胶体金粒径为20~40 nm;利用胶体金来标记苯甲酸单克隆抗体,再将BA人工合成抗原(BA-BSA)和羊抗鼠二抗(IgG)分别包被在硝酸纤维素膜的T线和C线处,组装成胶体金免疫层析试纸条;单抗的最佳标记量为5.0 μg/mL,单抗标记最佳的pH为9.0,复溶液为0.5%的Tween 20 pH为9.0的0.5 mol/L Tris;抗原的最佳包被量为7.0 μL,二抗的最佳包被量为9.0 μL,胶体金标记抗体量为5.0 μL,胶体金免疫层析试纸条的目测检测限为1.0 mg/L。试验对苯甲酸试纸条的重复性、稳定性、假阳性及假阴性率的测试验证,结果良好。并研究了几种与苯甲酸结构类似物对试纸条的特异性,实验结果显示:试纸条对甲苯、苯乙酸、苯磺酸、苯丙氨酸等均不发生交叉反应性。将试纸条方法和高效液相色谱法做比较,结果显示试纸条和高效液相色谱法结果一致。
