高糖饮食抑制后代雄性果蝇寿命和育性及其作用机制
2022-11-08文明明毕洁贺艳萍戴煌张威舒在习肖安红
文明明,毕洁,贺艳萍,戴煌,张威,舒在习,肖安红
(武汉轻工大学食品科学与工程学院,湖北武汉 430023)
在现代食品工业中,糖被添加到各种食品中。添加糖指非自然存在于食物中的糖,即在食品生产和制备过程中添加的糖,包括原糖、白糖和红糖、蜂蜜和糖浆[1]。食品中添加糖具有多种功能,如发酵、保鲜等作用,同时还可以满足消费者对甜味的偏好[2]。遗憾的是,糖的过多摄入是导致多种疾病的主要原因之一。高糖摄入对健康的影响一直是大众关注的重点。过量摄入糖分可能导致能量摄入过高,从而增加肥胖、心血管疾病和糖尿病的风险[3-5]。此外,高糖饮食也可能影响发育、寿命和生育力,有文献表明,高糖饮食损伤了机体的抗氧化能力,造成了氧化应激异常[6]。而相关研究表明,活性氧自由基(Reactive Oxygen Species,ROS)的产生与寿命和生育力呈负相关。Ku等[7]比较7种哺乳动物的超氧化物和过氧化氢生成率,发现ROS 生成率与寿命之间存在反比关系。Gallo 等[8]研究两种海洋无脊椎动物和一种哺乳动物的精子氧化状态、线粒体功能和活力,结果表明在三个被检测的物种中,精子活力与ROS 水平和过氧化脂(LPO)呈负相关,ROS 通过膜脂的氧化损伤导致精子活力下降。上述研究提示,高糖饮食对生物体的育性可能具有潜在的影响。因此,探究高糖饮食对生物体的育性具有一定的理论基础,同时也提供了一个新的视角来阐释糖分摄入过多的危害。
模式生物黑腹果蝇(Drosophila melanogaster)具有如下优势:遗传背景清晰、与人类70%的致病基因在进化上高度保守、生存周期短、繁殖量大、饲养成本低等[9]。此外,果蝇精子发生包括精原细胞的有丝分裂和精母细胞的减数分裂等过程,这些过程与哺乳动物的精子发生过程十分相似[10]。因此,选用黑腹果蝇作为研究对象,来研究高糖饮食对后代育性的影响。
目前,研究者大多采用DAPI 染精核、透射电镜超薄切片、免疫组化原位杂交和Western blot 分析等方法研究精子发生过程[11,12]。近年来,拉曼光谱分析由于能快速实现对成分和结构的分析和定位、不受样品水分的干扰、可以获得骨架结构方面的信息而日益受到重视。此外,拉曼分析具有无破坏性和无内源性标签及外源性染色的优势[13]。生物组织中普遍存在C-H、C-N、C=O、N-H 和O-H 等各种基团,而拉曼光谱能检测出样品不同的化学键的分子振动的信息[14]。因此,拉曼光谱在生物体系的研究中具有很大的优势。研究表明,采用共焦拉曼光谱研究镉(Cd)暴露对小鼠肾脏影响,结果发现所有生物学结果都与拉曼光谱检测一致[15]。然而,拉曼光谱在果蝇精子发生过程方面的应用尚无文献报道。
本文研究了亲代果蝇高糖饮食对后代雄性黑腹果蝇的寿命和育性的影响,通过给亲代果蝇喂养高蔗糖培养基来构建高糖果蝇模型,测定后代果蝇寿命和运动能力。重点研究了高糖饮食对后代雄蝇育性的影响,通过统计后代胚胎孵化率初探亲代高糖饮食对后代雄蝇育性的影响效果,并借助DAPI 染精核和共焦拉曼光谱来探究其育性的影响机制。最后本研究采用转录组测序尝试从基因水平上探明亲代果蝇高糖饮食后影响后代果蝇寿命和育性的机理。
1 材料与方法
1.1 原料与试剂
黑腹果蝇品系(W1118)由清华大学果蝇中心提供,并在本单位粮油储藏实验室长期饲养,培养于恒温光照培养箱中,(25±1)℃、光照12 h:黑暗12 h,湿度70%的条件下。
玉米粉、红糖、安琪酵母和0.9%生理盐水来源于市售。总蛋白(Total protein,TP)测定试剂盒(A045-2-2)、丙二醛(Malondialdehyde,MDA)测定试剂盒(A003-1-2)、总超氧化物歧化酶(Total superoxide dismutase,T-SOD)测试盒(A001-1-2)和过氧化氢酶(Catalase,CAT)测定试剂盒(A007-1-1)均购自南京建成生物工程研究所。蔗糖、丙酸(分析纯)、无水乙醇(分析纯)和冰醋酸(分析纯)均购自国药集团化学试剂有限公司。PBS 缓冲液、4%多聚甲醛组织固定液、10 μg/mL DAPI 染色液、逆转录试剂盒和荧光定量PCR试剂盒均购自Biosharp公司。Triton X-100 购自源叶生物。抗荧光淬灭封片剂购自武汉赛维尔生物科技有限公司。
1.2 主要仪器设备
SPL-450 生化培养箱,天津市莱玻特瑞仪器设备有限公司;Kimble 749540-0000 微量电动组织匀浆器,美国Kimble;SCILOGEX D3024R 高速冷冻离心机,美国赛洛捷克;Enspire 多功能酶标仪,新加坡Perkin Elmer 公司。PCR 仪、电泳仪、凝胶成像系统和CFX96实时荧光定量PCR 仪,美国伯乐(BIO-RAD)公司。LS-1200CP 超净工作台,深圳市蓝思净化科技有限公司;DMI 3000B 倒置荧光显微镜,德国Leica 公司;inVia Qontor 共焦显微拉曼光谱成像系统,雷尼绍(上海)贸易公司。
1.3 试验方法
1.3.1 培养基的配制
普通培养基的配制[16]:30 g 玉米粉,30 g 红糖,2 g 酵母,2 g 琼脂,300 mL 的蒸馏水,加热配制。冷却后,加入2 mL 丙酸,以防止霉菌生长。
高糖培养基的配制,蔗糖浓度参照张晓月[17]的实验方法:100 g 蔗糖,21 g 玉米粉,5 g 酵母,2 g 琼脂,300 mL 蒸馏水,加热搅拌均匀后煮沸三次。
胚胎收集盘的配制:首先称取4.2 g 琼脂,6.6 g蔗糖,溶于300 mL 蒸馏水中,剧烈搅拌,搅拌均匀后在微波炉中煮沸两次,使琼脂和蔗糖充分溶解。将培养基冷却至50~60 ℃,加入3 mL 无水乙醇和1.5 mL 冰醋酸,搅拌均匀。最后加入30 mL 葡萄汁,搅拌成透明状。将配制好的培养基倒入灭好菌的圆形胚胎收集盘中(紫外灭菌30 min),待培养基凝固,盖上盖子,用塑料袋密封,置于4 ℃冰箱中保存备用。
1.3.2 高糖模型的构建
将亲代果蝇持续进行高糖饮食处理直至羽化出子一代果蝇,收集子一代果蝇即为高糖果蝇。具体操作为:将普通培养基中羽化的2~3 d 果蝇转入高糖培养基中适应3 d(亲代),任其交配,待第4 天换瓶转入新的高糖培养基中(连续换瓶两次后灭掉亲代成蝇),收集第4 天后产下的卵,卵羽化至成蝇(后代)即为高糖果蝇。为了保证果蝇的处理效果相同,每批果蝇控制收集前两瓶的卵。操作示意图见图1。

图1 高糖果蝇模型构建示意图Fig.1 Schematic diagram of high-sucrose D.melanogaster model construction
1.3.3 生存实验
收集普通和高糖培养基中羽化8 h 内的雄蝇,分别转入含有对应培养基的培养管中,每管20 头,每组3 管,普通培养基为对照组。记录并观察果蝇的生存时间。
1.3.4 攀爬能力的测定
对羽化8 h 内的雄蝇进行运动能力测试。每管雄蝇20 头,适应3 min 后,轻轻晃动培养管,使果蝇落在底部,果蝇会自发向上爬,记录10 s到达培养管7 cm刻度及以上果蝇的数目(A),每管果蝇至少测试5 次,两次测试间隔至少1 min,确保每次晃动的力度相同。普通培养基为对照组。攀爬指数(Climbing Index,CI)计算公式为:

式中:
A——果蝇向上爬的数量,头;
B——果蝇总数量,头。
1.3.5 果蝇体内抗氧化酶的活力及丙二醛含量的测定
选取1 d 雄蝇,普通组为对照组,高糖组为实验组,进行样品前处理,按照试剂盒说明书测定相关指标,测定指标有T-SOD 和CAT 活力以及MDA 含量。
1.3.6 果蝇产卵总数和胚胎孵化率的统计
将1 d 高糖雄蝇(40 头),与3~5 d 的普通雌性处女蝇(40 头),在葡萄汁收集盘中进行交配,在葡萄汁收集盘中央放置一些酵母粉。24 h 后去除雄蝇,更换胚胎收集盘。每个重复每天更换一次新的胚胎收集盘,连续更换4 d,更换胚胎收集盘的时候数换下的胚胎收集盘中的总胚胎数,24~36 h 后,重新数此收集盘中已孵化的胚胎数,得出胚胎孵化率。解剖镜下可观察到已经孵化的胚胎只剩下干瘪的卵壳,而未孵化的则呈饱满的米粒状。对照组为1 d 普通雄蝇(40 头)与3~5 d 普通雌性处女蝇(40 头)交配。每个交配做3 个生物学重复实验。胚胎孵化率计算公式为:

式中:
C——胚胎孵化率,%;
D——已孵化的胚胎数;
D0——收集的胚胎总数。
1.3.7 果蝇精巢DAPI 染色
1.3.7.1 精巢的解剖
取高糖培养基(实验组)和普通培养基(对照组)中羽化的1 d 雄蝇于解剖镜下解剖,在滴加w=0.9%的生理盐水的解剖盘上解剖雄蝇精巢约30 对,为了避免清洗和染色过程中精巢遗失,解剖时需要保留一点黑色的尾端。
1.3.7.2 DAPI 染色步骤
在离心管中加入适量w=4%多聚甲醛溶液,将解剖后的果蝇精巢放入w=4%多聚甲醛溶液中,在室温下固定30 min;随后用PBS 缓冲液冲洗数次,冲洗过程将离心管缓慢来回晃动,每次5 min;小心移去液体,紧接着将PBT 溶液(φ=0.1% Triton X-100+1x PBS)加入离心管中,在室温下固定30 min;同样地,移去多余液体,用1× PBS 冲洗2 次,5 min/次;接下来,加入少量(约50 μL)DAPI(10 μg/mL)对精巢进行染色,染色时间为5~10 min。最后,进行压片,在清洗干净的载玻片上滴一滴封片液,将200 μL 黄色枪头的尖端剪去,小心吸取2~3 对精巢放于封片液上,用解剖镊和解剖针去除多余组织,将精巢小心摆放好,用滤纸吸去多余的PBS,盖上盖玻片。将制好的玻片放于倒置荧光显微镜下拍照,选用10×物镜。
1.3.8 拉曼光谱的获取及预处理
1.3.8.1 拉曼光谱测量和拉曼成像
选用532 nm 激光的固体激光器对果蝇精巢进行拉曼成像,以减少可能的荧光信号干扰,其输出功率为50 MW,扫描样品的激光功率为20 MW。激光束以5×物镜聚焦在样品上。在测试之前,首先进行硅片校正,出峰位置为520.5 cm-1处。对精巢进行单谱扫描,光谱采集的范围为0~4 000 cm-1,曝光时间为10 s。每组样品测试三个,每个样品测试三个不同的点。此外,选取储精囊200 μm×200 μm 区域进行面扫描拉曼成像,曝光时间为0.01 s,激光功率为50%。
1.3.8.2 光谱预处理
使用WIRE 4.0 对数据进行拉曼光谱预处理,包括扣除宇宙射线、背底和噪声滤波等。Origin 2017 数据处理软件对光谱进行归一化处理并分析各样品的平均拉曼光谱。
1.3.9 转录组测序
基于Illumina Novaseq 6000 测序平台对1 d 对照组和高糖组雄蝇进行转录组测序,测序实验采用Illumina TruseqTM RNA sample prep Kit 方法进行文库构建,其操作流程图如图2 所示。

图2 转录组测序流程图Fig.2 Flow chart of transcriptome sequencing
1.3.10 荧光定量
将提取的总RNA 在逆转录酶的作用下反转合成cDNA。将合成的cDNA 稀释8 倍,待用。qRT-PCR反应体系:cDNA 为2 μL,上、下游引物分别为0.3 μL,SYBR Green qPCR Mix 为10 μL,RNase-Free ddH2O为7.4 μL。采用两步法PCR 反应程序:95 ℃预变性5 min,循环1 次;随后95 ℃变性10 s,52~58 ℃退火延伸数据采集30 s,循环40 次(具体基因引物见表1)。目的基因与内参基因(Rp49)之间的相对表达量通过2-ΔCT 公式计算,ΔCT=CT 目的基因-CTRp49,用Student′st检验来统计基因表达量之间的差异性。

表1 实验中所用引物Table 1 Primers used in the experiment
1.3.11 数据处理
所有实验至少进行三次重复,实验数据采用平均值±标准差表示。使用GraphPad Prism 7.0 软件对所有统计数据进行分析和绘图,并进行Student’st-检验。生存试验采用Log-rank 检验来评估寿命的显著性。以p<0.05 为差异具有统计学意义。
2 结果与分析
2.1 高糖饮食对雄蝇寿命的影响
通过连续给雄蝇喂养高糖饮食,结果表明,雄蝇的中位生存期由34 d 缩短到29 d,高糖组生存曲线与对照组生存曲线相比极显著缩短(图3,p<0.000 1)。结合之前的研究,猜测果蝇寿命的缩短可能是由于糖分摄入量过高损伤了果蝇体内的抗氧化系统[6]。
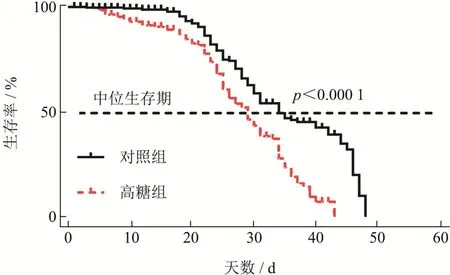
图3 高糖对果蝇生存曲线的影响Fig.3 Effect of high sucrose on the survival curveof D.melanogaster
2.2 高糖饮食对雄蝇攀爬能力的影响
果蝇具有反趋地性行为,即在一个垂直的空间内果蝇会自发向上运动[18]。利用果蝇的这种特性,测定了果蝇的攀爬能力用来反映果蝇的运动能力。攀爬实验结果表明,高糖饮食极显著降低了雄蝇的攀爬能力,损伤了雄蝇的运动能力。高糖组果蝇的攀爬指数由77%降低到 35.67%,约为对照组的 46.32%(图4,p<0.000 1)。

图4 果蝇运动能力的测定Fig.4 Exercise ability of D.melanogaster
2.3 高糖饮食对雄蝇抗氧化能力的影响
高糖对雄蝇的抗氧化能力有显著的抑制效果。与对照组相比,高糖组T-SOD 和CAT 活性显著降低,说明高糖饮食降低了雄蝇清除氧自由基的能力;MDA含量极显著增加,说明雄蝇抗脂质过氧化反应的能力降低。高糖组T-SOD 活性由32.72 U/mg prot 降低到27.31 U/mg prot,活性为对照组的83.47%(图5a,p<0.001);CAT 活性由8.72 U/mg prot 降低到6.93 U/mg prot,活性为对照组的79.47%(图5b,p<0.01);MDA 含量由13.33 nmol/mg prot 增加到20.18 nmol/mg prot,为对照组含量的1.51 倍(图5c,p<0.000 1)。

图5 高糖饮食对雄蝇抗氧化能力的影响Fig.5 Effect of high-sucrose diet on antioxidant capacity of male flies
2.4 高糖饮食对雄蝇繁殖力的影响
按照表2 的交配方法,统计后代的胚胎孵化率。与对照组相比,高糖组果蝇胚胎孵化率显著降低,由88.08%降低到70.77%,说明了高糖饮食损伤了雄蝇的育性。
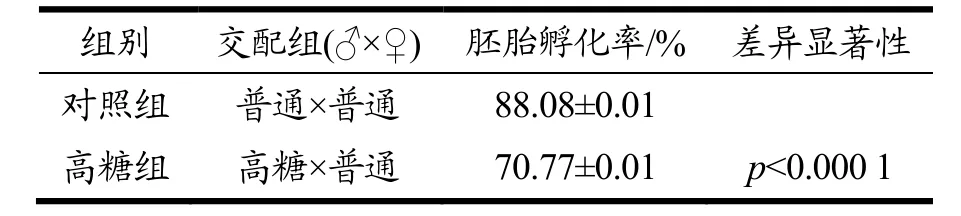
表2 雄性果蝇繁殖力实验结果Table 2 The fertility test of male D.melanogaster
2.5 高糖饮食对雄蝇生殖细胞的影响
为了探明高糖饮食影响雄蝇育性的机理,探究是否影响果蝇精子的发生过程,对雄蝇精巢进行了DAPI染色,结果表明,与对照组相比,高糖组果蝇精巢整体膨大异常,精巢末端精子细胞核数量减少(图6a、6c);高糖组精巢储精囊中不存在精子束,而对照组储精囊中存在明显的精子束图(图6b、6d)。
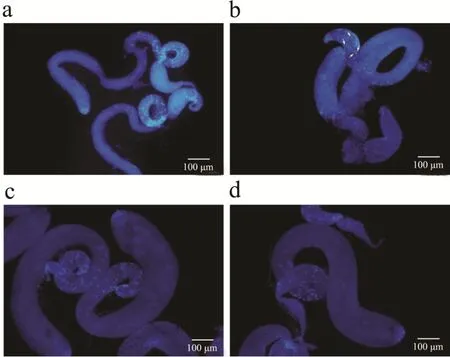
图6 对照组和高糖组果蝇精巢的DAPI 染色Fig.6 DAPI staining of fly testis in control group and high sucrose group
2.6 高糖饮食对雄蝇精巢组织生化成分的影响
对果蝇精巢进行平均拉曼光谱扫描,两组的平均拉曼光谱如图7 所示,可以看出对照组和高糖组出现多个峰值变化,反映出了明显差异。对照组和高糖组峰位信号强度变化的主要峰值在573、813、996、1 100、1 450、1 520、1 558 和1 720 cm-1处。光谱中拉曼峰所代表的生化成分如表3 所示。高糖组精巢的拉曼光谱中代表蛋白质条带(1 100、1 450、1 558 和1 720 cm-1),核酸条带和胶原带(481、573、813 和996 cm-1)的拉曼峰强度明显低于对照组。通过观察拉曼组织成像,结果发现对照组精巢573 cm-1(色氨酸、核酸),813 cm-1(胶原蛋白、RNA),1 100 cm-1(DNA、蛋白质),1 450 cm-1(蛋白质、磷脂)和1 720 cm-1(天冬氨酸、谷氨酸)处的生物成分分布均匀,而高糖组精巢的物质分布不规则(图8)。

图7 两组处理后平均拉曼光谱(200~1 800 cm-1)Fig.7 Average Raman spectra of the two groups after treatment(200~1 800 cm-1)

表3 各个拉曼峰位代表的生化成分Table 3 Biochemical components of Raman peak

图8 对照组精巢(Ctrl)和高糖组精巢(Hgcr)在200 μm×200 μm 区域面扫描的拉曼成像Fig.8 Raman imaging of testis of control group (Ctrl) and high-sucrose group (Hgcr) in 200 μm×200 μm region
2.7 转录组测序与荧光定量
利用Illumina 测序平台对对照组和高糖组雄蝇进行测序,筛选出表达量大于1 的基因,可以发现对照组雄蝇特有159 个基因,高糖组雄蝇特有574 个基因,两组共有基因为12 037 个(图9a)。采用edgeR 差异分析软件筛选出差异表达量基因,筛选阈值为:差异倍数|log2FC|≥1 和p<0.05,并对每个基因进行多次检测和分析。结果表明,对照组与高糖组雄蝇差异表达基因共739 个(图9b)。随后,通过GO 功能注释分析比较基因的功能,发现这些差异表达基因参与生物学过程、分子功能和细胞组分。在生物学过程分类中,245 个基因参与代谢过程、89 个基因参与应激反应、50 个基因参与发育过程、29 个基因参与繁殖过程、12 个基因与昆虫行为相关(图10)。GO 富集分析差异表达基因主要具有哪些功能,结果表明差异表达基因主要涉及氧化还原过程和氧化还原酶活性(图11)。进一步,通过荧光定量PCR 验证了部分差异基因的表达量(表4),结果与转录组测序一致(图12)。与糖代谢相关的基因Pepck1和谷胱甘肽合成相关的基因GstD2表达上调,与成虫寿命相关的基因mthl2、参与凋亡细胞清除的基因NimC4、与早期胚胎信号转导相关的基因vkg、参与雄性求偶行为的基因CheB42a表达下调。

图9 对照组和高糖组雄蝇基因表达差异图Fig.9 Differences in gene expression between male flies in the control group and the high-sucrose group
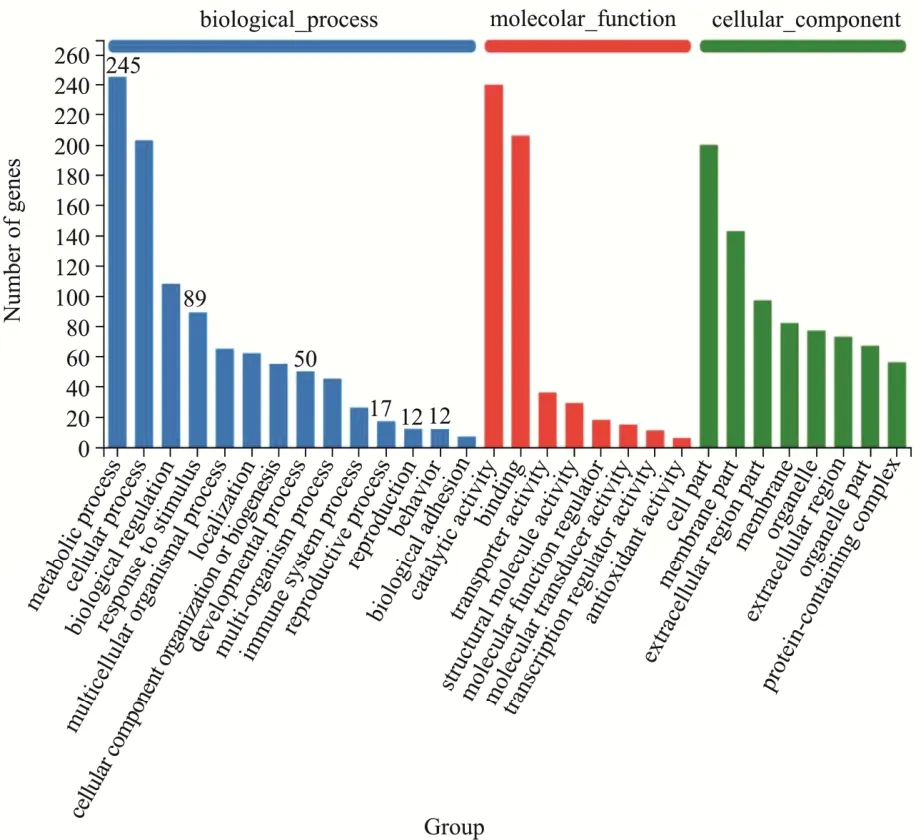
图10 对照组和高糖组果蝇差异基因的GO功能注释分类统计图Fig.10 Statistical diagram of GO functional annotation classification of differential expression genes in flies
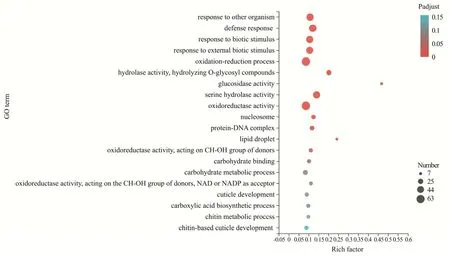
图11 对照组和高糖组果蝇差异基因的GO 富集分析图Fig.11 GO enrichment analysis of differential expression genes

图12 对照组和高糖组果蝇差异表达基因的qRT-PCR 验证Fig.12 qRT-PCR validation of differential expression genes in flies

表4 荧光定量验证的基因Table 4 Genes verified by fluorescence quantification
3 讨论
本实验研究结果表明,高含糖饮食会造成后代雄性果蝇寿命、运动能力、抗氧化能力和生育能力降低。胚胎孵化率统计结果表明,高糖组果蝇的胚胎孵化率降低,说明高糖饮食对雄蝇的育性产生了不利影响。有研究发现,氧化应激可能在糖尿病及其诱发相关男性生殖功能障碍和异常的病理生理学中都起重要作用[29]。因此,高糖饮食诱导雄蝇抗氧化能力损伤,可能是导致雄蝇生育能力降低的原因之一,这些改变会影响睾丸细胞的糖代谢[30,31]。此外,精子的细胞膜由大量的不饱和脂肪酸构成,容易被氧化(脂质过氧化);另一方面,细胞质中含有的能够中和ROS 的酶又很少量,所以精子特别容易受到ROS 的破坏作用[32]。
为了进一步探究影响雄性育性的机理,我们通过DAPI 精核染色发现,高糖饮食组果蝇精巢整体膨大异常,储精囊中没有明显的精子束。在大鼠中的研究也有相似结果,与正常组大鼠附睾组织形态结构相比,高脂高糖组附睾结构受损,管腔内精子数目极少[33]。激光显微共焦拉曼成像结果与生物学测定结果一致,高糖组精巢的拉曼光谱中代表蛋白质条带(1 100、1 450、1 558 和1 720 cm-1),核酸条带和胶原带(481、573、813 和996 cm-1)的拉曼峰强度明显低于对照组。在1 520 cm-1代表的类胡萝卜素处,对照组的拉曼峰强度明显高于高糖组。而类胡萝卜素在抗氧化方面具有重要的功效,不仅能直接作为抗氧化剂来清除自由基,还能增加体内SOD、谷胱甘肽过氧化物酶(GSH-Px)和CAT 等抗氧化酶的含量,进而强化机体自身的抗氧化能力[34],进一步联系了氧化损伤与生育力的关系。
转录组测序及荧光定量验证结果表明,与糖代谢相关的基因Pepck1和谷胱甘肽合成相关的基因GstD2出现了表达上调,说明高糖组果蝇可能是由于糖代谢异常和氧化应激异常导致果蝇发育和育性受到影响。同时,我们也发现了与成虫寿命相关的基因mthl2、参与凋亡细胞清除的基因NimC4表达量出现下调,进一步解释了高糖饮食导致雄蝇寿命缩短的原因。Park等研究发现CheB42a突变雄性果蝇比对照组雄性果蝇更早、更频繁地尝试与雌性交配,表明CheB42a能调节雄性的求偶行为[35]。同样地,本研究中与早期胚胎信号转导相关的基因vkg、参与雄性求偶行为的基因CheB42a表达量也出现了下调,说明这些基因可能影响着果蝇的育性。
4 结论
综上,高糖饮食抑制了雄性黑腹果蝇发育,同时对果蝇的生育能力造成了损伤,DAPI 精核染色和共焦拉曼光谱均说明了高糖饮食对精巢造成了损伤。通过转录组测序,我们发现高糖组果蝇的差异表达基因富集在果蝇发育过程、机体代谢活动调控及应激反应等方面,从而缩短果蝇寿命和损伤果蝇育性。
