马铃薯中噻虫胺和嘧菌酯的残留和膳食风险评估
2022-11-08李若同胡继业
李若同,胡继业
(北京科技大学化学与生物工程学院,北京 100083)
马铃薯(Solanum tuberosum)是我国一种重要的粮食作物,和水稻、小麦、玉米并称我国四大粮食作物。我国的马铃薯种植面积广,总产量位居世界前列,但单位面积产量却显著低于世界平均水平,主要原因之一就是病虫害的威胁,尤其是黑痣病Rhizoctonia solani、枯萎病Fusariumspp.等主要病害和马铃薯块茎蛾、马铃薯甲虫、蛴螬等主要害虫[1]。由于施用单一农药品种的防治效果有限,且易产生抗药性,这使得多种农药的混合施用成为防治马铃薯病虫害的新选择[2]。目前,2%噻虫胺·嘧菌酯颗粒剂(噻虫胺1%,嘧菌酯1%)正在我国申请登记,用于防治马铃薯黑痣病和蛴螬,亟需开展噻虫胺和嘧菌酯在马铃薯上的残留试验,为这种新型的农药制剂制定合理的使用准则,保障马铃薯的生产和膳食安全。
噻虫胺(Clothianidin,结构式见图1a)是一种具有内吸性的新烟碱类杀虫剂,具有胃毒和触杀活性,通过作用于昆虫神经系统的烟碱乙酰胆碱受体,使昆虫神经过度兴奋,导致全身痉挛,最终麻痹而死,与传统烟碱类杀虫剂相比具有用量少、毒性低、内吸和渗透作用强的特点[3]。嘧菌酯(Azoxystrobin,结构式见图1b)是一种新型杀菌剂,属甲氧基丙烯酸酯类,作用机制是通过干扰线粒体呼吸作用,抑制菌丝的形成和生长,具有广谱,持效期长、内吸性强、对非靶标生物安全等特性,是近年来我国广泛应用的新品种杀菌剂,有着较好的应用前景[4]。《食品安全国家标准食品中农药最大残留限量》(GB 2763-2021)中规定了嘧菌酯在马铃薯中的最大残留限量为0.1 mg/kg,尚未制定噻虫胺在马铃薯中的最大残留限量[5]。
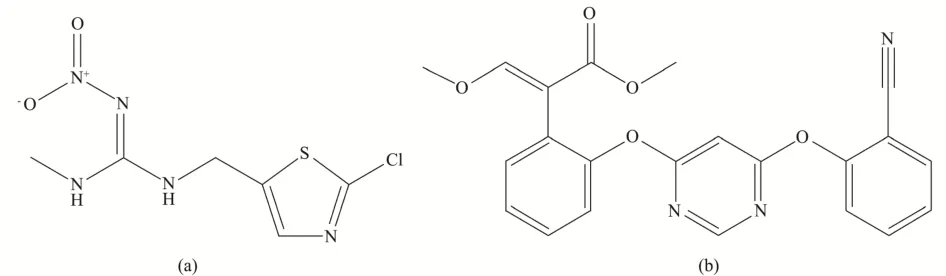
图1 噻虫胺(a)和嘧菌酯(b)化学结构式Fig.1 The structural formula of clothianidin (a) and azoxystrobin (b)
由于噻虫胺的广泛使用,已有对水果[6,7]、蔬菜[3,8-18]、粮食作物[19,20]和茶叶[21]等基质上噻虫胺的相关研究。针对以上多种基质的前处理方法主要包括乙腈匀浆提取-固相萃取柱净化和乙腈匀浆提取-基质分散萃取,部分方法操作步骤复杂耗时,使得样本通量小,不适用于大量样本的检测。而且这些研究主要集中于方法和残留行为,对其膳食风险评估的研究较少,未能全面的评估农药残留对人体健康的影响。目前嘧菌酯的检测方法主要是QuEChERS 结合高效液相色谱法(HPLC)或高效液相色谱-串联质谱法(HPLC-MS/MS),涉及基质有马铃薯[22]、洋葱[23]、大豆[24]、草莓[25]、花生[26]、人参[27]、香蕉[28]等,也有部分研究者对嘧菌酯在金银花[29]和甜菜根[30]等作物中的膳食风险进行研究。关于噻虫胺和嘧菌酯的同时检测,仅有一篇研究报道了马晨等人建立了噻虫胺和嘧菌酯在内的45 种农药在芒果上同时检测的方法[31]。综上所述,目前适合于噻虫胺、嘧菌酯的残留检测方法主要是QuEChERS 结合液相色谱-串联质谱法,其优势在于能够简便快速的对复杂基质中的痕量化合物进行准确地定性定量,但目前尚未见利用QuEChERS结合液相色谱-串联质谱法对马铃薯中的噻虫胺和嘧菌酯进行同时检测的报道,且未见通过12 地残留试验结果对噻虫胺和嘧菌酯在马铃薯中的膳食风险进行评估的相关研究。
本研究依据《农作物中农药残留试验准则》[32]在中国12 地开展了2%噻虫胺·嘧菌酯颗粒剂在马铃薯上施用的田间规范残留试验,利用QuEChERS 结合HPLC-MS/MS 法对噻虫胺和嘧菌酯在马铃薯上的残留量进行分析,并结合田间残留试验结果、膳食结构和毒理学数据进行了噻虫胺和嘧菌酯的膳食风险评估,为2%噻虫胺·嘧菌酯颗粒剂在马铃薯生产中的科学使用和噻虫胺在马铃薯上的最大残留限量制定提供理论依据和数据支持。
1 材料和方法
1.1 仪器和试剂
Agilent 1260HPLC-6420 MS/MS 液相色谱-三重四极杆串联质谱仪,美国Agilent 公司;FA2504 型电子天平(0.0001 g)、MP2002 型电子天平(0.01 g),恒平科学仪器;QL-861 型涡旋振荡器,其林贝尔仪器;TG16B 型离心机,湖南凯达科学仪器。
w=2%噻虫胺·嘧菌酯颗粒剂(w=噻虫胺1%,w=嘧菌酯1%)由河南瀚斯作物保护有限公司提供;纯度为99.7%的噻虫胺购于上海源叶生物科技有限公司;纯度99.0%的嘧菌酯标准品购于北京勤诚亦信科技开发有限公司;分析纯乙腈购自天津市津科精细化工研究所;色谱纯乙腈购自迈瑞达科技有限公司;色谱纯甲酸购自北京迪马科技有限公司;N-丙基乙二胺(PSA)购于天津博纳艾杰尔科技有限公司;氯化钠和无水硫酸镁购于国药集团化学试剂有限公司。
1.2 田间试验
w=2%噻虫胺·嘧菌酯颗粒剂在马铃薯上的残留试验于2020 年在内蒙古乌兰察布、甘肃定西、山西晋中、宁夏银川、北京、山东莱阳、安徽宿州、湖南长沙、广西南宁、贵州贵阳、重庆万州和广东肇庆12 地开展。依据NY/T 788-2018《农作物中农药残留试验准则》在每个试验地设置两个小区,分别作为试验小区和对照小区,每个小区面积为50 m2,两个小区间设置隔离区。w=2%噻虫胺·嘧菌酯颗粒剂用于防治马铃薯黑痣病和蛴螬,施药剂量为900 g a.i./ha,在马铃薯播种或移栽前施药1 次,施药方法为沟施。施药时,先在试验地边开沟,将称取的制剂倒在小盆中,戴上一次性手套,将制剂均匀的撒在沟内,覆土后再播种马铃薯。收获期采集马铃薯样品。随机在每个试验小区从不少于6 株上至少采集12 个大的块茎或24 个小的块茎,采集2 份样本各1 kg,装入样本容器中包扎妥当。可在田间进行简单处理。距小区周边0.5 m 范围内不采样。采用四分法缩分马铃薯样本,去除块茎顶部,然后将每份马铃薯样本切成1 cm 以下的小块,四分法分取100 g 样本两份,分别装入封口样本容器中,贴好标签并分类标记和贮存,储存于-20 ℃冷库。
1.3 残留分析方法
1.3.1 样品前处理
将马铃薯样品混匀粉碎,称取5 g(精确至0.01 g)于50 mL 聚丙烯离心管中,加入5 mL 水和10 mL 乙腈,涡旋1 min,加入1 g 氯化钠和4 g 无水硫酸镁,涡旋30 s,3 000 r/min 离心3 min。取1.5 mL 上清液转移至预先加有150 mg MgSO4和50 mg PSA 的3 mL离心管中,涡旋30 s,10 000 r/min 离心3 min。上清液过0.22 μm 滤膜后,保存于进样小瓶中,待HPLC-MS/MS 检测。
1.3.2 HPLC-MS/MS 检测条件
色谱条件:使用Agilent Poroshell 120 SB-C18 色谱柱(3.0×50 mm,2.7 μm),柱温保持在30 ℃,进样量5 μL;洗脱方式为梯度洗脱,流动相为乙腈(A)和含体积分数为0.2%的甲酸水溶液(B),梯度洗脱程序为:0~0.80 min,50%~90%(A);0.80~1.00 min,90%(A);1.00~1.10 min,90%~50%(A);1.10~1.50 min,50%(A),流速0.35 mL/min。
质谱条件:选用电喷雾离子源(ESI)进行正离子扫描,干燥气流速为11 L/min,温度300 ℃,雾化气压力45 psi,毛细管电压4 000 V。多反应监测模式(MRM)下的其他质谱条件见表1。
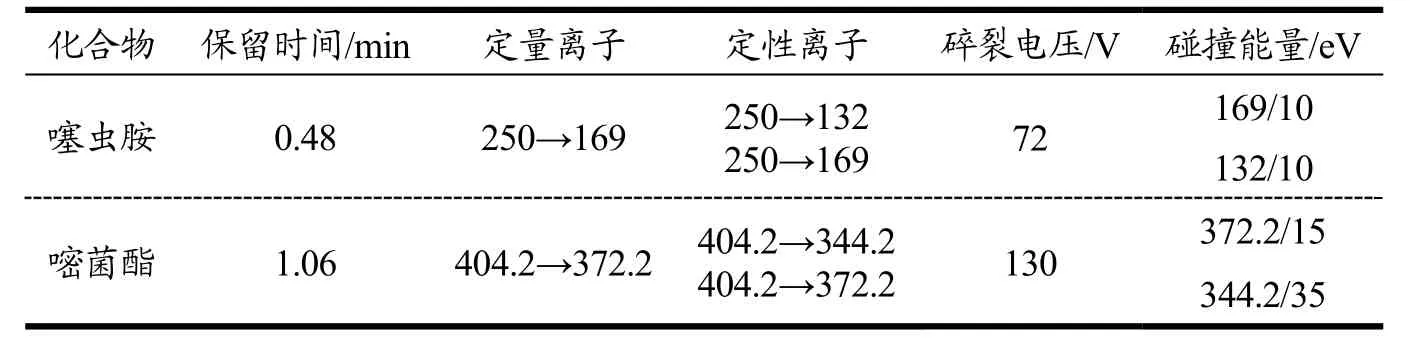
表1 噻虫胺和嘧菌酯质谱检测条件Table 1 Mass spectrometry parameters for clothianidin and azoxystrobin
1.3.3 标准溶液配制及标准曲线绘制
称取25.0 mg 噻虫胺标准品,用乙腈溶解并定容至25 mL,配成质量浓度为997.00 mg/L 的标准储备液;称取13.2 mg 嘧菌酯标准品,用乙腈溶解并定容至50 mL,配成质量浓度为261.36 mg/L 的标准储备液。取适量的噻虫胺和嘧菌酯标准储备液用乙腈配制混合标准溶液,放置于4 ℃,用于后续试验。
分别用提取的马铃薯空白基质溶液和乙腈配制浓度为0.005、0.01、0.025、0.01 和0.5 mg/L 的马铃薯基质匹配标准溶液和溶剂匹配标准溶液。于上述检测条件下进样测定,分别以噻虫胺和嘧菌酯的质量浓度为横坐标(x),对应的峰面积为纵坐标(y),绘制噻虫胺和嘧菌酯基质匹配标准曲线和溶剂匹配标准曲线。
1.3.4 添加回收试验
在空白马铃薯样品中添加三档浓度的噻虫胺和嘧菌酯混合标准溶液,每个水平重复5 次,进行添加回收试验。对添加了标准溶液的样品按照1.3.1 的方法进行前处理,使用HPLC-MS/MS 进行分析检测,具体方法参照1.3.2。根据检测结果计算添加回收率及相对标准偏差(RSD)(n=5)。方法的定量限(LOQ,mg/kg)为最低添加浓度,检出限(LOD,μg/kg)是信噪比为3 时的基质匹配标准溶液浓度。
1.3.5 基质效应
基质效应(Me)的计算公式如下:

式中:
Sm——基质匹配标准溶液曲线斜率;
Ss——溶剂标准溶液曲线斜率。
若Me>0,说明存在基质增强效应,反之则存在基质减弱效应[33]。
1.3.6 样品检测
GB 2763-2021 规定噻虫胺监测定义为噻虫胺,嘧菌酯监测定义为嘧菌酯[5]。按照上述方法对田间收获期采集的马铃薯样品进行检测分析,明确噻虫胺和嘧菌酯在马铃薯上的残留量情况。每批检测样本都设置两个质控样本。马铃薯样本中噻虫胺和嘧菌酯的添加浓度为0.01 mg/kg。质控样品在每批实际样品之前进行检测。
1.4 膳食风险评估
对噻虫胺和嘧菌酯进行风险评估,首先应计算噻虫胺和嘧菌酯的国家估算每日摄入量(NEDI),计算公式如下:

式中:
NEDI——国家估算每日摄入量,mg;
STMRi——噻虫胺和嘧菌酯在马铃薯和中国已登记的其它作物中的规范残留试验中值,mg/kg;对于没有残留试验中值的登记作物,残留试验中值取相应的MRL 值,若中国没有相应的MRL 值,则取美国或欧盟等制定的MRL 值;
Fi——中国一般人群某类食品的人均消费量,kg。
用风险商(RQ)表示噻虫胺和嘧菌酯的膳食摄入风险,当RQ<100%,表明膳食风险处于可接受范围,反之则表示风险不可接受,且数值越大风险越高[34]。计算公式如下:

式中:
ADI——噻虫胺和嘧菌酯的每日允许摄入量,mg/kg·bw;
bw——中国消费者的平均体重(63 kg)。
2 结果与讨论
2.1 方法验证
《农作物中农药残留试验准则》[32]规定,如果已制定相关MRL,添加水平应包括MRL 值和检测方法定量限,因此噻虫胺的添加水平为0.01、0.2 和1 mg/kg。如果未尚未制定MRL,添加水平应包括定量限和高于10 倍定量限的浓度,因此嘧菌酯的添加水平为0.01、0.1 和0.5 mg/kg。
在空白马铃薯样品中添加三档浓度的噻虫胺和嘧菌酯混合标准溶液,按上述条件分析检测,添加回收试验结果(表2)表明:噻虫胺在马铃薯中的平均回收率在91.76%~96.31%之间,RSD≤7.42%;嘧菌酯在马铃薯中的平均回收率在91.76%~98.13%之间,RSD≤7.63%。基质标准匹配曲线的结果(表3)表明:噻虫胺和嘧菌酯在0.005~0.5 mg/L 范围内,马铃薯基质匹配标准溶液的质量浓度与其响应值间均呈良好的线性关系,线性相关系数R2≥0.9972。在上述仪器条件下,噻虫胺和嘧菌酯在马铃薯基质中的定量限均为0.01 mg/kg,检出限均低于0.065 μg/kg。噻虫胺在马铃薯中表现为基质减弱效应,嘧菌酯在马铃薯中均表现为基质增强效应,因此采用基质匹配标准曲线定量来消除基质效应造成的影响。综上所述,所建立的检测方法在线性度、准确度、精密度和灵敏度上都能满足《农作物中农药残留试验准则》中的规定。对比前人的研究,本文建立的检测方法前处理步骤简单,节省时间和成本,样本通量大,更适合大量样本的检测。较其他研究者建立的马铃薯中噻虫胺的检测方法(回收率74.6%~90.6%)[10],回收率有明显提高。并且增加了对基质效应的评价,通过基质匹配标准曲线定量来消除基质效应造成的影响。因此,本研究建立的方法适于噻虫胺和嘧菌酯在马铃薯中的残留分析研究。
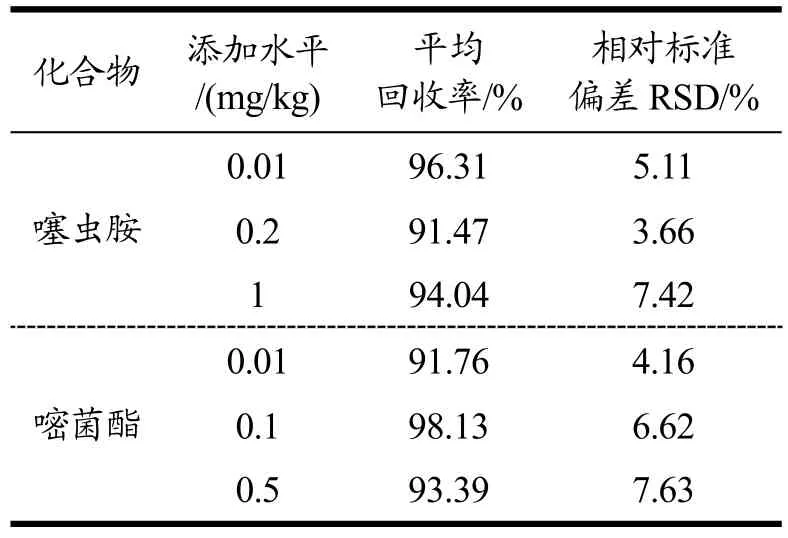
表2 噻虫胺和嘧菌酯在马铃薯中的平均添加回收率和相对标准偏差(n=5)Table 2 The average recoveries and RSDs of clothianidin and azoxystrobin in potato (n=5)
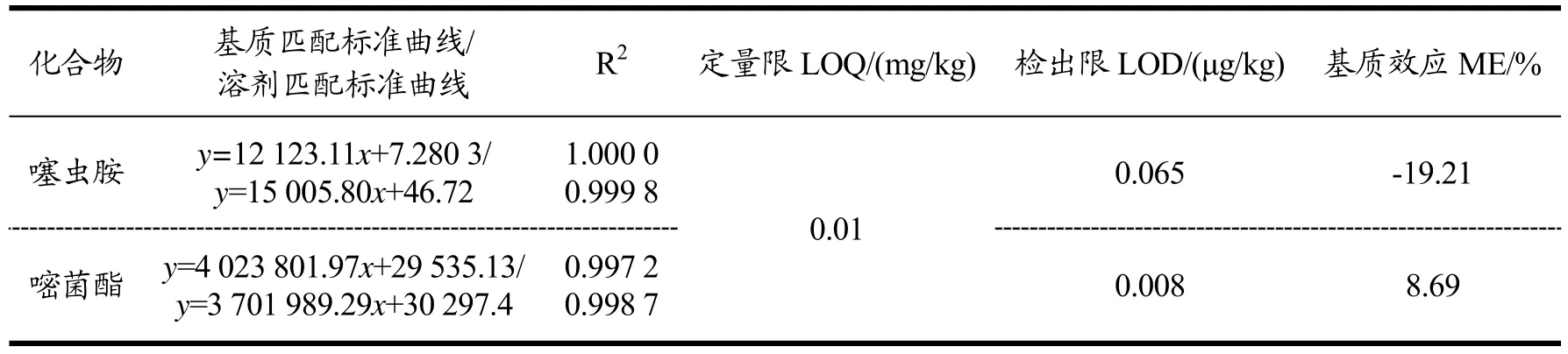
表3 噻虫胺和嘧菌酯在马铃薯中的基质匹配标准曲线、溶剂匹配标准曲线、定量限、检出限及基质效应Table 3 Matrix-matched linear equation,regression equation of standard solution,LOQ,LOD and matrix effects of clothianidin and azoxystrobin in potato
每批检测样本都设置两个质控样本。马铃薯样本中噻虫胺和嘧菌酯的添加浓度为0.01 mg/kg,质控样本添加回收率在92.41%~97.08%之间,RSD≤0.74%,满足《农作物中农药残留试验准则》(NY/T 788-2018)中规定的添加回收率的要求,说明该检测方法稳定可靠,保证了田间试验样品检测的结果的可靠性。
2.2 最终残留量
w=2%噻虫胺·嘧菌酯颗粒剂施药剂量为900 g a.i./ha,在马铃薯播种或移栽前施药1 次,施药方法为沟施。12 个试验点的噻虫胺和嘧菌酯最终残留结果见表4。在收获期采集的马铃薯样品中,噻虫胺的残留量均≤0.17 mg/kg,嘧菌酯的残留量均≤0.074 mg/kg。由于噻虫胺和嘧菌酯具有内吸性,施药后会被快速吸收至马铃薯植株之中,所以即使在播种或移栽时期进行沟施,收获期的马铃薯块茎中仍能检测到少量的噻虫胺和嘧菌酯残留。对比其他研究者的研究结果,朱峰等[15]研究了收获期时贵州和黑龙江的马铃薯中噻虫胺的含量,最终残留试验结果显示,由于较强的内吸性,采用土壤施药后噻虫胺被吸收至马铃薯植株的其它部分,而马铃薯中累积的噻虫胺较少,含量均小于0.076 mg/kg;杨阳等人[22]对定西市马铃薯块茎和土壤中嘧菌酯的残留进行了测定,结果表明,嘧菌酯在马铃薯块茎中的残留量为0.044 mg/kg。可以看出,与本研究所得结果类似:由于噻虫胺和嘧菌酯的内吸性,在马铃薯中均可检测到两种农药的残留。

表4 噻虫胺和嘧菌酯在12地马铃薯样品中的最终残留量(n=2)Table 4 Terminal residues of clothianidin and azoxystrobin in potato samples from 12 test sites (n=2)
我国尚未制定马铃薯中噻虫胺的最大残留限量,欧盟、美国、韩国和日本制定马铃薯中噻虫胺的最大残留限量分别为:0.03、1.5、0.1 和0.3 mg/kg[35]。与之比较可见,噻虫胺的残留量小于美国和日本制定的相应最大残留限量。中国制定马铃薯中嘧菌酯的最大残留限量为0.1 mg/kg[5],嘧菌酯的残留量小于中国制定的相应最大残留限量。
2.3 膳食风险评估
JMPR(2014)规定噻虫胺评估定义为噻虫胺[35],JMPR(2017)报告规定嘧菌酯评估定义为嘧菌酯[36],所以针对噻虫胺和嘧菌酯分别进行了慢性膳食风险评估。噻虫胺和嘧菌酯在我国使用范围广,在水稻、小麦、玉米等多种作物均有登记。将登记作物进行膳食分类,结合我国居民膳食消费量,利用公式(2)估算该农药的国家估算每日摄入量(NEDI)。其中,马铃薯所在的薯类的STMR分别采用收获期的马铃薯样品中噻虫胺和嘧菌酯的残留中值0.023 和0.01 mg/kg。对于没有残留试验中值的登记作物,按风险最大化的原则取相应的MRL 值代替残留试验中值,确保风险评估的可靠性。选择MRL 遵循的优先顺序为:中国>食品法典委员会(CAC)>美国>欧盟>澳大利亚>韩国>日本[34]。结果汇总于表5。
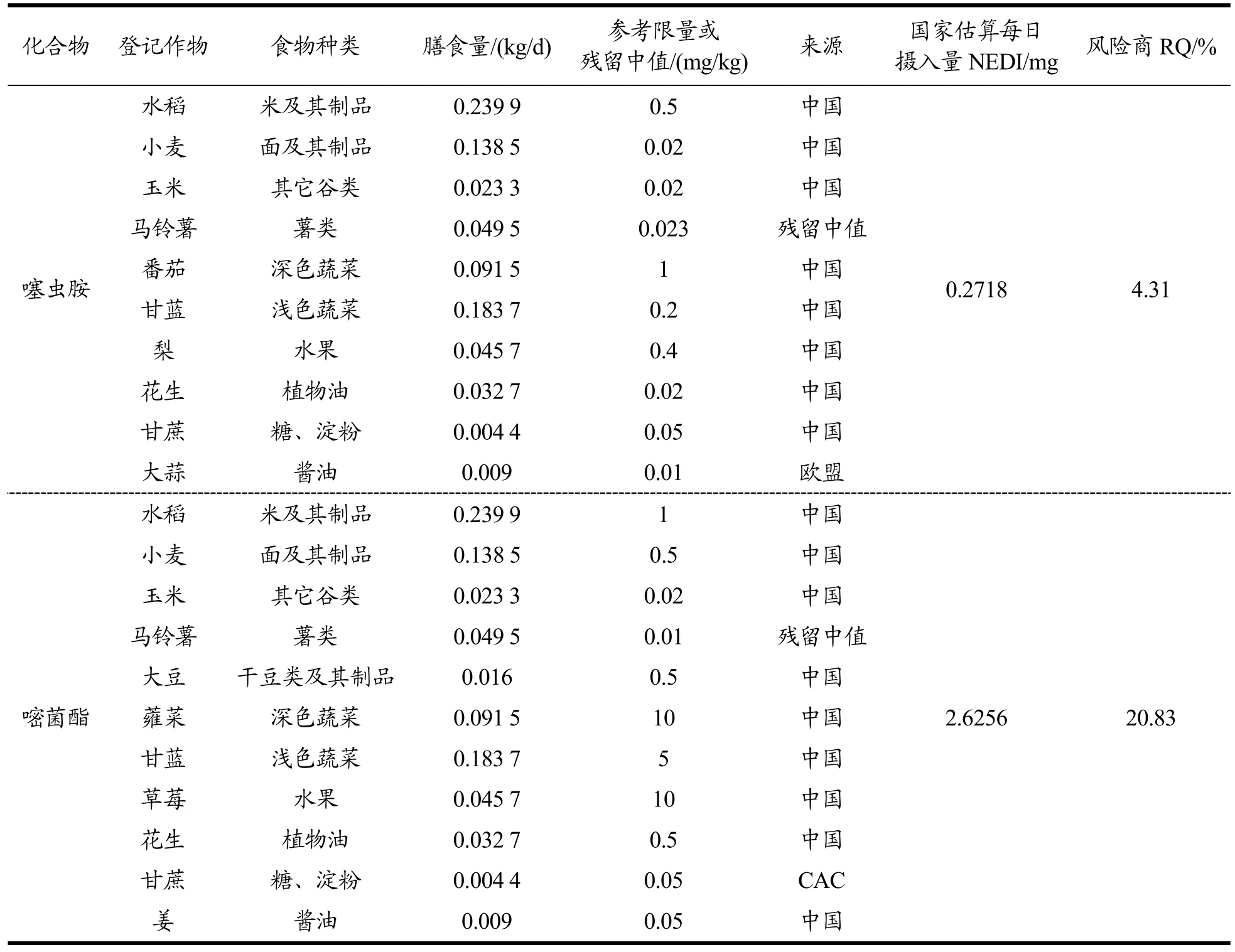
表5 噻虫胺和嘧菌酯的膳食风险评估Table 5 Dietary risk assessment of clothianidin and azoxystrobin
GB 2763-2021 规定噻虫胺的ADI 值为0.1 mg/kg(以体质量计),嘧菌酯的ADI 值为0.2 mg/kg(以体质量计)[5]。利用公式(3)将NEDI 与每日允许摄入量(ADI)进行比较。噻虫胺和嘧菌酯的国家估算每日摄入量分别为0.271 8 mg 和2.625 6 mg,所有登记作物中的风险商RQ 值分别为为4.31%和20.83%,均低于100%。结果表明,2%噻虫胺·嘧菌酯颗粒剂以900 g a.i./ha 的施药剂量,在马铃薯播种或移栽前沟施1 次,收获期马铃薯中噻虫胺和嘧菌酯的残留对我国一般人群的健康风险处于可接受的水平。
目前尚未见马铃薯中噻虫胺和嘧菌酯的膳食风险评估,但有研究者对芦笋[12]、苦瓜[13]、甘蓝[14,18]和小麦[20]中的噻虫胺进行了膳食风险评估研究,也有研究者评估了小麦[4]和金银花[29]中嘧菌酯的膳食风险,得出的结论均表明噻虫胺和嘧菌酯的残留,不会对一般人群健康产生不可接受的风险,与本研究所得结论一致。
3 结论
运用QuEChES 结合HPLC-MS/MS 建立了同时检测马铃薯中噻虫胺和嘧菌酯的残留量的方法。依照《农作物中农药残留试验准则》(NY/T 788-2018)进行方法验证,该方法的线性度、准确度、精密度和灵敏度均能满足要求,适用于马铃薯中噻虫胺和嘧菌酯的残留检测。
通过2020 年在全国12 个试验地进行马铃薯田间规范残留试验,在收获期采集的马铃薯样品中,噻虫胺的残留量均≤0.17 mg/kg,嘧菌酯的残留量均≤0.074 mg/kg。我国尚未制定马铃薯中噻虫胺的MRL值,嘧菌酯的残留量小于中国制定的相应MRL 值。
对噻虫胺和嘧菌酯分别进行了膳食风险评估,结果显示,噻虫胺和嘧菌酯的国家估算每日摄入量分别为0.271 8 mg 和2.625 6 mg,其风险商分别为4.31%和20.83%,说明对我国一般人群的健康产生的风险处于可接受的范围。参照以上数据,结合马铃薯的生长特点和消费习惯,推荐在马铃薯播种或移栽前使用2%噻虫胺·嘧菌酯颗粒剂,施药剂量为900 g a.i./ha,施药1 次,施药方法为沟施。
本研究建立了噻虫胺和嘧菌酯同时检测的方法,丰富了噻虫胺和嘧菌酯在马铃薯中的最终残留量数据和膳食风险评估数据,为2%噻虫胺·嘧菌酯颗粒剂在马铃薯田间的安全使用以及噻虫胺在马铃薯中MRL值的制定提供理论依据和数据支持。
