抗坏血酸降解机理以及脱氢抗坏血酸对食品的影响研究进展
2022-11-08李洁李彩云舒佳欣姜慧雯严守雷王清章
李洁,李彩云,舒佳欣,姜慧雯,严守雷,2,3,王清章,2
(1.华中农业大学食品科技学院,湖北武汉 430070)(2.湖北省水生蔬菜保鲜加工工程技术研究中心,湖北武汉430070)(3.教育部长江经济带常规水生生物产业绿色发展工程研究中心,湖北武汉 430070)
L-抗坏血酸(L-ascorbicacid,AA),又名维生素C,是一种含有6 个碳原子的酸性多羟基化合物,分子式为C6H8O6[1]。AA 具有很强的抗氧化性,是一种重要的自由基清除剂。目前,AA 被广泛地用于食品添加剂,如食品抗氧化剂,在改善蛋白质性质、抑制酶促褐变、保护多酚稳定性等方面发挥重要作用,被世界卫生组织(WHO)食品添加剂委员会评定为具有营养性、无毒、高效、使用安全的食品添加剂之一[2]。但是,AA 在食品体系中稳定性较差,易受光照,温度等环境的影响,发生降解,其氧化产物既能自身进一步氧化聚合生成褐色素,又能够与氨基酸一起参与美拉德反应形成褐色素,严重影响了产品的感官质量[3,4];同时抗坏血酸降解产物脱氢抗坏血酸(Dehydroascorbicacid,DHAA)与食品中的营养成分会发生复杂的化学变化[5]。深入了解AA 在不同环境下的降解机制及其降解产物,对避免AA 的氧化降解和保持食品品质有重要意义。本综述从AA 降解机理以及DHAA 对食品的有利和不利影响入手进行了详尽阐述。
1 抗坏血酸降解
AA 的降解被认为是食品加工和存储过程中质量和颜色变化的主要原因之一[6,7],并且是褐色物质[8,9]生成的来源之一,AA 降解产物直接或间接影响食品的颜色和风味。AA 的降解过程很复杂,涉及许多氧化/还原和分子间重排反应。AA 的降解包括两类,一类是自降解,AA 的自降解又分为有氧和无氧两种途径[3]进行,具体取决于pH、氧气、温度、底物浓度、金属离子、光照的存在以及储存的时间,自降解产生的降解产物还原酮会导致褐色素生成。另一类是参与美拉德反应的降解,AA 氧化生成DHAA 和二羰基化合物,再与氨基酸共同作用生成羰胺类物质,形成二聚体、三聚体和四聚体。
1.1 抗坏血酸降解动力学
AA 自降解动力学研究主要集中在水果营养成分的影响上。AA 在柑橘汁、柠檬汁、番石榴和橄榄中的降解动力学已有报道[10-12]。Sapei 等[10]探讨了新鲜草莓汁在贮藏过程中AA 的降解动力学,以及贮藏温度和糖添加量对草莓汁中AA 损失的影响,发现AA 在草莓果汁中的降解反应均遵循零级动力学模型,低温贮藏结合加糖可以有效地减缓AA 的降解速度。Tiwari等[11]测定了超声波处理橙汁在贮藏过程中的AA 降解动力学,超声处理样品的降解动力学符合一级动力学,其保质期因AA 的保留而延长。Montano 等[12]研究了不同添加量的AA 和不同温度下对包装橄榄贮藏过程中AA 损失的影响,在80 ℃下AA 通常按照一级动力学降解,在40 ℃下遵循二级动力学,在10 ℃下遵循零级动力学。在每个贮存温度下,AA 浓度的增加显著降低了AA 的降解速率。
建立抗坏血酸降解动力学模型,一般采用两步数学方法。在第一步中,应用线性回归分析来计算AA的降解速率常数,AA 的降解反应级数为零级,见公式(1)、一级,见公式(2)或二级,见公式(3),则反应物质量浓度Ct与时间t、ln(Ct/C0)与时间t、1/Ct与时间t均呈线性关系,相应线性回归系数R2 最高的模型被认为是食品中AA 降解动力学模型,然后由回归线斜率确定降解速率常数。在第二步中,为了确定降解速率常数的温度依赖性,使用了阿伦尼乌斯(Arrhenius)方程,见公式(4),计算降解反应的活化能。活化能(Ea)是一种熵势,利用过程温度作为因果驱动力,通过对速率常数的估计来评估食品系统中的质量变化。

式中:
k1——零级降解速率常数;
k2——一级降解速率常数;
k3——二级降解速率常数;
t——时间,min;
Ct——反应物质量浓度,mg/mL;
C0——初始反应物质量浓度,mg/mL;

式中:
Ea——活化能,kJ/mol;
R——气体常数,8.314 J/mol·K;
T——绝对温度,K;
A——频率因子,h-1;
k——速率常数。
1.2 氧浓度对抗坏血酸降解的影响
在不同的降解条件下,AA 会产生不同的降解产物,吸收峰最大值在紫外区230~300 nm 之间。AA 在有氧和无氧条件下降解路径不尽相同。在有氧条件下,AA 首先转移一个电子形成半脱氢抗坏血酸自由基,再失去一个电子生成脱氢抗坏血酸,该产物的内酯桥式结构很不稳定,不可逆地水解生成2,3-二酮古洛糖酸,而后2,3-二酮古洛糖酸脱羧生成L-木酮糖,接着进行分子间氧化还原反应和脱水反应,最终生成2-糠酸和3-羟基2-吡喃酮。无氧条件下,AA 无需先氧化成DHAA,而是通过1,4-内酯桥式结构断裂和水分子的加入、脱羧、分子间的重排以及脱水形成糠醛来降解[13]。这说明降解反应体系中溶解氧浓度不足可能导致AA 向DHAA 转化不完全。Bree 等[14]研究了在一个模型果汁中,不同初始顶空O2浓度对AA 氧化以及随后DHAA 形成和分解的影响,使用零级和一级动力学估算AA 单独降解的动力学速率常数,同时使用一级不可逆和可逆连续模型描述AA 的降解动力学以及DHA 的氧化形成和不可逆分解,发现AA 一级降解常数与初始顶空氧浓度呈线性关系。Fata 等[15]为了了解氧气对罐装温度下AA 保留的影响,在pH 值3.5 的模型溶液中进行热处理,在0.03 MPa 的顶空氧气分压下,320 min 的处理不足以完全降解培养基中最初存在的所有AA,但当顶空氧气分压设定为0.1 MPa 时,120 min 的处理足以降解所有初始AA。当氧气存在时,无论其在顶空中的分压是多少,AA 的降解都不会随着温度的升高而加速反应。

图1 AA 在有氧和无氧条件下降解途径[13]Fig.1 AA degradation pathway under aerobic and anaerobic conditions [13]
1.3 温度对抗坏血酸降解的影响
温度是影响AA 降解速率的重要因素。在100 ℃和60 ℃下加热2 h,AA 溶液(pH 值4)中糠醛含量分别为2.88 和0.01 mg/L,3-羟基2-吡喃酮含量分别为3.68和0.4 mg/L。100 ℃时2-糠酸含量为0.56 mg/L,较低的温度可能会抑制AA 的降解,从而限制各种降解产物的积累[16]。Demiray 等[17]研究发现热风干燥温度对番茄中AA 的损失有显著影响,且AA 降解的反应速率常数高度依赖于干燥温度,实验证明,番茄中AA 降解的最有效温度在60~70 ℃。AA 含量一般随着食品温度的升高和水分含量的降低而降低。降解的原因可能是AA 氧化和热破坏。Marfil 等[18]研究了不同干燥条件下番茄中AA 的降解动力学,研究认为降解速率取决于干燥前的样品处理以及干燥温度,提高干燥温度会导致更高的降解率。除干燥温度外,物料厚度、相对湿度和干燥时间对AA 含量也有影响。相对湿度对AA 保留的影响是复杂的,因为相对湿度的增加可能会导致干燥时间的增加,这对AA 的保留有负面影响;另一方面,增加相对湿度可以降低氧化反应的速率,这对AA 的保留有积极的影响。
1.4 pH 值对抗坏血酸降解的影响
Li 等[19]基于挥发性产物定性分析研究了AA 的降解机理(图2)。烯二醇结构的存在使AA 容易氧化和分解。首先,AA 氧化为DHAA,然后DHAA 水解,环裂解为2,3-二酮-1-古洛糖酸,其分解产生醛戊糖,并通过异构化转化为1-脱氧苯醌,然后1-脱氧苯醌分解变成次级产物。最终产物在不同的初始溶液pH 值下会有所不同。在碱性条件下,主要产物为2-甲基呋喃、2,4-二甲基呋喃、2-乙酰基-5 甲基呋喃和2-甲基-2-环戊烯-1-酮。在酸性条件下,主要产物为糠醛和呋喃类衍生物,呋喃的衍生物包括2,2-亚甲基双呋喃、2-甲基呋喃和2,4-二甲基呋喃,这些产物是一类无色中间体,它们不断积累聚合成褐变产物,降低食品质量。Yuan 等[20]采用高效液相色谱法同时测定抗坏血酸降解产物,研究了不同pH 值下抗坏血酸在水溶液中的降解情况,发现低pH 值条件有利于糠醛、2-糠酸和3-羟基-2-吡喃酮的形成,在极低的pH 值(即pH值为1)下,糠醛的形成占主导地位;在碱性水溶液中,未知化合物成为抗坏血酸的主要降解产物;在pH值为10 时,仅检测到极少量的糠醛和3-羟基-2-吡喃酮,不含2-呋喃甲酸。
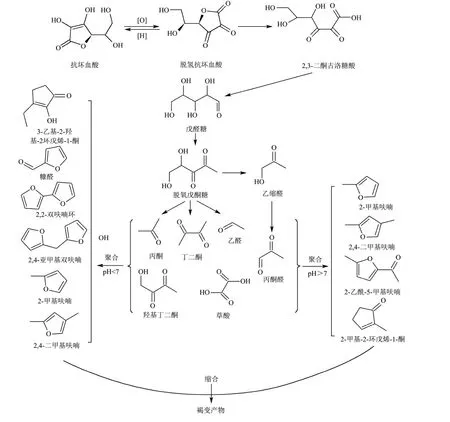
图2 AA 在不同pH 值条件下降解的可能机制及途径Fig.2 Possible mechanism and pathway of AA degradation under different pH value conditions
1.5 底物浓度对抗坏血酸降解的影响
不同浓度的抗坏血酸在溶液中表现出不同的作用。Buettner 和Jurkiewicz[21]在研究各种条件下金属催化的抗坏血酸氧化时,证明AA 可以根据AA 的浓度水平表现出“交叉”效应。他们发现,在较高浓度下,抗坏血酸可以起到抗氧化剂的作用,而在较低浓度下,抗坏血酸可以起到促氧化剂的作用。他们提出,交叉效应是由AA 氧化产生的自由基引起的。其他研究也表明AA 的抗氧化和促氧化特性具有类似的浓度依赖性。崔乃杰等[22]也认为AA 的促氧化作用主要是在金属离子参与下,发生Fenton 反应产生了羟基自由基,诱发一系列自由基连锁反应。
1.6 抗坏血酸/脱氢抗坏血酸参与美拉德褐变反应
AA 是一种还原剂,因此AA 及其氧化产物也可以通过美拉德反应与氨基发生反应形成类黑素和吡嗪。AA 在氨基酸存在下的美拉德反应行为已经得到了广泛的研究。
早在70 年代,研究人员[23]发现DHAA 能够与α-氨基酸发生褐变并能形成一种红色素,并对其形成机理进行了探讨,首先AA 被氧化形成DHAA,然后α-氨基酸发生Strecker降解反应(氧化脱羧),与DHAA反应生成4-氨基-2-(1,2-二羟基乙基)-5-羟基呋喃-3-酮,又名2-氨基-2-脱羧-抗坏血酸(L-Scorbamicacid,SCA),随后形成的SCA 可能在氧化作用下生成脱氢SCA,最终脱氢SCA 与SCA 反应生成红色色素2,2'-亚硝基-2(2’)-脱氧-L-抗坏血酸铵盐(NDA),见图3。
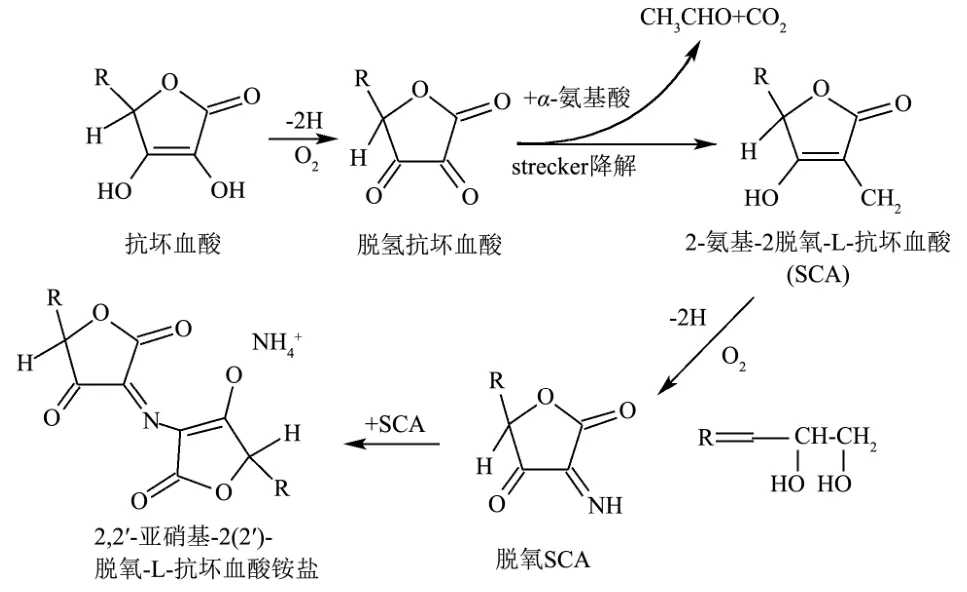
图3 抗坏血酸与α-氨基酸形成红色素可能的机理Fig.3 Possible mechanism of ascorbic acid and α-amino acids forming red pigment
Yu 等[24]分别以碱性氨基酸和酸性氨基酸为底物,研究了AA 参与美拉德褐变反应的动力学特征。结果表明,三种碱性氨基酸(赖氨酸、精氨酸、组氨酸)与AA 发生非酶促褐变,其褐变产物的形成符合零级动力学特征。反应体系的褐变程度只与反应体系中AA 的总量有关。在110~150 ℃的反应温度范围内,反应速度排序为AA/赖氨酸体系>AA/精氨酸体系>AA/组氨酸体系。
两种酸性氨基酸(谷氨酸、天冬氨酸)与L-抗坏血酸的褐变反应所导致的褐变产物也遵循零级反应动力学,AA/L-天冬氨酸反应体系的动力学行为与AA/L-谷氨酸反应体系相似,但反应速率稍高。吡嗪类化合物的产率与褐变产物浓度呈高度正相关。YU 等[25]认为,首先AA 与酸性氨基酸反应以及AA 自降解产生的褐变产物可以形成无色中间产物,然后AA 的降解产物丙酮醇、羟基丁二酮、丁二烯等与从酸性氨基酸中热释放出来的氨反应生成α-氨基醇,氨基醇聚合缩合形成有色的吡嗪类化合物,见图4。

图4 AA 和酸性氨基酸生成褐变产物和吡嗪化合物的途径[25]Fig.4 Proposed formation pathway for BP sand pyrazine compounds from AA and acidic amino acids [25]
由于AA 的不稳定性,在使用过程中注意条件的选择,最好在低温、避光、酸性、低氧条件下使用,避免发生降解氧化褐变,使其保留率尽可能提高,以发挥其最大抗氧化性能。
2 脱氢抗坏血酸对食品的有利和不利影响
AA 具有抗氧化特性,可以在水溶液中快速氧化形成脱氢抗坏血酸,DHAA 不稳定,会与食品中的其他成分会发生复杂的化学变化,对食品产生有利或不利影响。
2.1 有利影响
烘焙业多年来一直在对面团蛋白质进行化学改性,从而改善了许多烘焙食品的稠度、质地和强度[26]。研究发现添加氧化剂可以改善面团的性能,AA 在面包烘焙中常被用作面粉改良剂,在面团中添加AA 可改善面团的弹性和保持气体的特性,从而形成质地更好的大面包。AA 作为面粉改良剂的作用通常归因于它的第一个氧化产物DHAA。由于在面团中很容易发生相互转化,添加AA 或DHAA 通常会产生相同的效果。有些学者认为AA 在氧气存在的条件下可被氧化成DHAA,DHAA 能将面团中的硫氢键氧化为二硫键,使面筋蛋白通过分子间二硫键形成大分子面筋网络结构,增强面团筋力[27]。而有些学者认为AA 改善面团特性不是因为二硫键的形成,而是与美拉德反应有关。Gerrard 等[28]发现在DHAA 与蛋白质的模型体系中,在37 ℃条件下,通过不涉及二硫键的机制,DHAA 可以交联蛋白质。
Fayle 等[29]研究了蛋白质与DHAA 及其降解产物的交联,认为随着温度的升高,DHAA 和模型蛋白质RNAseA 之间的美拉德反应比率增加,其他DHAA 降解产物,如甲基乙二醛、乙二醛、二乙酰和三糖,也能引起蛋白质的交联,交联速度大于DHAA;所有反应都受到赖氨酸残基的保护而被抑制,这表明蛋白质的交联是通过游离赖氨酸残基和羰基化合物之间的美拉德反应进行的;在反应混合物中加入这些有效的蛋白质交联剂,可以提高交联速率。
2.2 不利影响
2.2.1 脱氢抗坏血酸与多酚形成加合物,促进酚类的降解
酚类物质是绿茶中主要的生物活性化合物,但是酚类物质不稳定,容易发生氧化降解,添加AA 是防止儿茶素氧化的最常用方法。Chen 等[30]发现DHAA对EGCG(表没食子儿茶素没食子酸酯)的稳定性、保护性和破坏性具有双重作用。DHAA 可以通过抑制水解来保护EGCG 的稳定性,也可以通过形成DHAA-EGCG 加合物来促进EGCG 的消耗。DHAA可诱导EGCG、ECG(表儿茶素没食子酸酯)、EC(表儿茶素)和EGC(表没食子儿茶素)形成儿茶素抗坏血酸加合物。在四种儿茶素中,DHAA 捕获儿茶素的能力,从高到低依次为EGCG、ECG、EC 和EGC,推测C 环的没食子酸基团影响了DHAA 和儿茶素之间的反应活性,这就说明DHAA 可以通过形成抗坏血酸加合物促进茶叶、茶饮料和茶叶食品中儿茶素的降解。
刘增辉等[31]分析了4 种常温无开口茶饮料中茶多酚和AA 的含量。结果表明,茶树叶片中总酚含量在第3 个月明显下降,AA 含量在第1-3 个月急剧下降。推测DHAA 是由AA 在1-3 个月内氧化形成,在第3个月后促进了总酚的显著降解。由此可见,在室温下密封贮存的茶饮料中,AA 的降解速度比儿茶素的降解速度快,因此,茶饮料的保质期应结合AA 的消耗和DHAA 对儿茶素的降解进行综合考量。
AA 通过抑制氧化从而保护儿茶素的稳定性。AA被氧化成DHAA,DHAA 在贮藏过程中通过形成脱氢抗坏血酸-儿茶素,促进儿茶素的消耗。DHAA 能捕获儿茶素形成抗坏血酸结合物,这有助于探索在食品加工过程中,儿茶素与AA 之间的相互作用。研究报道,在氧气存在下,AA 能引起DNA 链断裂,而且AA 能增加fenton 体系中的OH 自由基[32]。许多现象实际上可能是由DHAA 特性引起的。因此,当AA 用于保护茶饮料和茶叶食品中儿茶素的稳定性或与儿茶素协同增效改善健康功能时,必须重视AA 的氧化和DHAA的性质。
2.2.2 脱氢抗坏血酸与蛋白质交联,形成糖基化终产物
蛋白质糖基化在体内通过一系列复杂的非常缓慢的反应发生,包括amadori 反应、席夫碱形成和美拉德反应,从而促进晚期糖基化终产物的形成。晚期糖基化终产物最近受到越来越多的关注,因为这些物质在糖尿病并发症的发生和发展中起着重要的致病作用。活性二羰基是美拉德反应的重要中间产物,被认为在细胞内衰老形成中起重要作用[33]。例如,据报告甲基乙二醛比还原糖更具活性,可作为晚期糖基化终产物的前兆,对细胞和组织产生直接毒性[34]。AA 含量在人体晶状体、大脑和肾上腺等组织中显著较高,尤其是晶状体,AA 浓度可达3 mmol。AA 参与糖基化反应,促进蛋白质聚集和白内障形成。一个小鼠模型进一步证实了这一点,该小鼠模型选择性地在晶状体中过量表达人类AA 转运体svct2,从而增加AA 的内流,导致明显的晶状体褐变和晚期糖基化终产物积累[35]。AA 形成糖化剂的化学途径来源于其氧化形式DHAA。有研究报道,DHAA 能通过糖基化机制与晶状体蛋白质快速反应,形成交联蛋白质[36]。此外,体内研究发现AA或DHAA可以在人类晶状体内降解为更多的活性形式,如2,3-二酮古龙酸和3-脱氧苏糖酮,这可以通过晚期糖基化终产物形成,造成大量蛋白质损害。因此,DHAA 作为一种反应性的二羰基物质,可以促进晚期糖基化终产物的形成,DHAA 能与晶状体蛋白发生快速反应,形成交联蛋白。
3 总结与展望
AA 发生降解分为两个途径,AA 的自身降解和参与美拉德反应途径的降解,两个途径最终都会生成褐变产物,影响产品的感官。由于AA 具有不稳定、易降解的性质,富含AA 食品的贮藏或在AA 使用过程中要注意环境条件的选择,最好选择低温低氧避光条件。脱氢抗坏血酸对食品的有利影响是可以与面筋巯基交联,提高面团筋性;不利影响是与绿茶中的多酚形成加合物,促进酚类的降解,并且与蛋白质交联,会形成糖基化终产物,导致人体衰老和疾病的发生。
了解抗坏血酸的降解机理以及降解产物与食品成分之间的相互作用,对抗坏血酸的工业应用有很好的指导。在工业生产中,既要注意尽可能防止抗坏血酸的氧化分解,又要避免降解产物给食品带来的不利影响。目前对抗坏血酸的研究比较深入,无论是检测方法还是食品应用;但是对于脱氢抗坏血酸的研究较少,后续应该从脱氢抗坏血酸的检测手段,与食品成分的相互作用、对食品的影响等多角度进行深入研究,比如液质联用分析脱氢抗坏血酸以及降解产物,深入探讨脱氢抗坏血酸与食品中糖类、氨基酸、蛋白质、脂肪、酚类物质的相互作用,且这些物质对脱氢抗坏血酸的降解有什么影响,进一步研究脱氢抗坏血酸在美拉德反应中的作用,对其在食品中的应用以及化学变化提供理论指导。
