铁包金按摩膏联合刮法对膝骨关节炎模型兔关节软骨IL-1β、TNF-α及A20蛋白表达的影响*
2022-11-08匡浩铭钟秀远陈杰沉琳玲戎宽匡建军
熊 杰,匡浩铭,钟秀远,陈杰,沉琳玲,戎宽,匡建军,3
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省中医药研究院,湖南 长沙 410000;3.湖南中医药高等专科学校,湖南 株洲 412012)
膝骨关节炎(knee osteoarthritis,KOA)为临床常见病[1],其症状主要为膝关节肿胀、疼痛、活动障碍等。单纯西医治疗该病效果欠佳,且无法缓解患者的伴随症状。随着对中医药治疗KOA的深入研究,加之中医药治疗该病有“简、效、廉”的优点,应用中医药防治KOA越来越受到重视。药刮疗法具有显著的中医特色,对骨科疾病防治有较好的作用[2]。课题组前期临床研究证明,铁包金按摩膏联合刮法治疗不同部位的骨关节炎均有较好的疗效。铁包金药物刮痧治疗肩周炎的总有效率为92.50%(37/40)[3]。铁包金按摩膏药刮法治疗膝骨关节炎的总有效率为86.67%(26/30)[4]。但其作用机制不明确,限制了其在临床的进一步推广与运用。本实验以膝骨关节炎实验兔为模型,探索铁包金按摩膏联合刮法对实验兔膝关节软组织中A20表达的影响,以探究铁包金按摩膏联合刮法的作用机制。
1 材料与方法
1.1 实验动物 6个月龄健康新西兰实验兔40只,普通级,雌雄各半,体质量2.0~2.5 kg,购自湖南省中医药研究院实验动物中心,生产许可证号:SCXK(湘)2020-0005。实验兔饲养于开放式动物饲养室(湖南省中医药研究院动物房),室温控制在20~25 ℃,湿度50%~60%,12 h/12 h明暗周期,标准营养颗粒饲料喂养,自由饮水。动物日常护理及实验条件均符合《中华人民共和国实验动物环境及设施标准》。实验方案得到湖南省中医药研究院实验伦理委员会批准。
1.2 药物与试剂 铁包金按摩膏由湖南省中医药研究院制剂室生产,方药组成:铁包金50 g,大黄50 g,川乌25 g,草乌25 g,木瓜25 g,白芷25 g,木鳖子25 g,三棱25 g,莪术25 g,血竭10 g,木通25 g,当归25 g,肉桂25 g,赤芍25 g,透骨草25 g,乳香25 g,没药25 g,洋金花10 g。中药材均采购于康美药业股份有限公司,经湖南省中医药研究院附属医院药剂科胥新元主任药师鉴定均为2020年版《中华人民共和国药典》收录正品。木瓜蛋白酶(美国Genview公司,批号:GX-6024);肿瘤坏死因子-α ELISA检测试剂盒(北京百奥莱博科技有限公司,批号:ARB13479);白细胞介素-1β ELISA检测试剂盒(南京森贝伽生物科技有限公司,批号:SBJ-R0024);RIPA裂解液(中国长沙维世尔生物,批号:RA19060);兔抗鼠A20(英国abcam公司,批号:AB9234)。
1.3 主要仪器 TS-92型摇床(江苏其林贝尔仪器制造有限公司);DYY-6C型恒温箱(北京六一生物科技有限公司);M199型切片刀(德国徕卡显微系统股份有限公司);YD-315型切片机(浙江金华益迪医疗设备有限公司);BMJ-A型包埋机(常州中威电子仪器);BA210T显微镜(麦克奥迪实业集团有限公司);H1650R型台式冷冻离心机(湖南湘仪离心机有限公司);DYY-6C型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪均购自北京六一生物科技有限公司;GL-88B型旋涡混合器(江苏其林贝尔仪器制造有限公司);JB-13型磁力搅拌器、PHS-3C型精密pH计均购自中国雷磁;BioPrep-24型生物样品均质仪(杭州奥盛仪器有限公司)。
1.4 造模与分组 采用随机数字表法从40只实验兔中选出8只(雌雄各半)作为正常组,仅常规饲养,不做处理。其余32只实验兔制作兔KOA模型。具体操作:分别将0.5 mL的2%木瓜蛋白酶水溶液于实验开始第1、4、7天注入实验兔右后肢膝关节腔进行造模[5]。造模结束1周后,进行膝关节Lequesne MG评分[6],总分≥4分表示造模成功。造模成功后再将32只实验兔采用随机数字表法分成模型组、刮法组、涂擦组、药刮组,每组8只(雌雄各半)。
1.5 实验给药 各组实验兔均常规饲养。根据《中药药理实验方法学》中计算外用药物等效剂量的方法,计算出涂擦组、药刮组铁包金按摩膏剂量为6.25 g/kg。造模后1周开始给药,药刮组实验兔在固定状态下,腿部剃毛,涂上约12.5 g铁包金按摩膏后用特制牛角刮痧板沿肢体方向绕膝关节部顺时针以约70次/min的频率刮痧,约3 min或刮至皮肤微发红;刮法组实验兔在固定状态下,以纯净水保持润滑的前提下只行刮法,具体方法同药刮法;涂擦组实验兔在固定状态下,腿部剃毛,涂上约12.5 g铁包金按摩膏。以上3组每周周一、周三、周五的09:00:00进行干预,连续给药4周。正常组、模型组实验兔进行常规饲养,不予干预。
1.6 观察指标
1.6.1 膝关节Lequesne MG评分 实验过程中观察记录各组实验兔的体毛色泽、饮食情况、活动量及精神状态等。末次给药结束后1 d,使用Lequesne MG的膝关节级别评估方法评估各组实验兔右膝关节局部反应、步态改变、关节活动范围及肿胀程度等情况。评分标准见表1。
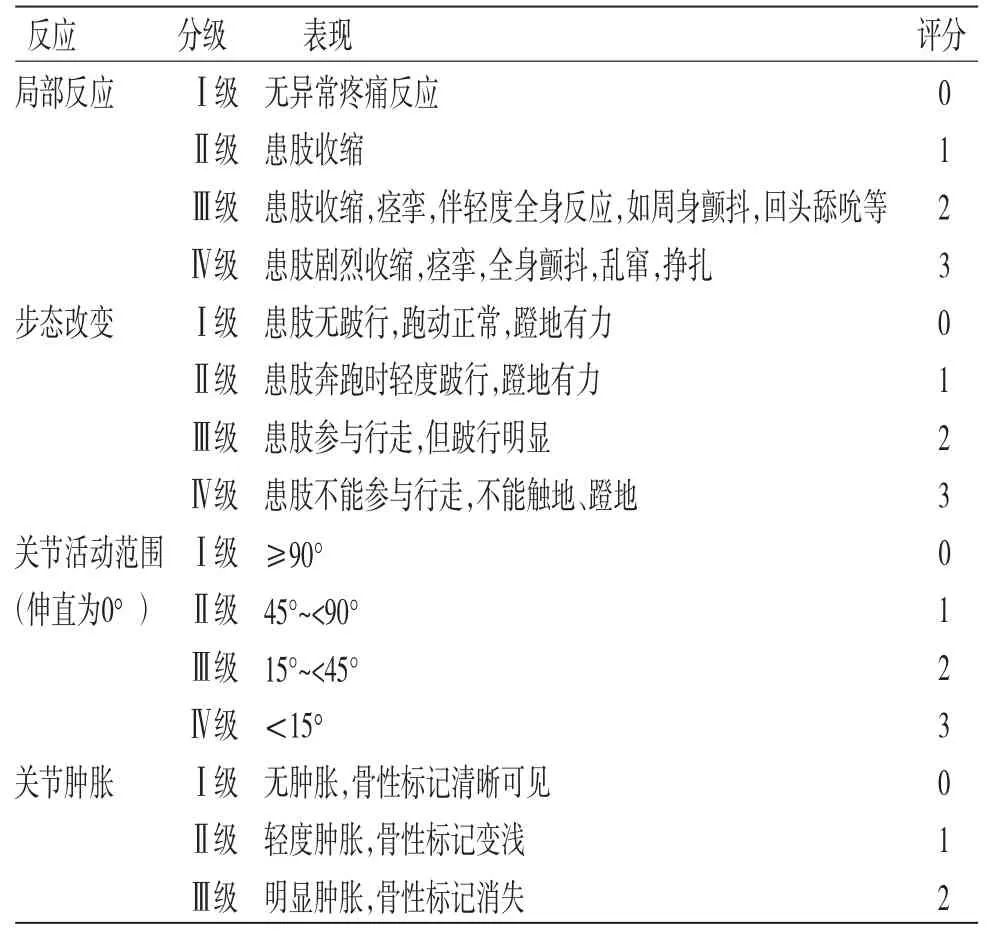
表1 Lequesne MG 评分标准
1.6.2 Mankin评分 末次给药结束后1 d,空气栓塞法处死实验兔[7],打开关节腔观察膝关节软骨关节面的形态学改变、滑膜状态、关节腔积液情况、关节软骨状态。采集各组实验兔部分膝关节软骨并制成切片,行番红O-固绿软骨染色法后,光镜下观测已切片、染色的内、外髁的软骨,按Mankin评分标准对表层软骨细胞分裂增生程度、细胞排列情况、染色程度、潮线及血管翳生成情况进行评分,并拍摄照片。评分标准见表2。

表2 Mankin 评分标准
1.6.3 软骨组织中炎症因子水平 末次给药结束后1 d,取出-70 ℃保存的软骨组织,在1 mg软骨组织中添加9 mg/L的生理盐水,置于匀浆器内制备匀浆液,5 000 g离心10 min后,收集上清液,利用ELISA试剂盒检测TNF-α、IL-1β水平。
1.6.4 软骨组织中A20表达水平 取软骨组织,将50 mg软骨组织放入研磨皿中裂解,将匀浆组织液12 000 g离心3 min,取上清液,95℃煮沸10 min变性,-20 ℃保存。采用BCA法检测蛋白浓度。取20 μL蛋白样品,加入5 μL的蛋白上样缓冲液(6×)混匀,加热5 min后冷却;按预定的顺序上样、恒压电泳,将目的蛋白转移至PVDF膜上,脱脂牛奶封闭1 h,加入稀释的一抗(兔抗鼠A20,稀释度为1∶2 000)4 ℃孵育过夜;加入二抗羊抗兔IgG(稀释度为1∶6 000)室温孵育1 h,以β-actin为内参;ECL显影、曝光。最后扫描曝光后底片,用Quantity One专业灰度分析软件进行分析。
1.7 统计学方法 采用SPSS 26.0统计软件进行分析,计量资料以“均数±标准差”()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组兔膝关节Lequesne MG评分比较 与正常组比较,模型组、刮法组、涂擦组及药刮组兔膝关节Lequesne MG评分均明显升高(P<0.05);与模型组比较,刮法组、涂擦组及药刮组兔膝关节Lequesne MG评分均明显降低(P<0.05);刮法组兔膝关节Lequesne MG评分与涂擦组比较,差异无统计学意义(P>0.05);药刮组兔膝关节Lequesne MG评分明显低于刮法组、涂擦组(P<0.05)。(见表3)
表3 各组实验兔膝关节Lequesne MG 评分比较(,分)
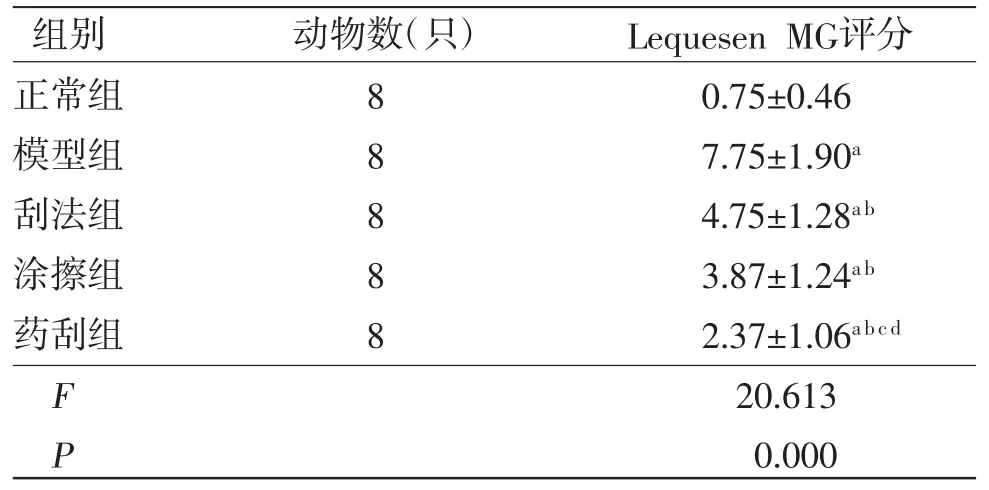
表3 各组实验兔膝关节Lequesne MG 评分比较(,分)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与刮法组比较,cP<0.05;与涂擦组比较,dP<0.05
2.2 各组兔膝关节软骨病理学改变情况 正常组兔膝关节软骨细胞分布均匀,呈红染;模型组兔膝关节软骨细胞分布不均匀,呈蓝染;刮法组兔膝关节软骨细胞分布欠均匀,呈红蓝相间染色;涂擦组兔膝关节软骨细胞分布欠均匀,呈淡红染;药刮组兔膝关节软骨细胞分布较均匀,呈红染。(见图1)
与正常组比较,模型组、刮法组、涂擦组及药刮组兔膝关节软骨Mankin评分均明显升高(P<0.05);与模型组比较,刮法组、涂擦组及药刮组兔膝关节软骨Mankin评分均明显降低(P<0.05);刮法组兔膝关节软骨Mankin评分与涂擦组比较,差异无统计学意义(P>0.05);药刮组兔膝关节软骨Mankin评分明显低于刮法组、涂擦组(P<0.05)。(见表4)
表4 各组兔膝关节软骨组织Mankin 评分比较(,分)
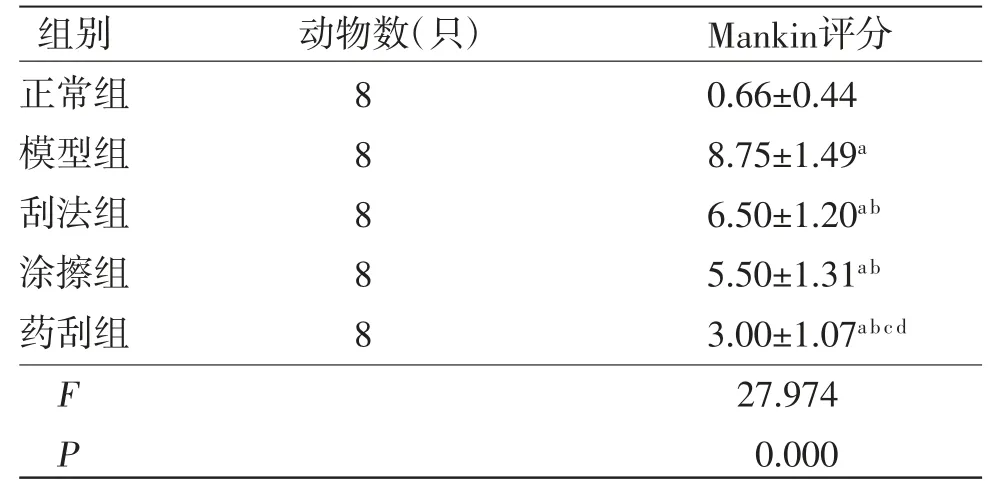
表4 各组兔膝关节软骨组织Mankin 评分比较(,分)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与刮法组比较,cP<0.05;与涂擦组比较,dP<0.05
2.3 各组兔膝关节软骨组织中TNF-α、IL-1β水平比较 与正常组比较,模型组、刮法组、涂擦组及药刮组兔膝关节软骨组织中TNF-α、IL-1β水平均明显升高(P<0.05);与模型组比较,刮法组、涂擦组及药刮组兔膝关节软骨组织中TNF-α、IL-1β水平均明显降低(P<0.05);刮法组兔膝关节软骨组织中TNF-α、IL-1β水平与涂擦组比较,差异无统计学意义(P>0.05);药刮组兔膝关节软骨组织中TNF-α、IL-1β水平明显低于刮法组、涂擦组(P<0.05)。(见表5)
表5 各组兔膝关节软骨组织中TNF-α、IL-1β水平比较(,ng/L)
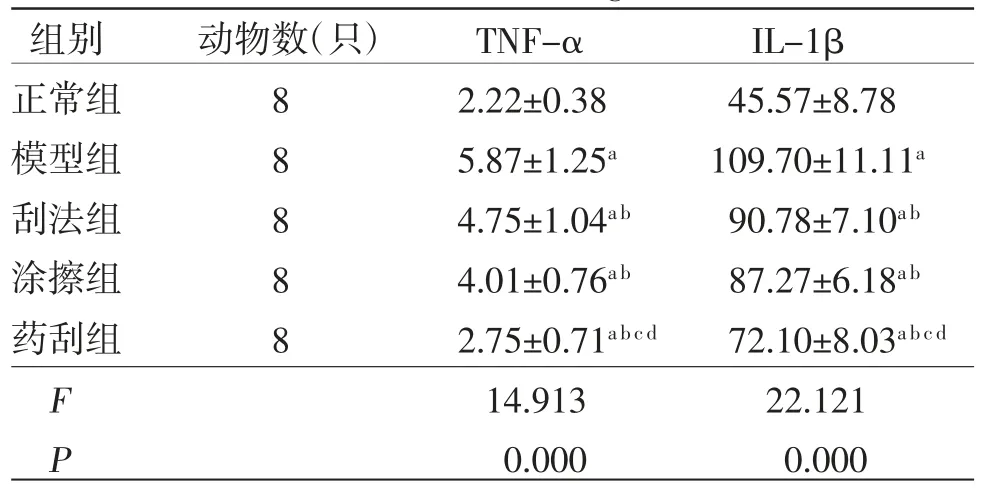
表5 各组兔膝关节软骨组织中TNF-α、IL-1β水平比较(,ng/L)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与刮法组比较,cP<0.05;与涂擦组比较,dP<0.05
2.4 各组兔膝关节软骨组织中A20蛋白表达水平比较 与正常组比较,模型组、刮法组、涂擦组及药刮组兔膝关节软骨组织中A20表达均明显下调(P<0.05);与模型组比较,刮法组、涂擦组及药刮组兔膝关节软骨组织中A20表达均明显上调(P<0.05);刮法组兔膝关节软骨组织中A20表达水平与涂擦组比较,差异无统计学意义(P>0.05);药刮组兔膝关节软骨组织中A20表达明显高于刮法组、涂擦组(P<0.05)。(见图2、表6)
表6 各组兔膝关节软骨组织中A20 蛋白表达水平比较()
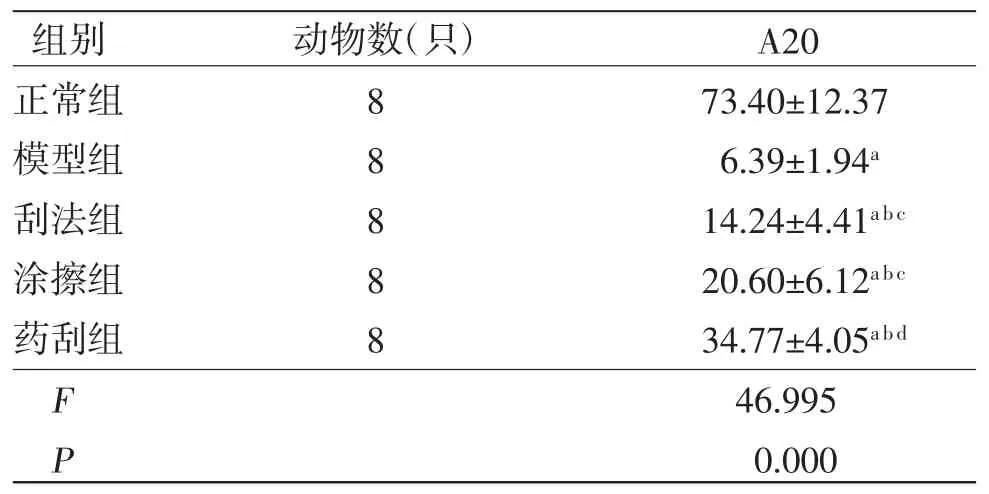
表6 各组兔膝关节软骨组织中A20 蛋白表达水平比较()
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与药刮组比较,cP<0.05
3 讨 论
KOA的发病机制复杂,一般认为与遗传、肥胖、劳动过度等因素密切相关,但其具体发病机制尚不明确,近年来炎症因子等介质的表达成为主流学说之一。研究发现IL-1β和TNF-α表达的增加在KOA患者疾病发生发展的过程中起着重要作用[8]。IL-1β作为IL-1的一种亚型,是炎症调节的起始因素。IL-1β通过与软骨细胞膜上的IL-1受体相结合,干扰软骨细胞的正常代谢活动;同时可刺激软骨细胞及滑膜合成基质金属蛋白酶,使软骨基质内溶解蛋白分子的酶类数量增多,从而间接增强了对软骨细胞的破坏。TNF-α可作用于软骨细胞,阻止基质大分子如蛋白多糖的生成,刺激软骨降解酶如中性蛋白酶的生成、分泌,增加软骨聚蛋白多糖的分解,从而诱发关节软骨破坏。且IL-1β与TNF-α可相互协同裂解蛋白多糖及降解胶原片段,促进软骨基质剥脱于骨质而暴露[9],从而加重关节炎症反应。核因子-κB(nuclear factorκB,NF-κB)是细胞内一条重要信号通路,对于维持细胞的正常生理功能具有重要意义。其广泛参与炎症反应的调节,是导致KOA发生发展的关键环节[10-11]。而锌指蛋白A20可降低NF-κB抑制蛋白激酶复合物活性、抑制NF-κB抑制蛋白磷酸化过程,干预NF-κB激活合成释放,影响下游炎症通路[12-13],从而影响KOA的疾病进程。
KOA现代中医命名为膝痹,《素问·痹论篇》有相关原文记载。现代研究亦认为骨关节痹证多为风寒湿邪乘虚袭入骨节所致[14]。寒性凝滞,湿性重着,故易引起局部气血运行不畅,邪气聚于骨节、肌肉、经脉,以致痰瘀,瘀则不通,不通则痛。中医治法则以祛风除湿、散寒止痛、活血通络等为主。
铁包金按摩膏[15]是匡建军临床近三十年的经验膏方,君药为铁包金,《中华本草》谓其根、茎、叶入药有祛风除湿、活血止痛的功效。铁包金主要含有黄酮、苷类、木脂素、醌类及二聚体等化学成分。药理研究表明其根与藤茎的提取物具有较好的保肝和清除自由基的生物活性[16]。川乌、草乌为臣药,具有祛风散寒除湿的功效。乌头中的乌头碱具有显著抗炎、镇痛作用[17-18]。肉桂亦为臣药,能够温中补肾、散寒止痛,《本草纲目》谓其能坚筋骨、通血脉、导百药。肉桂挥发油主要成分桂皮醛有明显的扩张皮肤血管作用,可增加体表血流,升高体表温度[19]。木瓜为佐药,能舒筋活络、祛风除痹,是治疗筋脉拘急的要药。木瓜中的多糖能够抗炎、抗氧化[20]。木鳖子亦为佐药,能消肿散结。木鳖子皂苷有抗炎作用[21]。诸药共奏祛风除湿、活血通络止痛之功效。刮法是中医特色疗法之一,通过刮法的物理作用,温通局部腠理、脉络[22],再加以膏药,增强药物吸收的同时,加强疗效。
本研究结果显示铁包金按摩膏联合刮法可以改善KOA模型兔膝骨关节炎的症状,降低Lequesne MG、Mankin评分及软骨组织TNF-α、IL-1β的水平,提高实验兔膝关节软骨组织中A20的表达,为铁包金按摩膏联合刮法治疗KOA提供了实验。其作用机制可能与抑制TNF-α、IL-1β表达和促进A20蛋白表达有关。但铁包金按摩膏成分复杂,其有效成分及具体作用机制需进一步探索研究。
