复合有机酸对大肠杆菌攻毒小鼠免疫功能及肠道菌群的影响
2022-11-04夏莹莹高增兵胡友军赵晓南游金明邹田德
夏莹莹,董 潮,高增兵,胡友军,赵晓南,游金明*,邹田德*
(1.江西农业大学 江西省动物营养重点实验室/江西省优质安全畜禽生产产教融合重点创新中心,江西 南昌 330045;2.广东酸动力生物科技有限公司,广东 清远 511545)
【研究意义】产肠毒素性大肠杆菌(EnterotoxigenicEscherichia coli,ETEC)是引起人和动物腹泻的主要病原菌之一[1]。ETEC 通常附着在小肠微绒毛上,产生肠毒素引起肠粘膜炎症,并诱导上皮细胞凋亡,破坏其紧密连接完整性,进而导致肠屏障功能损伤,破坏肠稳态,临床上造成剧烈腹泻,具有很高的发病率和死亡率[2]。有研究表明,ETEC 感染导致腹泻的主要机制可能是通过降低肠道细胞抗氧化酶活性,介导脂质过氧化反应,从而破坏动物肠道粘膜完整性和功能[3],导致机体免疫力下降和肠道菌群紊乱。抗生素在动物生产中被广泛用作生长促进剂和治疗药物,现今抗生素滥用导致耐药菌的出现,引起了人们对于在动物饲粮中正确使用抗菌物质的广泛关注[4]。因此,寻找抗生素替代品迫在眉睫。【前人研究进展】许多学者研究发现,有机酸(organic acid,OA)在改善动物生长性能和促进肠道微生物稳态方面显示出良好的效果[5-7]。有机酸是一类酸性有机化合物,常以游离态、盐、酯的形式存在于食品中,是常见的饲料添加剂之一。有机酸是核酸不可缺少的组成部分,对动物体内多种生物酶具有激活作用,参与机体的三羧酸循环,并具有促生长、抗菌等类似抗生素的作用[8]。前人研究发现,有机酸具有诸多益生特性,在仔猪饲料中添加甲酸,通过降低消化道pH 值,能够抑制大肠杆菌、球肠菌等肠道原菌的增生、繁殖,同时可以穿入到细菌内部,使病原菌代谢功能紊乱,可在一定程度上减少肠道病原菌数量,保持仔猪肠道微生态健康,从而起到防止和减少断奶仔猪发生腹泻的作用[9-10]。研究表明,苯甲酸可以改善动物生长性能和营养物质的消化率,抑制病原菌的增殖,维持肠道微生态平衡[11-12]。Kinza 等[13]在对肉鸡的研究中发现,饲粮中添加甲酸盐和丙酸盐混合物可以提高适口性,降低胃内pH值,具有显著的抗菌效果,改善肠道微生物组成,提高肠道的免疫功能,同时能刺激肠上皮细胞的分化和增殖,提高营养物质的消化率。Wang 等[14]研究发现,添加三丁酸甘油酯可显著增加断奶仔猪肠道的绒毛高度和绒毛高度/隐窝深度(V/C)值,增强线粒体功能,缓解仔猪的氧化应激,促进肠道发育。另外,在阳巧梅等[15]用酸化剂替代抗生素的试验中发现,断奶仔猪饲粮中添加甲酸、乙酸等有机酸可以显著提高仔猪生产性能,改善绒毛形态,降低粪便大肠杆菌数目并提高血清免疫因子含量。有机酸的使用形式多种多样,有的是单独使用,有的是混合使用,或者与不同的衍生物共同使用。甲酸、苯甲酸等均是潜在的促生长剂,但要达到更加稳定效果和经济效益,需要协同配伍使用。近年来,对复合酸化剂在畜牧生产中的作用,越来越引起国内外有关学者的重视。【本研究切入点】许多研究已经表明甲酸、乙酸等有机酸在动物生产中的有利作用,但有关甲酸、苯甲酸及三丁酸甘油酯在饲料中联合使用的报道较少。小鼠是一类对ETEC 菌株较为敏感的动物,与猪等动物的致病机理相似,许多研究以小鼠为ETEC 攻毒模型来探讨新型饲料添加剂的作用机理。因此,在大肠杆菌攻毒条件下,饲料中添加复合有机酸对小鼠生长、肠道免疫以及肠道微生物组成的影响值得深究。【拟解决的关键问题】试验以复合有机酸(甲酸、苯甲酸、三丁酸甘油酯)为添加剂来源,以昆明小鼠为试验动物,体内探讨复合有机酸水平及其在ETEC 攻毒条件下对小鼠生长性能、肠道屏障功能和微生物区系的影响,为复合有机酸制剂作为无抗饲料添加剂的研发和科学应用提供理论依据。
1 材料与方法
1.1 试验材料与基础日粮
试验所用复合酸化剂为广东酸动力生物科技有限公司提供(包被甲酸20%,包被苯甲酸20%,三丁酸甘油酯3%,其余成分为载体二氧化硅)。ETEC 菌株购自中国兽医微生物菌种保藏管理中心(CVCC),血清型为O149:K91:K88ac。7 周龄昆明(KM mouse)雌鼠购于江西中医药大学。小鼠基础饲粮购于江苏美迪森生物医药有限公司,并在基础饲粮中添加不同剂量有机酸定制有机酸饲粮。基础饲粮组成及营养成分见表1。

表1 饲粮组成及营养水平(风干基础)Tab.1 Composition and nutrient levels of diet(air-dry basis)%
1.2 试验设计
1.3 测定指标及方法
1.3.1 生长性能和器官指数在试验的第1、7、14、21 天对各组小鼠的体质量进行称量,计算体增重,并统计采食量,称量前对小鼠断粮、断水6 h 以上。饲养21 d 后所有小鼠眼球采血。解剖并观察小鼠内脏有无病变。取出心脏、肝脏、脾脏、胸腺、肾脏、大肠、小肠、胃,剔除筋膜及脂肪组织后称量,计算各器官指数。
1.3.2 血清生化指标将采集后的血液37 ℃静置2 h后,4 ℃、3 500 r/min离心15 min(离心半径13.5 cm)后,吸取上清,即为小鼠血清,置于4 ℃保存备用。采用酶联免疫试剂盒测定血清白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、二胺氧化酶(DAO)、D-乳酸(D-LA)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)含量,试剂盒购自上海酶联生物科技有限公司。
1.3.3 空肠组织学检测每只小鼠分别取2 cm长的空肠样品去除内容物,蒸馏水清洗后固定在4%的多聚甲醛溶液,经过脱水、软蜡硬蜡浸泡、石蜡包埋、切片(5 μm)、摊片、拷片、烘片、脱蜡、苏木精-伊红染色等步骤制作好的切片置于光学显微镜下观察空肠组织形态。

表2 引物序列Tab.2 Primer sequences
1.3.4 肠道炎症反应和屏障功能相关基因表达采集空肠粘膜样品,采用RNAios Plus 提取RNA,使用RT Master Mix 试剂盒(AE311,北京全式金生物)反转录合成cDNA。参考SYBR Green Master Mix 试剂盒(AQ141,北京全式金生物)使用说明书,在荧光定量PCR 仪(CFX Connect TM Optics Module,BIO-RAD,美国)进行实时荧光定量PCR检测。试验选取20 μL的反应体系,每次反应一式三份。反应程序参考Livak[16],以18SrRNA为参比基因,使用2-ΔΔCt计算各组基因的mRNA相对表达量。
1.3.5 肠道菌群多样性测定使用十六烷基三甲基溴化铵(CTAB)法从储存在-80 ℃超低温冰箱的每只小鼠结肠内容物中提取总基因组DNA,并在10 g/L 琼脂糖凝胶上检测其纯度。将细菌16S rDNA(V4 高变区)在PCR 系统中扩增(98 ℃1 min,然后在98 ℃10 s,50 ℃30 s 进行30 个循环,最后在72 ℃延伸5 min),使用特异性引物(515F 5′-GTGCCAGCMGCCGCGGTAA-3′和806R 5′-GGACTACHVGGGTWTCTAAT-3′)。用Qiagen Gel Extraction Kit(Qiagen,德国)纯化混合物PCR 产物。测序文库使用Qubit@2.0荧光计(Thermo Scientific)和Agilent Bioanalyzer 2100 系统对纯化的PCR 产物进行定量,由NovoGene(中国,北京)在Illumina NovaSeq平台上进行检查测序和生物信息学分析。
1.3.6 测序数据处理与生物信息学分析使用UPARSE 软件,将高质量且有效的序列(clean data)进行操作分类单位(operational taxonomic unit,OTU)聚类(基于相似性>97%),对照Silva数据库进行注释。使用QIIME(版本1.7.0)计算alpha 多样性(Shannon 指数,Simpson 指数,ACE 指数,Chao 1 指数和observed species 指数)。线性判别分析效果大小(LEfSe)用于检测各组之间微生物分类群相对丰度的显著差异,然后使用线性判别分析(LDA)来测量每个丰富分类群的效果大小。使用Spearman相关性分析确定肠道菌群与血清代谢参数之间的相关性。Spearman 相关性分析是以Spearman 相关系数作为量度,利用两变量的秩次大小作线性相关分析,对原始变量的分布不作要求,属于非参数统计方法。
1.3.7 结肠挥发性脂肪酸含量将样品解冻,参考耿梅梅等[17]方法,准确称取1 g结肠内容物于EP管中。加入2 mL 超纯水,漩涡振荡使内容物混合均匀。以离心半径13.5 cm 15 000 r/min,离心15 min,转移上清,按体积比9∶1比例添加25%偏磷酸(上清液/偏磷酸),气相色谱仪测定样品中挥发性脂肪酸含量。
1.4 数据统计及分析
所有数据用Excel 2019简单处理后,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),并用Duncan’s进行多重比较。各组数据以“平均值±标准误”表示。以P<0.05为差异显著性判断标准。
苏:羌族沙朗舞主要是脚下动作,其实并没有想象中的那么复杂。除了领头的舞者可以出现单独的摆手、张手及甩手的动作以外,其余的舞者始终手牵手,也就是牵手、并肩、连臂。在场的所有舞者都是手牵着手站立成一排,或者围成一个圆圈。先由男子领唱开始唱歌,当首句唱响后,所有参加舞蹈的人开始踩踏节奏。男子歌唱结束后,女子便紧接着开始唱。每当一首歌唱完后,庞大的舞蹈队便转一个大圆圈。
2 结果与分析
2.1 复合有机酸对大肠杆菌攻毒小鼠体质量和器官指数的影响
如图1所示,攻毒前和攻毒后,各组间小鼠体质量均无显著差异(P>0.05)。由表3可知,不同剂量有机酸对ETEC攻毒小鼠器官指数无显著影响(P>0.05)。

表3 有机酸对ETEC攻毒小鼠器官指数的影响Tab.3 Effect of organic acids on organ index of mice challenged by ETEC

图1 有机酸对ETEC攻毒小鼠体质量的影响Fig.1 Effect of organic acids on body weight of mice challenged by ETEC
2.2 复合有机酸对大肠杆菌攻毒小鼠血清生化指标的影响
由表4 可知,与CON 组相比,ETEC 组和ETEC+6.0% OA 组小鼠血清IL-6、TNF-α、D-lactate 含量和DAO 活性显著升高(P<0.05)。与ETEC 组相比,饲粮添加1.5%OA 显著降低了小鼠血清中IL-6 和TNFα 含量(P<0.05),有助于缓解小鼠因ETEC 感染导致的机体炎症反应,而ETEC+3.0% OA 组和ETEC+6.0% OA 组血清IL-6、TNF-α、D-lactate 含量及DAO 活性无显著差异(P>0.05)。各处理组之间的血清IL-1β、IgA、IgG和IgM含量无显著差异(P>0.05)。
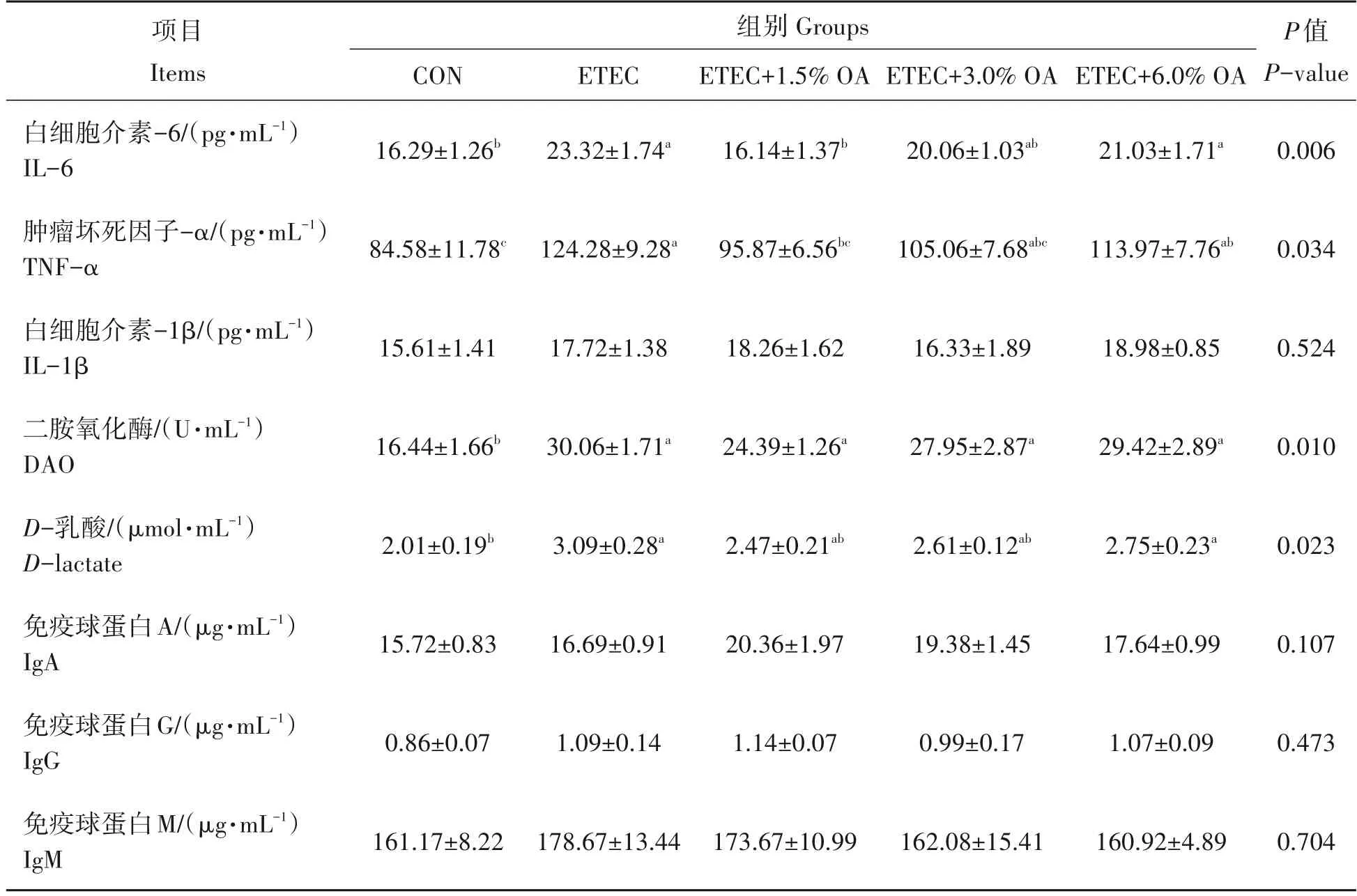
表4 有机酸对ETEC攻毒小鼠血清生化指标的影响Tab.4 Effects of organic acids on serum biochemical indexes of mice challenged by ETEC
2.3 复合有机酸对大肠杆菌攻毒小鼠空肠组织学结构的影响
如图2 所示,与CON 组相比,ETEC 组小鼠空肠上皮细胞绒毛排列长短不一,排列不够紧密,且有较多断裂的绒毛。与ETEC 组相比,饲喂有机酸小鼠肠上皮绒毛排列整齐,长短一致且更加致密。如表5所示,与CON 组相比,ETEC 组小鼠空肠绒毛高度和V/C 比值显著降低(P<0.05),而饲粮添加1.5%和3.0%OA 可缓解ETEC 诱导的肠道形态结构损伤。6.0%OA 组和ETEC 组之间空肠绒毛高度和隐窝深度无显著差异(P>0.05)。
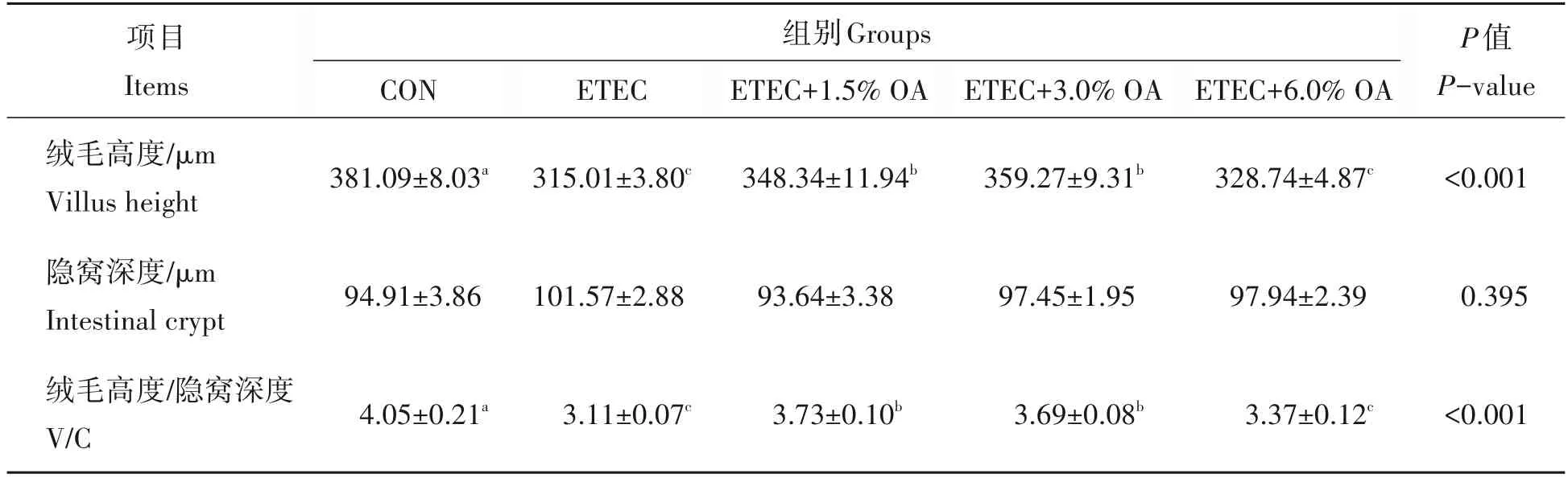
表5 有机酸对ETEC攻毒小鼠绒毛高度和隐窝深度及其比值的影响Tab.5 Effects of organic acids on villus height and crypt depth and their ratio in mice challenged by ETEC

图2 有机酸对ETEC攻毒小鼠空肠组织形态的影响Fig.2 Effects of organic acids on the morphology of jejunum in mice challenged by ETEC
2.4 复合有机酸对大肠杆菌攻毒小鼠肠道炎症反应和屏障功能相关基因表达的影响
由图3 可知,与CON 组相比,ETEC 组小鼠空肠IL-6、TNF-α、Toll 样受体-4(TLR-4)、髓样分化因子(MyD88)和巨噬细胞趋化蛋白-1(MCP-1)mRNA 表达量显著升高(P<0.05),ETEC+6.0% OA 组小鼠空肠IL-6、TLR-4和MyD88mRNA 表达量显著升高(P<0.05)。与ETEC 组相比,ETEC+3.0% OA 组和ETEC+6.0% OA 组小鼠空肠IL-6和MCP-1基因表达量无显著差异(P>0.05),而饲粮中添加1.5% OA可以显著抑制小鼠因ETEC 攻毒引起的空肠黏膜炎性相关基因(IL-6、TNF-α、MyD88和MCP-1)的过表达(P<0.05)。各处理组之间的空肠IL-1β和Toll 样受体-2(TLR-2)基因mRNA 表达量无显著差异(P>0.05)。由图4 可知,与CON 组相比,ETEC 组小鼠空肠组织中ZO-1和OccludinmRNA 表达量显著下降(P<0.05),ETEC+6.0% OA 组小鼠空肠组织中ZO-1mRNA 表达量显著下降(P>0.05),而饲粮中添加1.5% OA 可显著缓解小鼠因ETEC 攻毒引起的空肠粘膜屏障功能相关基因(ZO-1和Occludin)的表达量下降(P<0.05)。
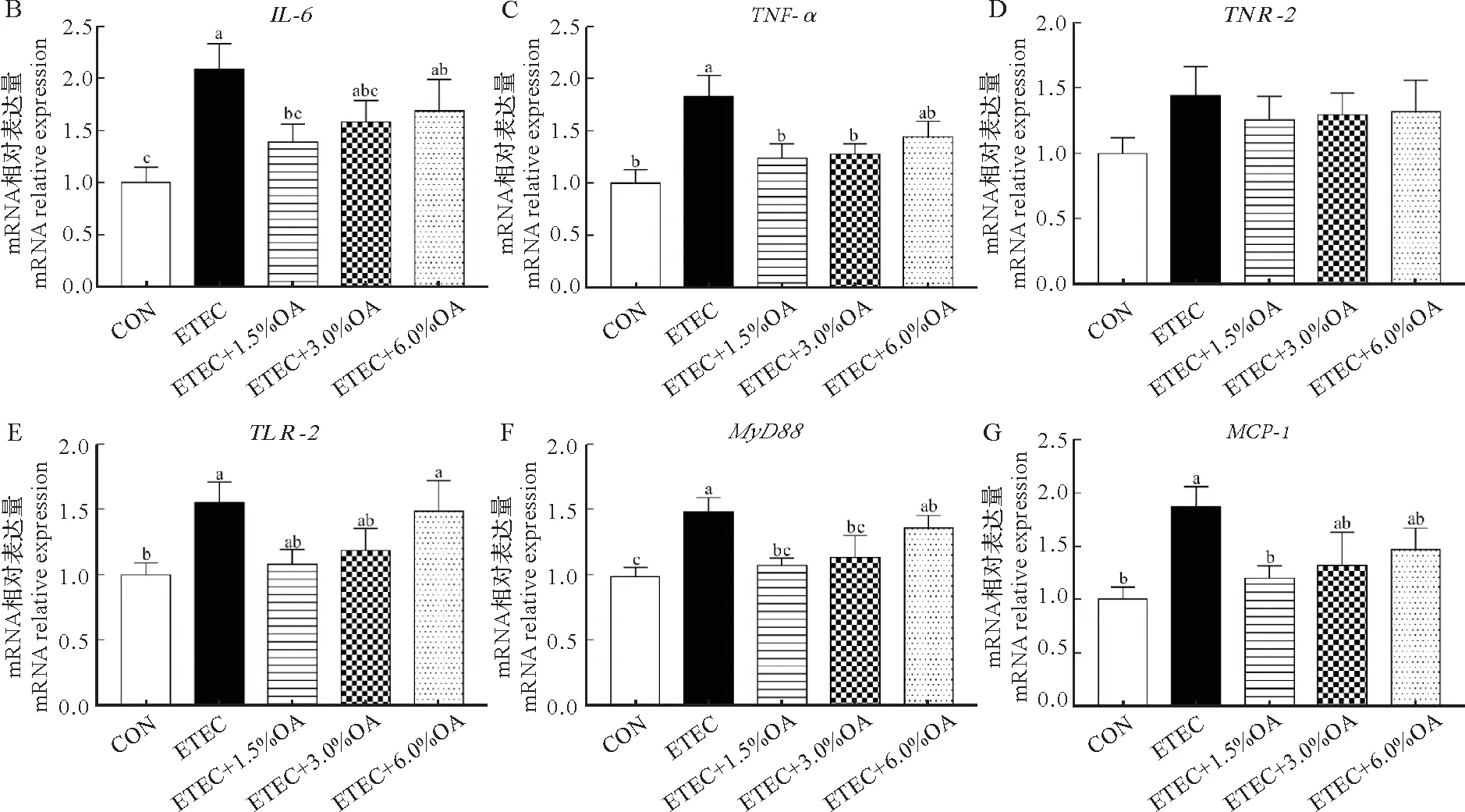
图3 有机酸对ETEC攻毒小鼠肠道炎症相关基因相对mRNA表达量的影响Fig.3 Effects of OA on the relative mRNA expression levels of intestinal inflammation-related genes in ETEC challenged mice


图4 有机酸对ETEC攻毒小鼠肠道屏障相关基因相对mRNA表达量的影响Fig.4 Effects of organic acids on relative mRNA expression levels of intestinal barrier related genes in mice challenged by ETEC
2.5 有机酸对大肠杆菌攻毒小鼠肠道菌群结构的影响
由图5 可以看出小鼠结肠微生物中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和脱硫杆菌门(Desulfobacterota)为优势菌门,乳酸杆菌属(Lactobacillus)、粪杆菌属(Faecalibaculum)和脱硫弧菌属(Desulfovibrio)为优势菌属。其中1.5% OA 添加组中Bacteroidota 丰度较ETEC 组显著降低(P<0.05),且较接近于CON 组。由表6 可知,与CON 组相比,ETEC 组和ETEC+1.5% OA 组小鼠结肠微生物ACE 指数和Chao1 指数显著降低(P<0.05)。而添加1.5% OA 和6.0% OA 能够显著提高小鼠结肠微生物Chao1指数(P<0.05),有助于缓解因ETEC 攻毒导致的结肠微生物丰富度降低。为了获得有机酸调节ETEC攻毒小鼠肠道菌群微生态的主要差异菌群,通过应用LEfSe分析(LDA>3.5)对数据进行了β差异性分析。由图6可知,与CON组相比,ETEC组中拟杆菌门(Bacteroidota)、拟杆菌科(Bacteroidaceae)和拟杆菌属(Bacteroides)等菌群占优势;ETEC+1.5% OA 组中乳酸杆菌目(Lactobacillales)、乳酸杆菌科(Lactobacillaceae)和乳酸杆菌属(Lactobacillus)为主要优势菌群;ETEC+3% OA 组中Muribaculaceae 菌门占优势;ETEC+6% OA 组中Faecalibaculum占主要优势。结果表明,小鼠肠道微生物群落组成由于ETEC 介导而产生改变,而饲粮添加1.5%OA 后使得结肠微生物群落的变化更接近于CON 组。
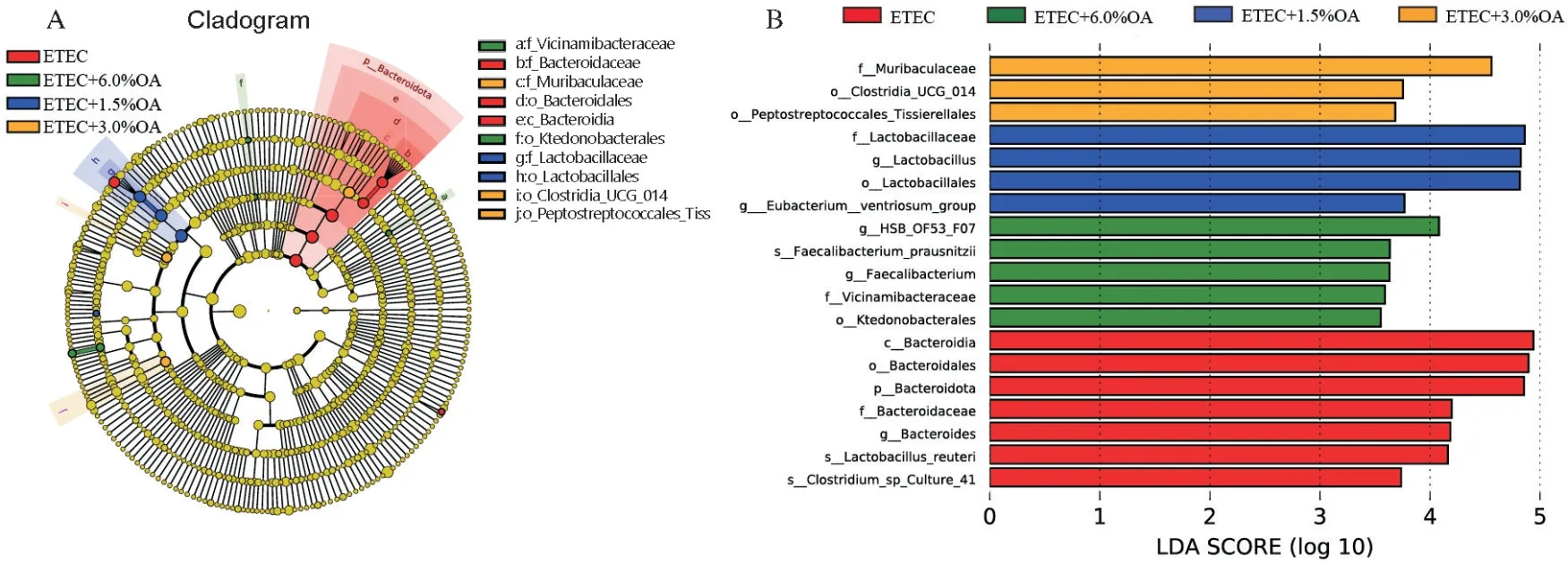
图6 小鼠结肠内容物肠道菌群LEfSe分析Fig.6 LEfSe analysis of intestinal flora of mouse colon contents
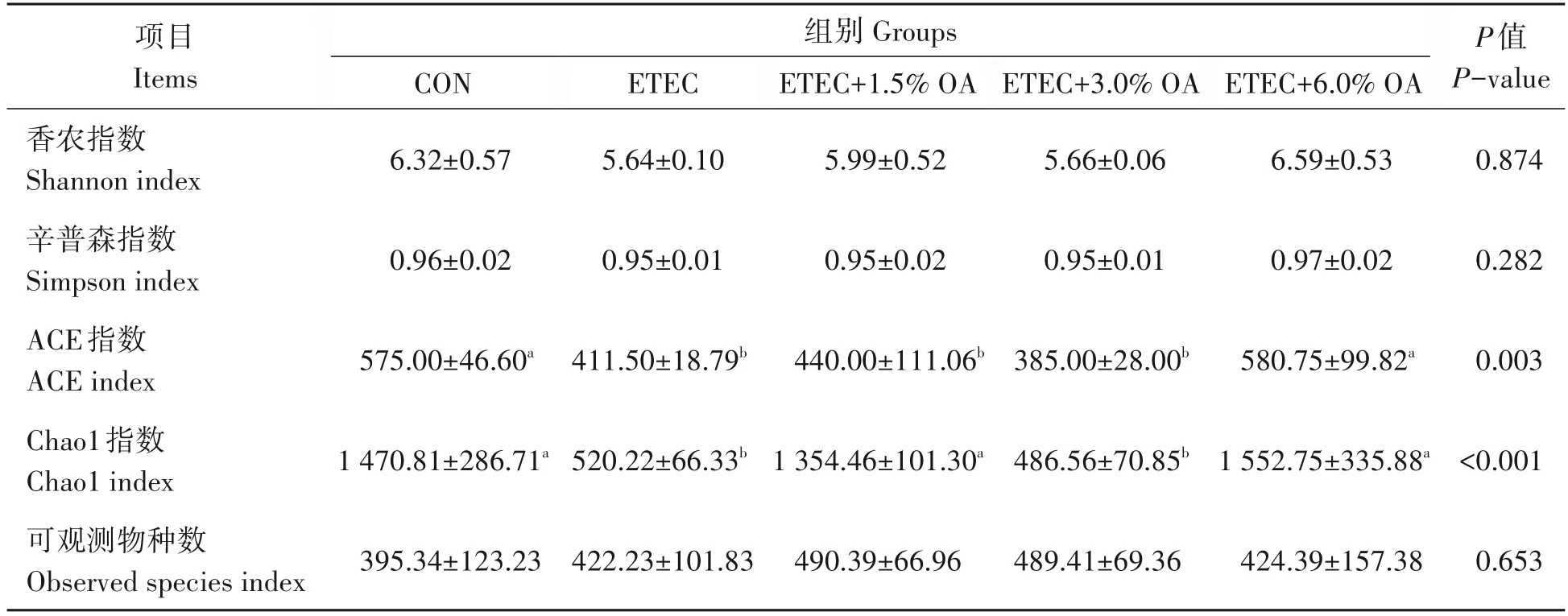
表6 有机酸对ETEC攻毒小鼠肠道菌群α多样性的影响Tab.6 Effects of organic acids on the diversity of intestinal microflora α in mice challenged by ETEC

图5 有机酸对ETEC攻毒小鼠肠道菌群相对丰度的影响Fig.5 Influence of organic acids on relative abundance of intestinal microflora of mice challenged by ETEC
2.6 肠道菌群与血清生化指标Spearman相关性分析
进一步对ETEC 攻毒小鼠肠道菌群和血清生化指标的相关性进行了Spearman 分析,来探究肠道菌群与机体炎症之间的内在联系。从图7 可以看出,在属水平上多数肠道菌与血清生化指标呈正相关,比如,Bacteroides、Akkermansia相对丰度与血清IL-6 含量呈正相关(P>0.05),Faecalibaculum相对丰度与血清IL-1β 含量呈正相关(P>0.05)。而仅有少数呈负相关,比如其中Desulfovibrio相对丰度与血清Dlactate 和IgA 含量呈显著负相关(P<0.05);Blautia和Candidatus_Saccharimonas相对丰度与血清IL-1β含量呈显著负相关(P<0.05);Helicobacter相对丰度与血清D-lactate 含量呈显著负相关(P<0.05)。结果证明Bacteroides、Akkermansia、Faecalibaculum等菌相对丰度的降低与血清炎性因子的降低存在正相关性,推测OA 可能通过调控肠道菌群的分布,间接调控机体的炎性因子水平,改善机体免疫能力。
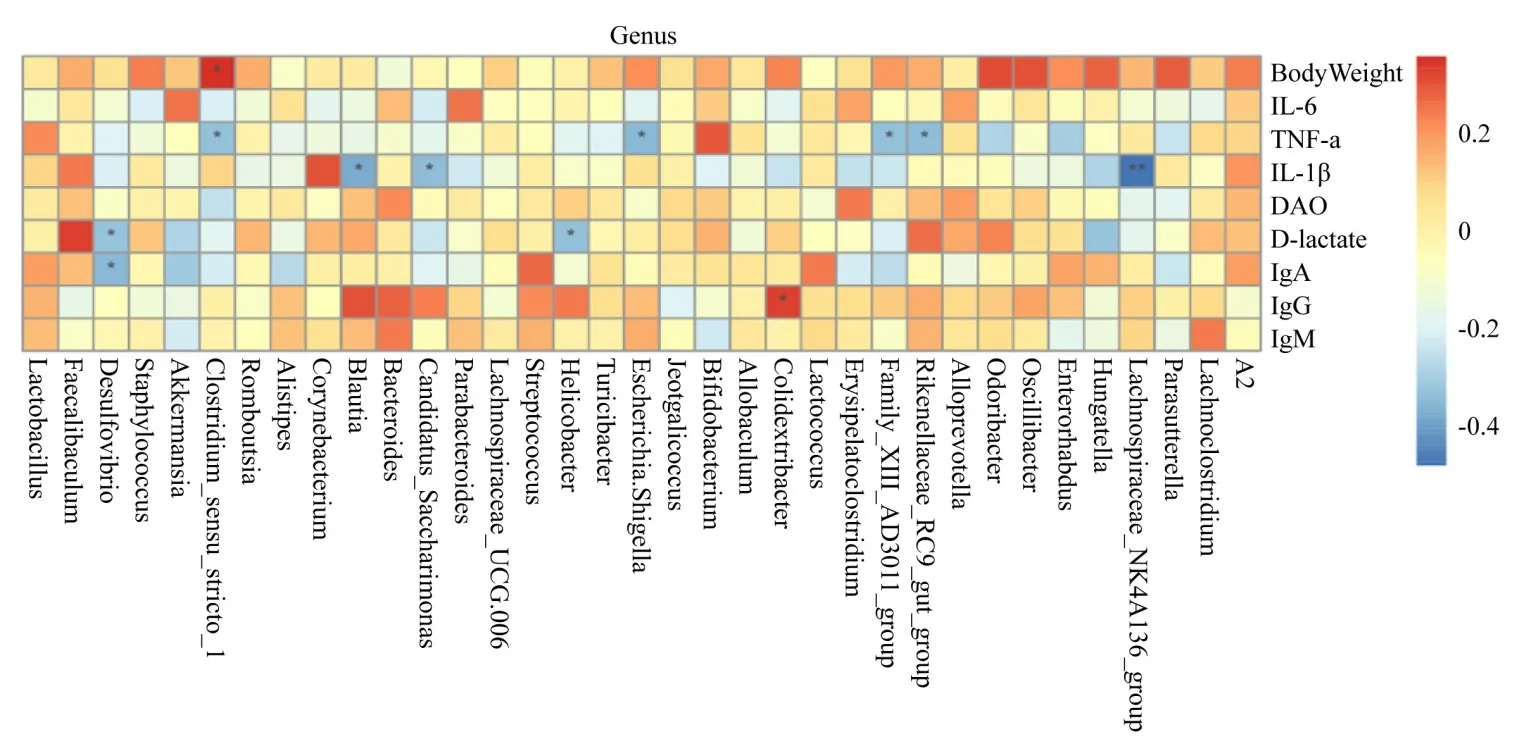
图7 小鼠肠道菌群与血清生化指标相关性分析Fig.7 Correlation analysis of intestinal flora and serum indexes in mice
2.7 有机酸对大肠杆菌攻毒小鼠结肠食糜挥发性脂肪酸含量的影响
由图8可知,与CON组相比,ETEC组和ETEC+6.0%OA组小鼠结肠食糜的乙酸含量显著下降(P<0.05),ETEC+1.5% OA 组小鼠结肠食糜的丙酸含量显著上升(P<0.05)。而在饲粮中添加1.5%和3.0%OA 有助于缓解因ETEC攻毒导致的小鼠结肠食糜中乙酸含量的下降(P<0.05)。
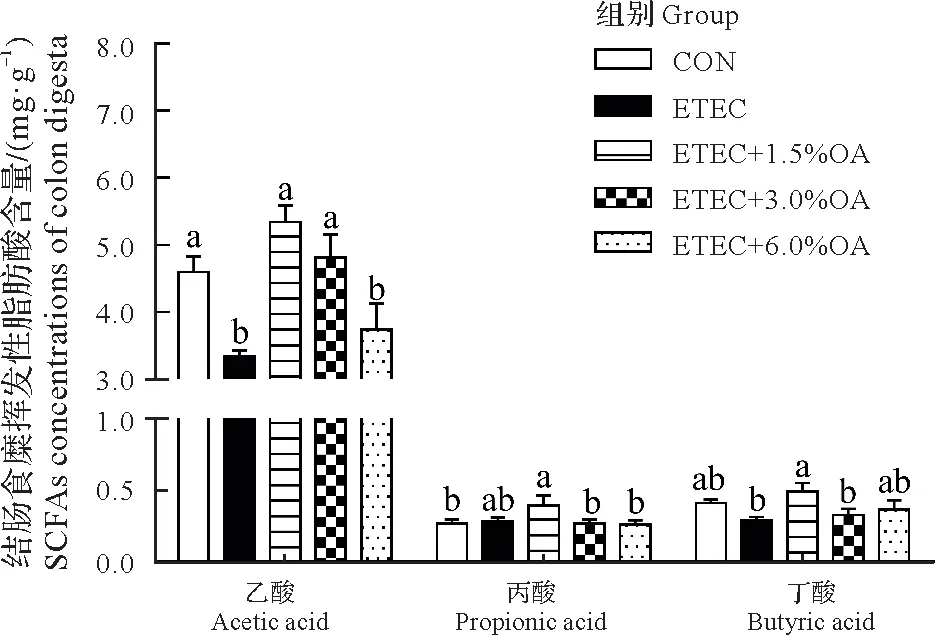
图8 大肠杆菌攻毒对小鼠结肠食糜挥发性脂肪酸含量的影响Fig.8 Effect of Escherichia coli challenge on volatile fatty acids in colonic contents of mice
3 结论与讨论
产肠毒素大肠杆菌病是导致动物腹泻的主要原因之一,是影响畜禽正常生长、繁殖的关键病因。ETEC 是导致动物腹泻的主要病原体,其致病机理是通过菌毛黏附在动物肠道上皮细胞膜表面,大量繁殖并释放毒力因子,进而刺激肠道上皮细胞分泌大量液体到肠腔中发生腹泻[18]。动物腹泻会导致机体生长发育受阻,存活率降低等不良现象。而有机酸具有多种生物学特性,包括改善畜禽生长性能,减轻炎症反应,抑制病原菌的增殖并有助于调节肠道微生态平衡。此外,有机酸能通过降低肠道pH 值,保护肠道免受病原菌入侵和增殖,具有抗菌、促生长的功效。研究表明,在肉鸡饲粮中添加2 g/kg 苯甲酸可以改善肉鸡的生产性能,提高代谢活性[19]。Øverland 等[20]研究发现,在日粮中添加1.0%甲酸提高了断奶仔猪生长性能和饲料效率,对心脏、脾脏、肝脏等器官无明显影响。另外,Upadhaya等[21]研究发现,0.4%的OA混合物(富马酸、乳酸、丙酸、柠檬酸和苯甲酸)可以提高育苗猪的生长速度、采食量和饲料转化率。试验研究发现,小鼠饲粮添加OA 对于减轻感染ETEC 后造成的体质量下降无显著影响。有机酸中毒的主要病理变化表现为眼球突出,肾脏、肝脏、心脏肿大充血,脾脏萎缩。本试验中,虽然饲喂不同剂量OA对心脏、脾脏、肝脏及肾脏重在数值上有一定的提高,但均无显著影响且未观察到明显病理变化,表明OA添加并未对机体器官产生毒性作用。
相关研究表明,当机体感染ETEC 后,会触发多种炎性细胞因子网络,包括IL、Ig、TNF-α 等[22]。促炎细胞因子和抗炎细胞因子的失衡是导致肠粘膜损伤的重要原因之一。在试验中,经ETEC 感染后,小鼠血清中的IL-6、TNF-α、IL-1β、IgA、IgG以及IgM 水平均高于对照组。在不同的OA添加剂量中,1.5%OA可以显著降低因ETEC感染导致的血清IL-6和TNF-α的含量,有助于缓解小鼠的机体炎症反应,结果与文献[23-24]报道一致。相关研究表明,在机体发生炎症时,TLRs起着重要的作用,TLRs识别外源性配体或内源性分子后,将识别信号传递给中间蛋白MyD88,MyD88 再将该信号传递给核因子-κB(NF-κB)并引起NF-κB活化,进而诱导炎症因子的表达,参与炎症反应[25]。试验研究发现,经ETEC攻毒后小鼠空肠组织TLR4和MyD88mRNA 表达相较于对照组显著增强,此时机体可能通过上调TLR4 的表达来激活下游信号分子,进而激发免疫应答。而1.5%和3.0%OA组小鼠空肠组织MyD88表达量显著降低。因此,可以推测,饲粮添加OA 可以通过抑制TLRs/MyD88 通路,减少TNF-α、IL-6、IL-1β 等炎性细胞因子的产生水平,对机体免疫异常起到调节作用,从而保护小鼠免受高内毒素血症的袭击,减轻肠道免疫反应的损伤和炎症反应。
机体促炎因子增多会导致肠黏膜损伤,从而影响肠道屏障功能。肠道屏障是机体重要的黏膜屏障,在肠道免疫和稳态中起着重要作用[26]。完整的肠道屏障结构可以保证其功能的完整性,其中V/C值是最能体现肠道屏障结构完整性的指标。经试验研究发现,ETEC 攻毒后小鼠空肠绒毛高度和V/C 值显著降低,而添加1.5%和3.0%有机酸能够显著提高空肠绒毛高度和V/C 值。这与Wang 等[14]的研究结果相同,表明OA 能够较好改善ETEC 攻毒引起的肠道结构损伤。肠上皮细胞由几种独特的蛋白质连接在一起,包括跨膜蛋白、连接黏附分子、Claudin 家族、连接蛋白等[27]。其中Occludin、ZO-1和Claudin-1在肠上皮细胞紧密连接结构中发挥着至关重要的作用[28]。当机体感染ETEC 时,会破坏肠道屏障功能,肠上皮屏障一旦受损,肠道微生物群分泌促炎细胞因子进入血液中,导致机体产生更多炎性因子,从而处于更大的炎症风险中。大量研究表明,ETEC 感染可诱导宿主肠粘膜损伤,血清中DAO 和D-LA 含量升高[29],进而产生大量炎症因子,导致Occludin、ZO-1和Claudin-1表达量减少[30],加重肠上皮屏障功能障碍。为了更好地阐明OA 对于抵抗ETEC 侵染肠道构筑的分子保护机制,通过试验测定了空肠粘膜中Occludin、ZO-1 和Claudin-1mRNA 表达量的变化。结果显示,饲粮中添加1.5%OA 可显著缓解小鼠因ETEC 攻毒引起的空肠粘膜屏障功能相关基因(ZO-1和Occludin)的表达量下降。表明OA 可激活空肠粘膜中Occludin、ZO-1和Claudin-1mRNA 的表达,从而提高小鼠肠道上皮细胞的屏障完整性,增强肠上皮屏障功能,缓解因ETEC感染导致的肠道损伤。
肠道菌群是动物肠道中重要的生物屏障,其中菌群失调与炎症性肠道疾病有着密不可分的关系,当肠道平衡被打破时,条件性致病菌会大量繁殖,从而影响肠道健康。有研究表明受到致病性大肠杆菌攻毒的大鼠肠道中普氏杆菌、肠球菌和Akkermansia 的比例显著降低,而致病性大肠杆菌/志贺氏菌的比例显著增加,从而降低了肠道菌群丰富度,改变了粪便中细菌群落在门、属水平上的分布[31]。在不同的分类水平上,肠道微生物区系的微生物多样性较低,预示着生态失调。研究结果表明,对照组和添加有机酸组肠道菌群α 多样性均显著高于ETEC 组,有机酸能够有效恢复肠道菌群α 多样性,起到调控肠道微生态平衡的作用。Gauthier等[32]发现,在肉鸡饲粮中添加有机酸,可调节肠道微生物菌群,并减少肠道内容物中致病微生物的数量。另外有研究发现,在肠出血性大肠杆菌(EHEC)攻毒小鼠饲粮中添加有机酸,可有效增加小鼠肠道中Lactobacillus 和双歧杆菌属的数量,同时降低了大肠杆菌数量[33]。试验发现,饲粮中添加复合有机酸(甲酸、乙酸、丙酸)可以减少肠道微生物区系中大肠杆菌和厌氧菌总数,增加乳酸菌的数量,从而降低仔猪腹泻率,这与Long等[34]的研究结果一致。Amka等[35]研究发现当机体存在炎症反应时,炎性因子指标异常升高,将这些指标与肠道菌群进行相关性分析,发现Desulfovibrio、Faecalibaculum等菌群与炎性因子水平呈正相关。同样,研究结果显示Bacteroides、Akkermansia、Faecalibaculum等菌的相对丰度的降低与IL-6 等血清炎性因子的降低呈正相关,属水平上的相对丰度显示1.5%OA 有降低Akkermansia和Faecalibaculum的趋势。因此,可以推测饲粮添加1.5%OA 可能通过介导肠道微生物菌群,降低Akkermansia和Faecalibaculum的相对丰度从而减少IL-6等炎性因子水平,实现优化肠道菌群结构,提高机体免疫能力。
肠道微生物能够利用肠腔中未完全消化的膳食纤维发酵合成微生物代谢产物SCFAs,例如,结肠微生物群落中Faecalibacterium、Clostridia、Lactobacillus等菌具备产SCFAs 的能力。SCFAs 能够促进肠道上皮细胞的增殖,其中乙酸、丙酸、丁酸等有助于结肠调节性T 细胞的发育,从而限制肠道局部炎症,增强肠道屏障功能[36]。试验通过对结肠微生物群落LEFSe分析发现,1.5%OA 添加组结肠中群落Lactobacillus占显著优势。与此同时对结肠内容物进行挥发性脂肪酸检测发现ETEC 攻毒小鼠饲粮中添加1.5%OA可以显著提高小鼠乙酸和丁酸浓度。由此推测饲粮中添加1.5%OA 可以通过增加结肠中产SCFAs 的微生物群落来改善肠道功能。
综上所述,饲粮添加复合有机酸(甲酸、苯甲酸与三丁酸甘油酯)可显著缓解大肠杆菌诱导的肠道屏障功能损伤,减轻机体炎症反应,改善肠道微生物区系及代谢,维持肠道健康,以添加剂量为1.5%和3.0%时效果较好。
