白心与黄心糖木薯代谢物及相关基因表达分析
2022-11-04安飞飞罗秀芹薛晶晶陈松笔
安飞飞,罗秀芹,薛晶晶,陈松笔,蔡 杰
(中国热带农业科学院 热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室,海南 海口 571101)
【研究意义】木薯作为世界上近十亿人的口粮,其块根富含淀粉但缺乏类胡萝卜素、蛋白质和微量元素铁、锌等,因此选育营养加强型木薯品种是育种家追求的重要目标之一。木薯块根薯肉颜色在长期进化过程中形成了不同颜色,包括白色、橙黄色、黄色、粉红色等[1],但我国缺乏粉红心木薯资源,大多为白心木薯资源,黄心木薯资源比例不高。目前白心木薯和黄心木薯薯肉代谢物组成及其含量仍不清楚,因此开展两种颜色木薯薯肉中代谢物质的研究对木薯薯肉营养成分的遗传改良具有重要意义。【前人研究进展】由于木薯在世界粮食安全中的重要作用,对人体有益的代谢物质被鉴定,同时具有营养价值的生物强化品种也得到开发[2]。黄心木薯块根含有类胡萝卜素,而白心木薯块根类胡萝卜素含量极低[3]。黄心木薯经不同方式的蒸煮,总类胡萝卜素含量范围在2.64~14.15 μg/g,其中β-胡萝卜素占总类胡萝卜素的75%左右[4]。自然界中存在块根维生素B1 和类胡萝卜素含量的变异品种[3,5],研究[6-7]显示增加维生素原A 含量可提高木薯块根中的胡萝卜素含量。Sánchez 等[8]对高营养价值的3 000 多份木薯样品进行分析,挖掘高β-胡萝卜素的木薯资源。中国热带农业科学院热带作物品种资源研究所[9]于2005 年选育出块根薯肉富含β-胡萝卜素的蛋黄木薯,同时构建蛋黄木薯自然杂交群体用于关联分析,挖掘与类胡萝卜素代谢的关键基因[10]。代谢组学研究生物体由于基因修饰或外界环境改变引起的代谢物变化,是目前组学研究的热点之一[11]。靶向代谢组学和非靶向代谢组学手段已被广泛应用于不同作物及不同器官的代谢物分析[12-13]。木薯中已建立了初级和次级代谢物的筛选方法,并用于农艺性状相关生物标记代谢物的鉴定[4]。采用非靶向代谢组学技术在木薯叶片中鉴定到184 种代谢物[14],同时分析不同品种木薯叶片差异代谢产物和代谢通路[15],靶向代谢组学方法也应用于研究木薯块根采后生理变质(PPD)过程中类胡萝卜素、类黄酮、花青素和酚类物质的动态变化[16-17]。研究[18]发现,木薯各器官中代谢成分存在显著差异,其中根营养价值最丰富。【本研究切入点】尽管学者们开展了黄心木薯的杂交利用和遗传改良,同时利用代谢组学分析木薯组织的代谢物及PPD 过程中代谢物的变化,但有关白心木薯与黄心木薯薯肉代谢物比较分析却鲜有报道。【拟解决的关键问题】为明确两者薯肉中代谢物差异及相关基因表达情况,本研究拟选用父母本相同、遗传背景一致,但薯肉颜色差异明显的白心糖木薯2-17 与黄心糖木薯2-27 为试验材料,采用LC-MS 技术,结合qRT-PCR,分析两者薯肉代谢物差异,为木薯薯肉代谢物鉴定及品质遗传改良提供科学参考。
1 材料与方法
1.1 试验材料
本研究所选用的材料为白色薯肉木薯2-17和黄色薯肉木薯2-27,两者均来自中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃的糖木薯杂交F1代群体,其中2-17为对照。试验材料于2019 年3 月种植,2020 年1 月收获,收获后立即取块根薯肉头、中、尾3 个部分,切碎混匀后置于液氮速冻,后保存于-80 ℃备用。
1.2 UPLC测定薯肉β-胡萝卜素含量
将保存好的块根薯肉置于液氮研磨成粉末,后称取0.5 g 薯肉粉末,加入5.0 mLV(三氯乙烷)∶V(无水乙醇)=1∶1,50 ℃水浴60 min。取上清液3 mL,加入0.6 mL 20%的氢氧化钾-甲醇,50 ℃水浴60 min,取0.2 mL 上层液复溶过滤后备用。色谱柱Agilent HC-C18(2)(250 mm×4.6 mm,5 μm);流动相A:乙腈;流动相B:异丙醇。洗脱程序:0~10 min,100%A,10~15 min,20%A,15~30 min,100%A,流速:1 mL/min,进样量:10 μL,柱温25 ℃,检测波长:450 nm。
1.3 GC-MS测定薯肉糖含量
称取0.2 g 薯肉,加2.0 mL 80%乙醇提取,离心后取上清,量取0.5 mL 上清液氮吹干。后加入30 μL 20 mg/mL 甲氧基胺基盐酸盐吡啶溶液,37 ℃,650 r/min,摇晃1.0 h。随后加入70 μL N,O-双(三甲基硅烷基)三氟乙酰胺,70 ℃,650 r/min 振荡1 h,室温放置30 min,离心取上清液备用。安捷伦毛细管柱为HP-5,30 m×0.25 mm,0.25 μm;质谱为5975C四级杆质谱仪;气化室温度:280 ℃;升温程序:80 ℃,1 min;6 ℃/min升温至240 ℃,保持15 min;载气:氦气,载气流量:1 mL/min;分流比为20∶1;进样量1 μL。
1.4 氯化钙-旋光法分析薯肉淀粉含量
将收获后的新鲜木薯块根薯肉置于55 ℃烘箱中烘至恒重,后用小型粉碎机将其粉碎,粉体过325目筛子得到木薯干粉。称取0.1 g木薯干粉,参照氯化钙-旋光法(GB/T 5514—2008)测定各样品的旋光度,按公式计算样品的淀粉含量。
1.5 qRT-PCR检测基因表达
利用Primer 5.0设计合成淀粉及β-胡萝卜素代谢途径中的关键基因的qRT-PCR引物(表1),包括蔗糖磷酸合酶(SPS)、ADP葡萄糖焦磷酸化酶(AGPase)、可溶性淀粉合成酶(SSS)、β-淀粉酶(β-amylase)、八氢番茄红素合成酶(PSY)、八氢番茄红素脱氢酶(PDS)、六氢番茄红素脱氢酶(ZDS)和番茄红素β-环化酶(LCYB)。参照植物总RNA 提取试剂盒提取薯肉总RNA,利用反转录试剂盒反转录合成cDNA 第一链。将合成的cDNA 稀释5倍作为模板,采用qRT-PCR 检测各基因的表达情况,以actin基因为内参。反应体系为10.0 μL,以2-17为对照,采用2-ΔΔCt计算各基因的相对表达量。

表1 木薯淀粉代谢相关基因的qRT-PCR引物序列Tab.1 qRT-PCR primers sequence for starch and β-carotene metabolism related genes
1.6 LC-MS分析薯肉代谢物
样品送至上海欧易生物医学科技有限公司进行代谢组学分析,每个样本设6个重复。称取80 mg薯肉,加入内标(0.3 mg/mL的L-2-氯苯丙氨酸,0.01 mg/mL的Lyso PC 17:0)各20 μL和1 mL的70%甲醇,-20 ℃放置2 min,60 Hz,研磨2 min后超声提取30 min,-20 ℃静置20 min,4 ℃,离心半径4 cm,13 000 r/min,离心10 min。取300 μL上清液挥干,后用400 μL 20%甲醇复溶,涡旋30 s,超声2 min。4 ℃,离心半径4 cm,13 000 r/min,离心10 min,吸取150 μL的上清液过滤后备用。质控样本(QC)由所有样本的提取液等体积混合制备而成,每个QC体积与样本相同。试验分析仪器为ACQUITY UPLC 超高效液相串联AB Triple TOF 5600高分辨质谱仪组成的液质联用系统。色谱条件:色谱柱:ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温:45 ℃;流动相:A,水(含0.1%甲酸),B,V(乙腈)∶V(甲醇)=2∶3(含0.1%甲酸);流速:0.4 mL/min;进样体积:5 μL。质谱条件:离子源:ESI,正负离子电离模式。
1.7 数据分析
利用UNIFI 1.8.1 软件采集原始数据,原始数据经Progenesis QI v2.3 软件进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化。化合物的鉴定基于精确质量数、二级碎片以及同位素分布,使用The Human Metabolome Database(HMDB)和Lipidmaps(v2.3)以及METLIN 数据库进行定性。对数据进行无监督的主成分分析(PCA),偏最小二乘法判别分析(PLS-DA)以及正交偏最小二乘法判别分析(OPLSDA)。变量权重值(VIP)大于1 的变量被认为是差异代谢物,OPLS-DA 和t-检验相结合,筛选两组试验材料中的差异代谢物(VIP>1,P<0.05),根据Log2 FC 值筛选TOP20 差异代谢物。利用差异代谢物的KEGG ID 进行通路富集分析,应用超几何检验,找出与整个背景相比,在显著性差异表达代谢物中显著富集的pathway条目。
用Excel 2013和DPS v7.05统计软件对生理数据进行分析,差异显著性标准采用新复极差法(Duncan)。
2 结果与分析
2.1 白心与黄心糖木薯薯肉β-胡萝卜素含量分析
糖木薯杂交F1代株系2-17和2-27薯肉颜色存在显著差异(图1A,图1B),2-17 块根薯肉为白色,2-27 块根薯肉呈黄色。进一步分析其薯肉中β-胡萝卜素含量发现两者存在极显著差异(图1C),2-27 块根薯肉中β-胡萝卜素含量为9.60 μg/mL,而2-17 块根薯肉中β-胡萝卜素含量仅0.83 μg/mL。

图1 2-17和2-27薯肉颜色及β-胡萝卜素含量比较Fig.1 Comparison of flesh color and β-carotene content between 2-17 and 2-27
2.2 白心与黄心糖木薯薯肉糖及淀粉含量分析
经测定2-17 和2-27 块根薯肉中蔗糖、果糖、葡萄糖、半乳糖、海藻糖及淀粉含量,得到表2 所示的结果。黄心木薯2-27 薯肉中淀粉、半乳糖、果糖含量较白心木薯2-17 显著升高,其中半乳糖含量升高最显著,达到3.21 g/kg。2-27 薯肉蔗糖含量和海藻糖含量显著下降,海藻糖含量下降极显著,仅为2.29 g/kg,然而两者薯肉葡萄糖含量无显著差异。
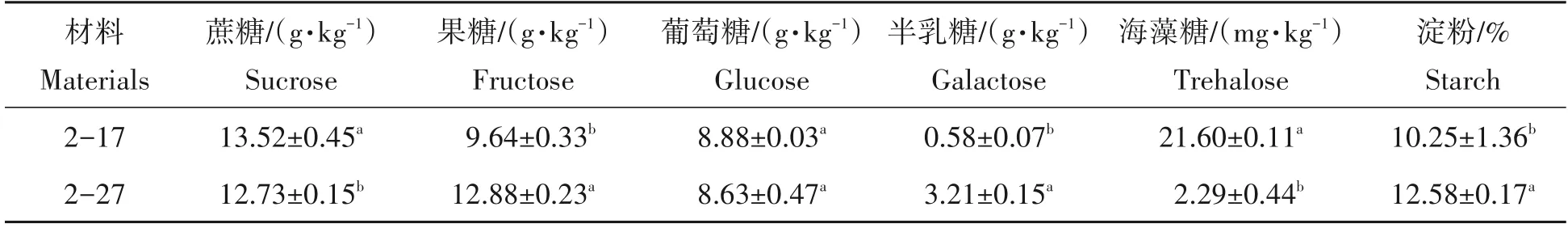
表2 2-17和2-27块根薯肉淀粉及糖含量Tab.2 Starch content and sugar content in cassava flesh of 2-17 and 2-27
2.3 白心与黄心糖木薯薯肉代谢组学的主成分分析
为鉴定两组样品间的差异,首先采用无监督的PCA方法观察样品间的总体分别趋势,共得到2 个主成分,两组木薯薯肉样品均处于置信区间内。两组点分别单独在第2象限(t[1]<0,t[2]>0)、第3象限(t[1]<0,t[2]<0)以及第1象限(t[1]>0,t[2]>0)、第4象限(t[1]>0,t[2]<0),表明两种颜色木薯薯肉中代谢物间有显著差异。OPLS-DA 可最大化地凸显组别间的差异,如图2-B 所示,该结果与PCA 结果大体一致,两组6 个生物学重复数据点能很好地集中在一起并分成两组,说明两组样品的代谢物在种类、含量等方面存在差异。
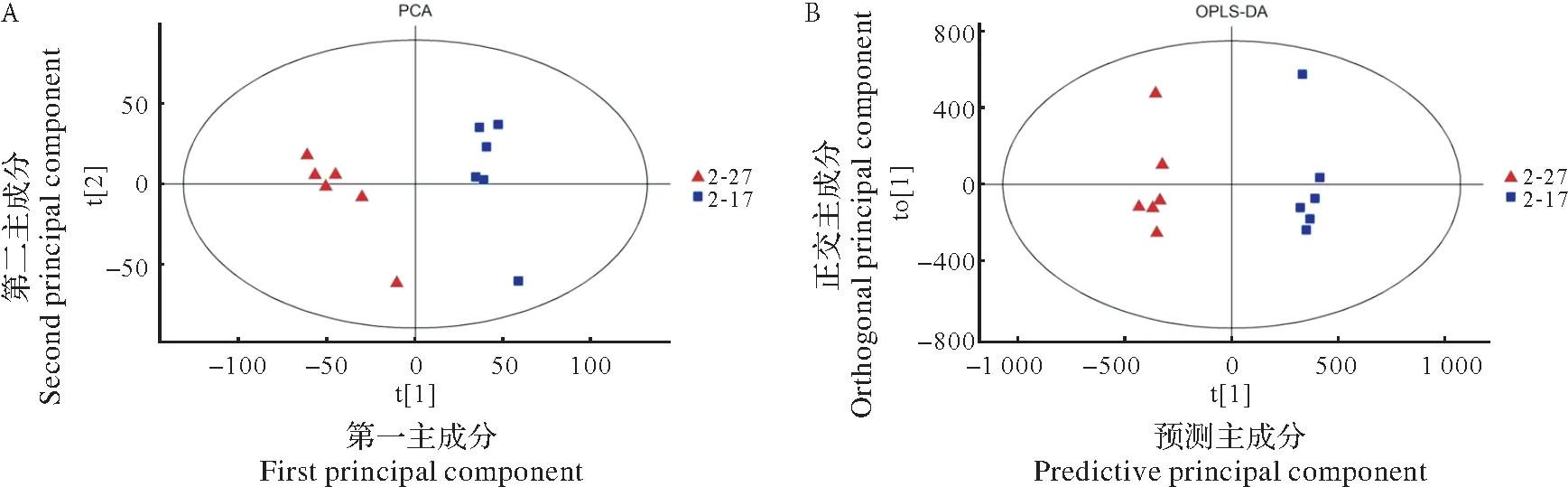
图2 2-17和2-27薯肉代谢物PCA散点图(A)与OPLS-DA散点图(B)Fig.2 PCA(A)and OPLS-DA(B)scatter plots of 2-17 and 2-27
2.4 白心与黄心糖木薯薯肉中差异代谢物分析
在2-17和2-27木薯薯肉中共检测到2 719种代谢物。结合VIP大于1及T检验,共筛选到存在显著差异的代谢物267个,其中上调代谢物163个,下调代谢物104个。将TOP20的差异代谢物进行分析(图3),可更直观地看出它们在两组间的表达差异。其中3-O-阿魏基奎宁酸上调倍数最大,为26.40 倍。差异代谢物主要涉及能量代谢(苹果酸、琥铂酸、异柠檬酸)、脂肪酸代谢(亚麻酸、亚油酸、胆固醇)、氨基酸代谢(亮氨酸、异亮氨酸、L-谷氨酸、色氨酸)、苯丙烷生物合成(东莨菪素)、淀粉和糖代谢(蔗糖、果聚糖、半乳糖、6-磷酸葡萄糖)以及类黄酮代谢(咖啡酰奎宁酸)。

图3 2-27薯肉代谢物中上调和下调差异倍数分别排在前10位的代谢物Fig.3 Top ten differential metabolites(up or down regulated)between 2-17 and 2-27
应用超几何检验,找出在显著性差异表达代谢物中显著富集的pathway条目(图4)。结果发现267种差异代谢物被注释到74个代谢通路中,其中18个代谢通路发生显著或极显著变化。前10位发生极显著改变的代谢通路分别是亚油酸代谢、α-亚麻酸代谢、ABC 转运、丙氨酸、天冬氨酸和谷氨酸代谢、丙酮酸代谢、氨酰tRNA生物合成、氧化磷酸化、碳代谢、乙醛酸和二羧酸代谢和TCA循环。

图4 2-27组/2-17组前20位代谢通路气泡图Fig.4 The bubble charts of top 20 metabolic pathways in 2-27 and 2-17
2.5 白心与黄心糖木薯与淀粉及胡萝卜素代谢相关基因表达分析
淀粉代谢相关基因表达见图5A,与2-17 相比,MeSPS2和Meβ-amylase基因的表达量均显著下调,SPS 和β-amylase 参与淀粉的分解代谢,这表明2-27 块根中淀粉的分解能力较2-17 弱。而MeAGPase和MeSSS1的相对表达量均显著上调,由于AGPase 和SSS 参与淀粉的合成代谢,表明2-27 块根中淀粉的合成能力较2-17 强。β-胡萝卜素代谢相关基因表达见图5B,与2-17 相比,MePSY2、MePSY2、MeZDS和MeLCYB基因的表达量均显著上升,由于这些基因均是β-胡萝卜素合成的关键基因,因此可以看出2-27块根中β-胡萝卜素代谢较强。

图5 2-17和2-27薯肉中淀粉及胡萝卜素代谢相关基因表达Fig.5 The expression profile of starch and carotene metabolism related genes in fleshes of 2-17 and 2-27
3 讨论与结论
代谢组学是测定植物代谢物组分的一种有效手段,在木薯叶片、块根等不同组织代谢物分析中有广泛应用[14,19]。木薯块根薯肉中代谢物含量及其变化可直接影响木薯块根营养品质,为进一步挖掘木薯薯肉中的代谢组分,本研究采用非靶向代谢组手段测定木薯薯肉中的代谢物,在黄心糖木薯与白心糖木薯薯肉共鉴定出267 种差异代谢物,研究所得差异代谢物数量明显高于前人关于块根中代谢物数量的报道[20],这可能由木薯品种差异造成。木薯块根富含淀粉,但蛋白质、微量元素和氨基酸含量较少。本研究结果表明白心糖木薯块根中亮氨酸、异亮氨酸、L-谷氨酸、色氨酸含量高于黄心糖木薯。有报道称氨基酸的组成和含量会影响果实品质[18],其中亮氨酸、异亮氨酸对葡萄的苦味有贡献[21],本试验材料中白心糖木薯2-17 比黄心糖木薯2-27 苦,可能是由于白心糖木薯薯肉中亮氨酸及异亮氨酸含量较高导致,这些氨基酸后续可作为木薯块根品质筛选的代谢标记物。代谢组数据显示黄心糖木薯薯肉中淀粉和蔗糖、果聚糖、半乳糖、6-磷酸葡萄糖较白心木薯高,这与试验结果中氯化钙-旋光法测定的淀粉含量及GC-MS 分析得到的糖含量结果一致,同样基因表达分析结果也显示2-27 淀粉合成能力较高,淀粉降解能力较弱。也再次证实了代谢组学数据的可靠性。
东莨菪素和β-胡萝卜素在木薯块根应对采后生理变质过程中起重要作用,可作为一种潜在的耐采后生理腐烂(postharvest physiological deterioration,PPD)生物标志物[20,22]。本研究中黄心糖木薯薯肉中东莨菪素含量显著高于白心木薯,推测黄心糖木薯比白心糖木薯更耐PPD,这与Morante 等[23]、Sánchez 等[24]的研究结果一致。相关研究[24]表明β-胡萝卜素是一种优良抗氧化剂,其含量与木薯块根的耐贮性呈显著正相关。本研究发现黄心糖木薯中β-胡萝卜素含量显著高于白心糖木薯,且与β-胡萝卜素合成相关的基因表达均上调,这也可能是黄心糖木薯更耐PPD 的原因。但在本研究的差异代谢物中未找到类胡萝卜素代谢途径中的相关代谢物,推测前期样本处理时并未针对类胡萝卜素类物质提取,且代谢组为非靶向代谢手段,在进行数据库匹配时,无类胡萝卜素相关数据库,因此质谱检测时未检测到。本文也针对类胡萝卜素中的β-胡萝卜素含量进行定量分析,后期将针对其它类胡萝卜素种类和含量进行靶向分析。
脂肪酸在植物生长发育过程中起基础作用,为植物的生长过程提供能量[25]。研究[26]结果表明黄心糖木薯中脂肪酸主要包括亚麻酸、亚油酸、胆固醇等,且其含量高于白心糖木薯。脂肪酸可以转化为乙酰辅酶A,而乙酰辅酶A在碳水化合物代谢和氨基酸代谢过程中起着至关重要的作用[27-28],因此在黄心糖木薯中脂肪酸代谢的增强促进了淀粉及半乳糖代谢。乙酰辅酶A也可参与类固醇的生物合成[29],本研究中也发现甾体和油菜素甾体生物合成在黄心糖木薯中较为活跃。
木薯基因组高度杂合,且块根中的营养成分受基因和环境的综合影响[30-31],块根营养是由多基因位点控制的复杂性状[32-33],而代谢组学用于发掘木薯营养物质的研究较少,且相关数据库也有待完善。目前,木薯中仅阐明了部分营养物质如淀粉、类胡萝卜素积累的生物合成途径,但其内在的遗传规律及其调控机制尚未清晰。因此有必要结合其他组学数据,以快速、准确地了解木薯中营养物质的表达信息,并把这些数据作为准确的分子性状衡量指标,结合分子生物学手段,应用于关键基因挖掘、功能解析乃至木薯新品种培育过程中。
本研究表明,黄心糖木薯与白心糖木薯薯肉共鉴定出267种差异代谢物(其中上调163个,下调104个),其中59种差异代谢物显著或极显著影响了18个代谢通路,主要涉及脂肪代谢、糖代谢、氨基酸代谢和能量代谢等。黄心糖木薯薯肉β-胡萝卜素、淀粉、半乳糖和果糖含量高,而白心糖木薯薯肉中蔗糖和海藻糖含量高。黄心糖木薯脂肪酸代谢、淀粉及半乳糖代谢、苯丙烷生物合成及类黄酮代谢更活跃,而白心糖木薯氨基酸代谢和能量代谢更活跃。黄心糖木薯中淀粉合成相关基因表达上调,淀粉降解相关基因表达下调,β-胡萝卜素合成相关基因上调。
