基于GC-MS技术的糯稻“航天稻”和籼稻“昌恢871”代谢组学研究
2022-11-04付海辉胡嘉敏黄俊英周大虎贺浩华傅军如
付海辉,胡嘉敏,黄俊英,周大虎,贺浩华,傅军如
(江西农业大学 农学院,江西 南昌 330045)
【研究意义】代谢组学(metabolomics)是对特定环境和时间条件下细胞、组织或生物体内所有分子量小于1 000 的化合物的定性、定量及动态变化研究。这些内源性小分子(代谢物)的水平是生物对遗传修饰或环境变化的响应[1]。代谢组学研究技术手段包括核磁共振(nuclear magnetic resonance,NMR)、气相色谱质谱联用(gas chromatographymass spectrometry,GC-MS)和液相色谱质谱联用(liquid chromatography mass spectrometry,LC-MS)等[2]。其中GC-MS 具有高灵敏和高分辨能力,是最先大规模应用于植物代谢组学研究的技术方法[2]。该技术的应用,为水稻的食味品质、营养品质等方面的提升提供了更多可能。【前人研究进展】目前,GC-MS 已广泛地运用到水稻的改良育种、抗逆性研究、基因功能研究等方面。Hu等[3]利用GC-MS 检测不同品种水稻的成熟种子的代谢物,揭示了代谢表型与水稻种子地理起源之间的相关性;Zhang 等[4]运用GC-MS 技术测定低温胁迫水稻代谢物,明确了水稻低温响应和恢复的动态代谢模型;Long 等[5]采用GC-MS 技术方法分析基因修饰水稻赖氨酸生物合成和分解代谢途径中代谢产物,揭示了解赖氨酸在水稻中积累的代谢规律。【本研究切入点】水稻(Oryza sativaL.)是禾本科草本植物,广泛分布于亚洲、拉丁美洲和非洲等地区,是世界上主要的粮食作物之一。稻米产量一直是研究者们关注的对象[6-8]。随着生活水平的提高和科技水平的快速发展,人们逐渐将关注点放在稻米的口感和营养品质上[9-10]。稻米含有种类十分丰富的代谢物(包括初生代谢物和次生代谢物),既包含糖类、氨基酸、脂肪酸等基本营养物质,还包含黄酮、白藜芦醇、生物碱等生物活性物质[11]。这些代谢物受遗传因素控制,影响着稻米品质和产量[12-13]。王希越等[14]运用代谢组学方法分析不同品种(稻花香、状元和农大)水稻种子的代谢产物,发现稻花香种子的脂肪酸、柠檬酸、糖类和天冬酰胺含量较高,稻花香种子果糖和琥珀酸及状元种子苏氨酸含量均低于农大种子,稻花香种子乳酸、琥珀酸、硬脂酸、果糖等物质含量低于状元种子。Dias等[15]发现2-乙酰-1-吡咯啉是影响香米香气的挥发性化合物,在香米中含量较多。【拟解决的关键问题】基于GC-MS非靶向代谢组学技术,检测糯稻航天稻和籼稻昌恢871的代谢组分,筛选两种材料间的差异代谢物,构建差异代谢网络,以期明确两种水稻材料的主要化学成分,为稻米营养品质的改良育种提供理论依据。
1 材料与方法
1.1 试验材料
供试稻谷材料为糯稻“航天稻”(图1A)和籼型常规水稻“昌恢871”(图1B)。其中糯稻“航天稻”是江西省糯米品种搭载我国微重力科学实验卫星“实验十号”,遨游太空12 d 返回地球,经江西农业大学初步筛选,扩繁而得。于2021年水稻成熟季节取两种水稻种子于液氮中,-80 ℃保存于江西农业大学农学院实验室。

图1 航天稻(A)和昌恢871(B)种子形态特征Fig.1 Morphological character of Hangtian Dao(A)and Changhui 871(B)
1.2 代谢物提取
运用GC-MS 技术进行非靶向代谢组学研究[16-17]。取50 mg 糙米于2 mL 离心管中,加入500 μL 提取液(V(甲醇)∶V(氯仿)=3∶1)和10 μL核糖醇(内标),涡旋30 s,45 Hz研磨仪研磨4 min,冰水浴超声5 min(重复3次)后,4 ℃,离心半径5 cm,12 000 r/min离心15 min。移取300 μL上清液于1.5 mL离心管中,每个样本各取80 μL 混合成QC 样本。上清液经真空浓缩器干燥后,加入60 μL 吡啶-甲氧胺,混匀,80 ℃上清孵育30 min。之后,加入70 μL BSTFA(含有体积分数1% TMCS),70 ℃孵育1.5 h。冷却至室温,向混合的样本中加入5 μL FAMEs(溶于氯仿)后,上机检测。
1.3 非靶向代谢组(GC-MS)检测
使用7890A 气相色谱(Agilent,USA)联合PEGASUS HT 质谱仪(LECO,USA),并配有Agilent DB-5MS 毛细管柱(J&W Scientific,Folsom,CA,USA)。1 μL 衍生化后的样品注入DB-5MS 毛细管柱(30 m×0.25 mm)(Agilent JW Scientific,Folsom,CA)分离后检测。将进样口温度设置为280 ℃,离子源温度设置为250 ℃。经5 min 溶剂延迟后,将GC 箱温度调整至50 ℃;注射1 min 后,将其温度从50 ℃以10 ℃/min的速度提高至310 ℃。高纯氦气作为载气,流速为3.0 mL/min。电压为-70 eV,扫描范围50~500 m/z。
1.4 数据分析
下机原始数据使用Chroma TOF 软件(V 4.3x,LECO)进行数据搜库预处理,通过保留时间、质荷比对数据进行简单筛选并进行峰对齐;通过XIC 图中的质荷比确定化合物的精确分子量,根据质量数偏差、化合物离子信息进行分子式预测;通过与LECO-Fiehn Rtx5 数据库中每个化合物的碎片离子、碰撞能等信息进行匹配,对生物体系中的代谢物进行鉴定。然后选取QC样本中CV(coefficient of variance)值小于30%的化合物作为最终的鉴定结果[18],进行后续分析。
运用t检验分析航天稻和昌恢871代谢物相对含量的差异。其次,运用无监督的主成分分析(principal component analysis,PCA),观察所有样本总体分布,运用有监督的偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA),分析品种对水稻代谢物的影响。为防止PLS-DA 模型过拟合,采用200 倍排列检验对其进行检验。排列检验中的R2>0.7 和Q2>0.4,表明PLS-DA 模型可靠。此外,PLS-DA 模型第一主成分的变量投影重要度(variable importance in the projection,VIP)对于解释PLSDA 模型中的数据十分重要。选择VIP>1.0 和t检验P<0.05 的代谢物作为区分两种水稻的差异代谢物。运用皮尔逊相关分析(Pearson’s correlation test),分析差异代谢物之间的相互关系。PCA、PLS-DA 和PLS-DA 模型检验均使用SIMCA-P 14.1(Umetrics,Sweden);t检验和皮尔逊相关分析使用IBM SPSS Statistics 20.0(SPSS,Inc.,IBM Corp,New York,NY,USA);绘图应用OriginPro 8.0(Origin Lab Corporation,USA)和Excel 2007。此外,所有数据在分析前均进行log转换,数据均以平均值±标准误表示。
2 结果与分析
2.1 样本质控分析
生物代谢组易受外界因素干扰且变化迅速,因此,数据质量控制(quality control,QC)是获得可重复性和准确性代谢组结果的必要步骤。基于峰面积值计算QC 样本之间的皮尔逊相关系数R2均大于0.9(图2A),说明整个检测过程稳定性好,数据质量较高。

图2 质控样本(QC)相关性分析(A)及基于昌恢871、航天稻和质控样本代谢组数据的PCA得分图(B)Fig.2 Correlation analysis of quality control samples(QC)(A)and Score plots of PCA for metabolomic data from Hangtian Dao,Changhui 871 and QC(B)
PCA 是将一组可能存在相关性的变量,通过正交变换转换为一组线性不相关变量的统计方法,转换后的这组变量即称为主成分。代谢组数据可被认为是一个多元数据集,PCA 可将代谢物变量按一定的权重通过线性组合进行降维,然后产生新的特征变量,通过主要新变量(主成分)的相似性对其进行归类,从总体上反映各组样本之间的总体代谢差异和组内样本之间的变异度大小[19]。由图2B 可知,QC 样本的分布会聚集在一起,且各样本组间明显分离,一方面说明整个方法稳定性好,数据质量较高,另一方面说明样本组间存在明显差异,数据处理结果可信。
2.2 代谢物分析
基于GC-MS 技术手段,在航天稻和昌恢871中共检测到221个代谢物。基于代谢物的分子结构,可将该221 个代谢物划分为7 种类型:氨基酸及其衍生物(39 个)、糖类及其衍生物(35 个)、有机酸(80 个)、醇类(15 个)、酯类(14 个)和其它(33 个)(图3)。航天稻氨基酸及其衍生物相对含量极显著高于昌恢871(P<0.001),但航天稻糖类及其衍生物和有机酸含量显著低于昌恢871(0.01<P<0.05),且醇类代谢物极显著低于昌恢871(P<0.001)(图3)。

图3 基于GC-MS的航天稻和昌恢871代谢物所占比例Fig.3 Proportions of different metabolites in Hangtian Dao and Changhui 871 based on GC-MS
2.3 差异代谢物筛选
PLS-DA是一种有监督的判别分析统计方法。该方法运用偏最小二乘回归建立代谢物表达量与样品类别之间的关系模型,来实现对样品类别的预测[20]。基于稳定可靠模型PLS-DA(R2>0.7 且Q2>0.4),航空稻和昌恢871 两组样本可明显区分开(图4)。基于VIP>1 和P<0.05,筛选出81 个差异代谢物,主要是氨基酸及其衍生物(24 个),有机酸(24 个)和糖类及其衍生物(15 个),其中航空稻中39 个代谢物与昌恢871 相比上调,42个下调。进一步结合差异倍数值FC(fold change)筛选出差异倍数前20的差异代谢物(表1):航空稻与昌恢871相比上调幅度前20 的差异代谢物包括4 个氨基酸及其衍生物,5 个糖类,5 个有机酸,1个胺类,1个黄酮类,1个核苷酸,1个酯类,2个醇类;下调幅度前20的差异代谢物包括10个有机酸,6个糖类,1个胺类,1个酯类,2个核苷酸。其中与昌恢871相比,航天稻上调幅度最大的是果糖1,航天稻果糖1 是昌恢871 的144.7 倍;航天稻下调幅度最大的是肌醇半乳糖苷,昌恢871 肌醇半乳糖苷含量是航天稻的33.8倍(表1)。

表1 航天稻(HT)和昌恢871(CH)水稻差异倍数前20的差异代谢物Tab.1 The top 20 differential metabolites in seeds of Hangtian Dao(HT)and Changhui 871(CH)
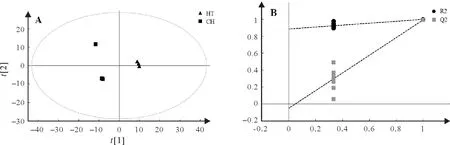
图4 航天稻和昌恢871稻代谢物PLS-DA分析(A)及其模型验证(B)Fig.4 Score plots of PLS-DA for metabolomic data from Hangtian Dao and Changhui 871(A)and the permutation test results of the PLS-DA model(B)
2.4 代谢通路分析
KEGG 是进行生物体内代谢分析和代谢网络研究的强有力工具[21-23]。运用KEGG 代谢通路富集分析,可确定差异代谢物参与的最主要的代谢途径。将81 个差异代谢物共注释到52 条代谢通路。基于P<0.05,共筛选到12条富集显著的通路,包括5条富集极显著代谢通路(氨酰tRNA 生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸生物合成,淀粉和蔗糖代谢及赖氨酸生物合成)(P<0.01)(图5,表2)。基于差异代谢物和差异代谢物KEGG 富集分析结果,本研究构建了两种水稻材料的果糖和氨基酸代谢途径。果糖是甜度最高的天然糖源,广泛存在植物内。相较于昌恢871,航天稻果糖含量上调,其FC值为144.7。人体必需氨基酸包括亮氨酸、蛋氨酸、色氨酸、苏氨酸、赖氨酸、缬氨酸、苯丙氨酸和异亮氨酸。与昌恢871相比,航天稻的苏氨酸、赖氨酸、缬氨酸、苯丙氨酸和异亮氨酸含量上调(图6),N-乙酰-L-亮氨酸(亮氨酸衍生物)和5 甲氧基色胺(色氨酸衍生物)含量上调(图6),其FC 值分别为4.5、5.1、2.6、2.3、1.80、3.2和12.2。同时发现,两种水稻材料间的其它单糖(如核糖)和二糖(如蔗糖、乳糖、海藻糖)含量及其它氨基酸(如瓜氨酸、谷氨酸、鞘氨醇等)含量也存在显著差异(P<0.05)。

图5 航天稻和昌恢871差异代谢物的代谢通路富集图Fig.5 Pathway enrichment map of the differential metabolites of Hangtian Dao and Changhui 871
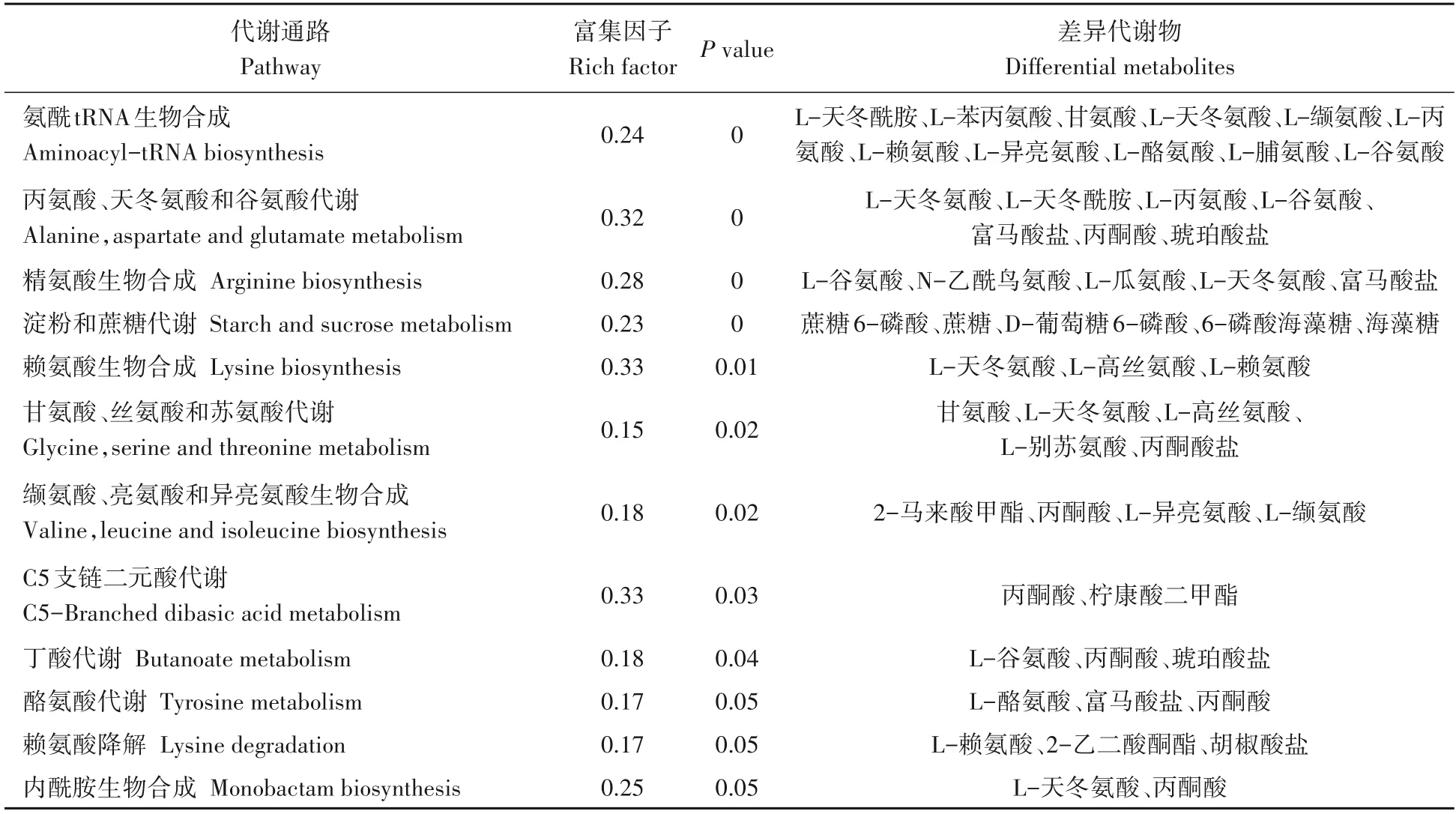
表2 航天稻和昌恢871差异代谢物显著富集通路Tab.2 Significant enrichment pathways of differential metabolites in Hangtian Dao and Changhui 871
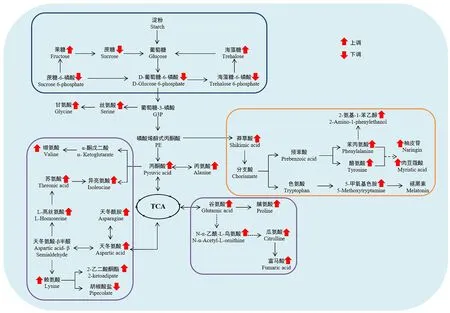
图6 基于“航天稻”和“昌恢871”差异代谢物的局部代谢网络Fig.6 Local metabolic network based on differential metabolites between Hangtian Dao and Changhui 871
3 讨论与结论
3.1 糯稻“航天稻”和籼稻“昌恢871”差异代谢物
代谢组是生物体内代谢产物的综合,可直观反映生物在特定时间和环境条件下的生物学过程及其机制[24]。本研究采用非靶向的GC-MS 代谢组学技术,分析了糯稻航天稻和籼稻昌恢871 的代谢组分。QC 样本间的皮尔逊相关系数R2 均大于0.9,说明整个检测过程仪器稳定性好。基于无监督的判别分析PCA,各样本(包括QC样本)间差异明显,说明整个方法稳定性好,前期处理得到的数据可信。
两种水稻材料中共筛选到81种差异代谢物,与昌恢871相比,航天稻中包括57个上调差异代谢物和24个下调差异代谢物。上调差异代谢物中有10个糖类,11个有机酸,24个氨基酸,2个胺类,4个醇类,1个酮类,3个酯类和2个黄酮类;下调代谢物中有2个胺类,1个醇类,2个核酸,6个糖类,12个有机酸和1个酯类。由此可见,相较于昌恢871,航天稻糖类、氨基酸、有机酸等上调代谢物明显多于下调代谢物。
3.2 糯稻“航天稻”和籼稻“昌恢871”差异代谢通路
运用KEGG Pathway 数据库对筛选到的差异代谢物进行注释,共获得52 条差异代谢通路,其中5 条通路较为显著(P<0.01),这5条通路涉及氨基酸代谢(如氨酰tRNA生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸生物合成和赖氨酸生物合成)和糖代谢(如淀粉和蔗糖代谢)。淀粉和蔗糖代谢包括蔗糖分解为葡萄糖和果糖及葡萄糖合成淀粉[25]。一方面可为氨基酸代谢、三羧酸(TCA)循环及次生代谢提供原料物质,另一方面可储存能量物质淀粉[25]。果糖经磷酸化转化为果糖-6-磷酸(F6P),F6P 经多步反应依次转化为葡萄糖-6-磷酸(G6P)、葡萄糖-3-磷酸(G3P)、磷酸烯醇式丙酮酸(PE)、丙酮酸(PA)和乙酰辅酶A。G3P、PE 和PA 是氨基酸代谢和次级代谢的重要参与者。在本研究中,两种水稻材料葡萄糖含量没有显著差异,但航天稻果糖含量显著高于昌恢871(航天稻果糖含量是昌恢871的144.7倍),蔗糖含量显著低于昌恢871(P<0.05),且两种水稻材料间G6P和PA 含量存在显著差异。通过非靶向代谢组测定,发现航天稻和昌恢871 两种水稻中果糖的含量差异极大,在航天稻中显著上调,上调的果糖通过分解代谢转化为磷酸二羟丙酮,磷酸二羟丙酮进入三羧酸循环,生成酮戊二酸,酮戊二酸又可以转化为谷氨酸,谷氨酸再进一步生成瓜氨酸。在本次研究中也检测发现谷氨酸和瓜氨酸含量显著上调。果糖经磷酸化转化为果糖-6-磷酸(F6P),F6P 经多步反应依次转化为葡萄糖-6-磷酸,相应地,检测发现葡萄糖-6-磷酸上调非常显著。相反,笔者检测发现蔗糖的含量显著下调,推测下调的蔗糖主要转化为果糖。因此,航天稻和昌恢871的差异代谢通路淀粉和蔗糖代谢与其果糖、蔗糖、G6P和PA含量之间的差异存在紧密联系。暗示了两种水稻品种间稻米品质三大营养成分之一糖的差异。
氨基酸参与多种代谢途径和生理生化途径的调节,直接影响植物中许多生理过程[26-27]。必需氨基酸(如缬氨酸、异亮氨酸、苯丙氨酸等)在人体或动物体内无法合成,必须通过饮食获得[28]。氨基酸代谢不仅与蛋白质合成有关,还与能量和碳水化合物代谢、碳氮收支、激素和次级代谢、非生物和生物应激反应等密切相关[29]。本研究中,与昌恢871相比,航天稻必需氨基酸苏氨酸、赖氨酸、缬氨酸、苯丙氨酸和异亮氨酸FC 值分别为4.5、5.1、2.6、2.3 和1.8,亮氨酸衍生物N-乙酰-L-亮氨酸和色氨酸衍生物5 甲氧基色胺的FC 值分别为3.2和12.2。因此,两种水稻材料差异代谢通路氨酰tRNA 生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸生物合成及赖氨酸生物合成可能对两种稻米的三大营养成分之一蛋白质上的差异有重要的贡献。
不同氨基酸代谢之间也存在紧密联系。天冬氨酸代谢途径涉及赖氨酸、蛋氨酸、苏氨酸和异亮氨酸的合成,也与高丝氨酸、谷氨酸、甘氨酸和脯氨酸的合成密切相关[29]。精氨酸生物合成涉及鸟氨酸、瓜氨酸、谷氨酸和脯氨酸的合成[29]。本研究中,两种水稻材料必需氨基酸(苏氨酸、赖氨酸、缬氨酸、苯丙氨酸和异亮氨酸)及其衍生物(N-乙酰-L-亮氨酸和5甲氧基色胺)含量差异显著,非必需氨基酸脯氨酸、鸟氨酸、瓜氨酸、丝氨酸等含量也呈现显著差异。鉴于植物氨基酸代谢连接TCA 循环和糖类代谢。因此,两种水稻材料差异代谢通路氨酰tRNA 生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸生物合成及赖氨酸生物合成与其氨基酸和糖类含量差异有关。
本研究通过非靶向代谢组学技术手段对糯稻“航天稻”和籼稻“昌恢871”的代谢物进行了分析,利用KEGG数据库对差异代谢物进行注释并获取了相应的代谢通路,构建了两种稻米材料中果糖和氨基酸的代谢网络,为深入研究稻米营养品质及其合成机理提供依据。
致谢:江西省教育厅自然基金一般项目(GJJ190187)同时对本研究给予了资助,江西农业大学作物生理生态与遗传育种教育部重点实验室提供了实验平台,谨致谢意!
