慢性阻塞性肺疾病患者外周血及肺组织中高迁移率族蛋白1和Th17/Treg的变化及意义
2022-11-04郑相如余思源张兰英欧阳瑶
张 婧,龙 瀛,郑相如,余思源,张兰英,欧阳瑶
0 引 言
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种具有较高的发病率和死亡率的呼吸系统疾病,可能发生肺癌、骨质疏松和抑郁等多种并发症,造成巨大的经济和社会负担[1-2]。COPD的发病机制至今未研究明确,T细胞介导的免疫反应在COPD发病机制中的作用是目前的研究热点。辅助性T细胞(T helper,Th)17通过分泌促炎性细胞因子(如:IL-17、IL-21)发挥促炎作用,而调节性T细胞(T regulatory, Treg)通过分泌抗炎性细胞因子(如:TGF-β、IL-10)具有抑制炎症反应的作用,两种细胞在功能上相互拮抗。正常状态下,Th17细胞和Treg细胞保持相对平衡,一旦失衡就可能导致疾病的发生。高迁移率族蛋白1(Highmobilitygroupbox 1,HMGB1)是一种具有促炎作用的DNA结合核蛋白,参与多种疾病的发病机制。研究显示,COPD的发生发展与HMGB1表达增加和Th17/Treg细胞失衡均有关[3-6]。在一些疾病的发病中已经证实HMGB1可以导致Th17/Treg细胞失衡[7-9]。然而,在COPD的发病中HMGB1是否与Th17/Treg细胞失衡有关尚不明确。因此,本研究通过观察COPD患者肺组织和外周血中HMGB1、Th17细胞和Treg细胞的变化,分析HMGB1与Th17/Treg细胞的关系,以进一步丰富COPD的发病机制。
1 资料与方法
1.1 研究对象回顾性收集2015年9月至2016年3月于遵义医科大学附属医院胸外科因支气管扩张症或肺癌接受肺叶切除术患者的肺组织标本(标本取自与病灶外缘相距5 cm以上处)。纳入标准:①因支气管扩张症接受肺叶切除术患者的肺组织标本;②因肺癌接受肺叶切除术患者的肺组织标本。排除标准:合并结核病、支气管哮喘和其他自身免疫性疾病的患者。根据患者是否存在吸烟和是否确诊COPD,将实验对象分为3组:对照组(无吸烟且无COPD患者,n=12)、CS+COPD-组(有吸烟且无COPD患者,n=21)、CS+COPD组(有吸烟且有COPD患者,n=10)。一般资料见表1。根据世界卫生组织1997年定义在一生中累积或持续吸烟6个月或更长时间的人为吸烟者。
回顾性收集2017年11月至2018年2月遵义医科大学附属医院呼吸一科COPD患者的外周血标本。纳入标准:①因COPD急性加重而住院治疗;②存在基础疾病COPD。排除标准:合并支气管哮喘、肺结核和其他自身免疫性疾病患者的标本。COPD急性加重期(acute exacerbation COPD,AECOPD)和COPD稳定期(Stable COPD,SCOPD)的评估条件根据2017版慢性阻塞性肺疾病全球倡议指南[10]。将我院年龄大于45岁且经体检证实身体健康的人群纳入有吸烟无COPD组、无吸烟无COPD组。将上述实验对象分为4组:无吸烟无COPD组、有吸烟无COPD组、AECOPD组(COPD急性加重期患者)和SCOPD组(COPD稳定期患者),每组30例。每组实验对象于清晨空腹状态下抽取3 mL的外周静脉血用于ELISA实验。一般资料见表2。本研究经遵义医科大学附属医院伦理委员会讨论通过[批准号:(2014)1-027],患者均签署知情同意书。

1.2方法
1.2.1 主要试剂盒仪器兔抗人IL-21抗体、兔抗人IL-17抗体、兔抗人FOXP3抗体、兔抗人TGF-β抗体、鼠抗人HMGB1抗体均购于武汉三鹰生物技术有限公司。人IL-17、IL-21、IL-10、TGF-β和HMGB1酶联免疫分析试剂盒均购于Andy Gene生物公司。免疫组化试剂盒购于上海蓝基生物科技有限公司。
1.2.2肺组织HE染色将石蜡切片脱蜡至水,苏木素染细胞核,伊红染细胞质,脱水封片,最后置于光镜下观察,并采集图像。通过Bosken评分对COPD患者肺组织进行定量分析[11]。
1.2.3ELISA严格按照ELISA试剂盒说明书,检测外周血中IL-17、IL-21、IL-10、TGF-β和HMGB1的含量。
1.2.4免疫组化采用免疫组化检测肺组织中HMGB1、IL-17和IL-21(Th17细胞)以及FOXP3和TGF-β(Treg细胞)的含量,上述指标相应的一抗溶液的配制浓度均为1∶200。免疫组化的操作步骤如下:组织切片脱蜡,内源性过氧化物活性阻断,修复抗原,山羊血清封闭,滴加一抗,滴加二抗,DAB显色,苏木精复染,分化,脱水,干燥,最后采用中性树胶封片。
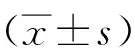
2 结 果
2.1 人肺组织病理学特征对照组肺组织病理学表现为气道结构正常,肺泡壁结构完整,无明显炎症细胞浸润,小气道管腔无阻塞,肺血管未见明显改变,Bosken评分为(2.76±0.56)分。CS+COPD-组肺组织病理学表现为管壁炎症细胞浸润,细支气管缩短,伴有黏膜溃疡,肺泡壁结构无改变,小气道管腔无明显阻塞,血管无明显异常,Bosken评分为(6.68±2.26)分。与对照组、CS+COPD-组相比,CS+COPD组肺泡黏膜上皮重度受损,肺泡壁结构破坏,肺泡间隔无连续性,部分肺泡融合为肺大疱,气道平滑肌及黏液杯状细胞明显增生,小气道管壁有大量炎症细胞,红细胞增多,肺血管管壁增厚,小气道明显阻塞,Bosken评分(12.76±2.72)明显增加(P<0.05)。见图1。
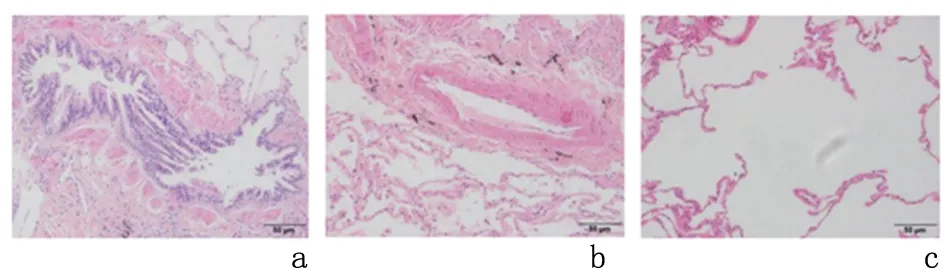
a:对照组; b:CS+COPD-组; c:CS+COPD组
2.2人肺组织中HMGB1、IL-17、FOXP3、IL-21与TGF-β表达情况与对照组相比,CS+COPD-组肺组织内HMGB1、IL-17、IL-21及TGF-β的表达升高(P<0.05),FOXP3的表达下降(P<0.05),提示吸烟可以导致Th17/Treg细胞比例增加。与对照组、CS+COPD-组相比,CS+COPD组肺组织内HMGB1、IL-17、IL-21及TGF-β的表达升高(P<0.05),FOXP3的表达下降(P<0.05),提示COPD中Th17/Treg细胞比例增加。见图2,表3。

图 2 免疫组化检测各组肺组织中IL-17、IL-21、TGF-β、FOXP3和HMGB1的表达
表 3 肺组织中IL-17, IL-21, TGF-β, FOXP3和HMGB1的表达
2.3人外周血中IL-17、IL-21、IL-10、TGF-β和HMGB1的表达情况与无吸烟无COPD组相比,有吸烟无COPD组IL-17、IL-21、TGF-β和HMGB1的表达升高(P<0.05),而IL-10的表达降低(P<0.05)。与无吸烟无COPD组和有吸烟无COPD组相比,AECOPD组中IL-17、IL-21、TGF-β和HMGB1的表达升高(P<0.05),而IL-10的表达降低(P<0.05)。与SCOPD组相比,AECOPD组IL-17、IL-21、TGF-β、IL-10和HMGB1的表达均升高(P<0.05)。上述结果提示吸烟可以导致Th17/Treg细胞比例上调以及COPD患者中Th17/Treg细胞比例上调。见表4。
2.4AECOPD患者外周血中HMGB1与IL-17、IL-21、IL-10和TGF-β的相关性将AECOPD组外周血中HMGB1与IL-17、IL-21、IL-10和TGF-β进行相关性分析。结果显示,HMGB1与IL-17呈正相关(r=0.836,P=0.02),HMGB1与IL-21呈正相关(R=0.563,P=0.01),HMGB1与TGF-β呈正相关(R=0.585,P=0.01),HMGB1与IL-10呈负相关(R=-0.650,P=0.03)。上述结果表明HMGB1可能促进Th17/Treg细胞比例上调。
表 4 入组患者外周血中各因子的表达
3 讨 论
吸烟是COPD发病的关键因素,戒烟后COPD的慢性炎症仍持续存在,可能与T细胞介导的免疫应答和HMGB1增加有关,但具体机制仍不清楚。在免疫性疾病中Th17增加,Treg减少或功能障碍[12,13],可能使炎症反应持续发展,导致疾病进展。HMGB1通过诱导树突状细胞、单核细胞释放炎症因子调节Th17/Treg平衡,参与多种疾病的发病[14]。
本研究发现Th17相关的细胞因子IL-17和IL-21在吸烟者和COPD中表达增多,且COPD高于吸烟者,AECOPD高于SCOPD,提示吸烟可使Th17增加,Th17通过分泌IL-17、IL-21促进COPD的炎症反应,这种炎症反应在AECOPD中更明显。而Treg相关的细胞因子FOXP3和IL-10在吸烟者和COPD中表达减少,且COPD低于吸烟者,而TGF-β在吸烟者和COPD中表达增加,且COPD高于吸烟者,AECOPD高于SCOPD。同样地,Li等[15]发现在吸烟者和COPD患者中TGF-β表达增加。Jin等[16]发现AECOPD患者中TGF-β的表达较SCOPD患者和非吸烟者增高。其原因可能为:第一,TGF-β和IL-6是Th17和Treg重要的调节因子,在TGF-β与IL-6协同作用下诱导初始T细胞向Th17分化,当只有TGF-β时,则诱导初始T细胞向Treg分化[17]。吸烟者和COPD患者中IL-6表达增加,IL-6和TGF-β增加使初始T细胞向Th17分化,抑制初始T细胞向Treg分化,使Th17增多,Treg减少[18];第二,TGF-β不仅有抗炎作用,还有促进组织修复的作用,吸烟者及COPD患者存在支气管上皮细胞、肺上皮细胞等损伤,TGF-β增加有利于肺组织的损伤后修复;第三,在COPD中除Treg外,肺上皮细胞和肺巨噬细胞均可分泌TGF-β,使TGF-β增多。此外,FOXP3是鉴定Treg最可靠的指标,FOXP3的含量可以反应Treg的含量。由此可见,在吸烟者和COPD患者中Treg减少,提示吸烟可以使Treg及其细胞因子FOXP3、IL-10减少,从而可能使COPD的炎症反应不能有效地控制。上述结果提示COPD患者中Th17增多,Treg减少,吸烟可能导致Th17/Treg失衡,参与COPD的发生发展。
HMGB1被证实与多种免疫性疾病有关[19]。本研究发现在吸烟者和COPD中HMGB1的表达明显升高,提示CS能够诱导HMGB1增加。HMGB1可促使其他炎症因子释放,这些炎症因子又可进一步促使HMGB1释放[20,21],如此反复,HMGB1可能通过这种方式使COPD的炎症反应不断扩大。此外,COPD急性加重期HMGB1的表达较稳定期升高,表明HMGB1可能对COPD急性加重期的诊断有一定价值。
本研究将AECOPD患者外周血中HMGB1与IL-17、IL-21、IL-10和TGF-β进行相关性分析,发现HMGB1与IL-17、IL-21和TGF-β呈正相关,而与IL-10呈负相关,提示HMGB1可能促进Th17释放炎症因子,使Th17及其炎性因子IL-17、IL-21增加;HMGB1可能抑制Treg释放抑制性因子,使Treg及其细胞因子IL-10、FOXP3减少。可见,HMGB1可以导致Th17/Treg失衡,偏向于Th17介导的促炎反应,从而可能使COPD的炎症反应持续存在且不断放大。HMGB1通过调节Th17/Treg平衡参与多种疾病的发病[7-9]。在小鼠急性移植排斥反应模型中HMGB1可以诱导同种反应性T 细胞产生IL- 17[22]。在慢性乙型肝炎中HMGB1通过TLR4-IL-6 轴来调节Th17/Treg平衡[8]。在类风湿性关节炎中HMGB1通过TLR2通路促进Th17分化[7]。然而,在COPD中HMGB1调节Th17/Treg平衡的机制仍不清楚。
综上所述,本研究发现HMGB1和Th17/Treg失衡与COPD的发病机制有关,HMGB1可以使Th17/Treg平衡向Th17倾斜,促进炎症反应,从而参与COPD的发生发展,但其具体机制尚不明确。此外,阻断HMGB1信号能否控制Th17/Treg失衡,以减轻COPD的炎症反应,均有待进一步研究,以期为COPD患者的临床诊疗提供新靶点。
