NSCLC患者恶性胸水中H19下调miR-203对肺癌细胞侵袭能力的影响
2022-11-04刘帅妹杜雨轩程文亮葛晓军
刘帅妹,王 妹,杜雨轩,程文亮,李 洁,葛晓军
0 引 言
肺癌是最常见的恶性肿瘤之一,并且是世界上死亡率最高的癌症[1-4]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)占总体肺癌组织类型的80%~85%[5-6]。NSCLC的早期治疗主要以手术治疗为主,但早期无明显症状,大部分患者确诊时已是晚期,失去了手术治疗的最佳时机[7-8],此时,化疗成为了治疗NSCLC的主要手段,但部分患者对化疗的疗效并不佳[9-10]。随着靶向治疗的出现,NSCLC的治疗取得了一定的进展,患者的生存率及生存质量得到了提高[11-12],但是总体治愈率及生存率仍然很低,尤其在出现癌细胞转移的患者中。
据统计,15%肺癌患者在就诊初期患有恶性胸腔积液(malignantpleuraleffusion,MPE),多达50%的肺癌患者在疾病过程中发展为MPE[13]。MPE的癌症按频率高低依次为肺癌、乳腺癌、淋巴瘤、泌尿生殖道癌和胃肠道癌等[14]。临床上,MPE的预后较差,中位生存期为3到12个月,具体取决于肿瘤的组织学类型。NSCLC导致的MPE在临床上很常见,其伴有MPE中的癌细胞多为转移癌细胞,与原发灶来源的癌细胞相同且易于获取。
长非编码RNA(LncRNA)是一组长度大于200nt的RNA,位于细胞核或细胞质中[15]。虽然lncRNA不具有编码蛋白质的功能,但它的发现促进了非编码RNA领域的研究进展[16]。H19是一种受C-MYC调控的LncRNA[17]。在肺癌、乳腺癌、膀胱癌等中H19表达明显升高起促癌作用,而抑制H19的表达能限制肿瘤的进展[18-20]。Lv等[21]研究表明H19的表达可通过与miR-29b-3p结合介导BC膀胱癌细胞增殖、迁移,并促进上皮间质转化的发生;Yang等[22]表明H19的高表达抑制结肠癌细胞中miR-138的表达而促进HMGA1蛋白表达介导细胞发生迁移。H19的高表达抑制了miR-200a的功能,从而上调了miR-200a的靶基因ZEB1和ZEB2,从而增强了肺癌的增殖和转移[23]。本研究旨在探究NSCLC患者恶性胸水中H19的表达水平及其与miR-203的调控关系,以探究NSCLC致病的分子机制。
1 资料与方法
1.1 研究对象收集2019年6至2021年5月遵义医科大学第二附属医院检验科132例NSCLC胸水标本。平均年龄(59.8±14.2)岁,男78例,女54例。纳入标准:所有研究对象均无心、肝、肾等器官合并症及其他感染,无糖尿病、自身免疫相关性或免疫性疾病,3个月内未用过免疫抑制剂及激素等药物。排出标准:①合并严重基础疾病或器官功能不全者;②失访患者。恶性胸水诊断标准:通过体查及影像学检测确诊胸水,引流穿刺取胸水,行脱落细胞学和病理学检测见肿瘤细胞,免疫组化检测确定为癌细胞,并结合临床诊断为肿瘤。在样本采集时,所有患者均未接受任何抗结核、抗癌、皮质类固醇或其他非甾体抗炎药等药物的治疗,且患者在住院前3个月内没有接受过任何直接进入胸膜腔的侵入性手术或遭受胸部创伤。收集胸水标本放入冰箱中保存。本研究得到了遵义医科大学伦理委员会的批准(批准号:20200525),患者均签署知情同意书。
1.2主要试剂与仪器RPMI-1640、胎牛血清购自德国SigmaAldrich公司;普通光学显微镜购自日本Nikon Corporation公司;TRIzol试剂、玻璃特氟隆均质器、ABI 7500系统购自美国Invitrogen 公司;PCR引物购自深圳市华大基因科技服务有限公司;逆转录试剂盒购自武汉博斯特生物科技有限公司;CCK-8试剂购自武汉生物有限公司;酶标仪购自美国Bio-Rad公司;Matrigel Transwell室购自美国Corning Incorporated公司;免疫一抗和二抗购自英国Abcam公司;化学发光试剂盒购自美国Cell Signaling Technology公司;双荧光素酶报告基因检测试剂盒美国Promega Corporation公司。
1.3细胞培养
1.3.1 胸水中肿瘤细胞的培养收集NSCLC患者的胸水,1200 r/min离心5 min,离心半径为10 cm,吸取红细胞上层灰白色细胞于细胞培养瓶中,并加入含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的RPMI1640培养液,于37 ℃、5%CO2恒温培养箱中培养,每1~2天更换一次培养液,待细胞达到80%~90%融合时传代培养。用普通光学显微镜观察到细胞贴壁后使用PBS冲洗,去掉红细胞及其他悬浮细胞后进行培养。
1.3.2细胞纯化待所培养细胞状态稳定后收集细胞制成细胞悬液,用异硫氰酸标记的CD133抗体孵育,进行流式分选,将CD133阳性的细胞进行培养。
1.4方法
1.4.1 Western blot检测细胞内蛋白表达将纯化后的细胞培养至对数生长期,提取细胞RNA进行qRT-PCR检测细胞内H19及miR-203的表达,提取细胞蛋白通过Western blot检测细胞内CDH1、SNAL1和Vimentin蛋白表达。根据H19的相对表达水平,将患者分为H19高表达组(肿瘤/对照≥1.5)和H19低表达组(肿瘤/对照<1.5),健康供者为对照组。 根据miR-203的相对表达水平,将患者分为miR-203高表达组(肿瘤/对照≥2.0)和miR-203低表达组(肿瘤/对照≤2.0)。在萤光素酶检测分析中,健康供者为空白对照组,未加入miR-203激活剂和miR-203抑制剂为阴性对照组,加入miR-203激活剂为miR-203激活剂组,加入miR-203抑制剂为miR-203抑制剂组。在EMT标记蛋白的变化分析,未加入miR-203抑制剂和H19抑制剂为阴性组,加入miR-203抑制剂和H19抑制剂为miR-203抑制剂+H19抑制剂组,加入miR-203抑制剂为miR-203抑制剂组。
1.4.2CCK-8检测细胞增殖能力采用胰蛋白酶消化细胞后1200 r/min离心5 min,离心半径为10 cm,去上清,加入培养基将细胞稀释至2×103/孔接种于96孔板中,于37 ℃、5 % CO2培养箱孵育。在接种135 d后每种细胞选取3孔,加入CCK-8混合液(基础培养基:CCK-8溶液为10∶1)200 μL/孔,孵育3 h后,用全波长酶标仪检测450 nm波长处的吸光度值,绘制细胞生长曲线。
1.4.3Transwell检测细胞侵袭能力在冰浴下将Matrigel基质胶用基础培养基稀释至300~400 μg/mL,在transwell小室中加入100 μL/孔,于37 ℃培养箱抚育过夜。收集细胞,用基础培养基稀释至5×105个/mL后加入含基质胶的transwell小室上层每孔200 μL,下层加入500 μL含10%FBS培养基,37 ℃孵育24 h,用棉签擦去上室细胞,将小室浸泡于甲醇中固定30 min,风干后加入1%结晶紫染色20 min,用PBS清洗3遍,在400倍显微镜下随机拍摄10个视野并计数细胞。
1.4.4流式细胞术检测细胞周期及凋亡收集细胞,PBS清洗后弃上清,用1mL预冷PBS重悬细胞沉淀,缓慢加入至3 mL预冷的无水乙醇中,吹打混匀,4 ℃固定过夜。1200 r/min离心5 min,离心半径为10 cm,弃上清,加PBS静置15 min,弃上清,加入周期检测试剂,应用流式细胞仪检测样本荧光强度,检测细胞周期。收集细胞,PBS清洗后弃上清,进行细胞计数(1×105~1×106个)按说明书加入凋亡检测试剂染色后30 min内完成细胞凋亡检测。
1.4.5H19及miR-203表达调控通过转染miRNA下调细胞内H19的表达后,提取细胞RNA进行qRT-PCR检测细胞内H19及miR-203的表达,提取细胞蛋白通过Western-blot检测细胞内CDH1、SNAL1和Vimentin表达,通过CCK-8检测细胞增值能力,transwell检测细胞侵袭能力,流式细胞术检测细胞周期及凋亡。通过RNA高表达质粒的转染上调细胞内miR-203的表达,提取细胞RNA进行q-RT-PCR检测细胞内miR-203的表达,细胞提取细胞蛋白并检测CDH1、SNAL1和Vimentin的表达,检测细胞增殖能力、细胞侵袭能力、细胞周期及凋亡。通过构建野生型和突变型H19 3′-UTR结合序列的荧光素酶报告和分析TCGA(https://cancergenome.nih.gov/))的公开数据集,探讨H19与miR-203之间的关系。
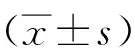
2 结 果
2.1 H19高表达对NSCLC细胞增殖及侵袭的影响与对照组(2.46±1.31)比较,H19高表达组在转染细胞的H19表达水平(13.36±4.18)明显升高(P<0.05);与对照组细胞增殖速度比较,H19高表达组在培养72 h后增殖明显加快。见图1。H19高表达组的细胞侵袭能力(45.76±11.86)较对照组(13.90±5.76)明显增强(P<0.05)。见图2。

与对照组比较,*P<0.05

a:对照组; b:H19低表达组; c:H19高表达组
2.2H19和EMT表达的相关性与对照组比较,H19高表达组细胞转移相关的间质细胞表面标记物N-cadherin及Vimentin蛋白的表达明显升高,而与黏附相关的上皮细胞表面标记物CDH1蛋白表达却降低,提示H19表达升高与肿瘤细胞EMT相关。见图3。
2.3H19和miR-203表达的相关性H19高表达组的生存时间[(59.22±20.97)个月]较H19低表达组[ (85.70±13.12)个月]明显缩短(P<0.05),即H19高表达与NSCLC的预后不良相关。见图4。而miR-203高表达组生存时间[(64.15±25.89)个月]较miR-203低表达组生存时间[(55.44±26.65)个月]明显延长(P<0.05)。见图5,表1。H19与miR-203的表达呈负相关(r=-0.66,P<0.01)。通过分析TCGA(https://cancergenome.nih.gov/))的公开数据集,证实H19和miR-203的表达呈负相关 (r=-0.13,P<0.05)。与H19低表达组比较,H19高表达组导致肺腺癌患者的累积生存率显著降低(P<0.05)。见图5。然而,与miR-203低表达组比较,miR-203高表达组肺腺癌患者的累积生存率显著提高(P<0.05)。见图5。因此,H19高表达可能通过抑制miR-203的表达直接或间接影响疾病的进程。

图 4 H19表达高低的总体生存率
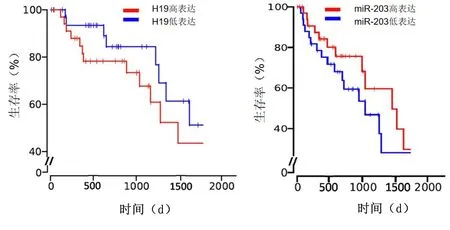
图 5 公共数据集TCGA进行H19及miR-203表达的生存分析
2.4H19高表达通过下调miR-203促进肿瘤细胞的EMT与H19突变型比较,H19野生型的荧光素酶活性受到miR-203 激活剂显著抑制(P<0.05);且miR-203抑制剂组较空白对照组能显著提高H19细胞的荧光素酶活性(P<0.05)。见表1。此外,与阴性组比较,miR-203抑制剂组能抑制上皮标志物CDH1的表达,并促进间质标志物SNAI1和Vimentin的表达(P<0.05),见表2。然而,与阴性组比较,miR-203抑制剂+H19抑制剂组能促进上皮标志物CDH1的表达,且抑制间质标志物SNAI1和Vimentin的表达(P<0.05),见表2,图6。因此,H19高表达可通过下调miR-203促进肿瘤细胞的EMT。
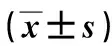
表 1 萤光素酶检测miR-203与H19直接结合作用分析
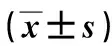
表 2 miR-203或H19调控后细胞中EMT标记蛋白的变化分析

1: 阴性组; 2: miR-203 抑制剂+H19 抑制剂组; 3:miR-203抑制剂组
3 讨 论
世界卫生组织2018年公布的肿瘤发病及死亡情况表明,每年全球新增肺癌患者约209.4万例, 死亡约176.1万例, 分别占全部恶性肿瘤的11.6%和18.4%[24]。目前,肺癌的发病年龄逐渐趋于年轻化,且随着年龄增长和环境污染等因素日趋严重,肺癌的发病率呈现逐渐增高的趋势[25]。NSCLC的发病率占肺癌发病率的 80%[26]。NSCLC是目前全世界范围内发病率与致死率均居前列的恶性肿瘤[27]。NSCLC进展速度较快,大多数患者确诊时已是中晚期,失去了手术治疗的机会。化疗药物的出现很大程度上的改善了患者生存期,然而,经过一段时间的治疗后绝大多数NSCLC患者出现了耐药现象和复发现象,使化疗效果大打折扣,缩短了患者的生存期[28-29]。目前根本性的治疗NSCLC原发灶存在重大困难,因此,从MPE中寻找新型的靶向特异性分子以降低肺癌细胞的侵袭能力可能成为NSCLC治疗的新方向。
近年来,LncRNA在肿瘤的发生发展及耐药中的作用是现在的研究热点[30]。LncRNA不仅在细胞中充当中间载体的辅助性角色,而且承担着调控功能,如X染色体沉默、基因组印记、染色质修饰、转录途径的激活和干扰、核内运输等多种重要的调控过程[31]。H19是一种在肿瘤中差异表达的长非编码RNA[32]。有体外研究发现H19的高表达促进了肿瘤的增殖,增加了肿瘤细胞的迁移和侵袭,降低了对化疗的敏感性,表明H19在肿瘤的发生和癌症的发展中起着重要的作用[33],分析结果与上述结果一致,即H19高表达可导致NSCLC细胞的增殖及侵袭增强相符合,原因是因为H19可通过激活多条下游通路,导致肿瘤的发生、发展及免疫逃逸[34]。同时其也在是预后不良及疗效较差通路的交汇中心发挥重要作用。本研究通过对总体生存分析发现,H19的高表达与NSCLC患者预后不良有关,提示H19作为NSCLC预后生物标志物具有潜在的应用价值。
研究表明,在各种癌症中,lncRNA H19通过作为miRNAs的海绵来介导EMT[35-38]。最近有报道,miR-203在EMT核心网络中发挥重要作用,该核心网络在肿瘤进展过程中作为控制上皮细胞可塑性的开关而发挥作用[39]。已有报道,H19通过miR-484及ROCK2途径导致肺癌细胞侵袭及迁移能力增强,并诱导了上皮间质转化的发生[40]。正如本研究结果示:上皮标志物CDH1表达降低同时伴随间充质标志物SNAI1和Vimentin表达增加以及H19表达增强都提示EMT在促进细胞侵袭中起中介作用。由于上皮间质转化(epithelial mesenchymal transition, EMT)在肿瘤的转移及耐药中的作用已经得到越来越多的认可[41],表现为上皮基因表达降低,间质细胞基因表达升高,导致肿瘤细胞表型发生了改变,如细胞形态改变、粘附力丧失及干细胞样特征[42]。EMT还参与了细胞的其他病理过程,包括肿瘤的转移及耐药。
既往的研究表明,发现miR-203表达降低与转移性肿瘤有关[43]。而且,miR-203在各种癌细胞系中的高表达导致EMT过程的抑制,如细胞增殖、迁移、侵袭和肿瘤转移[44]。这本研究结果一致,即H19负调控miR-203,H19可减弱miR-203诱导的EMT过程,EMT标记蛋白Vimentin、SNAI1表达增加,上皮标记蛋白CD1表达降低。通过抑制H19的表达降低肿瘤的增殖、侵袭及增加miR-203的表达,使肿瘤细胞凋亡增多。由于miR-203在肿瘤的发生发展中起负调控作用,即miR-203在大部分肿瘤患者中表达降低,且miR-203高表达后肿瘤细胞趋于凋亡[45];另有研究表明miR-203通过下调RGS17抑制NSCLC的细胞增殖、侵袭和迁移[33]。通过调控H19的高表达会使细胞内miR-203表达降低及间质细胞表面抗原的表达升高,说明H19的高表达通过负向调控miR-203基因从而使肿瘤产生上皮间质转化介导肿瘤转移。
综上所述,H19高表达可诱导肺癌细胞发生EMT,促进肺癌细胞的侵袭。miR-203与H19在EMT过程中的直接结合效应表明,H19介导的EMT改变中可能是一个潜在的调控网络。因此,H19有望成为NSCLC的治疗靶点,对指导临床用药具有潜在的应用价值。
