Hsa_circ_0000128通过miR-623/EIF4A1轴促进人胃腺癌细胞增殖和迁移的机制研究
2022-11-04王亚东曹碧月高生宝王雪君步雪峰
王亚东,曹碧月,高生宝,王雪君,步雪峰
0 引 言
胃癌在世界常见肿瘤中发病率居第四位,是癌症相关死亡的第三大原因,仅次于肺癌和肝癌[1]。胃癌分为早期胃癌和晚期胃癌,肿瘤的分期决定了治疗效果和治疗决策,如早期胃癌患者行根治性手术,后期同时进行化疗治疗,术后5年生存率为90%,因此,胃癌的治疗效果是可以接受的[2]。但是,如目前常用的癌胚抗原、CA199等肿瘤标记物,在胃癌早期诊断中阳性率较低,因此,需要发现一种更有效的早期胃癌诊断标志物[3]。环状RNA(CircRNAs)是一种特殊非编码RNA,广泛存在于生物体内[4-5]。不仅与人类许多疾病密切相关,且具有潜在的癌症诊断与生物治疗价值[6]。其本身为闭合环状结构,可不受外切酶影响,遂在细胞内更加稳定[7]。
MicroRNA(miRNAs)是一种小型非编码RNA,可通过抑制信使RNA(mRNA)翻译或促进mRNA降解在逆转后水平上调控基因表达,正确调控miRNA的表达是维持平衡生理环境的必要条件,这些小分子几乎影响细胞周期检查点、细胞增殖到细胞凋亡的所有遗传途径,其靶基因范围广泛,干预着疾病的发生发展[8-10]。
本研究筛选出环状hsa_circ_0000128暂未有相关研究,该研究探讨hsa_circ_0000128在胃癌组织、细胞株中的表达及其对胃癌细胞增殖、迁移及凋亡的机制。探讨作为早期诊断标志物及可能作为治疗的分子靶点的可能性。
1 材料与方法
1.1 材料来源
1.1.1 标本来源选取2019年11月至2020年8月至江苏大学附属人民医院病理科的40份胃腺癌及癌旁组织标本。术前均未接受任何放、化疗。其中取距离胃癌组织外缘5 cm的组织作为癌旁组织。病理科收取组织后液氮罐中运输至实验室-80 ℃冰箱,已备进一步使用。本研究经过江苏大学附属人民医院伦理委员会批准(批准号:K-20200058-Y),患者均签署知情同意书。
1.1.2材料高通量测序(上海欧易生物医学技术有限公司);人胃癌细胞MGC-803、BGC-823、HGC-27(中国科学院上海生科院细胞资源中心);正常人胃黏膜上皮细胞株GES-1(南京凯基生物科技发展有限公司);胎牛血清(BI公司);RPMI 1640、DMEM培养基(BI公司);Trizol试剂(Ambion life technologies);小干扰RNA(si-RNA,苏州吉玛基因股份有限公司)、miR干预试剂(上海生工生物有限公司);PCR引物(苏州吉玛基因股份有限公司);逆转录试剂盒、荧光定量PCR试剂盒(TaKaRa公司);Lipofectamine 2000 Transfection Reagent (南京厚载生物科技有限公司);过表达质粒、hsa_circ_0000128-WT、hsa_circ_0000128-Mut与mimics/miR-NC(湖州河马生物科技有限公司);BCA蛋白定量试剂盒(南京福麦斯生物技术有限公司);兔抗Bcl-2、EIF4A1(杭州华安生物技术有限公司);兔抗 cleaved-caspase-3(CST公司);兔抗Bax(武汉博士德生物工程有限公司)。
1.2方法
1.2.1 环状RNA及miR-623的筛选收集5对胃腺癌组织及癌旁组织(距离肿瘤>10 cm),上海欧易生物公司,通过第二代测序技术检测全基因组序列,使用DE-Seq软件对样本检测结果经行处理,进行差异显著性分析。挑选出表达差异的环状RNA hsa_circ_0000128,通过数据库筛选出下游miR-623。
1.2.2细胞培养用含10%胎牛血清的RPMI 1640、DMEM于饱和湿度的培养箱中分别培养胃癌细胞BGC-823、HGC-27以及MGC-803,培养条件为37 ℃,5%CO2。
1.2.3RNA的提取及对hsa_circ_0000128、miR_623、EIF4A1相对表达量的检测采用Trizol试剂提取胃癌及癌旁组织、胃癌细胞株、干预后胃癌细胞株及正常胃黏膜上皮细胞中总RNA.使用Nanodrop2000微量分光光度计检测总RNA 浓度及纯度。按照TAKARI逆转录试剂盒加样步骤将RNA逆转录为cDNA,后按照试剂盒说明书配置20 μL PCR反应体系,反应体系配置方法为:10 μL SYBR Premix Ex Taq Ⅱ,环状RNA上、下引物各0.4 μL,8.2 μL DEPC水以及1 μL cDNA。RT-PCR实验程序为:95 ℃预变性30 s,95 ℃ 5 s,62 ℃退火 30 s,40次循环,独立样本均设置3个复孔。在CFX96荧光定量PCR仪中进行RT-PCR反应,以2-ΔΔCt法反映hsa_circ_0000128、miR-623、EIF4A1的相对表达水平。Hsa_circ_0000128上游引物:5′-TCAGACACGACTTATCACCCAG-3′,下游引物:5′-GCAGATGGCACAAGCAAAG -3′,内参GAPDH上游引物:5′-CCCACTTCTCTCTAAGGAGAAT-3′下游引物:5′-TACACGAAAGCAATGCTATCAC-3′。miR_623上游引物:5′-GCCGAGTGGGTTGTCGGGGACG -3′,下游引物:5′-CAGTGCGTGTCGTGGAGT -3′,U6上游引物:5′-CTCGCTTCGGCAGCACATATACT -3′,下游引物:5′-ACGCTTCACGAATTTGCGTGTC -3′,EIF4A1上游引物:5′-CATCCAGCAGCGAGCCATTCTAC -3′,下游引物:5′-ACCAACCAGATGCCACTCTACCC -3′。根据RT-PCR在胃癌细胞株及胃上皮粘膜细胞中的结果选取表达量最多及最少的细胞系继续后续实验。
1.2.4细胞转染将HGC-27、MGC-803细胞株分别接种于两块细胞培养板中,培养板中设置相应的circRNA组别:Si-NC组(Si-NC转染胃腺癌细胞)、Si-circ组(si-hsa_circ_0000128转染胃腺癌细胞)、Si-EIF4A1组(Si-EIF4A1转染胃腺癌细胞)、miR-NC组(miR-623-NC转染胃腺癌细胞)、miR-mimics 组(miR-623-mimics转染胃腺癌细胞)、miR-inh组(miR-623-inhibitors转染胃腺癌细胞)、Si-circ +miR-NC组(Si-circ、miR-NC转染胃腺癌细胞)、Si-circ +miR-inh组(Si-circ、miR-inh转染胃腺癌细胞)。每孔接种细胞5×105个,温箱培养12 h后待细胞贴壁。将按比例配置完全的干扰试剂通过LipofectamineTM 2000转染于相对于的细胞孔中,更换无血清1640培养基培养4~6 h后重新换至10%FBS 1640培养液培养48 h后,提取相对应的RNA并进行RT-PCR验证其转染效率,转染48 h后提取蛋白并进行目的蛋白的蛋白印迹实验验证其表达水平。同期进行相对应的细胞功能学实验。
1.2.5细胞功能学实验①克隆形成实验:将转染相对应干扰的MGC-803、HGC-27细胞分别接种在6孔板中(500个/孔),每组设置3个复孔,于37 ℃培养箱中培养10~14 d,每3~5 d换液一次,经常观察,待平板中出现肉眼可观察到的克隆团时终止培养,去除上清,使用磷酸盐缓冲液(PBS)清洗3次,加入4%甲醛溶液后置于4 ℃冰箱内固定细胞15 min,再次使用PBS清洗3次,加入结晶紫溶液(1 mL/孔)染色,时长20 min,使用PBS清洗染色剂,空气干燥。计数细胞的克隆数,公式如下:
克隆形成率(%)=(克隆数/接种细胞总数)×100%
②TRANSWELL实验:将转染完成后的MGC-803、HGC-27贴壁细胞消化离心后置于无血清培养基中,于24孔板中加入600 μL 10%BI血清的培养液,后放置TRANSWELL小室,加入细胞数为1×104个的细胞悬液,于37 ℃、5%CO2温箱中培养24 h后,弃置培养液,使用PBS清洗两次,后4%甲醛溶液固定30 min,适当风干,后0.1%结晶紫溶液染色20 min,棉签擦去上室中未迁移的细胞,再次使用PBS清洗3次,显微镜随机挑选六个视野观察,计数。
1.2.6检测EIF4A1基因在胃癌中的表达及干预胃癌细胞株后相应的表达取干预后的MGC-803、HGC-27细胞,按1.2.2提取细胞RNA,后同前RT-qPCR验证。
1.2.7蛋白印迹实验检测胃癌细胞株中相关凋亡蛋白及EIF4A1蛋白表达水平取干预后胃癌细胞MGC-803、HGC-27,在6孔板中加入每孔1 mL/孔配置完全的RIPA裂解液,冰上裂解15 min后,使用蛋白刮沿板孔壁反复刮取完全,后吸入1mL EP管中,100 ℃水浴锅加热5 min,煮沸完全后4000 rcf/min,离心5 min,取上清,按照BCA蛋白定量测定试剂盒操作步骤测定蛋白浓度,后按3∶1比例加入配置均匀的4×上样缓冲液。
配置10% SDS-PAGE凝胶,80 V 电泳30 min,110 V电泳60 min,将蛋白按mark标识分子量大小切胶分离,350 mA转膜110 min。观察PVDF膜上是否存在mark条带,存在则使用牛血清白蛋白常温封闭条带1.5 h,配置相关一抗按1∶1000稀释后分别予条带敷兔抗cleaved-caspase-3,Bcl-2, Bax,EIF4A1,兔多抗β-actin及GAPDH,4 ℃冰箱敷于育过夜,次日TBST洗膜3次,每次15 min,洁净滤纸吸出残留TBST后敷二抗,再次使用TBST洗膜3次,每次10分钟。使用增强型化学发光试剂(ECL)显影。Image J对蛋白条带吸光度进行定量分析。
1.2.8荧光素酶验证结合位点通过数据库筛选出下游miR-623,通过荧光素酶实验验证结合位点。在24孔板内培养胃癌细胞,将hsa_circ_0000128-WT、hsa_circ_0000128-Mut与mimics/miR-NC转染至HGC-27和MGC-803细胞中,温箱培养24 h。培养基弃置,PBS缓慢洗涤2次,每孔中加入100 μL的1×Passive Lysis Buffer(由5×Passive Lysis Buffer加双蒸水稀释得到),摇床震荡30 min。吸取裂解产物,15 000 rfc/min,离心10 min,取20 μL上清至标记好的离心管,荧光素酶检测仪检测荧光值。
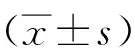
2 结 果
2.1 hsa_circ_0000128的筛选使用五组胃腺癌组织、癌旁组织进行高通量测序,筛选出相对表达量相对较大且尚未被研究的环状RNA:hsa_circ_0000128,见图1。
图 1 高通量测序结果
2.2胃腺癌组织及胃癌细胞株中has_circ_0000128、miR-623的表达通过高通量测序筛选出环状RNA(hsa_circ_0000128),在胃腺癌组织和正常组织中的相对表达量。40例胃癌组织中hsa_circ_0000128的相对表达量显著高于正常组织(P<0.05)。hsa_circ_0000128在3种胃癌细胞MGC-803、HGC-27以及BGC-823中的相对表达量均高于正常人胃黏膜上皮细胞GES-1(P<0.05)。通过数据库分析预测circRNA下游具有表达差异的miRNA为miR-623,通过样本PCR验证miR-623在40例胃癌组织中含量均小于癌旁组织(P<0.05),在胃癌细胞株中含量均低于正常胃正常粘膜上皮细胞(P<0.05)。结果所示在HGC-27与MGC-803中差异最明显,后续挑选此两种细胞株进行实验研究。见图2。

与GES-1比较,*P<0.05;与癌旁组织比较,#P<0.05
2.3hsa_circ_0000128的敲减效率及miR-623对应表达情况胃癌细胞转染相应的si-circ-000128及si-NC 48h后,RT-qPCR法检测胃癌细胞HGC-27、MGC-803中hsa_circ_0000128的表达水平,SI-circ组的相对表达量明显低于SI-NC组(P<0.05)。转染si-circ-0000128后miR-623的含量明显升高,加入miRNA inhibitor后,SI-circ+miR-inh组较SI-circ+miR-NC组miR-623含量下降(P<0.05)。结果说明通过si-circ-0000128可明显降低hsa_circ_0000128在在胃癌中的相对表达量,hsa_circ_0000128可作为miR-623的海绵,影响其表达。见图3。

*P<0.05
2.4敲减hsa_circ_0000128对细胞凋亡的影响取干预后的胃癌细胞株提取对应蛋白进行Western-blot实验结果显示,SI-circ组Cleaved-caspase-3、Bax相对表达量较SI-NC组增加(P<0.05);SI-circ组Bcl-2相对表达量较SI-NC组下降(P<0.05),见图4,表1。miR-623 inhibitor加入减缓了凋亡蛋白的表达,间接说明促进了细胞的凋亡,见图5,表2。

1、2:分别为HGC-27细胞Si-NC组、Si-circ组; 3、4:分别为MGC-803细胞Si-NC组、Si-circ组

1、2:分别为HGC-27细胞SI-circ+miR-NC组、Si-circ+miR-inh组; 3、4:分别为MGC-803细胞SI-circ+miR-NC组、Si-circ+miR-inh组
表 1 敲减环状RNA后细胞中凋亡蛋白表达情况
表 2 敲减环状RNA加入miRNA抑制剂后细胞中凋亡蛋白表达情况
2.5敲减hsa_circ_0000128对细胞增殖的影响转染相对应干扰48 h后,克隆形成实验显示,HGC-27和MGC-803中Si-circ组的克隆形成率[(11.57±1.724)%、(12.47±2.401)%]明显低于Si-NC组[(32.53±3.250)%、(25.07±1.557)%]。加入miR-623 inhibitor后可逆转抑制现象,SI-circ+miR-NC组克隆形成率为[(10.43±1.305)%、(12.50±1.400)%]明显低于Si-circ+miR-inh组[(25.03±1.665)%、(19.63±1.955)%],差异具有统计学意义(P<0.01)。说明低表达的hsa_circ_0000128可抑制细胞增殖,敲低miR-623可挽救circRNA被敲减的情况进而增加细胞功能。
2.6敲减hsa_circ_0000128对细胞迁移的影响通过Transwell实验表明,SI-circ组较SI-NC组迁移明显降低(P<0.05)。miRNA inhibitor干预后可减轻影响,说明转染si-circ-0000128可明显降低胃癌细胞株的迁移能力,敲低miR-623可减轻相应表现。见图6,表3。

图 6 敲减环状RNA hsa_circ_0000128将降低胃癌细胞迁移能力
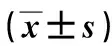
表 3 不同干预组的胃癌细胞迁移数据比较
2.7荧光素酶结合靶点验证将hsa_circ_0000128-WT荧光素酶报告质粒转染到miRNA的mimics中,与miR-NC相比,可显著降低相对荧光素酶活性。Hsa_circ_000128-WT可以抑制miR-623荧光素酶活性,而突变型hsa_circ_0000128-Mut则对miR-623荧光素酶活性无明显影响,差异具有统计学意义(P<0.05),见图7,表4。

图 7 hsa_circ_0000128与miR-623靶点预测
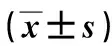
表 4 荧光素酶验证靶点验证hsa_circ_0000128与miR-623关系
2.8hsa_circ_0000128通过miR-623靶向调节EIF4A1的表达通过Targetscan等数据库预测简单miR-623下游靶基因EIF4A1,见图8。通过PCR验证EIF4A1在40对胃癌组织(7.627±2.146)及胃癌细胞株HGC-27、MGC-803(2.757±0.211、1.967±0.130)表达较癌旁组织(5.343±1.507)、正常胃黏膜上皮细胞GES-1(1.020±0.125)中呈高表达,差异具有统计学意义(P<0.01)。miR-623含量的增多会抑制EIF4A1的表达,见表5。使用蛋白免疫印迹实验显示当敲减hsa_circ_0000128时,EIF4A1的含量下降,当加入miR-623 inhibitor逆转敲减circRNA情况时,EIF4A1的表达含量上升(P<0.01),见图9。综上,hsa_circ_0000128通过竞争性结合miR-623促进胃腺癌细胞中EIF4A1的表达。
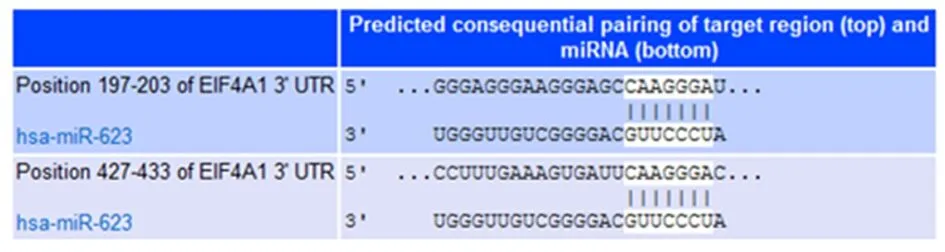
图 8 miR-623与EIF4A1预测位点
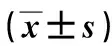
表 5 胃癌细胞中miR-623含量对EIF4A1表达的影响

*P<0.05
3 讨 论
尽管在胃癌相关研究方面有许多重大的进展,胃癌的发病已经下降,尤其在发达国家,但胃癌仍是世界上最普遍的癌症之一[11]。胃癌具有起病隐匿、早期易漏诊、易转移等特点[12]。为了改善胃癌治疗的预后,迫切需要敏感、较特异的分子标志物及相关治疗靶点,以获得更好的诊疗效果[13]。circRNA是一种新的非编码RNA,以往的众多研究发现,circRNA在众多癌症当中发挥相关作用,但其生物学机制仍不清楚,如hsa_circ_0000096与胃癌细胞增殖、迁移相关[14-15]。不同的circRNA在不同的肿瘤中含量也不同,通过过表达或者敲减相关circRNA导致不同肿瘤的生物学特性发生改变,从而影响其发生增殖、凋亡等不同变化,如hsa_circ_0001649 在胃癌细胞中表达下调,与胃癌病理分化程度显著相关[16-18]。本实验通过对5组胃癌标本及其相对应癌旁组织进行高通量测序,筛选出中高表达的hsa_circ_0000128进行研究。通过预实验也可证实hsa_circ_0000128在胃癌组织及相关胃癌细胞株中高表达。由此表明环状RNA hsa_circ_0000128在胃癌中可能发挥的是原癌基因的作用。
Zhang等[19]发现环状RNA CircNRIP1在胃癌中上调AKT1蛋白从而增强胃癌细胞增殖的能力,通过siRNA敲减CicrRNA后,导致胃癌细胞株的增殖、迁移及侵袭能力下降。Xie等[20]发现外泌体中环状RNA CircSHKBP1通过影响热休克蛋白HSP90从而影响胃癌细胞的生物学特性。本研究使用小干扰RNA干扰环状RNA hsa_circ_0000128使其含量变化从而影响胃癌细胞株HGC-27、MGC-803的生物学特性的变化。下调环状RNA后可明显观察到胃癌细胞的增殖、迁移、侵袭等能力下降,同时促进细胞的凋亡。由此可见,hsa_circ_0000128可能成为胃癌的诊断及治疗新的靶点,但其机制需进一步研究。
近年来,多数研究证明了circRNA与miRNA存在竞争性抑制关系,circRNA可以充当miRNA海绵的作用[21]。Shi等[22]发现环状RNA LPAR3海绵miRNA-198促进食管癌侵袭和转移。Shang等[23]发现外泌体中circPACRGL通过miR-142-3p/miR-506-3p-TGF-β1轴促进结直肠癌进展。本实验预测hsa_circ_0000128可能影响miRNA的靶点及其相对应的蛋白EIF4A1。
EIF4A1为真核翻译起始因子4A1,EIF4A1基因在胃癌细胞株中明显高表达于正常胃上皮细胞,调控细胞的生长,在胃癌中存在促瘤效应,EIF4A1的减少将导致胃癌细胞的凋亡[24]。结果发现敲减hsa_circ_0000128后胃癌细胞内EIF4A1含量也随之下降,导致凋亡相关蛋白BCL-2及Bax的含量改变,其可能是导致胃癌凋亡的关键因素。
因此,本研究说明hsa_circ_0000128的高表达可能促进胃癌细胞的增殖、迁移及侵袭,抑制细胞的凋亡。其通过竞争性抑制miR-623上调EIF4A1影响胃癌的发生发展,降低环状RNA的含量,胃癌细胞株HGC-27、MGC-803的细胞生物学效应也发生改变。本文尚可加大研究患者样本数量,分类研究,同时还可以检测术前、术后、及术后随访患者血清中环状RNA的变化,完善hsa_circ_0000128在胃癌发生发展中所起到调控的作用,发掘其成为新的胃癌诊疗标志物的潜力。
