钾离子掺杂提高锂离子电池正极锰酸锂性能的微观机制
2022-11-04王洋范广新刘培尹金佩刘宝忠朱林剑罗成果
王洋, 范广新, 刘培, 尹金佩, 刘宝忠, 朱林剑, 罗成果
钾离子掺杂提高锂离子电池正极锰酸锂性能的微观机制
王洋1,2, 范广新1,3, 刘培2, 尹金佩1, 刘宝忠2, 朱林剑3, 罗成果3
(1. 河南理工大学 材料科学与工程学院, 焦作 454000; 2. 河南理工大学 化学化工学院, 焦作 454000; 3. 焦作伴侣纳米材料工程有限公司, 焦作 454000)
改善尖晶石锰酸锂的大倍率性能是目前锂离子电池的重点研究方向之一。本研究用高温固相法合成掺K+的尖晶石锰酸锂, 研究K+提高锰酸锂倍率性能的微观机制。结果表明, 尽管随着电流密度增大, 电极的放电比容量下降, 但掺K+提高材料的大倍率性能效果显著, 如最佳掺K+量(物质的量分数)1.0%时, 在10(1=150 mA·g-1)下比容量提高了一倍, 远高于0.5下的1.9%。原因在于掺K+后, 首先, 锰酸锂的晶胞体积扩大, Li–O键变长, Li、Mn阳离子混排程度降低, 载流子(Mn3+)量增多; 其次, 电极极化和电荷迁移阻抗降低, 提高了材料的充放电可逆性、导电性及锂离子扩散能力; 再者, [Mn2]O4骨架更稳定, 减小了电化学过程中内应力变化, 抑制了晶体结构变化和颗粒破碎; 最后, 钾离子掺杂使制备过程中材料团聚, 从而减小电解液与电极的接触面积, 减轻电解液的侵蚀, 抑制锰的溶解。
锂离子电池; 正极材料; 钾离子掺杂; 微观机制; 倍率性能
随着锂离子电池在便携电子设备、电动工具、电动汽车等领域的应用日趋广泛, 人们对其倍率性能、输出能量、寿命、成本等提出了更高的要求[1-2]。在实际应用的锂离子电池正极材料中[3], 尖晶石锰酸锂(LMO)凭借输出能量高、安全性好、环境友好以及成本低等优势, 成为最有希望的正极材料之一[4-5]。然而, 现阶段仍需进一步提高该材料的倍率和循环性能[6]。
离子掺杂是改善上述性能的有效方式。F–可以提高LMO的比容量保持率(掺F–后40周循环比容量保持率提高了5.5%)[7]; S2–能够使LMO拥有更高的比容量(0.2下由107.2 mAh·g–1提高到 125.3 mAh·g–1)[8]; Al3+提高了LMO的倍率性能和高温循环稳定性(55 ℃、1倍率进行500周循环后比容量保持率由18.5%提高到81.5%)[9]; Zn2+提高了LMO的充放电效率(300周循环后充放电效率提高了16%)[10]; Na+提高了LMO的大倍率放电比容量(12倍率下正极比容量由82 mAh·g–1提高到 108 mAh·g–1)[11]。在常用的金属元素中, K与Li在元素周期表中属于同一主族, 具有与Li相近的物理化学性质, 兼具储量丰富、成本低的优点, 受到了研究者重视。
目前, 通过掺K+改善LiMn2O4的倍率性能已达成共识。Xiong等[12]在锰酸锂中掺K+, 提高了其在不同倍率下的比容量保持率(放电倍率从1增大到12, 比容量保持率由59.0%提升到80.6%)。Krystian Chudzik等[13]采用K、S离子共掺杂锰酸锂, 提高了其在大倍率下的放电比容量(20下由20 mAh·g–1提升到85 mAh·g–1)。性能改善的原因如下: 第一, K离子扩展了尖晶石的结构骨架, 扩大了锂的脱/嵌通道,提升了锂离子迁移率[12-13]; 第二, K离子可以参与正极的电子导电, 降低电池内阻, 提高材料的导电性[14]; 第三, K、S离子共掺的协同效应增强了锂离子的扩散能力[15]。然而, 掺杂的K离子如何影响尖晶石锰酸锂的微观结构(如: 对Li、Mn阳离子混排及Mn离子的价态影响), 不同倍率下K离子掺杂的锰酸锂在电化学过程中的结构、内应力如何变化及K离子对锰的溶解度的影响等有待进一步深入探讨。
为此, 本研究以KOH为钾源, 采用高温固相法对尖晶石锰酸锂进行K离子掺杂改性, 系统研究了K+影响其晶体结构、微观形貌以及倍率性能的机制。
1 实验方法
1.1 材料的制备
用高温固相法制备了K+掺杂的尖晶石锰酸锂。原料Li2CO3(阿拉丁试剂有限公司)、MnO2(山西同杰化学试剂有限公司)、KOH(山西同杰化学试剂有限公司)均为分析纯。按照摩尔比(Li2CO3) :(KOH) :(MnO2)=(1.1–) :: 2 (=0, 0.01, 0.02, 0.03)将原料混合均匀, 在空气气氛中, 在650 ℃保温5 h, 再升温至750 ℃保温15 h, 最后自然冷却至室温。将制备的样品分别标记为LKMO–(=0, 1, 2, 3)。
1.2 物理表征
采用X射线衍射仪(X-ray Diffraction (XRD), 日本理学SmartLab)分析材料的晶体结构, 测试条件: CuK辐射, 电压40 kV, 电流150 mA, 测试范围2=10°~80°, 测试速度5 (°)/min, 步长0.02°。使用搭配能谱仪(Energy Dispersive Spectrometer (EDS))的场发射扫描电子显微镜(Scanning Electron Microscopy (SEM), 德国蔡司Merlin Compact)观察材料的微观形貌和表面元素组成。使用氮吸附比表面积测试仪(Brunner-Emmett-Teller, BET, 北京贝士德3H-2000)和激光粒度仪(Particle Size Distribution, Dx, 英国马尔文3000)分析材料的比表面积和粒度分布。用电感耦合等离子体发射光谱仪(Inductively Coupled Plasma-Optical Emission Spectroscopy, ICP-OES, 德国斯派克Spectro ARCOS)和X射线光电子能谱仪(X-ray Photoelectron Spectroscopy, XPS, 美国赛默飞世尔K-Alpha)分析了材料组成元素的含量、结合能及价态。
1.3 电化学性能测试
将正极材料(Li1.1–xKMn2O4(0≤≤0.03))、导电剂(乙炔黑)、黏结剂(PVDF)按质量比8 : 1 : 1混合均匀作为溶质, 以-甲基吡咯烷酮(NMP)为溶剂, 制备电极浆液。将浆液涂覆在铝箔上, 在100 ℃真空干燥箱中干燥12 h, 制作正极片。在氩气气氛手套箱中, 将正极片、负极片(金属锂)、隔膜(美国Celgard2325)和电解液(1 mol·L–1LiPF6的碳酸乙烯酯/碳酸二乙酯(体积比1 : 1)溶液)组装成CR2016型纽扣电池。采用深圳NEWARE电池测试系统测试电池的充放电性能: 恒流恒压充电(截止电压4.3 V, 截止电流0.02 mA), 恒流放电(截止电压3.0 V)。采用武汉CorrTest CS350H电化学工作站进行循环伏安分析(Cyclic Voltammetry, CV, 扫描速率0.2~ 0.8 mV·s–1)与交流阻抗测试(Electrochemical Impedance Spectroscopy EIS, 频率范围0.05 Hz~100 kHz)。
2 结果与讨论
2.1 掺K+对LMO结构与形貌的影响
图1是掺K+前后样品的XRD图谱, 可以看到, 所有样品都具有相似的衍射图谱, 对应尖晶石锰酸锂晶相(PDF04-008-6541, 空间群: Fd-3m)。图谱中没有其他衍射峰, 说明掺杂少量K+没有引入新相。此外, 各样品的主要衍射峰(111)、(311)和(400)晶面都较为尖锐, 表明晶体生长完整[16]。为深入探究掺K+对LMO晶体结构的影响, 对XRD数据进行Rietveld精修, 结果列在表1中。精修时从无机晶体结构数据库(ICSD)中选择同为尖晶石晶型的LiMn2O4(ICSD1805220)为模型, 并修改原子组成(16 d位Mn3+和Mn4+的比例由1 : 1修改为1.1 : 0.9)以符合Li1.1Mn2O4。结果表明, 掺K+后所有样品的晶胞参数都有所增大。据文献[14-15]报道, 离子半径更大的K+(K+=0.133 nm,Li+=0.059 nm)进入Li+亚晶格后, 会使晶胞参数增大, 由此推测K+已经成功掺入晶格。同时, 掺K+可以增大晶体的晶面间距, 使锂离子扩散通道扩大, 并使Li–O键长增长, 导致Li–O键的结合能减弱, 有益于锂离子的脱/嵌过程。
在尖晶石结构中, (111)和(311)晶面的衍射峰强度比值((111)/(311))可代表阳离子的混排程度[17]。掺K+后(111)/(311)增大(表1), 说明K+可抑制尖晶石结构的阳离子混排, 这与掺K+后Mn占Li位(表1)的减小程度相一致。在尖晶石结构(Fd-3m空间群)中, Li+占据四面体8a位置, Mn3+/Mn4+占据八面体16d位置。八面体中空余的16c位与四面体8a位, 连通成了锂离子扩散的三维通道: 8a-16c-8a[17-18]。发生阳离子混排时, Li和Mn离子会互占彼此位置, 占据8a位的锰离子会妨碍锂离子的脱/嵌, 影响正极的充放电稳定性。综上可知, K+掺杂使尖晶石锰酸锂的晶胞增大、Li–O键增长、Li和Mn阳离子混排减少, 有助于锂离子在充放电过程中脱/嵌。
图2是(a, c)LKMO-0和(b, d)LKMO-1不同放大倍数的SEM照片。可以看出, K+掺杂前后样品都是由粒径约200 nm的一次粒子聚集成的不规则二次颗粒组成。然而, 与未掺杂样品相比, 掺K+材料(图2(d))的初级粒子有明显团聚, 有助于减小材料的比表面积(由BET测试证实, 表S1), 抑制电解液对电极的腐蚀, 提高材料的循环稳定性。此外, 根据能谱扫描(图2(e))结果, K元素在样品表面分布均匀, 证明高温固相法可实现K+均匀掺入Li1.1–xKMn2O4(0≤≤0.03)。

图1 LKMO-n的XRD图谱与元素组成
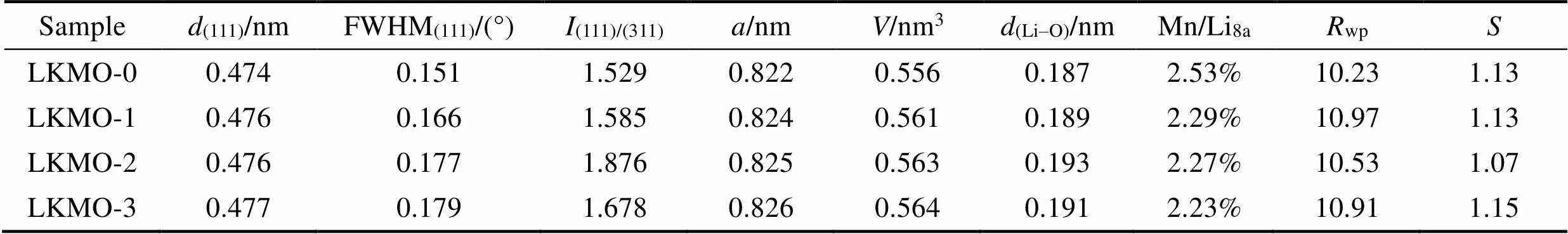
表1 LKMO-n的详细晶体结构参数
: Intensity of diffraction peak

图2 LKMO-0(a, c)和LKMO-1(b, d)的SEM照片, LKMO-1的EDS分布图(e) (方框区域)
通过XPS研究K在LMO中的存在形式及其对Mn价态的影响(如图3)发现, LKMO-1(图3(a))在结合能约为296.5和292.4 eV处检测到K2p信号, 证实K成功引入到晶格中, 并以K+的形式存在。在LKMO-0(图3(b))和LKMO-1(图3(c))中, Mn的化合价态都为+3和+4价, 说明引入K+不改变过渡金属的价态。而在掺K+后Mn3+/Mn4+所对应的峰面积比增大, 由=0的1.28增加至=0.01的1.36, 表明K+促使晶格中Mn3+的比例更高。在LMO中, Mn3+起到载流子的作用[13], Mn3+更多意味着导电性更强。
2.2 掺K+对LMO电化学性能的影响
图4是各个样品的倍率性能测试结果。所有材料的比容量都随着电流密度(1=150 mA·g–1)的增大而降低。然而, 掺适量的K+后, 样品的倍率性能有所改善(图4)(具体测试数据列于表S2、S3)。与LKMO-0相比较, 掺K+量=0.01时, 不同倍率下LKMO-1的放电比容量分别提升了1.9%(0.5)、7.5% (1)、20.4%(2)、69.2%(5)和102.8%(10), 表明适量的K+掺杂能够显著提高LMO的倍率性能, 尤其是高倍率条件下。而过量K+掺杂致使材料的倍率性能下降, 可能是由于过多的K+会形成细小的含K化合物(因超出XRD的精度范围并未被检出)妨碍Li+的迁移; 同时过量K+也会占据原来Li+的四面体8a位, 影响了晶胞中Li+沿通道(8a-16c-8a)的脱/嵌过程。
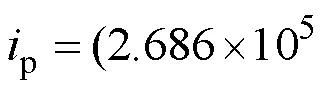
图6是LKMO-0和LKMO-1的交流阻抗(EIS)谱图和等效电路{R(CR)W}, 曲线均由中高频区的半圆和低频区的斜线组成,s代表电池欧姆电阻, 对应曲线与坐标轴的截距;ct是电荷迁移阻抗, 对应中高频区的半圆; 斜线为Warburg阻抗(w, 在拟合后的EIS中固定显示为45°的斜线), 反映了锂离子在正极材料中的迁移扩散能力[20]。由拟合结果(2)可知, 掺K+后样品的s基本不变, 但是LKMO-1在充放电前后的ct都比LKMO-0低, 这可归因于掺K+使正极中载流子(Mn3+)数量增多, 相应的可迁移电荷数增加, 导致ct降低, 进而导电性提高。

图3 LKMO-1的XPS全谱图(a), LKMO-0(b)和LKMO-1(c)的Mn2p XPS高分辨光谱图
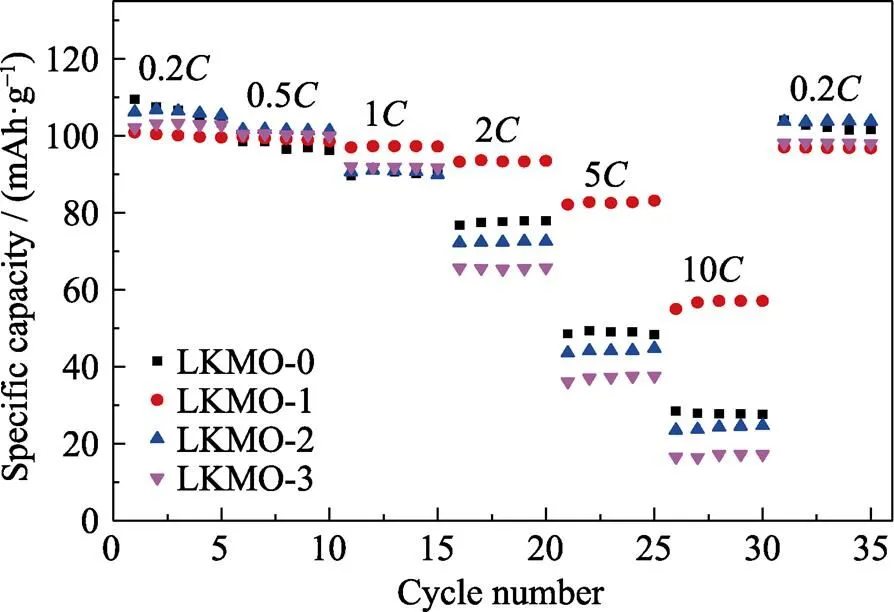
图4 LKMO-n的倍率性能
为进一步探究K+掺杂对正极材料锂离子扩散能力的影响, 运用公式(1)和(2)计算K+对LMO锂离子扩散系数(Li+)的影响[21-22]:


其中,是气体常数,是环境温度,是法拉第常数,是电极面积(0.308×10–4m2),是转移的电子数(LMO为1[14]),是Li+的物质的量浓度(由ICP-OES测试所得(表S4)),是Warburg因子,Ω是电池内阻, 由阻抗和角频率–1/2拟合所得(图S2)。计算结果列于表2, LKMO-1的Li明显高于LKMO-0, 与文献[15]报道一致。结合图5与图6可知, 适量的K+掺杂能够提高LMO的锂离子扩散能力, 这可归因于掺K+在增大晶胞体积, 扩大Li+扩散通道的同时, Li–O键增长、结合能减弱, 使Li+在晶格中的扩散阻力减小。且掺K+抑制了Li、Mn阳离子混排, 使得妨碍Li+脱/嵌的Mn离子数量减少, 这也是锂离子扩散能力提高的重要因素。
2.3 掺K+对LMO在不同倍率充放电过程中结构变化的影响
为了探究K+掺杂对电化学过程中晶体结构变化的影响, 在不同倍率(0.2、10)条件下对LKMO-0和LKMO-1电池进行5次充放电循环后, 测试掺杂前后放电态电极样品的XRD谱图, 如图7所示, 具体的结构信息见表3。可以看出, 两样品的XRD图谱仍对应尖晶石构型, 均没有出现新的衍射峰, 表明电化学反应未改变正极材料的晶型, 也没有生成新的物相。但结合表1和表3发现, 样品在经历充放电后, 晶体的晶胞体积与主要衍射峰的晶面间距都缩小, 表明随着锂离子从晶格中脱出, 两种正极的晶体结构都发生了不可逆改变, 致使部分锂离子无法再回嵌入原晶格中。然而, 放大(111)和(311)晶面的衍射峰(图7), 可以看到, 两种样品的结构变化并不相同。未掺杂样品经充放电测试后, 衍射峰的强度下降, 峰位明显向2高角度区偏移; 而掺K+样品衍射峰的强度与位置基本没有改变。这可能是由于K+钉扎在晶格中, 持续提供一个单位的正电荷,抑制部分Mn3+向Mn4+转变, 可以稳定[Mn2]O4骨架, 控制LMO在充放电过程中的结构变化, 起到增强其结构稳定性的作用, 进而提高循环性能。
电化学反应中, 锂离子的反复脱/嵌会产生内应力, 导致正极晶体结构逐渐被破坏[23]。该应力值与电荷状态密切相关, 在电流密度较大时, 电荷运动更快, 导致应力迅速增大, 同时使正极的容量快速衰减[23-24]。结合布拉格方程、谢乐公式以及威廉霍姆公式(公式3)计算这种电化学内应力(拟合曲线见图S3, 计算结果见表3)[25-26]:
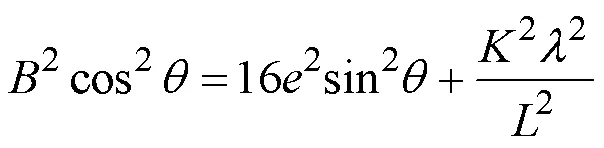
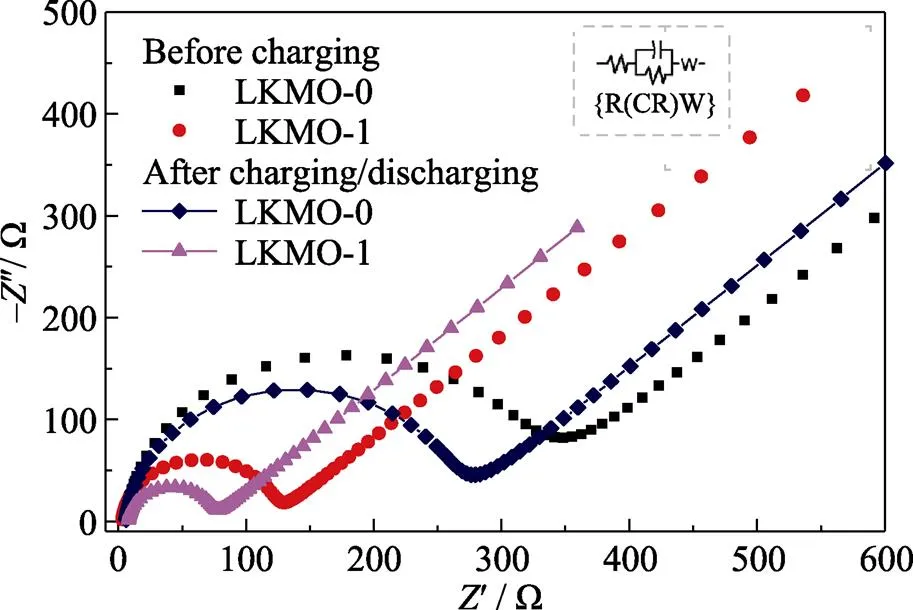
图6 LKMO-0和LKMO-1的EIS谱图

表2 LKMO-0和LKMO-1的EIS拟合结果和Li+扩散系数
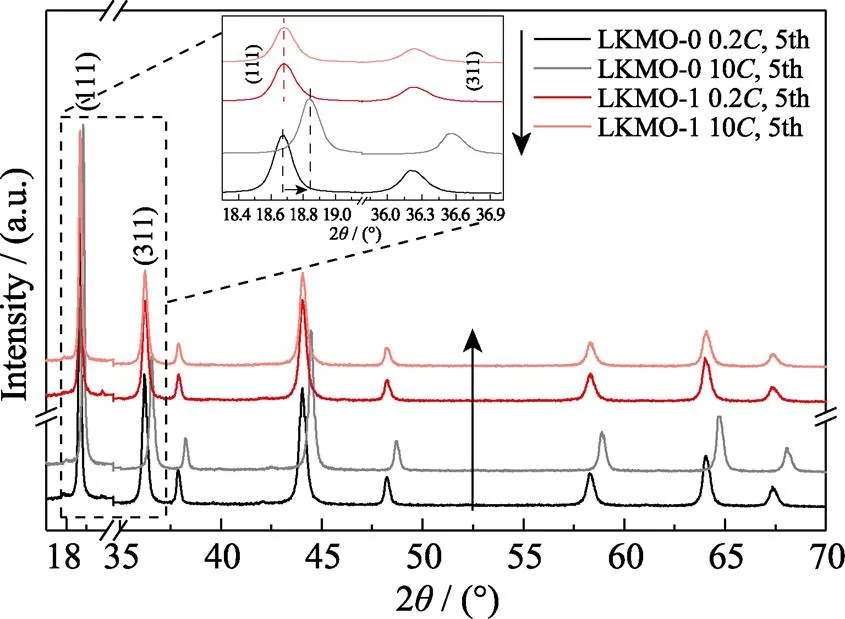
图7 LKMO-0和LKMO-1在0.2C和10C倍率下循环5周后的XRD图谱
其中, 16e表示局部应变(Strain),是晶粒尺寸,是谢乐常数(与微晶形状有关),是X射线波长,是经过标准硅式样校正后的半高宽。应变分量反映了内应力的变化, 随着它的增大或减小, 晶体相应地膨胀或者收缩[23]。根据计算结果, 原始样品的局部应变分量在充放电过程中持续变化。这种持续不断的晶体体积变化使材料的结构改变不可逆, 严重影响了充放电性能的稳定性。需要特别说明的是, 掺K+样品的应变分量在充放电后基本保持不变, 表明K+稳固了[Mn2]O4骨架, 抑制了大电流冲击下锰酸锂晶体的体积变化, 稳定了锂离子脱/嵌通道, 使LMO的锂离子扩散能力更好。
图8是经30次充放电循环后(从0.2到10分别循环5次)LKMO-0(a, c, d)和LKMO-1(b, e)在不同放大倍数下的SEM照片。与原始形貌相比(图2), 两种样品的颗粒形态都发生了改变, LKMO-0(图8(a, c, d))的变化尤为明显, 一次粒子破碎为直径约50 nm的小颗粒(图8(c, d))。而掺K+样品(图8(b, e))表面的初级粒子较为完整, 仍保持粒径约200 nm的块状。这是两方面的原因造成的:一是掺K+促使锰酸锂颗粒在形成过程中团聚(图2(b, d)), 减小了材料的比表面积(表S1); 二是掺K+缓解了内应力引起的锰酸锂晶体的体积变化(表3), 抑制了宏观粒子在充放电过程中的机械破碎[27]。电化学过程中由Mn3+歧化生成的Mn2+极易溶解于HF(由电解液分解产生)[28], 造成样品的表层Mn溶解。而掺K+可减小材料与电解液的接触面积, 有助于减轻电解液对材料的腐蚀, 抑制锰的溶解, 更进一步提高材料的循环稳定性。

图8 经30周循环后LKMO-0(a, c, d)和LKMO-1(b, e)的SEM照片

表3 LKMO-0和LKMO-1在0.2C和10C循环5周后的晶体结构参数
3 结论
1)通过高温固相法可以实现K+在尖晶石锰酸锂的均匀掺杂。适量地掺K+可提高材料的倍率性能, 在高倍率条件下尤其显著, 掺K+(物质的量分数) 1.0%的锰酸锂在10下放电比容量提高了一倍。
2)适量的K+掺杂可增大材料的晶胞体积, 增长Li–O键长, 降低晶格中Li、Mn阳离子的混排程度, 提高晶格中载流子(Mn3+)的含量, 降低电极极化, 减小电荷迁移阻抗, 增大锂离子扩散系数, 从而提升材料的充放电可逆性、高倍率的放电比容量及充放电效率。
3)掺K+能够抑制充放电过程中锰酸锂晶体的结构变化, 减轻电化学内应力造成的晶体破坏和宏观粒子破碎; 而且掺K+能促使制备的材料团聚, 减小材料的比表面积, 从而缓解电解液对电极的腐蚀, 抑制锰的溶解, 提高材料的循环稳定性。
本文相关补充材料可登陆https://doi.org/ 10.15541/jim20210757查看。
[1] DURMUS Y E, ZHANG H, BAAKES F,. Side by side battery technologies with lithium-ion based batteries.,2020, 10(24): 2000089.
[2] LI L L, LI S Y, LU Y Y. Suppression of dendritic lithium growth in lithium metal-based batteries.,2018, 54(50): 6648–6661.
[3] DING Y L, CANO Z P, YU A P,. Automotive Li-ion batteries: current status and future perspectives.,2019, 2(1): 1–28.
[4] MU C H, LOU S A, ALI R,. Carbon-decorated LiMn2O4nanorods with enhanced performance for supercapacitors.,2019, 805: 624–630.
[5] ZHU Z X, WANG M M, MENG Y H,. A high-rate lithium manganese oxide-hydrogen battery.,2020, 20(5): 3278–3283.
[6] LI S Y, ZHU K L, LIU J L,. Porous LiMn2O4microspheres with different pore size: preparation and application as cathode materials for lithium ion batteries., 2019, 16(1): 1–8.
[7] XIANG M W, ZHOU X Y, ZHANG Z F,. LiMn2O4prepared by liquid phase flameless combustion with F-Doped for lithium- ion battery cathode materials.,2013, 652–654: 825–830.
[8] JIANG Q Q, LIU D D, ZHANG H,. Plasma-assisted sulfur doping of LiMn2O4for high-performance lithium-ion batteries., 2015, 119(52): 28776–28782.
[9] LIU J T, LI G, YU Y,. Synthesis and electrochemical performance evaluations of polyhedra spinel LiAlMn2-xO4(≤0.20) cathode materials prepared by a solution combustion technique., 2017, 728: 1315–1328.
[10] CHANDA P, VIVEK BANSALA, SUKRITIA V S. Investigations of spinel LiZnMn2−xO4(≤0.03) cathode materials for a lithium ion battery application., 2018, 238–239(DEC): 93–99.
[11] XIONG L L, XU Y L, LEI P,. The electrochemical performance of sodium-ion-modified spinel LiMn2O4used for lithium-ion batteries., 2014, 18(3): 713–719.
[12] XIONG L L, XU Y L, XIAO X,. The effect of K-ion on the electrochemical performance of spinel LiMn2O4.,2015, 11(1): 138–142.
[13] CHUDZIK K, ŚWIĘTOSŁAWSKI M, BAKIERSKA M,. Electrochemical properties of K and S doped LiMn2O4studied by GITT and EIS., 2021, 373: 137901.
[14] CHUDZIK K, ŚWIĘTOSŁAWSKI M, BAKIERSKA M,. Surface modification and carbon coating effect on a high-performance K and S doped LiMn2O4.,2020, 531:147138.
[15] BAKIERSKA M, ŚWIĘTOSŁAWSKI M, CHUDZIK K,. Enhancing the lithium ion diffusivity in LiMn2O4−yScathode materials through potassium doping.,2018, 317(January): 190–193.
[16] RODRÍGUEZ R A, PÉREZ-CAPPE E L, LAFFITA Y M,. Structural defects in LiMn2O4induced by gamma radiation and its influence on the Jahn-Teller effect., 2018, 324(June): 77–86.
[17] YU Z M, ZHAO L C. Structure and electrochemical properties of LiMn2O4.,2007, 17(3): 659–664.
[18] MARCHINI F, CALVO E J, WILLIAMS F J. Effect of the electrode potential on the surface composition and crystal structure of LiMn2O4in aqueous solutions., 2018, 269: 706–713.
[19] ZHAO H Y, LI F, BAI X Z,. Enhanced cycling stability of LiCuMn1.95–xSi0.05O4cathode material obtained by solid-state method., 2018, 11(8): 1–10.
[20] RAGAVENDRAN K, CHOU H L, LU L,. Crystal habits of LiMn2O4and their influence on the electrochemical performance., 2011, 176(16): 1257–1263.
[21] WANG X Y, HAO H, LIU J L,. A novel method for preparation of macroposous lithium nickel manganese oxygen as cathode material for lithium ion batteries.,2011, 56(11): 4065–4069.
[22] CHEN S, CHEN Z, CAO C B. Mesoporous spinel LiMn2O4cathode material by a soft-templating route.,2016, 199: 51–58.
[23] ZHOU S, WANG G X, XIAO Y,. Influence of charge status on the stress safety properties of Li(Ni1/3Co1/3Mn1/3)O2cells.,2016, 6(68): 63378–63389.
[24] SETHURAMAN V A, VAN WINKLE N, ABRAHAM D P,. Real-time stress measurements in lithium-ion battery negative- electrodes.,2012, 206: 334–342.
[25] FAN G X, WEN Y, LIU B Z,. An insight into the influence of crystallite size on the performances of microsized spherical Li(Ni0.5Co0.2Mn0.3)O2cathode material composed of aggregated nanosized particles., 2018, 20(2): 43.
[26] KIZILTAŞ-YAVUZ N, HERKLOTZ M, HASHEM A M,. Synthesis, structural, magnetic and electrochemical properties of LiNi1/3Mn1/3Co1/3O2prepared by a Sol-Gel method using table sugar as chelating agent.,2013, 113: 313–321.
[27] GREELEY J, WARBURTON R E, CASTRO F C,. Oriented LiMn2O4particle fracture from delithiation-driven surface stress.,2020, 12(43): 49182–49191.
[28] THACKERAY M M. Exploiting the spinel structure for Li-ion battery applications: a tribute to John B. Goodenough.,2021, 11(2): 1–8.
Microscopic Mechanism of K+Doping on Performance of Lithium Manganese Cathode for Li-ion Battery
WANG Yang1,2, FAN Guangxin1,3, LIU Pei2, YIN Jinpei1, LIU Baozhong2, ZHU Linjian3, LUO Chengguo3
(1. School of Materials Science and Engineering, Henan Polytechnic University, Jiaozuo 454000, China; 2. College of Chemistryand Chemical Engineering, Henan Polytechnic University, Jiaozuo 454000, China; 3. Jiaozuo Banlv Nano Materials Engineering Co., Ltd, Jiaozuo 454000, China)
Improving the high rate performance of lithium manganese spinel is one of the key research directions of Li-ion battery. In this study, spinel Li1.1–xKMn2O4(0≤≤0.03) was synthesized by a high-temperature solid-state method. The results indicate that K+doping significantly improved the high rate performance of the cathode, while the discharge specific capacity of the electrode decreased with the current density increasing. With the optimum doping amount of 1.0% (molar fraction) K+, the discharge specific capacity of the cathode increased by 102.8% at 10(1=150 mA·g-1), much higher than that (1.9%) at 0.5. It can be attributed to the following points: K+doping can firstly expand the cell volume and the Li-O bond length, lower the cation mixing of Li/Mn, and increase the content of carriers (Mn3+) of the material. Secondly, K+doping can reduce the electrode polarization and charges transfer resistance, which develops the charge-discharge reversibility, electrical conductivity as well as the diffusion capability of the Li ions for the cathode. Thirdly, K+doping can stabilize the framework of [Mn2]O4, degrade the change of internal stress during the electrochemicalprocess, which inhibits the modification of the crystal structure and particle fragmentation. In addition, the existence of K+promotes the agglomeration of the material during the preparation process, which reduces the contact area between the electrolyte and cathode in cell, thereby alleviating the erosion of the electrolyte, as well as the Mn dissolution of the cathode.
lithium-ion battery; cathode material; K+doping; microscopic mechanism; rate performance
1000-324X(2022)09-1023-07
10.15541/jim20210757
TQ152
A
2021-12-10;
2022-02-13;
2022-02-21
国家自然科学基金(52071135, 51871090, U1804135, 51671080); 河南省科技创新人才计划(194200510019); 河南省教育委员会重点项目(19A150025)
National Natural Science Foundation of China (52071135, 51871090, U1804135, 51671080); Plan for Scientific Innovation Talent of Henan Province (194200510019); Key Project of Educational Commission of Henan Province (19A150025)
王洋(1997–), 男, 硕士研究生. E-mail: wangyang1857@126.com
WANG Yang (1997–), male, Master candidate. E-mail: wangyang1857@126.com
范广新, 副教授. E-mail: fangx@hpu.edu.cn
FAN Guangxin, associate professor. E-mail: fangx@hpu.edu.cn
