ω-3鱼油脂肪乳剂通过醛类应激激活Nrf2/HO-1信号通路减轻肺缺血再灌注损伤
2022-11-03张裕坚刘付丽董娇娇叶颖超林婷婷蔡瑶瑶
张裕坚,刘付丽,董娇娇,叶颖超,林婷婷,蔡瑶瑶,刘 乐
0 引言
肺缺血再灌注(Ischemia/reperfusion,I/R)损伤是一种急性无菌性肺部损伤,涉及机制复杂广泛[1-2],可形成炎症级联反应[3]、氧化应激[4-5]、内皮细胞屏障损伤[6]、细胞凋亡[7]等一系列病理生理过程,其中氧化应激起着关键作用。醛类物质是脂质过氧化的主要终产物,参与氧化应激,高剂量的醛类物质具有细胞毒性,但是低剂量的醛类物质对机体具有保护作用[8-9]。前期团队研究发现,ω-3鱼油脂肪乳剂(ω-3 fish oil fat emulsion,ω-3FOFE)预处理通过产生低剂量的醛类物质,刺激抗氧化酶的产生,从而减轻心肌I/R损伤[10]。目前尚未见醛类应激在肺I/R损伤中的研究,因此,本项目通过确定ω-3FOFE预处理产生醛类应激的时间,构建大鼠在体肺I/R模型,探讨ω-3FOFE对肺I/R的保护作用。
1 材料和方法
1.1 材料 健康成年SPF级雄性SD大鼠,体重300~350 g,由温州医科大学实验动物中心提供。原位TUNEL凋亡检测试剂盒(上海碧云天生物技术有限公司);丙二醛(Malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);还原型谷胱甘肽(Glutathione,GSH)试剂盒(南京建成生物工程研究所);兔抗大鼠多克隆Nrf2抗体 (美国Abcam公司),兔抗大鼠多克隆HO-1抗体(美国Santa Cruz公司),兔抗大鼠单克隆组蛋白H3抗体(美国Millipore公司),兔抗大鼠单克隆β-actin抗体(美国Abcam公司)。
1.2 方法
1.2.1 确定ω-3FOFE预处理产生醛类应激激活抗氧化信号通路时间 ω-3FOFE 注射液剂量参考团队前期报道(2 ml/kg)。选择24只 SD雄性大鼠,随机分成4组(n=6):NS5组(生理盐水注射液2 ml/kg尾静脉注射5 d)、FO5组(ω-3FOFE 注射液2 ml/kg尾静脉注射5 d)、FO3组(ω-3FOFE 注射液2 ml/kg尾静脉注射3 d)、FO1组(ω-3FOFE 注射液2 ml/kg尾静脉注射1 d)。于末次给药后24 h处死大鼠,取肺组织置于液氮保存。采用相应的试剂盒检测大鼠肺组织MDA和GSH含量;免疫印迹(Western blot,WB)法检测核因子-E2相关因子2(Nuclear factor-E2-related factor 2,Nrf2)和血红素氧合酶-1(Heme oxygenase -1,HO-1)蛋白来确定ω-3FOFE预处理产生醛类应激激活抗氧化信号通路时间。本项目医院伦理批件编号:(2021)第(0110)号。
1.2.2 动物分组及构建大鼠肺I/R模型 参考前期团队方法建立大鼠肺I/R模型[11],选择18只 SD雄性大鼠,随机分为3组(n=6):Sham组(假手术组)、I/R组(肺缺血再灌注组)、FO组(ω-3FOFE预处理+缺血再灌注组)。Sham组造模前生理盐水注射液2 ml/kg尾静脉注射5 d,造模开胸仅分离左肺动脉和左支气管,不阻断左肺动脉,观察150 min活体取肺;I/R组造模前生理盐水注射液2 ml/kg尾静脉注射5 d,造模开胸阻断左肺门30 min,再开放恢复供血和通气120 min;FO组于造模前ω-3FOFE 注射液2 ml/kg尾静脉注射5 d,其余同I/R组。实验结束处死大鼠,取肺组织置于液氮保存。测定各组湿干重比(Wet/Dry ratio,W/D);光学显微镜下苏木精-伊红(Hematoxylin-eosin staining,HE) 染色观察肺组织病理学改变;TdT介导的dUTP缺口末端标记(TdT-mediated dUTP Nick-End Labeling,TUNEL)法检测肺组织细胞凋亡情况;试剂盒检测GSH含量;WB检测Nrf2、HO-1蛋白表达。
1.2.3 肺W/D测定 取出右上肺组织,滤纸吸净表面水分后称湿重(Wet,W),然后置于75 ℃烘箱烘干24 h至恒重,称干重(Dry,D),两者比值即为肺W/D值。
1.2.4 肺组织病理学改变 取左中肺甲醛固定,脱水透明包埋后制成石蜡切片,HE染色后脱水透明封片,置于光学显微镜下观察肺泡形态、结构改变及肺间质充血水肿等情况。
1.2.5 肺组织细胞凋亡测定 采用TUNEL法检测细胞凋亡,根据试剂盒说明书操作。荧光显微镜下显示为绿色荧光即为凋亡细胞。
1.2.6 MDA含量测定 采用硫代巴比妥酸法测定MDA含量。按照试剂盒说明书操作上样,在532 nm,1 cm光径检测各管吸光度值并根据说明书公式计算含量。
1.2.7 GSH含量测定 按照GSH检测试剂盒说明书操作上样检测,405 nm处,酶标仪测定各孔吸光度值并根据说明书公式计算含量。
1.2.8 WB检测胞核转录因子Nrf2蛋白 取左肺组织约1 g,提取肺组织核蛋白测定其蛋白浓度,配置10%分离胶,5%浓缩胶,电泳转膜,将蛋白转置聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜上。配置含5%脱脂奶粉的TBST封闭液,室温封闭1 h,将膜放入相应兔抗大鼠多克隆Nrf2抗体(1∶2 000)、兔抗大鼠单克隆组蛋白H3抗体(1∶2 000)的一抗液中4 ℃孵育过夜,次日加入山羊抗兔IgG(1∶5 000)的二抗液中室温孵育1 h,TBST洗去抗体液后,加入发光液,用凝胶成像仪显影,系统导出各条带灰度值,以组蛋白H3为内参,计算目的蛋白条带灰度值与内参条带灰度值的比值。组间数据比较时,以NS5组或Sham组为对照组,计算其他组与对照组的比值。
1.2.9 WB检测HO-1蛋白 提取肺组织胞浆总蛋白,如上述步骤电泳转膜封闭,将膜放入相应兔抗大鼠多克隆HO-1抗体(1∶200)、兔抗大鼠单克隆β-actin抗体(1∶1 000)的一抗液中4 ℃孵育过夜,后续如上述测定灰度值,以β-actin为内参,计算目的蛋白条带灰度值与内参条带灰度值的比值。最后组间数据比较时,以NS5组或Sham组为对照组,计算其他组与对照组的比值。

2 结果
2.1 确定ω-3FOFE预处理产生醛类应激激活抗氧化信号通路时间 如表1及图1所示,与NS5组、FO3组和FO1组相比,FO5组大鼠肺组织的醛类物质MDA含量明显增加(P<0.05),且FO5组的Nrf2/HO-1抗氧化通路蛋白表达和抗氧化酶GSH含量也均明显增加(P<0.05)。NS5组、FO3组、FO1组之间两两比较差异无统计学意义(P>0.05)。结果表明,FO5组产生醛类物质发生醛类应激激活抗氧化信号通路,故在后续缺血再灌注实验中,选择ω-3FOFE 2 ml/kg连续注射5 d的预处理。

表1 各组大鼠肺组织MDA、GSH和Nrf2、HO-1蛋白表达量比较(n=6)

图1 WB检测各组大鼠肺组织Nrf2及HO-1蛋白
2.2 ω-3FOFE抑制大鼠肺I/R损伤 在后续实验中,将18只大鼠随机分为Sham组、I/R组和FO组,检测ω-3FOFE 对大鼠肺I/R损伤的影响。如表2所示,与Sham组相比,I/R组的肺W/D显著升高(P<0.05),在ω-3FOFE预处理后被抑制(P<0.05)。相应地,与Sham组相比,I/R组大部分肺泡被破坏,腔内有大量的红细胞及水肿液聚集,肺间质明显水肿伴大量中性粒细胞浸润;与I/R组相比,FO组肺泡破坏程度明显改善,腔内仅有少量红细胞渗出,如图2所示。此外,通过荧光显微镜检测细胞凋亡情况,结果显示,与Sham组相比,I/R组出现大量凋亡细胞,在ω-3FOFE预处理后被抑制,如图3所示。本实验结果表明,ω-3FOFE预处理抑制了肺W/D的升高,改善肺组织病理损伤和减少细胞凋亡,对肺I/R损伤有保护作用。
2.3 ω-3FOFE抑制大鼠肺I/R过氧化损伤 如表2及图4所示,与Sham组相比,I/R组肺组织Nrf2、HO-1蛋白表达和GSH含量均显著下降(P<0.05);与I/R组相比,FO组肺组织Nrf2、HO-1蛋白表达和GSH含量均显著增加(P<0.05)。结果表明,在大鼠肺I/R模型中,ω-3FOFE预处理后可激活Nrf2/HO-1抗氧化信号通路,从而发挥肺保护作用。

表2 各组大鼠肺组织W/D、GSH含量和Nrf2、HO-1蛋白表达量比较(n=6)

图2 各组大鼠肺HE染色病理图(100×)
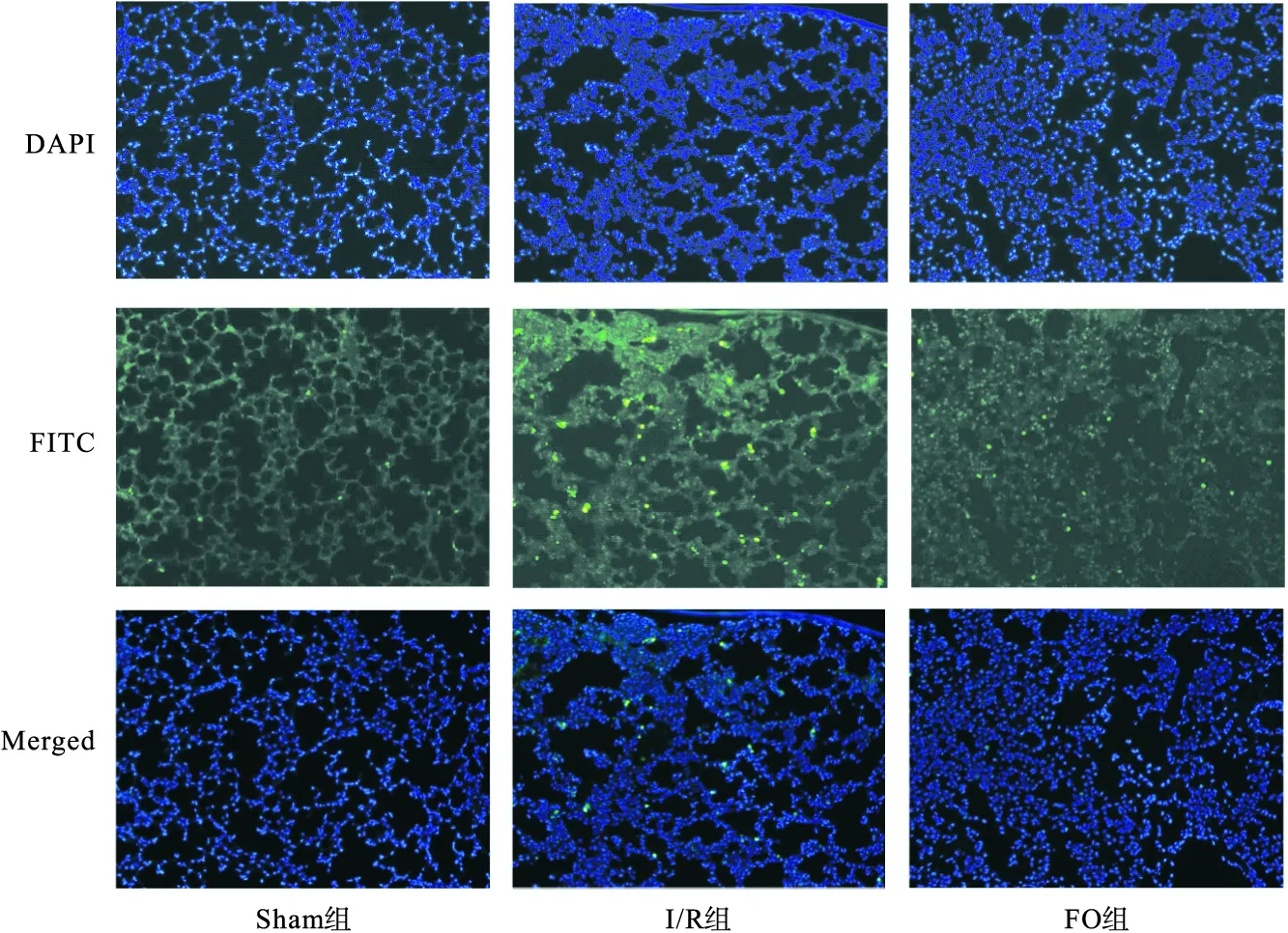
图3 各组大鼠肺组织凋亡情况(200×)

图4 WB检测各组大鼠肺组织Nrf2及HO-1蛋白
3 讨论
本研究在大鼠肺I/R模型中检测了ω-3FOFE预处理后对I/R损伤的影响,结果表明,与I/R组相比,FO组大鼠的肺组织W/D下降、肺泡损伤明显改善、细胞凋亡数量大大减少,说明ω-3FOFE对肺I/R损伤有保护作用。这些发现与之前报道ω-3FOFE对不同器官I/R损伤有保护作用一致[10,12-13],表明ω-3FOFE在预防和治疗肺I/R损伤中具有潜在的临床意义。
ω-3FOFE 中的不饱和双键作为脂质过氧化的靶点可生成醛类物质,而研究表明,低水平的醛类物质对机体存在保护作用。Zhang等[8]报道,在法洛四联症患儿行心脏手术中,体内醛类表达水平较高的一组患儿术后测得肌钙蛋白更低,所需正性肌力药物更少,术后ICU和住院时间更短。MDA是一种醛类物质,是脂质过氧化的主要终产物。GSH有助于保持正常的免疫系统功能,并具有抗氧化作用。本研究结果显示,注射ω-3FOFE 5 d后,大鼠肺组织中MDA表达水平显著提高,GSH含量显著增加,表明ω-3FOFE预处理5 d会使大鼠产生醛类应激产生抗氧化酶,与Dong等[10]的报道一致。
Nrf2是细胞氧化应激反应中的关键转录因子,可保护细胞免受氧化应激引起的凋亡[14]。HO-1作为Nrf2下游的靶基因蛋白,是催化血红素降解的重要限速酶,具有抗炎抗氧化的作用[15]。Dong等[10]报道,ω-3FOFE通过激活Nrf2信号通路减轻了心肌的氧化损伤。Sun等[16]在肺I/R实验模型中证明了maresin 1具有保护作用,这种保护部分可能依赖于Nrf2/HO-1信号通路介导的抗氧化应激能力。Fan等[17]报道,激活Nrf2/HO-1通路可减少大脑I/R损伤。Qin等[18]报道,通过上调 HO-1 表达可减少氧化应激从而减轻大鼠的肺缺血再灌注损伤。同样,在本研究中,与I/R组相比,FO组大鼠的肺组织中Nrf2和HO-1的蛋白表达显著增加,表明ω-3FOFE激活Nrf2/HO-1通路,与上述报道相符合。
综上所述,本研究首次证明了ω-3FOFE通过醛类应激激活Nrf2/HO-1抗氧化蛋白,从而减轻肺I/R损伤。这为今后的研究和治疗提供了一些思路,但仍需要深入细致的研究来证实。
