白细胞介素-12对肿瘤切除术后肿瘤复发抑制作用的实验研究
2022-11-03王赛刘晓燕
王赛 刘晓燕
(1 青岛大学基础医学院,山东 青岛 266071;2 山东省青岛卫生学校;3 青岛市第六人民医院)
白细胞介素12(IL-12)是一种多效性细胞因子,主要发挥免疫刺激作用,已被证明可以调节肿瘤治疗中的先天性(自然杀伤细胞)和适应性(细胞毒性T淋巴细胞)免疫[1]。研究证明IL-12在血液肿瘤中的抗肿瘤作用高于实体瘤,因为实体瘤往往在肿瘤组织内部形成免疫抑制微环境,使IL-12难以发挥作用[2]。目前实体瘤的常用治疗手段是手术切除,但部分患者手术后可能残留微小瘤灶[3],患者术后多需进行放化疗,以消除残余的微小瘤灶,但现有的放化疗手段往往毒副反应较大,对患者造成较大的负担[4],低毒性的免疫治疗成为研究的热点。由于实体瘤切除后破坏了肿瘤组织微环境,免疫细胞能够进入肿瘤组织发挥杀伤作用,其中IL-12作为免疫刺激因子,可以对残余瘤灶的清除发挥积极作用[5]。基于上述背景,本研究参考相关文献[6],建立小鼠术后残瘤模型,用以评价IL-12作用及可能的作用机制。
1 材料与方法
1.1 药物与试剂
重组鼠源IL-12(rmIL-12)购自美国Peprotech公司(编号:210-12);注射用长春新碱购自浙江海正药业有限公司;肉瘤细胞S180、人脐静脉内皮细胞HUVEC由青岛大学附属医院中心实验室惠赠;鼠源性腹腔巨噬细胞Ana-1、人源性肺癌细胞A549购自中国科学院上海细胞研究所。RPMI 1640、高糖DMEM培养基及胎牛血清购自美国Hyclone公司。
1.2 实验动物
选取4~6周龄雌性Nu/Nu裸鼠55只,体质量18.0~22.0 g,购自北京维通利华实验动物技术有限公司,饲养于IVC笼中,喂饲专门配制的消毒饲料,自由饮用纯净水。4~6周龄雌性BALB/C小鼠55只,体质量18.0~21.0 g,购自济南朋悦实验动物繁育有限公司,饲养于SPF级动物房中,喂饲普通饲料。两种小鼠均置于温度25 ℃、相对湿度40%~70%的动物实验室内,每日光照12 h。
1.3 小鼠残瘤模型的建立
肉瘤细胞S180在含体积分数0.10胎牛血清高糖DMEM培养基中培养,每2~3 d传代1次,细胞达对数生长期后收集到离心管中,以1 000 r/min离心后以生理盐水重悬,将约5.0×106个细胞皮下注射到每只BALB/C小鼠和裸鼠右前肢腋部[7]。待肿瘤体积生长达到500~800 mm3时[8],将小鼠麻醉后固定于手术台上。在肿瘤组织下方剪开直径约0.5 cm的创口,切除部分肿瘤组织,残余体积大约为50 mm3,然后缝合皮肤[9]。
1.4 小鼠的分组和处理
建立残瘤模型术后24 h,将BALB/C小鼠随机分为5组,每组11只,模型对照组(A组)右前肢腋部皮下注射0.1 mL生理盐水,阳性对照组(B组)尾静脉注射长春新碱溶液10 mg/kg,IL-12低、中、高剂量组(C~E组)分别右前肢腋部皮下注射25、50、100 ng/kg的rmIL-12,均每2 d给药1次,共给药15 d,每2 d测量1次小鼠体质量。术后24 h,裸鼠随机分为F~J组,每组11只,分组方式及每组小鼠的处理方式同BALB/C小鼠。观察受试小鼠进食、饮水及活动情况。
1.5 IL-12对各组小鼠主要脏器和肿瘤组织的影响
末次给药24 h后麻醉各组裸鼠,处死后剥离肿瘤组织并称质量。于末次给药24 h之后麻醉各组BALB/C小鼠,腹主动脉取血后处死,剥离肿瘤组织并称质量,部分肿瘤组织研磨成匀浆,离心后取上清液,于-80 ℃保存备用;取BALB/C小鼠心脏、脾脏、肝脏、肾脏、肺及部分肿瘤组织于10 g/L多聚甲醛中固定48 h以后,冲水过夜,按照不同方案梯度脱水[10],石蜡包埋[11],切片后置于55 ℃烘箱中烘烤3 h,按照苏木精-伊红(HE)染色试剂盒(南京建成生物工程研究所,货号D006-1-1)说明书要求,将各组织切片分别进行脱蜡、苏木精染色、伊红染色,最后封片镜检。
1.6 细胞培养
将鼠源腹腔巨噬细胞Ana-1(巨噬细胞组)、人源性肺癌细胞A549(肿瘤细胞组)和人脐静脉内皮细胞HUVEC(正常细胞组)分别置于含体积分数为0.10胎牛血清高糖DMEM培养基、RPIM 1640培养基和RPIM 1640培养基中,于37 ℃、含体积分数0.05 CO2细胞培养箱中行无菌培养,每2~3 d传代1次,细胞达到对数生长期后用于后续实验。
1.7 MTT法检测细胞的增殖能力
取处于对数生长期的上述三组细胞,胰酶消化后接种于96孔板中,每孔3 000个细胞,37 ℃培养24 h后,每组细胞均依次加入0、1、10、100、1 000、10 000 μg/L浓度的rmIL-12,继续培养48 h。每个浓度设置3个复孔。取巨噬细胞组的细胞上清液于-80 ℃保存备用,肿瘤细胞组和正常细胞组细胞弃去培养基。上述三种细胞分别用PBS轻柔冲洗3次,每孔加入100 μL新鲜配制的MTT工作液(碧云天生物技术有限公司,货号C0009S),37 ℃孵育4 h,每孔加入200 μL DMSO,酶标仪测定570 nm波长处各孔的吸光度(A)值[12]。
1.8 ELISA法检测细胞因子γ干扰素(IFN-γ)和肿瘤坏死因子-α(TNF-α)的浓度
BALB/C小鼠血清稀释20倍,BALB/C小鼠肿瘤组织上清液稀释10倍,按小鼠IFN-γ试剂盒(北京四正柏生物科技有限公司,货号CME0003)说明书要求进行IFN-γ检测。将巨噬细胞组细胞上清液稀释2倍后,按照小鼠TNF-α ELISA试剂盒(北京四正柏生物科技有限公司,货号CME0004)说明书的要求检测TNF-α的水平。实验重复3次,结果取均值。
2 结 果
2.1 IL-12对小鼠术后残余肿瘤生长的影响
给药15 d后,A~J组小鼠残余肿瘤质量分别为(2.14±0.44)、(0.86±0.27)、(1.17±0.32)、(1.18±0.45)、(1.01±0.28)、(2.83±0.58)、(1.07±0.26)、(1.96±0.65)、(1.74±0.53)、(1.98±0.64)g,析因设计方差分析结果显示,小鼠种类对残余肿瘤质量有影响(F小鼠种类=52.75,P<0.05),分组对残余肿瘤质量有影响(F分组=31.08,P<0.05),小鼠种类和分组无交互作用(P>0.05)。单独效应结果显示,A~E组各组间比较差异具有显著意义(F=20.35,P<0.05),其中A组与B~E组间比较差异具有显著性(q=8.83~11.83,P<0.05),B~E组间差异无显著性(P>0.05)。F~J组各组间比较差异具有显著性(F=12.94,P<0.05),其中F与G~J组、G组与H~J组间比较差异均有显著性(q=5.12~10.62,P<0.05),H~J组组间比较差异无显著意义(P>0.05)。除A组外,BALB/C小鼠相应时间点残余肿瘤质量都低于裸鼠(F=7.92~24.07,P<0.05)。
2.2 IL-12对BALB/C小鼠体质量的影响
重复测量设计的方差分析结果显示,分组对小鼠体质量有明显影响(F分组=7.46,P<0.05),时间、时间和分组的交互作用对小鼠的体质量无明显影响(P>0.05),单独效应结果显示,不同时间点各组小鼠体质量比较,差异均具有显著性(F=2.81~5.48,P<0.05)。见表1。
2.3 IL-12对BALB/C小鼠主要脏器的影响
HE染色结果显示,与A组比较,B~E组的BALB/C小鼠肺、脾、肝、肾、心等主要脏器未见明显病理变化(图1)。
2.4 IL-12对BALB/C小鼠肿瘤免疫微环境影响
A~E组BALB/C小鼠血清中IFN-γ的浓度分别为(40.31±8.55)、(41.34±6.42)、(38.32±12.22)、(47.72±14.84)、(48.44±19.81)ng/g,各组之间比较,差异不具有显著性(P>0.05)。A~E组BALB/C小鼠的肿瘤组织当中IFN-γ浓度分别为(117.48±20.75)、(145.71±55.64)、(240.30±37.06)、(321.50±68.40)、(305.08±72.52)ng/g,各组间比较,差异有显著性(F=31.32,P<0.05),其中A组与C~E组、B组与C~E组、C组与D组比较,差异有显著性(q=4.94~12.42,P<0.05)。
A~E组BALB/C小鼠肿瘤组织HE染色结果显示,与A组比较,B~E组肿瘤组织切片中均出现大量空泡;与A组和B组相比,C~E组小鼠肿瘤组织中炎性浸润区域明显增多(图2)。
2.5 IL-12对巨噬细胞的影响
MTT检测结果显示,不同浓度rmIL-12处理的巨噬细胞组细胞增殖能力比较差异具有显著性(F=111.30,P<0.05)。其中0 μg/L与1、10、100、1 000、10 000 μg/L组间比较,1 μg/L与10、100、1 000、10 000 μg/L组间比较,10 μg/L与100、1 000、10 000 μg/L组间比较,差异均有显著性(q=8.63~24.42,P<0.05)。不同浓度rmIL-12处理的肿瘤细胞组和正常细胞组细胞增殖能力比较差异均无显著性(P>0.05)。见表2。

表1 IL-12对BALB/C小鼠体质量的影响Tab.1 Effect of IL-12 on the body weight of BALB/C mice(m/g, n=11,
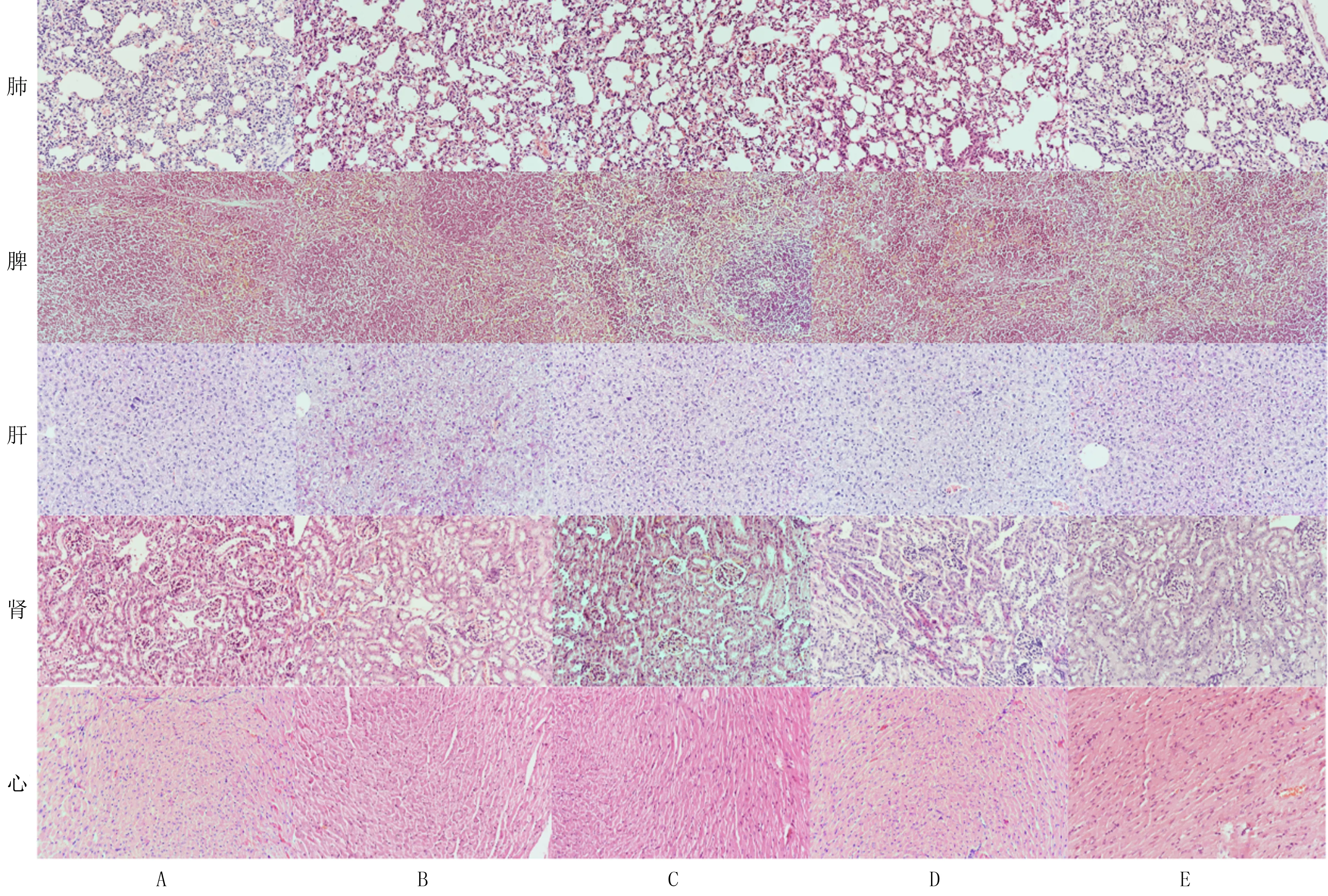
A~E:A~E组,HE染色,100倍图1 各组BALB/C小鼠主要脏器HE染色结果Fig.1 HE staining results of the main visceral organs of BALB/C mice in each group

A~E:A~E组,黑色箭头指向炎性浸润区域,HE染色,100倍图2 BALB/C小鼠肿瘤组织HE染色结果Fig.2 HE staining results of the tumor tissue of BALB/C mice
2.6 IL-12对巨噬细胞TNF-α分泌的影响
经ELISA方法检测后结果显示,0、1、10、100、1 000、10 000 μg/L浓度的rmIL-12处理后,巨噬细胞组中TNF-α浓度分别为(27.48±6.91)、(59.59±12.36)、(73.14±6.52)、(97.01±7.65)、(126.21±9.30)、(128.23±17.07) ng/g,不同组间比较差异具有显著的意义(F=55.11,P<0.05)。其中0 μg/L与1、10、100、1 000、10 000 μg/L组间比较,1 μg/L与100、1 000、10 000 μg/L组间比较,10 μg/L与1 000、10 000 μg/L组间比较,100 μg/L与1 000、10 000 μg/L组间比较,差异均有显著性(q=4.49~18.93,P<0.05)。
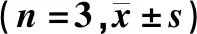
表2 不同浓度IL-12对3组细胞系增殖能力的影响Tab.2 Effect of different concentrations of IL-12 on the proliferative capacity of the three cell lines (n=3,
3 讨 论
肿瘤患者在行手术切除实体瘤后,破坏了肿瘤微环境,影响免疫细胞功能,造成机体免疫功能下降;另一方面,手术也对肿瘤造成刺激,促进肿瘤的转移,且由于机体免疫功能的下降,残余肿瘤的生长速度更快。本实验建立小鼠术后残瘤模型,经细胞因子药物IL-12治疗后,探讨IL-12通过免疫调节作用抑制肿瘤生长的作用及可能机制。
皮下移植瘤模型是目前肿瘤药物体内研究的常用模型,一般是将肿瘤细胞注射到小鼠皮下或直接移植肿瘤组织,但这种模型存在忽视肿瘤微环境的缺陷[13]。本实验在皮下移植瘤的基础上,切除部分肿瘤组织后缝合皮肤,建立手术后残瘤模型,以更好地研究IL-12对肿瘤微环境的影响。本研究结果显示,各组BALB/C小鼠体质量随时间没有发生明显变化,而不同时间点各组小鼠体质量有显著差异;另外与模型对照组(A、F组)比较,rmIL-12低、中、高给药组(C~E组、H~J组)均显著降低BALB/C小鼠与裸鼠残余肿瘤质量,提示IL-12对两种小鼠均具有抑制术后残瘤生长的作用。本研究结果还显示,除模型对照组外,BALB/C小鼠残余肿瘤质量均明显低于裸鼠,提示IL-12对缺乏胸腺T细胞的裸鼠抗肿瘤作用低于BALB/C小鼠,说明IL-12发挥抗肿瘤的作用可能需要有T细胞的参与,在IL-12抗肿瘤时,T细胞扮演着重要的角色,与既往文献报道的结果一致[14]。陈丽娜等[15]指出IL-12通过诱导T细胞产生IFN-γ从而发挥抗肿瘤作用,IFN-γ可以激活免疫细胞对肿瘤细胞发挥杀伤作用,也可以直接作用于肿瘤细胞,促进肿瘤细胞凋亡[16]。本研究中检测了各组BALB/C小鼠肿瘤组织和血清中IFN-γ的浓度变化,结果显示IL-12各给药组肿瘤组织中的IFN-γ浓度明显升高,但血清中IFN-γ的浓度无显著变化,提示IL-12可能只针对肿瘤组织发挥作用,而不会引起全身反应。由此推测术后残余肿瘤组织的免疫原性较高,在肿瘤组织附近聚集了较多的免疫细胞,IL-12主要通过免疫细胞发挥作用,因此可以靶向免疫原性高的肿瘤组织,且不易引起全身反应,并减少了毒副作用。本研究对A~E组BALB/C小鼠主要脏器(肺、脾、肝、肾、心)进行HE染色后结果显示,与A组比较,B~E组小鼠的主要脏器均未见明显病理变化,提示IL-12对BALB/C小鼠主要脏器无明显影响,具有良好的临床应用价值。本研究对BALB/C小鼠的肿瘤组织进行了HE染色,结果显示,与A组相比较,各给药组肿瘤组织切片中均出现大量空泡,说明IL-12对肿瘤细胞产生了一定的杀伤作用,但A组和B组肿瘤组织的炎症浸润区域较小且不明显,而IL-12各给药组炎性浸润区域则明显增多,进一步说明IL-12可能是通过调节肿瘤免疫微环境,促进肿瘤组织炎症反应,发挥抑制肿瘤生长的作用。
本研究进一步对鼠源腹腔巨噬细胞Ana-1、人源性肺癌细胞A549和人脐静脉内皮细胞HUVEC在体外以不同浓度的rmIL-12进行处理,结果显示rmIL-12浓度依赖性促进巨噬细胞Ana-1细胞增殖,但对肺癌细胞A549细胞和内皮细胞HUVEC细胞增殖没有明显影响,提示IL-12可促进巨噬细胞增殖,提高免疫反应,而不是直接对肿瘤细胞产生杀伤作用,并且IL-12对正常细胞无明显影响。再进一步通过ELISA方法检测不同浓度IL-12对巨噬细胞TNF-α分泌的影响,结果显示,rmIL-12可促进巨噬细胞分泌TNF-α,且随着rmIL-12浓度升高,巨噬细胞中TNF-α浓度增加。TNF-α是由巨噬细胞和单核细胞产生的主要促炎细胞因子,参与正常炎症反应和免疫反应,在抗肿瘤中发挥重要作用。综合本研究上述结果提示,IL-12可通过促进巨噬细胞分泌TNF-α发挥抗肿瘤的作用。
综上所述,本研究表明,IL-12对肿瘤细胞本身不具有直接杀伤作用,其可能是通过作用于T细胞和巨噬细胞等免疫细胞,促进TNF-α、IFN-γ等肿瘤杀伤因子的分泌而发挥抑制肿瘤生长的作用。本研究结果为IL-12在肿瘤中的作用提供了实验依据,其在抗肿瘤中的应用价值值得进一步深入研究。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
伦理批准和动物权利声明:本研究涉及的所有动物实验均严格按照国家动物卫生研究院《实验动物饲养与使用规定》和青岛大学伦理委员会的指导进行(动物福利保障编号:140027)。
EthicsApprovalandAnimalRight: All animal experiments protocols in this study were conducted in strict accordance with the Provisions for the Feeding and Use of Laboratory Animals of the National Institute of Animal Health and the guidelines of The Ethics Committee of Qingdao University (Animal Welfare Guarantee Number: 140027).
作者贡献:王赛参与了研究设计;王赛和刘晓燕参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byWANGSai. The manuscript was drafted and revised byWANGSaiandLIUXiaoyan. All the authors have read the last version of the paper and consented submission.
