水貂源肺炎克雷伯杆菌分离、鉴定及疫苗潜能分析
2022-11-03张国军王殿永杨艳梅陈建国畅丽芳吴金高玉龙楚洪源柳增善张媛媛
张国军王殿永杨艳梅陈建国畅丽芳吴 金高玉龙楚洪源柳增善张媛媛
(1.吉林大学人兽共患病研究教育部重点实验室,长春 130062;2.吉林大学致远有限公司,长春 130012;3.河北省昌黎县动物疫病预防控制中心,河北昌黎 066600;4.吉林和元生物工程有限公司,吉林松原 138000;5.北京大学临床医学院,北京 100080)
水貂克雷伯杆菌性肺炎是水貂养殖过程中的常见病和多发病,常在7-10月份发生局部流行。在山东、河北、辽宁等地的水貂养殖场个别年份成年貂的发病率可达50%以上,主要症状为发热,全身出现脓疡,特别是颈部有许多小脓泡,肺出血、呼吸困难等临床表现,严重者呈急性死亡[1-3]。
为了更好地控制本病,2010 年至2021 年期间,初步对山东、河北、辽宁等地疑似水貂肺炎克雷伯杆菌病病例进行病原分离与鉴定,利用分离菌对水貂的致病性、免疫原性及疫苗潜力进行分析,现将有关试验结果报告如下。
1 材料与方法
1.1 材料
1.1.1 病料 2010年至2021年,先后从山东诸城、河北饶阳、辽宁大连等地区大型水貂养殖场或养殖户的水貂无菌采集肺脏、肝脏、脾脏、肾脏作为病料。患病水貂以发热、全身出现脓疡,特别是颈部有许多小脓泡、肺出血、呼吸困难、急性死亡为特征。
1.1.2 培养基及氢氧化铝胶 普通琼脂、马丁琼脂、麦康凯琼脂培养基,购自中海生物科技有限公司。HiBio-IDTM系列微生物生化鉴定卡购自Hi-Media公司。普通肉汤与革兰氏染色液由实验室配制。氢氧化铝胶购自河南通商进出口有限公司。
1.1.3 引物 16S r DNA 扩增引物(F:5'-AGAGTTTGATCCTGGCTCAG-3';R:5'-ACGGCTACCTTGTTACGACT-3')由生工生物工程(上海)股份有限公司合成。
1.1.4 试验动物 10月龄健康易感青年貂购自辽宁省庄河市富贵养貂专业合作社,该合作社未曾接种过任何肺炎克雷伯杆菌疫苗,貂场也未曾发生疑似相关的呼吸道症状病例;新购貂在吉林和元生物工程股份有限公司动物房内饲养14 d后,临床表现健康者用于动物回归试验和毒力测定。
1.1.5 仪器 恒温培养箱购自江苏新春兰科学仪器有限公司,HZQ-QA/QB 型恒温培养摇床购自苏州威尔实验用品有限公司。BX53M 正立金相显微镜购自杭州全谱实验室设备有限公司。
1.2 方法
1.2.1 细菌分离与常规生理生化鉴定 细菌分离无菌操作从病死水貂体内采集肺脏、脾脏或肝脏及肾脏组织,划线接种于普通琼脂平板上,于37 ℃培养24~48 h,观察菌落形态。挑取单个较大的灰白色黏稠菌落,接种于普通琼脂平板划线纯化分离,确定纯化无污染后挑取少量菌落接种于普通肉汤培养基中,37 ℃培养14~18 h,冻干保存,记为F0代,其余培养物作鉴定用。
细菌鉴定:取纯培养的单个典型菌落作革兰氏染色,镜检。纯培养的单个菌落划线接种于普通琼脂、马丁琼脂、麦康凯琼脂培养基平板上,置于37℃培养24 h,观察细菌的生长状态。取纯培养物分别进行吲哚(靛基质)试验,甲基红(MR)试验,VP试验,明胶液化试验,氧化酶试验、葡萄糖、甘露醇、山梨醇、蔗糖、鼠李糖、乳糖等糖的发酵试验,触酶试验,硝酸盐还原试验,H2S试验等常规生化试验鉴定[4]。
1.2.2 分子生物学鉴定 根据临床特征、菌落形态、革兰氏染色、生化及致病性特点,选择其中的FY2和FY3株细菌划线纯培养,16~20 h后,取平板内直径不小于2 mm 的较大单菌落,全部挑入盛有100μL去离子水的1.5 m L 离心管内,沸水浴15 min。取出自然冷却至室温,12 000 r/min 离心5 min,取上清3 μL,用细菌的16S r RNA 引物扩增细菌16S r RNA。PCR 体系:Pre MixrTaq(2×)25μL,10μmol/L 上下游引物各1.5μL,模板(煮沸后上清)3μL,去离子水19μL。扩增条件:预变性94 ℃3 min;94 ℃30 s,50 ℃30 s,72 ℃1 min,30 个循环;最后72 ℃延伸10 min,4 ℃保温。
扩增产物长度1 400 bp,纯化后送吉林库美生物科技股份有限公司进行序列测定。按常规方法将所得序列提交NCBI网站的BLAST 功能网页进行核酸序列比对,网址为:http://blast.ncbi.nlm.nih.gov/Blast.cgi。
1.2.3 动物回归及毒力测定试验 分别取6株分离细菌的单个菌落划线接种于普通琼脂平板上,置37 ℃培养18 h,刮取平板上所有菌落混于灭菌PBS(0.2 mol/L,p H 7.2)中,制成细菌悬液,无菌条件下进行10倍梯度稀释,将不同浓度菌液分别接种于普通琼脂平板,37 ℃培养18 h,计数,判定菌液浓度。将其浓度稀释至1.0×106CFU/m L,以1.0 m L/只剂量肌肉注射10月龄健康易感青年貂5只,同时设立PBS注射对照组。攻毒后连续观察14 d,每日记录水貂的精神状况、食欲、排便、活动及死亡情况,死亡貂立即解剖,观察是否有病理变化,无菌采集脏器分离细菌。依据剂量和对动物致病结果确定菌株的毒力强弱。
1.2.4 强毒分离株对易感水貂最小完全致死量的确定 根据毒力回归试验结果,取其中2个典型强毒分离菌株纯培养的单菌落,划线接种于普通琼脂平板上,置37 ℃培养18 h,刮取平板上所有菌落混于灭菌PBS中制成细菌悬液,以平板培养活菌计数法确定菌数,根据预试验初步摸索的致病剂量,将其浓度稀释至1.0×105、2.5×105、5.0×105、1.0×106、1.5×106CFU/m L 共5组,每组以1.0 m L/只剂量肌肉注射10月龄健康易感青年貂5只,同时设立水貂(灭菌PBS注射)对照组。所获数据以Duncan氏显著性检测方法进行统计分析[5]。
攻毒后连续观察14 d,每日记录水貂的精神状态、食欲、排便、活动及死亡情况,对死亡貂立即解剖,取内脏分离细菌。
1.2.5 强毒分离株的免疫原性试验 将确定的强毒分离株接种普通肉汤培养24 h后,收集菌体制成20%氢氧化铝胶佐剂灭活疫苗,配苗后每毫升抗原液菌数分别为1.0×109CFU、2.0×109CFU、3.0×109CFU、4.0×109CFU,用10月龄健康易感青年貂各5只,分别皮下注射1.0 m L。同时设不接种对照5只。接种后21 d,每只免疫和对照水貂各肌肉注射“1.2.3”中确定的强毒分离株最小完全致死剂量的高一滴度,观测14 d。计算疫苗的免疫保护效果。
2 结果与分析
2.1 细菌分离结果
从山东、河北、辽宁等地区的水貂样品获得6个可疑分离菌株,在普通琼脂培养基上菌落呈圆形、湿润、光滑、稍隆起、边缘整齐的中等大灰白色黏稠菌落。挑取单个菌落进行革兰氏染色,菌体为革兰氏阴性粗短杆菌,呈单个或成对分布,偶尔呈链状排列,无芽胞。
2.2 分离菌株的生化鉴定
生化鉴定结果表明,6株分离细菌的生化反应相同,能发酵所试验的6种糖类,产酸产气,不产生硫化氢,不液化明胶,吲哚(靛基质)阴性,过氧化氢酶阴性,触酶阳性,VP阳性,甲基红(MR)阴性,还原硝酸盐,符合肺炎克雷伯菌的基本生化反应特征(表1),分别命名为FY1、FY2、FY3、FY4、FY5、FY6。
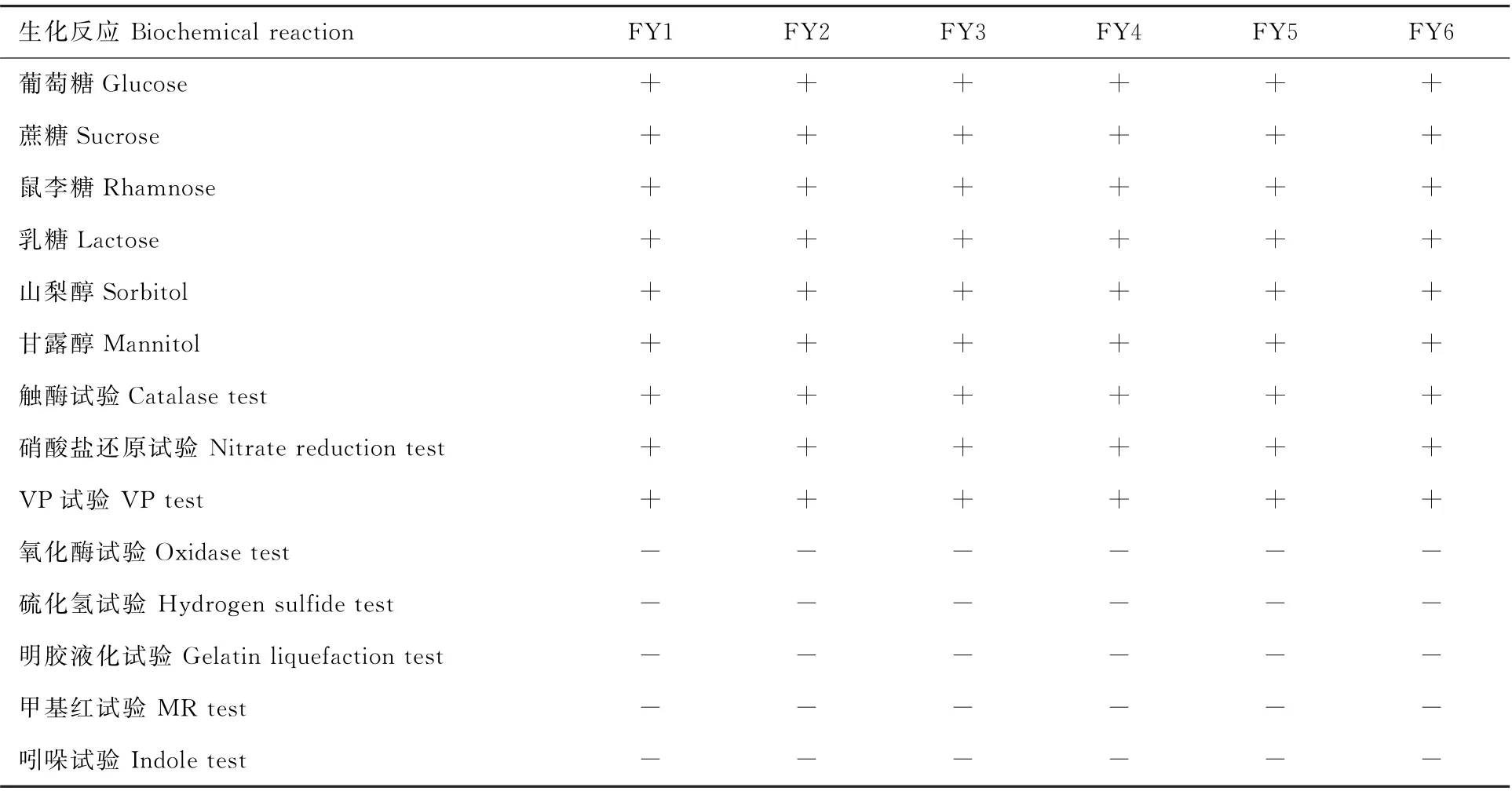
表1 6株分离菌主要生化反应结果Table 1 Main biochemical reaction results of 6 isolates
2.3 分子生物学鉴定结果
FY2和FY3菌株16S r RNA 的扩增片段大小为1 400 bp(图1),与预期大小一致。将测序结果进行BLAST 比对分析表明,2 个扩增序列与GenBank 库内序列号为NR074913.1 的ATCC 标准克雷伯氏菌菌株“Klebsiellapneumoniaesub sp.pneumoniaeMGH 78578 strain ATCC 700721; MGH 78578 16S ribosomal RNA,complete sequence”一致性为100%,与GenBank公布的肺炎克雷伯杆菌的16S r RNA(登 录 号 为 KJ803939.1、HM585430.1、AB558500.1等)的一致性为99%。表明两个分离菌株均为肺炎克雷伯杆菌(图2)。

图1 分离菌FY2和FY3株的16S r RNA扩增结果Fig.1 16S r RNA amplification results of isolated strains FY2 and FY3

图2 FY3株16S r RNA PCR 产物测序后拼接序列Fig.2 Splice sequences after sequencing of 16S r RNA PCR products of FY3 strains
2.4 动物回归及致病力测定试验
对6株分离菌株进行动物回归及致病力测定试验,将1 m L 浓度为1.0×106CFU/m L 的各分离菌株通过肌肉注射方式注入10月龄健康青年水貂的体内,在14 d内观察各组试验动物的死亡情况和发病症状。结果表明,6株菌所攻毒水貂在5 d后不同时间内,感染水貂发热、精神沉郁,体温高达40℃以上;呼吸困难,并出现急性死亡,不同分离菌株导致水貂死亡比例不同(表2)。取肺组织涂片和肝组织印片进行革兰氏染色后显微镜下观察,可见革兰氏阴性杆菌,单个或成对存在,对其再进行生化试验,结果与表1鉴定结果一致,符合肺炎克雷伯杆菌特征。

表2 6株可疑肺炎克雷伯杆菌分离株动物回归试验结果Table 2 Animal regression test results of 6 suspected Klebsiella pneumoniae isolates
以上不同强毒分离菌株在1.0×106CFU/m L时,肌肉注射后可引起20%~100%的水貂死亡。其中FY3和FY4毒力显著高于其他分离株。
2.5 强毒分离株对易感水貂最小致死量测定结果
取FY3、FY4毒株的普通肉汤培养液,分别稀释成1.0×105、2.5×105、5.0×105、1.0×106、1.5×106CFU/m L并接种10月龄健康易感青年貂,在14 d内,5.0×105CFU/m L以上浓度时可引起全部接种水貂死亡(表3)。通过表3可以看出,FY3即ZC1108 株(2011 年分离自山东诸城的毒株)的最小完全致死量为5.0×105CFU/m L。
由表3还可看出,FY3和FY4分离株的最小完全致死剂量均为5.0×105CFU/m L,但FY4致死所需时间较长。另外几个分离株因致死水貂死亡数量或时间较长,未进行最小完全致死剂量研究。因此ZC1108株为所有分离株中致病力较强的菌株,故可能具有较好的免疫原性。
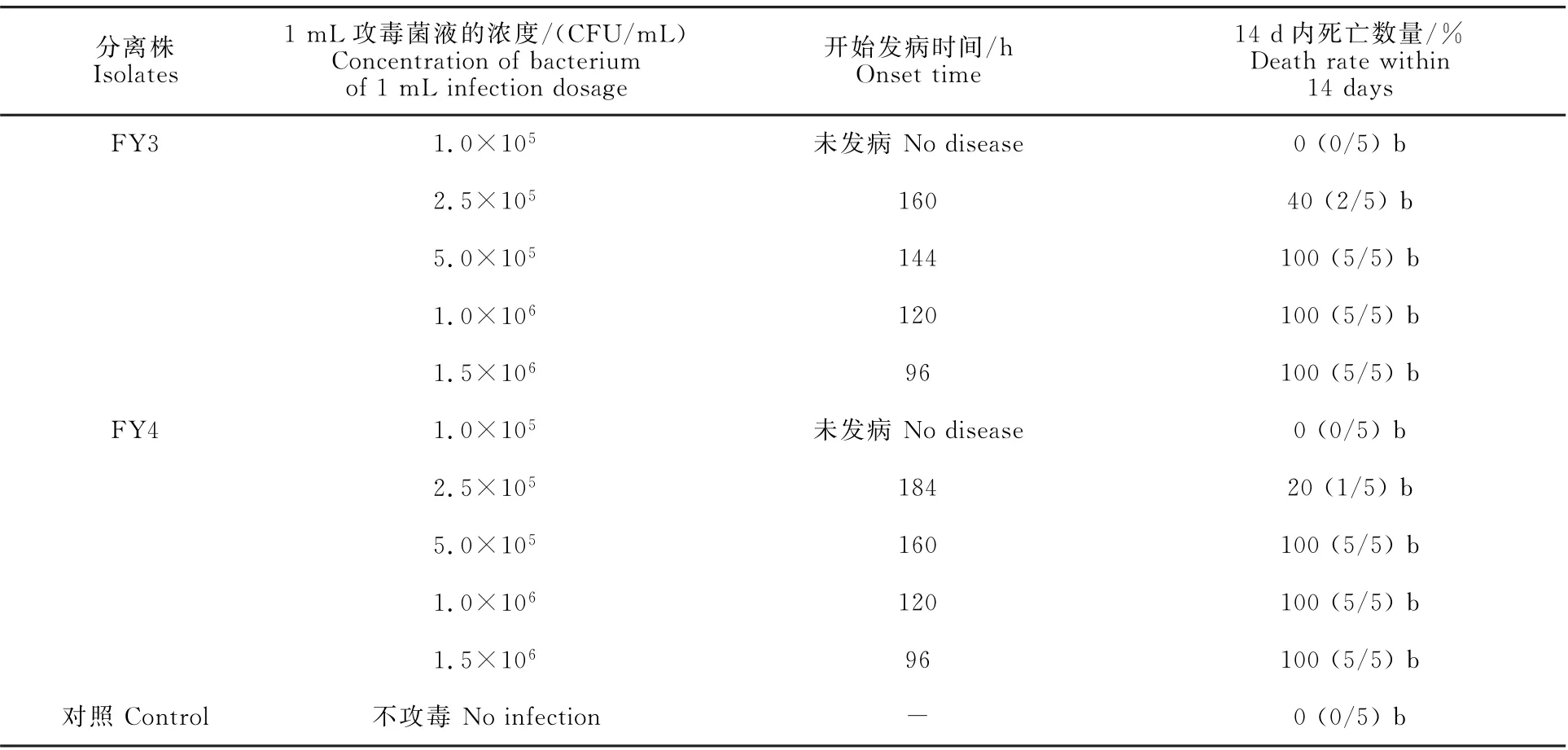
表3 分离株FY3和FY4不同感染量对易感水貂致死率试验结果Table 3 Experimental results of different infection doses of isolates FY3 and FY4 on mortality of susceptible mink
2.6 强毒分离株的免疫原性试验结果
将确定的ZC1108分离株做成20%氢氧化铝胶佐剂灭活疫苗,将10月龄健康易感青年貂20只分为4 组,每组5 只,分别皮下注射疫苗1.0 m L(细菌含量分别为1.0×109CFU/m L、2.0×109CFU/m L、3.0×109CFU/m L 和4.0×109CFU/m L)。另取5只健康水貂注射同量PBS作为非免疫对照。接种21 d后,每只水貂各肌肉注射ZC1108株菌液1.0 m L(1.0×106CFU/m L),观察14 d。结果发现对照水貂全部死亡,免疫水貂健活情况详见表4。
从表4可以看出,ZC1108株的最小有效免疫剂量为2.0×109CFU,在该剂量下被免疫水貂即可实现100%的保护率,保护效果显著优于1.0×109CFU 免疫剂量。

表4 ZC1108分离株免疫原性及保护试验结果Table 4 Immunogenicity and protective test results of ZC1108 isolate strain
3 讨论
2019年中国水貂取皮1 169万张左右,最大省份为山东省,其次为辽宁、黑龙江、河北等省市,都具有很大的养殖规模。水貂养殖受到各种传染病威胁,主要为病毒病和细菌病,细菌病中以绿脓杆菌为主要威胁病原[2,6-7],但近些年也有少部分受肺炎克雷伯杆菌感染威胁,或者见于少部分是两种菌以上混合感染的病例[8-10]。此外,猪等家畜也有肺炎克雷伯杆菌感染的病例,相关团队也对该菌相关特性进行了分析[11-12]。笔者从自然发病水貂出血性肺炎没有铜绿假单胞菌的病例病料中分离到6株可疑肺炎克雷伯杆菌,经系统的生化试验、基因序列、致病性等鉴定为肺炎克雷伯杆菌。从分离结果看肺炎克雷伯杆菌可能是这些水貂病例肺部感染和血液感染的主要致死原因。肺炎克雷伯杆菌在医学临床上也能引起人的肺炎、菌血症、尿路感染等,属于人兽共患病病原,其致病性越来越强。因此,研制针对肺炎克雷伯杆菌的疫苗非常必要,先前也有对包含克雷伯杆菌在内的亚单位苗、联苗进行相关研究[13-14],笔者对水貂进行的疫苗免疫可行性分析结果获得了较好的预期前景。
从动物回归试验、最小致死剂量和致病力及免疫原性试验的结果可见,分离的FY3(ZC1108)和FY4株致病性最强,攻毒1 m L 浓度为1.0×105CFU/m L 的菌液均能引起水貂发病,5.0×106CFU/m L 以上均可导致死亡;其中采用FY3分离株制备的疫苗免疫动物后,再用1.0×106CFU/m L攻毒后可达到5/5健活,免疫所需细菌数量为2.0×109CFU/m L 以上时就可达到很好的保护效果。因此,该毒株适合于作为肺炎克雷伯菌疫苗的候选株,可为水貂克雷伯杆菌预防提供潜在疫苗株,进一步考虑多价苗的研发,对防止动物和人类感染的源头防控有积极作用。
