低氧预适应对小鼠海马HT22细胞线粒体能量代谢的影响
2022-11-03齐瑞芳王立军石瑞丽马宝慧时静华郝肖琼
齐瑞芳,李 娜,王立军,吕 军,石瑞丽,马宝慧,时静华,郝肖琼,邵 国
氧气作为线粒体电子传递链的最终电子受体,在有氧呼吸和新陈代谢中起着关键作用。正常情况下,真核细胞需要足够浓度的氧气来维持各种生物活动并确保存活。当需氧量超过其供应量时,全身或局部组织中的氧含量降低(称为低氧),导致代谢危机,威胁生理功能和生存能力[1]。主要涉及的疾病包括脑卒中、新生儿缺氧性疾病和各种神经退行性疾病等[2]。
缺血/低氧预适应(ischemic/hypoxia preconditioning, I/HPC)通过预先暴露于亚致死性的缺血/低氧,增加对随后严重缺血/低氧的耐受,它是一种内源性细胞保护机制[3-4]。该研究通过体外培养小鼠海马神经细胞HT22,检测HPC对HT22细胞中三磷酸腺苷(adenosine triphosphate,ATP)和活性氧 (reactive oxygen species,ROS)水平的影响,验证HPC对细胞能量代谢的影响,并检测可能涉及的机制—雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) /自噬通路,为HPC对缺血/低氧等疾病的诊疗提供有效的理论依据。
1 材料与方法
1.1 材料
1.1.1实验细胞 小鼠海马神经元HT22细胞系购自北京协和细胞所。
1.1.2试剂与仪器 RIPA裂解液、ATP和ROS检测试剂盒购自杭州碧云天生物技术公司,兔抗mTOR、磷酸化mTOR (Ser2448)多克隆抗体购自美国CST公司;驴抗兔IgG购自北京中杉金桥生物技术有限公司;Alexa FluorTM594山羊抗兔IgG购自美国Invitrogen公司;DMEM培养基购自美国Gibco公司, LysoTrackerTM探针购自美国Invitrogen公司。蛋白电泳和转膜设备购自美国Bio Rad公司,化学发光仪购自上海天能科技有限公司,激光共聚焦显微镜购自日本Nikon公司。
1.2 实验方法
1.2.1HT22细胞培养 使用含有10%胎牛血清的DMEM培养基培养HT22细胞,培养条件为37 ℃、5%CO2。
1.2.2细胞诱导分化及分组 培养HT22细胞,镜下观察细胞长至40%~50%的融合度后对细胞进行诱导分化。用含有诱导剂的培养基诱导分化培养24 h。诱导剂的成分有:100×N2-添加剂、50 ng/ml β神经生长因子、0.1 mol/L D0627和0.1 mol/L P1269四种成分,7 ml培养基中各成分的体积分别为:400、10、4、40 μl。完成后的HT22细胞分为对照组、低氧组和HPC组。
1.2.3低氧预适应细胞模型建立方法 对照组细胞是21% O2常氧环境下培养。低氧组细胞先在1% O2的低氧环境下培养13 h,接着常氧环境下培养6 h。而HPC组细胞是低氧环境下培养30 min,后换至常氧环境培养30 min,如此交替进行4个循环,接着在低氧环境下继续培养13 h,复氧6 h,完成模型制备[5]。
1.2.4ATP检测 按照1.2.2项和1.2.3项方法对细胞进行处理。采用ATP试剂盒检测HT22细胞的ATP水平。冰上每孔加入裂解缓冲液200 μl,待细胞充分裂解后,4 ℃、12 000 r/min离心5 min;ATP检测试剂用ATP检测试剂稀释剂按1 ∶100的比例稀释,将100 μl ATP检测试剂滴入检测孔中;静置3~5 min后,滴加待测试剂20 μl;混合液体,间隔2 s后进行测试。根据标准曲线计算样品中ATP的浓度。最后,ATP浓度除以BCA法检测到的样品蛋白浓度即可。
1.2.5ROS水平检测 采用ROS试剂盒检测各组HT22细胞ROS水平。细胞诱导分化生长24 h后,HT22细胞密度长至70 %左右时,将细胞收集在EP管中,DCFH-DA孵育20 min,用不含血清的DMEM洗涤细胞3次。用细胞计数器计数,用200 μl PBS悬浮,最后用荧光酶标仪测定DCF,使用488 nm激发波长和525 nm发射波长检测。
1.2.6Western blot 将模型制备完毕的样品中加入100 μl RIPA裂解液,并分别加入1 μl蛋白酶及磷酸酶抑制剂常规进行超声辅助裂解,4 ℃、12 000 r/min离心15 min,取上清液采用BCA法进行蛋白定量。使用聚丙烯酰胺凝胶电泳,上样浓度:每孔15 μg蛋白。电泳条件:上层浓缩胶10 mA,恒流,下层分离胶15 mA,恒流;接着恒流400 mA转膜过夜,将蛋白转移到PVDF膜。5%脱脂奶粉室温封闭1 h,使用TBST漂洗3次,每次10 min;4 ℃孵育一抗(1 ∶1 000)过夜。TBST漂洗3次,每次10 min,室温孵育二抗(1 ∶1 000)1 h;TBST漂洗3次,每次10 min,ECL发光,采用Image J进行图像灰度值测定[6]。
1.2.7细胞免疫荧光 将HT22细胞按照每孔5×103个种至24孔板中,每孔中放置1个玻片,按照1.2.2项和1.2.3项方法对细胞进行处理;24 h后,PBS清洗3次,用4%多聚甲醛固定。室温PBS洗3次,每次5 min;用0.2% Triton X-100进行细胞通透,室温孵育15 min;10%山羊血清室温封闭30 min;孵育P-mTOR抗体(1 ∶300),4 ℃过夜;用1%BSA-PBS洗涤,60 r/min漂洗3次,每次5 min;孵育二抗(1 ∶500),室温孵育2 h,注意避光;用1%BSA-PBS清洗,60 r/min漂洗2次,每次5 min,去离子水再清洗1次;取出玻片,并将有细胞的一面扣在滴有DAPI(含防淬灭剂)的载玻片上,中性树胶封片,激光共聚焦显微镜扫描拍照,NIS-Elements AR Analysis软件检测并分析数据。
1.2.8LysoTrackerTM探针检测溶酶体 按照5×103/孔的密度将HT22细胞接种至24孔板中,每孔中放置一个玻片,培养24 h,细胞生长密度至60%左右,然后按照1.2.3项方法进行HPC和低氧实验模型。模型制备结束后,吸出培养基,用终浓度50 nmol/L的LysoTrackerTM试剂孵育细胞2 h,加入培养基,激光共聚焦扫描拍照,NIS-Elements AR Analysis软件检测并分析数据。
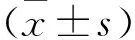
2 结果
2.1 HPC上调ATP水平ATP检测结果显示,与对照组相比,低氧组ATP水平明显降低,而HPC组与对照组相比有所下降但要高于低氧组,差异有统计学意义(P<0.05,n=6),见图1。
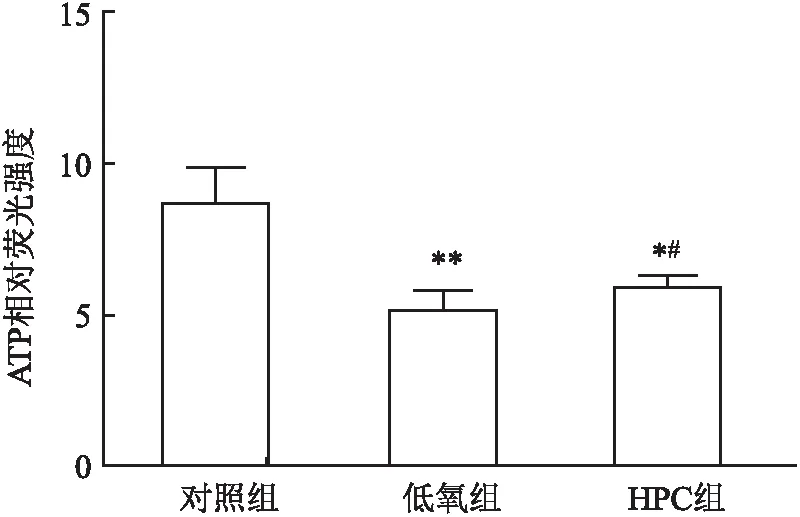
图1 HPC增加HT22细胞中ATP浓度与对照组比较:*P<0.05, **P<0.01;与低氧组比较: #P<0.05
2.2 HPC降低ROS水平通过检测不同组别中ROS水平发现,低氧组ROS水平高于对照组和HPC组,差异有统计学意义(P<0.05,n=6),见图2。提示HT22细胞在急性低氧复氧刺激后,ROS水平明显升高,而HPC可以降低ROS的水平。
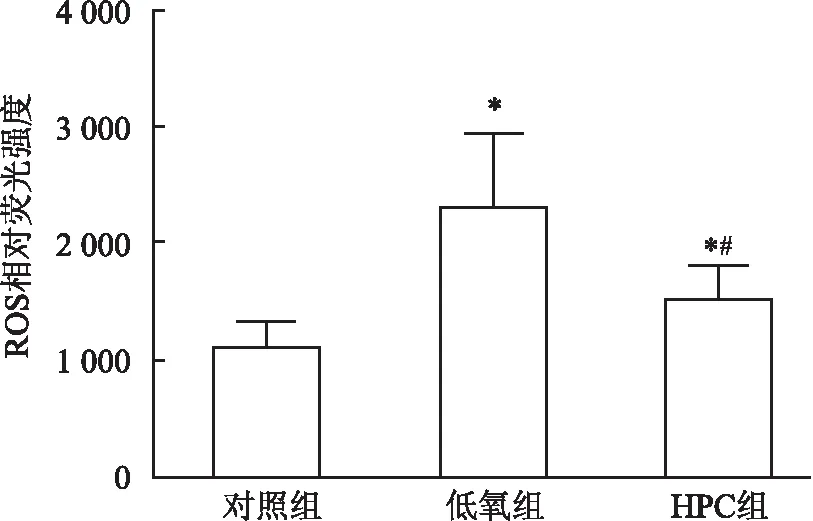
图2 HPC可下调ROS的水平与对照组比较:*P<0.05;与低氧组比较: #P<0.05
2.3 HPC降低磷酸化mTOR蛋白表达Western blot法检测HT22细胞中总mTOR和P-mTOR蛋白的表达,结果显示,HPC对总mTOR蛋白表达没有明显的影响,但可下调P-mTOR蛋白的表达(P<0.01,n=6),HPC组比低氧组稍有增加(P<0.05,n=6),见图3A、3B。P62蛋白作为自噬底物,HPC组明显少于对照组(P<0.01,n=6),见图3A、3B。细胞免疫荧光染色法检测P-mTOR蛋白的结果与Western blot的结果一致,见图3C、3D。
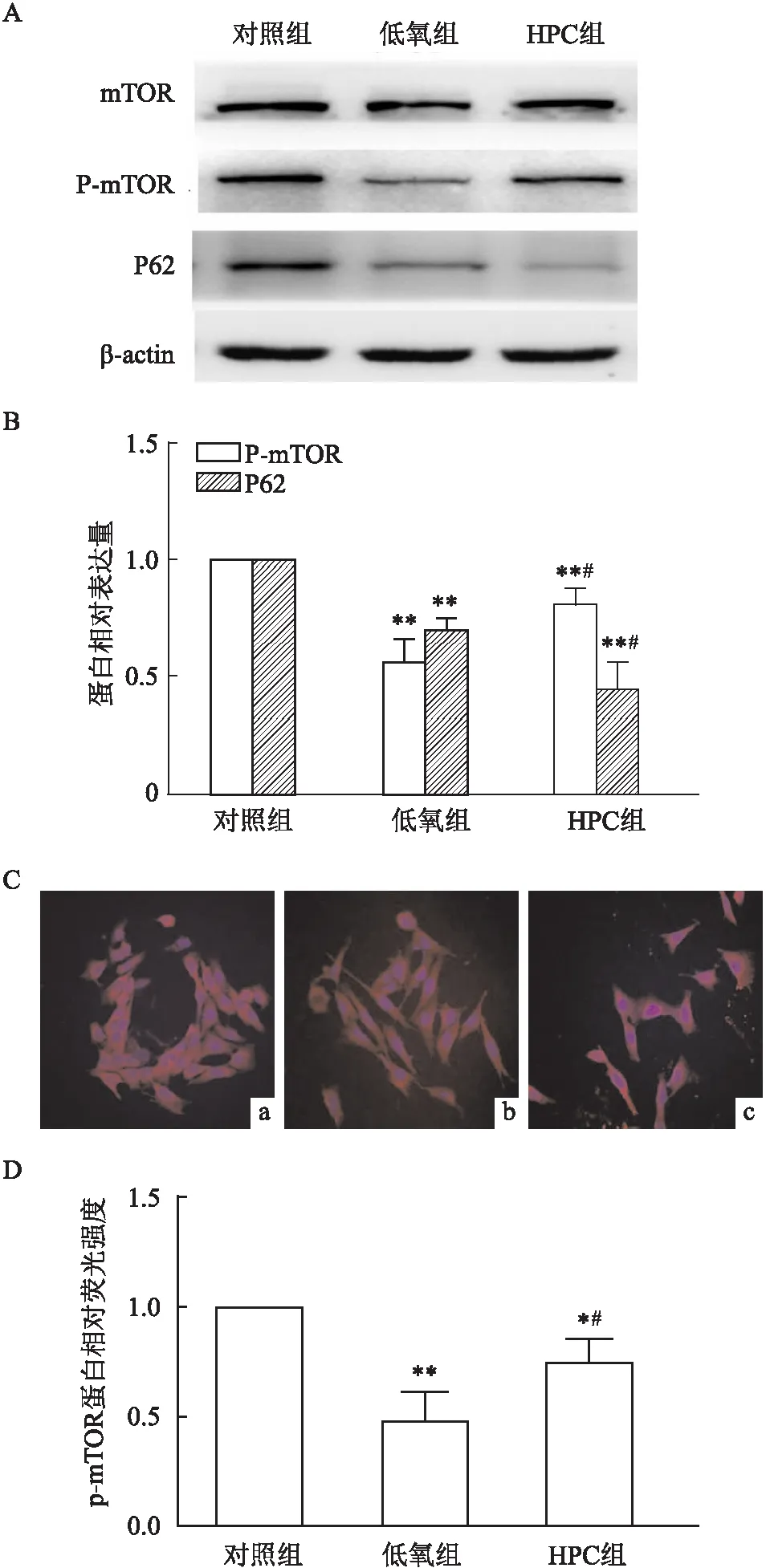
图3 HPC可下调P-mTOR蛋白的表达A:不同组别中各蛋白的Western blot典型图片;B:不同组别中P-mTOR和P62蛋白相对表达量;C:不同组别中P-mTOR蛋白免疫荧光染色 ×400;D:不同组别中P-mTOR蛋白相对荧光强度;a:对照组; b:低氧组; c:HPC组;与对照组比较:*P<0.05,**P<0.01;与低氧组比较: #P<0.05
2.4 HPC增加HT22细胞溶酶体染色与对照组相比,HT22细胞暴露于低氧及HPC后溶酶体染色明显增多,差异有统计学意义(P<0.05,n=6),而与低氧组相比,HPC组溶酶体染色有所增多,差异有统计学意义(P<0.05,n=6)。见图4。
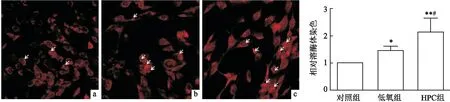
图4 HPC增加溶酶体染色 ×400a:对照组; b:低氧组; c:HPC组;与对照组比较:*P<0.05,**P<0.01;与低氧组比较: #P<0.05
3 讨论
哺乳动物对缺氧的反应有多种机制。急性低氧刺激颈动脉体化学感受器引发呼吸急剧增加,以及慢性一系列的变化,例如通过靶向促红细胞生成素和血管内皮生长的缺氧诱导因子诱导红细胞增殖和血管生成因子[7]。线粒体占细胞耗氧量的大部分,产生ATP是需氧过程。低氧时,线粒体中的电子传递链和氧化磷酸化首先受到影响,从而破坏细胞呼吸的完整性。除此之外,线粒体电子传递链复合物是ROS产生的主要场所。线粒体可以通过产生ROS和代谢物来影响细胞信号传导[8]。而HPC作为一种内源性神经保护机制可能涉及多个过程,如低氧信号通路的激活、抗炎、抗氧化应激和自噬诱导等[9]。
本研究通过体外培养小鼠海马神经细胞HT22,检测HPC对HT22细胞ATP和ROS水平的影响,观察HPC对HT22细胞能量代谢的影响。结果显示,HPC可上调HT22细胞ATP含量,降低ROS水平,并且可下调磷酸化mTOR蛋白表达,激活自噬,从而发挥保护作用。本课题组前期研究[6]结果显示HPC可增加LC3Ⅱ/Ⅰ的表达,为HPC可能通过激活自噬提供进一步实验数据。此外,本研究显示,HPC组磷酸化mTOR的表达高于低氧组,而P62在低氧组表达较低,提示自噬的增加除了mTOR参与之外可能还涉及了其他分子机制,需要进一步研究。
在正常情况下,人体具有有效的内源性抗氧化防御系统。氧化应激是体内氧化与抗氧化失衡的一种状态,可由ROS产生过多或清除ROS的能力下降引起。I/HPC可以降低 ROS 的水平并增加抗氧化酶的水平,以防止神经元损伤[9]。Tan et al[10]报道HPC 可防止 SH-SY5Y 细胞中的氧化应激,其保护机制可能涉及由 HPC 产生的 ROS 诱导的自噬激活引起的。Wu et al[11]报道HPC改善了星形胶质细胞线粒体功能并减少了氧糖剥夺(oxygen glucose deprivation,OGD) 诱导的氧化应激,是通过下调神经元凋亡和ROS水平。本研究结果与上述研究结果是一致的,HPC可通过减少ROS的产生从而减轻HT22细胞氧化应激损伤。
mTOR是一种丝氨酸/苏氨酸激酶,是细胞生长和代谢的中枢调节剂,可整合各种生长抑制信号,如葡萄糖、ATP 和氧气的消耗[12]。同时,mTOR 信号通路也是蛋白质合成和细胞代谢的中央调节器,以响应能量、营养和自噬的变化[13]。自噬是一种进化上保守且依赖溶酶体的过程,用于降解和回收细胞成分。当自噬激活时,溶酶体活动可能也会加快。Lu et al[14]报道,在SY5Y细胞中,HPC通过Hif-1α/Beclin1通路介导的自噬保护神经细胞免受OGD损伤。TSC1(hamartin)通过诱导自噬赋予对缺血的神经保护[15]。本研究结果与上述结果也一致,说明自噬可能被HPC诱导,发挥保护作用。但并不是所有的自噬都是保护作用,只有适度的自噬才能发挥保护作用,而过度的自噬可能促进细胞的死亡。
