RACK1与CLIC1的相互作用鉴定
2022-11-03李彩红朱亮亮王蓓华朱昉修范礼斌
李彩红,朱亮亮,王蓓华,周 恒,李 强,朱昉修,范礼斌
细胞中的氯离子通道在跨膜电位调节、跨上皮细胞运输以及细胞器的酸化等方面起着重要的作用[1]。胞内氯离子通道蛋白1(chloride intracellular channel protein 1,CLIC1)是最先被研究分析的人细胞内氯离子通道蛋白,具有核膜和质膜氯离子通道活性[2]。CLIC1在细胞周期调控[3]、细胞器酸化[4]以及细胞迁移[5]等方面起着重要作用。活化蛋白激酶C受体1(receptor for activated C kinase 1,RACK1)蛋白在进化上非常保守,属于WD重复家族的蛋白,含有7个WD40基序,构成一个β-propeller结构[6]。RACK1可作为支架蛋白参与蛋白质的迁移,从而改变蛋白质的胞内定位来增加或减少蛋白质(酶)的活性,也参与调控蛋白质的翻译和转录因子等的活性[7]。此外,RACK1还可募集激酶和磷酸酶等参与斑点连接的形成[7]。为了探究CLIC1的功能,课题组先前用酵母双杂交的方法从HeLa细胞cDNA文库中筛选到一个CLIC1的结合蛋白,即RACK1。该研究用GST-pulldown、免疫沉淀等方法检测RACK1与CLIC1在体内外的结合情况,观察二者结合情况。
1 材料与方法
1.1 细胞与质粒本实验所用的HEK 293T细胞和COS7细胞株、TG1和BL21菌株均为实验室自存;本实验所用到的质粒pcDNA3.1-CLIC1-FLAG、pGEX-5X-3-RACK1为先前研究[8]所构建,pcDNA3.1-RACK1-HA为本实验构建,引物如下:上游CCAAGCTTGGGGCCACCATGACTGAGCAGATGA,下游GATATCCTAAGCGTAATCTGGAACATCGTATGGG TAGCGTGTGCCAATGGTCA。
1.2 试剂与设备DMEM高糖培养基(北京赛默飞世尔科技有限公司);质粒提取试剂盒(美国OMEGA公司);胎牛血清(澳洲CLARK公司);胰酶细胞消化液(含EDTA)、细胞裂解液、苯甲基磺酰氟(PMSF)、一抗稀释液、Lipofectamine 8000脂质体转染试剂(上海碧云天生物技术有限公司);改良型Bradford法蛋白浓度测定试剂盒(上海生工生物有限公司);质粒小抽试剂盒(美国Axygen公司);Opti-MEM® Medium(美国Invitrogen公司);抗体:FLAG(F1804)(美国Sigma公司);HA(sc-7392)、CLIC1(sc-81873)、RACK1 (sc-17754)、Mouse IgG(sc-52336)(美国Santa Cruz公司);SuperSignal West Pico显色试剂盒(美国Pierce公司);IPTG、辣根过氧化物酶标记的山羊抗小鼠IgG和辣根过氧化物酶标记的山羊抗兔IgG、TRITC标记山羊抗小鼠IgG和AF488标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);谷胱甘肽琼脂糖球珠(美国GE Healthcare公司);A/G 琼脂糖球珠(美国Millipore公司);荧光封片胶(丹麦DAKO公司);Gelx-1620凝胶成像分析系统(上海Bioshine科学仪器有限公司);激光共聚焦显微镜(型号:LSM880,德国Zeiss公司); BSC-II级生物安全柜(美国Thermo公司);光吸收酶标仪(美国Molecular Devices公司);Microfuge 20R高速冷冻离心机(美国Beckman公司)。
1.3 方法
1.3.1细胞培养 待HEK 293T或COS7细胞长满,PBS清洗,胰酶消化收集细胞,以1×105~2×105/cm2的密度接种到含5%胎牛血清的DMEM(100 U/ml青霉素+100 μg/ml链霉素)培养皿中,37 ℃、5% CO2培养过夜。
1.3.2质粒构建 以pcDNA3.1-RACK1-FLAG质粒为模板,PCR扩增出含有HA标签的RACK1的CDS序列,并用试剂盒纯化回收琼脂糖凝胶电泳后的PCR产物,用HindIII和EcoRV双限制酶水解pcDNA3.1载体和纯化的PCR产物,然后用T4连接酶将两者的酶切产物进行连接;连接产物转化至TG1感受态细胞中,37 ℃培养约10 h后挑取单克隆并扩大培养抽提重组的质粒,质粒用HindIII、EcoRV双限制酶酶切鉴定,鉴定正确的质粒送公司测序(通用生物系统有限公司)。
1.3.3质粒转染 前1 d将细胞接种至六孔板中,使得次日HEK 293T或COS7细胞密度能达到约90%或50%。转染前,将培养有细胞的六孔板每孔换成2 ml新鲜完全培养液,然后取一个无菌离心管,于待转染的六孔板中每孔加入所需的Opti-MEM® Medium和目的质粒DNA,再加入适量的 Lipofectamine 8000转染试剂,混合液均匀滴加到孔内混匀,细胞培养48 h后用于检测蛋白表达或24 h后用于免疫荧光制片。
1.3.4GST、GST-RACK1的表达及纯化 将质粒pGEX-5X-3或pGEX-5X-3-RACK1转化到BL21大肠杆菌中,挑取单克隆至含有2 ml LB培养基(含氨苄)中37 ℃摇菌过夜。次日取500 μl 菌液到含50 ml LB(含氨苄)扩大培养,至OD600为0.4~0.6;30 ℃下,分别加入适宜浓度的诱导剂IPTG诱导其表达,收集细菌;细菌裂解液裂解,超声破碎;4 ℃、14 000 r/min离心10 min,取上清液,分装,-80 ℃冻存。分别取一管上清液离心并加入谷胱甘肽琼脂糖球珠,于4 ℃混悬孵育2 h,孵育结束后离心弃上清液,沉淀用GST结合缓冲清洗液清洗后备用。
1.3.5GST-pulldown实验 质粒转染HEK 293T细胞48 h后,离心收集细胞,然后向细胞中加入适量裂解液,裂解后的上清液加入到纯化好的GST或GST融合蛋白,4 ℃混悬孵育4 h,离心收集谷胱甘肽琼脂糖珠子,珠子中加入SDS上样缓冲液,变性后进行十二烷基硫酸钠聚丙酰烯胺凝胶电泳(SDS-PAGE)。
1.3.6免疫共沉淀实验 质粒转染HEK 293T细胞(内源性免疫沉淀中细胞不转染质粒),48 h后收集细胞,然后加入适量细胞裂解液,裂解结束向裂解液中加入适量的FLAG抗体,4 ℃混悬2 h。结束后加入20 μl A/G 琼脂糖球珠,4 ℃混悬4 h。离心并收集珠子。最后加SDS上样缓冲液变性,对照样品(细胞裂解液)直接用SDS上样缓冲液变性。
1.3.7免疫荧光实验 质粒转染后约24 h,取出长有COS7细胞的盖玻片,用预冷的甲醇固定,然后用1%脱脂牛奶封闭,室温一抗孵育2 h、二抗孵育1 h(一抗、二抗均用1%脱脂牛奶稀释,稀释比例1 ∶100),DAPI孵育细胞3 min,最后用封片胶封片,4 ℃保存,激光共聚焦显微镜观察拍摄。
1.3.8Western blot法检测蛋白表达 SDS-PAGE后,凝胶上的蛋白电转至PVDF膜上(PVDF膜临用前用甲醇活化)。PVDF膜用脱脂牛奶封闭1.5 h,然后用相关的适量一抗(1 ∶1 000)4 ℃孵育过夜,然后再用二抗(1 ∶2 500)室温孵育1.5 h,最后用ECL试剂盒显色并在蛋白成像仪上进行拍摄。
2 结果
2.1 pcDNA3.1-RACK1-HA重组质粒构建以pcDNA3.1-RACK1-FLAG作为模板,用PCR法将RACK1全长cDNA序列构建到pcDNA3.1载体中。构建的重组质粒双酶切(HindIII、EcoRV)4 h后,酶切产物进行琼脂糖凝胶电泳(图1A)。图中酶切后的质粒呈现两条DNA带,下端的DNA带分子量与预测的RACK1全长序列分子量一致。构建的质粒送公司测序,测定的序列与RACK1全长序列相同(图1B)。
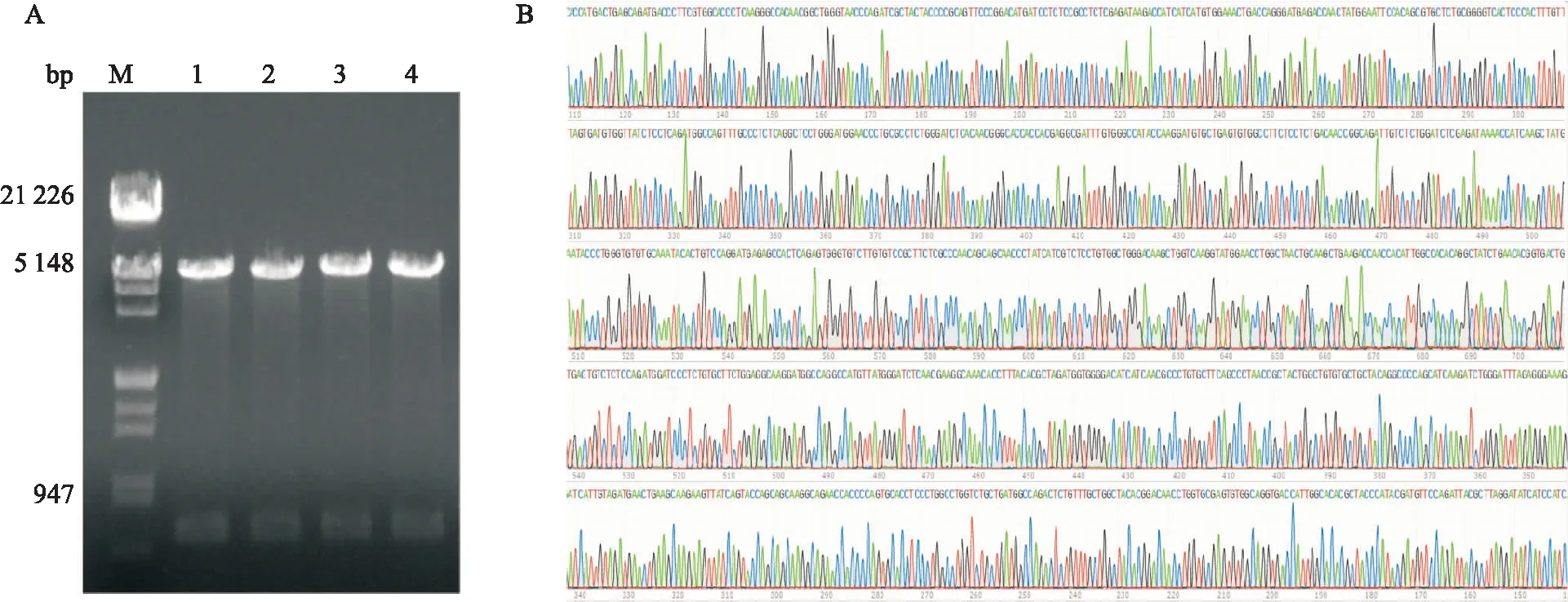
图1 pcDNA3.1-RACK1-HA重组质粒构建A:pcDNA3.1-RACK1-HA重组质粒酶切电泳结果;M:λDNA/EcoRⅠ+HindⅢ Marker;1~4:随机挑取的细菌克隆的质粒DNA;B:pcDNA3.1-RACK1-HA重组质粒中全长RACK1序列测序结果
2.2 CLIC1与RACK1可在体外结合转染CLIC1-FLAG的HEK 293T细胞经裂解后,裂解液与预先纯化好的GST和GST-RACK1融合蛋白在4 ℃混悬仪孵育(孵育前取适量裂解液作为对照),样品经Western blot检测后,结果见图2,用FLAG抗体印迹后,细胞裂解液中有较强的CLIC1表达(27 ku)(图2A,泳道1)。对照组(图2A,泳道2)无蛋白带,显示GST不能结合CLIC1-FLAG;而样品组中GST-RACK1可以结合CLIC1-FLAG(图2A,泳道3)。图2B显示共孵育溶液中GST(25 ku)(泳道2)和GST-RACK1(62 ku)(泳道3)。此结果表明CLIC1可在体外结合RACK1。

图2 CLIC1与RACK1的GST-pulldown结果1:pcDNA3.1-CLIC1-FLAG的细胞裂解液;2:转染pcDNA3.1-CLIC1-FLAG的细胞裂解液与已纯化的GST共孵育;3:转染pcDNA3.1-CLIC1-FLAG的细胞裂解液与已纯化的GST-RACK1共孵育
2.3 CLIC1可体内结合RACK1将pcDNA3.1-CLIC1-FLAG与pcDNA3.1-RACK1-HA两种质粒共转染至HEK 293T细胞48 h后,裂解细胞,细胞裂解液(Lysates)经FLAG抗体孵育和A/G琼脂糖球珠沉淀后,对蛋白样品进行免疫印迹,结果见图3。从图3中可以看到,FLAG抗体沉淀中存在RACK1(泳道4),而对照中(泳道3)不存在。此结果表明过表达的CLIC1和RACK1可在HEK 293T细胞中结合。
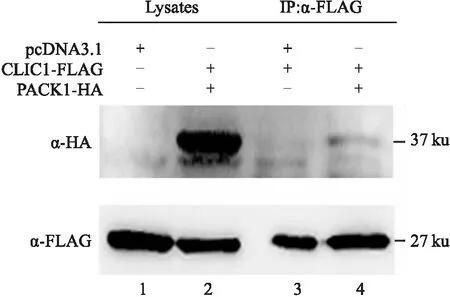
图3 RACK1与CLIC1的免疫共沉淀结果1:载体pcDNA3.1和pcDNA3.1-CLIC1-FLAG共转的细胞裂解液;2:pcDNA3.1-RACK1-HA和pcDNA3.1-CLIC1-FLAG共转的细胞裂解液;3:载体pcDNA3.1和pcDNA3.1-CLIC1-FLAG共转的细胞裂解液与FLAG抗体以及A/G琼脂糖球珠孵育后的沉淀;4: pcDNA3.1-RACK1-HA和pcDNA3.1-CLIC1-FLAG共转的细胞裂解液与FLAG抗体以及A/G琼脂糖球珠孵育后的沉淀
为了确定细胞中内源性的CLIC1和RACK1是否可以结合,本研究直接裂解HEK 293T细胞,裂解液(Lysate)与RACK1抗体孵育(对照与鼠IgG孵育),然后用A/G琼脂糖球珠沉淀,最后进行免疫印迹分析。结果(图4)表明293T细胞均含有丰富的CLIC1和RACK1蛋白(泳道1),RACK1抗体沉淀中含有CLIC1(泳道3),而对照抗体沉淀中没有CLIC1(泳道2)。
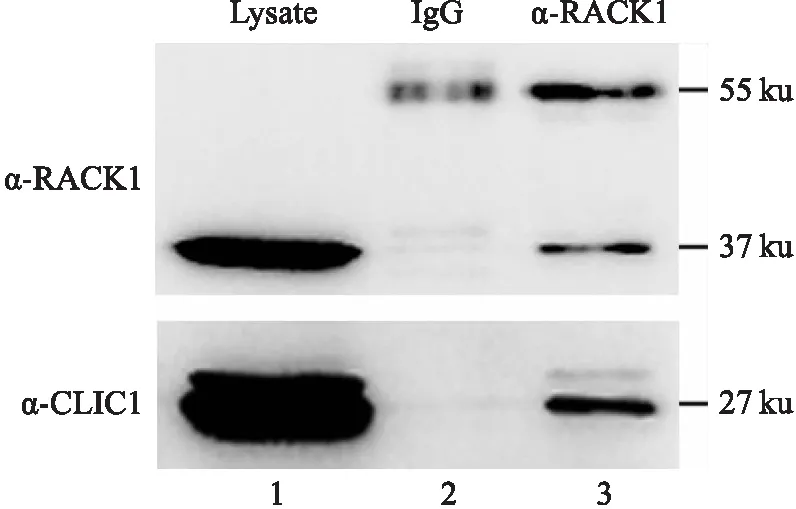
图4 RACK1与CLIC1的内源性免疫沉淀结果1:HEK 293T细胞裂解液;2:鼠IgG和A/G琼脂糖球珠与细胞裂解液孵育后的沉淀;3:RACK1抗体和A/G琼脂糖球珠与细胞裂解液孵育后的沉淀
上述实验证实了在细胞中CLIC1可与RACK1结合。
2.4 RACK1与CLIC1在COS7细胞中的定位蛋白质在细胞中的共定位可为蛋白质之间的结合提供进一步的证据。为此,本研究在COS7细胞中共转染了质粒pcDNA3.1-RACK1-HA和pcDNA3.1-CLIC1-FLAG,转染24 h后进行免疫荧光制片,并用荧光显微镜观察拍摄。结果表明,在COS7细胞中,CLIC1和RACK1在胞质中具有明显的共定位(图5)。
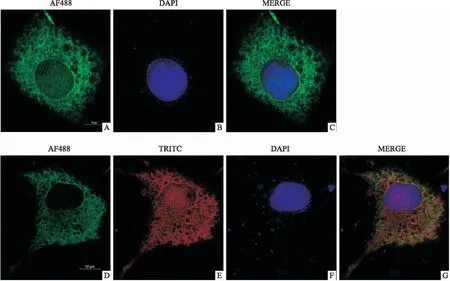
图5 RACK1与CLIC1在COS7细胞中的共定位 ×400A-C:过表达的pcDNA3.1-RACK1-HA在细胞中的分布;D-G:过表达的pcDNA3.1-CLIC1-FLAG和pcDNA3.1-RACK1-HA的共定位;AF488:绿色(pcDNA3.1-RACK1-HA);DAPI:蓝色(细胞核);TRITC:红色(pcDNA3.1-CLIC1-FLAG);MERGE:叠加
3 讨论
RACK1是一个进化上高度保守的蛋白质,主要由7个WD40结构域组成[6],许多实验都表明RACK1是一个介导细胞内多种功能的支架蛋白。例如RACK1可以介导蛋白激酶C β转移到合适的胞内部位,并活化PKCβ[6];已报道的RACK1结合蛋白基本上都是与RACK1羧端的WD40结构域结合,例如β整合素蛋白、Src激酶等[6]。本研究中过表达免疫沉淀实验也表明CLIC1与RACK1的羧端结合(结果尚未发表)。
研究发现的一类氯离子通道蛋白(chloride intracellular channel,CLIC)家族由7个成员组成,成员之间的序列相同性介于47%~76%[9],均具有介导氯离子跨膜运输和谷氧化还原蛋白样(glutaredoxin-like)活性[10]。不同的CLIC蛋白在细胞内也具有自身特有的功能,例如胞内氯离子通道蛋白4(chloride intracellular channel protein 4,CLIC4)在细胞中过表达可诱导细胞的凋亡[11]。CLIC1含有一个保守的谷胱甘肽-S-转移酶折叠并具有该酶活性,受到氧化时,CLIC1可形成二聚体并与其通道活性密切相关[12]。CLIC1是作为细胞内的氯离子通道而被分析鉴定的,它可以在人工膜中形成离子通道,其通道活性受到pH的影响。有研究[5]显示CLIC1可以影响肿瘤细胞的迁移性,而且对其机制有所了解。有研究[13]表明定位于质膜的CLIC1可以募集胞质中的PIP5K1A和PIP5K1C到质膜的前移部位,产生富含PIP2的微结构域以诱导整合素介导的细胞-基质黏附并发出细胞骨架延伸的信号,启动“PIP2-talin-integrin”信号通路,促进细胞基质黏附形成和信号转导,从而在肿瘤转移过程中对细胞的片状伪足和丝状伪足进行时空调控,此结果初步阐明了CLIC1介导肿瘤细胞转移的一个可能的机制。由于RACK1和CLIC1在细胞质膜上都有分布(本实验表明CLIC1存在于多种细胞的质膜上),而且RACK1可以介导蛋白激酶C转移到质膜并活化蛋白激酶C,这些为进一步研究RACK1和CLIC1在细胞质膜上的关系并探讨其功能提供了重要线索。
在血清刺激后,细胞中RACK1表达明显上调,提示RACK1可能参与细胞周期的调节[6],而CLIC1也参与细胞周期中G2/M期的转变[4],且在许多肿瘤细胞中CLIC1都是高表达的[14],因此在未来的研究中有必要详细解析RACK1和CLIC1的相互作用对细胞周期影响的机制。
本研究利用GST-pulldown、免疫共沉淀以及间接免疫荧光显微技术证明RACK1与CLIC1可以在细胞中相互结合。
