非团聚二钼酸铵热分解机理及热力学分析
2022-11-01何江山佀龙祥雷宁宁李玉涛
何江山,佀龙祥,刘 涛,雷宁宁,李玉涛,李 莉
(金堆城钼业股份有限公司化学分公司,陕西 渭南 714000)
0 前 言
二钼酸铵是钼产业链上重要的化工产品之一,作为终端产品,其应用于染料、颜料、防火剂、微量元素肥料[1]、石油精炼催化剂、重整催化剂领域[2];作为中间产品,是生产纯三氧化钼、钼粉以及后续钼制品的主要原料。二钼酸铵分为非团聚二钼酸铵和普通团聚态二钼酸铵,普通的二钼酸铵为多晶体聚合体,在热分解后易形成团聚态三氧化钼,进一步还原获得的钼粉形貌不一,无流动性;而非团聚二钼酸铵经过热分解、还原得到的钼粉流动性好、形貌规则、产品的一致性较好[3]。研究认为:颗粒大小均匀、无团聚的钼粉对钼丝、钼棒、钼板及钼溅射靶材等钼金属制品的性能和品质有着积极作用[4-7]。可见,非团聚二钼酸铵更适合作为钼深加工的原料。
目前,钼酸铵热分解研究集中在仲钼酸铵热分解机理及热分解产物形貌的探讨,且观点不尽相同[8-12]。关于二钼酸铵热分解过程及机理,程时定[13]认为二钼酸铵热分解分为两步:
第一步反应温度在180 ℃左右,反应方程式为:
(1)
第二步反应温度为300 ℃左右,反应方程式为:
(2)
本文以连续蒸发结晶工艺生产的非团聚二钼酸铵为原料,其热分析数据为依据,提出并论证非团聚二钼酸铵热分解过程机理,估算非团聚二钼酸铵热分解焓变及中间产物相关热力学数据,进一步充实非团聚二钼酸铵热分解相关数据,从而指导生产。
1 试验部分
1.1 试验原料
试验原料来自连续蒸发结晶工艺生产的非团聚二钼酸铵,其物理化学指标见表1。

表1 原料二钼酸铵指标
1.2 试验步骤
称取一定量的非团聚二钼酸铵样品放入德国耐驰SDT Q600型DSC-DTG综合热分析仪进行热分解试验,测量其在室温至800 ℃温度范围内的DSC-DTG曲线,升温速度为5 ℃/min。分析二钼酸铵的热分解过程。利用日本理学电机公司D/max-γ B型X-射线衍射仪(Cu Ka 靶, λ=0.154 06 nm)、Hitachi S-3400型扫描电镜分析非团聚二钼酸铵和热分解产物的结构及形貌。
2 试验结果与讨论
2.1 非团聚二钼酸铵的结构和形貌
非团聚二钼酸铵的XRD图谱见图1。由图1可以得出:该物相所有衍射峰均与标准卡片图谱PDF(37-0379)(a=7.947 Å,b=7.282 Å,c=7.269 Å)相吻合,没有杂质峰的出现,说明是较纯的二钼酸铵;该二钼酸铵晶体属于斜方晶系P-1(2)空间族群。

图1 非团聚二钼酸铵的XRD图谱
图2是非团聚二钼酸铵的SEM,由图2可以看到:非团聚二钼酸铵形貌整体均一,颗粒之间无相互粘连现象;此外,单个晶体棱角分明,晶体表面较为光滑,如图2(b)所示。图2为非团聚二钼酸铵微观形貌的典型特征。

图2 非团聚二钼酸铵SEM图(a:×50,b:×200)
2.2 非团聚二钼酸铵的差热分析
图3为非团聚二钼酸铵在室温至800 ℃范围内的TGA-DTG曲线。从图3可以看出:非团聚二钼酸铵在190 ℃左右开始失重,在室温至800 ℃温度范围内共出现4个失重阶段,第1阶段在196.79~206.63 ℃温度区间,第2阶段为227.55~235.15 ℃温度区间,第3阶段为278.06~305.658 ℃温度区间,第4阶段为735.97~800 ℃温度区间,以上4个阶段失重率分别为5.346%、2.578%、7.547%和8.540%。由二钼酸铵热分解反应方程式(1)可知:二钼酸铵热分解从开始反应至完成总失重率的理论值为15.297%,这与前3个阶段的失重总量基本一致。因而,可以断定第4阶段的失重是由于二钼酸铵经历前3个阶段的热分解产物超过自身沸点后气化造成的,故非团聚二钼酸铵热分解实质上是经历了前3个阶段。从图3中DTG曲线可以看出:DTG曲线峰顶点与TGA曲线的拐点位置一一对应,为失重速率最大值点,位于200.7 ℃、230.5 ℃和292.8 ℃。

图3 二钼酸铵热分解的TGA-DTG曲线
通过上述分析,非团聚二钼酸铵热分解过程可以描述如下:
总反应方程式:

(3)
第1阶段:

(4)
第2阶段:
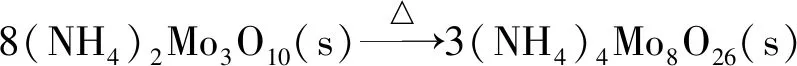
(5)
第3阶段:
(6)
从上述非团聚二钼酸铵热分解反应可以看出:非团聚二钼酸铵热分解过程与仲钼酸铵热分解[8]过程很相似,在热分解的前3个阶段失去的NH3和H2O的摩尔比都为2∶1,不同的是非团聚二钼酸铵的热分解过程不存在结晶水失去环节。
非团聚二钼酸铵不同温度范围失重情况见表2。从表2可以看出:第1阶段实际失重率略大于理论失重率,可能的原因是二钼酸铵自身所含水分和进行热分解试验前吸收了空气中的水分所致;第3阶段实际失重率略小于理论失重率,可能的原因是二钼酸铵中存在一定量的杂质或试验过程中焙烧条件控制上的误差所致;总体来讲,3个阶段的实际失重率与理论失重率基本吻合。因此,非团聚二钼酸铵的热分解机理可以用式(4)~(6)3个反应方程式进行解释。
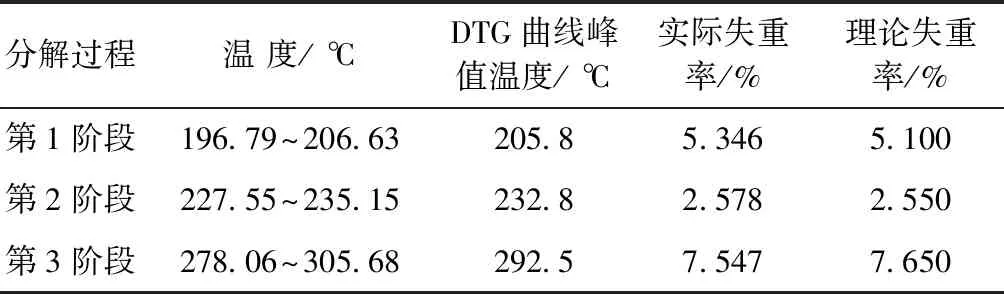
表2 非团聚二钼酸铵在196.8~305.7 ℃温度范围的失重情况
2.3 非团聚二钼酸铵热分解产物的结构和形貌
图4是非团聚二钼酸铵热分解产物的XRD图谱。从图4可以看出:几个主要的衍射峰出现的位置2θ分别为:12.78°、23.34°、25.67°、25.88°和27.34°,分别对应的晶面为(020)、(110)、(040)、(120)和 (021),与标准卡片PDF35-0609上的衍射峰出现位置基本吻合,产物为正交相MoO3[空间点群为Pbnm(62)]。衍射峰强度高且尖锐,没有杂峰,说明产物MoO3纯度较高。
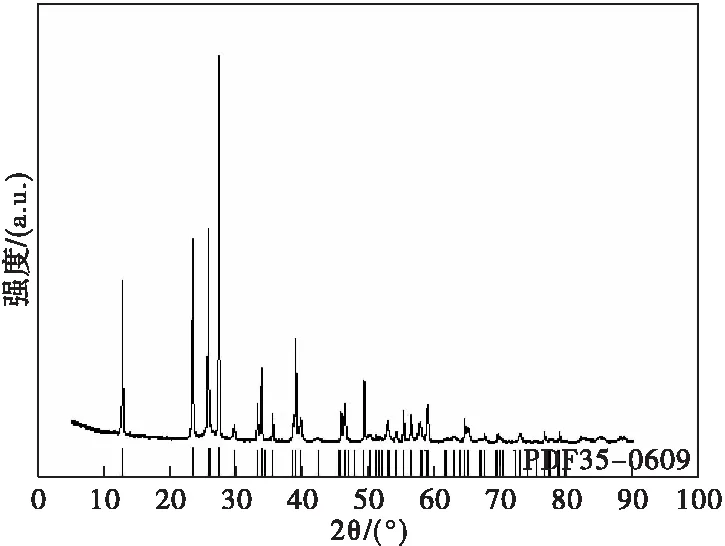
图4 非团聚二钼酸铵热分解产物XRD图谱
图5是非团聚二钼酸铵热分解产物MoO3的SEM图,整体形貌[图5(a)]“遗传”了母体非团聚二钼酸铵的形貌,可以清晰地看出,MoO3单个颗粒表面比较粗糙多孔。这种形貌的形成机理可用“扩散模型”来解释,“扩散模型”认为二钼酸铵晶体表面分子受热脱去NH3、H2O后,形成疏松多孔的MoO3膜,随着反应的进行,MoO3膜层逐步向二钼酸铵中心扩散,NH3、H2O以疏松多孔的孔膜结构为通道向晶体表面扩散,最终形成这种粗糙多孔形貌的MoO3[3]。

图5 非团聚二钼酸铵热分解产物SEM图
2.4 非团聚二钼酸铵热分解
图6是非团聚二钼酸铵在室温至800 ℃范围内的DSC曲线,由图6可见:在室温至800 ℃温度区间共出现4个强吸热峰,前3个吸热峰的顶点分别位于204.48、233.48和293.75 ℃,代表着非团聚二钼酸铵分解过程中的3个相变转换点。其所对应的位置与图3中TGA-DTG曲线峰所对应的位置基本一致。前3个阶段DSC曲线吸热峰面积为非团聚二钼酸铵热分解过程3个阶段的焓变值△H,分别为60.64、16.82和99.90 kJ/mol。

图6 非团聚二钼酸铵热分解DSC曲线
2.5 非团聚二钼酸铵及其热分解产物的热力学数据估算
MoO3(s)、NH3(g)、H2O(g)在标准状态(25 ℃、101 kPa)下的热力学数据,见表3[14]。

表3 几种物质在标准状态下的热力学数据
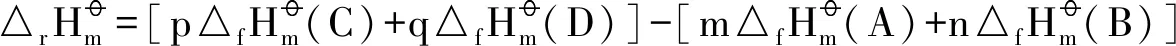
式中m、n、p、q分别是反应物A、B和生成物C、D的化学计量数。针对非团聚二钼酸铵热分解的3个化学反应方程式(4)~(6),结合表3中MoO3(s)、NH3(g)、H2O(g)热力学数据及DSC 3个阶段吸热峰面积(即焓变值),首先可推算出中间产物(NH4)4Mo8O26(s) 的标准摩尔生成焓,进而推算出(NH4)2Mo3O10(s)和(NH4)2Mo2O7(s)的标准摩尔生成焓。如式(6)所示第3阶段反应焓变计算过程如下:



由以上数据可求得非团聚二钼酸铵热分解标准摩尔焓变为:

因此,非团聚二钼酸铵的热分解反应为吸热反应。
3 结 论
(1)非团聚二钼酸铵在室温至800 ℃范围内热分解过程分为连续的4个阶段,各阶段反应温度区间分别为196.79~206.63 ℃、227.55~235.15 ℃、278.06~305.68 ℃和735.97~800 ℃,前3个阶段为二钼酸铵热分解生成三氧化钼的过程,其反应机理见反应方程式(4)~(6)。
每个阶段失去摩尔比为2∶1的NH3和H2O,当温度高于304 ℃时,热分解过程趋于结束,产物为正交相的纯MoO3。当温度高于735 ℃时,三氧化钼在超过自身沸点后气化。
(2)通过非团聚二钼酸铵的DSC试验数据推算出中间产物(NH4)4Mo8O26(s)、(NH4)2Mo3O10(s)以及非团聚二钼酸铵(NH4)2Mo2O7(s)在实验室条件下的标准摩尔生成焓分别为:-6 730.94、-2 609.92、-1 871.77 kJ/mol,非团聚二钼酸铵热分解标准摩尔焓变为46.59 kJ/mol,说明非团聚二钼酸铵的热分解反应为吸热反应。
