高稳定性SrF2-Na2O-Fe2O3-P2O5体系氟磷酸盐玻璃的制备与表征
2022-11-01李秀英陶歆月肖卓豪贺一峰李朝圆孔令兵
李秀英,陶歆月,肖卓豪,贺一峰,李朝圆,夏 莹,孔令兵
(1.景德镇陶瓷大学材料科学与工程学院,景德镇 333403;2.深圳技术大学新材料与新能源学院,深圳 518118)
0 引 言
90Sr是235U的主要裂变产物(产率为6%),235U衰变过程中会释放出高能γ射线和大量热[1-3]。乏燃料干法后处理过程中常用卤化物作稀释剂[4-5],所得高水平放射性废物(high level radioactive waste, HLW)中有较高含量的90SrF2;熔盐堆作为未来优先发展的第四代核反应堆,其废物中90SrF2的含量也较高[6-8]。将90SrF2从核电废液里分离出来,则高水平放射性废液变成了中、低水平放射性放废液,可达到放射性废物减容降级,降低固化成本的目的[5-6]。核电站产生的另一类重要废物是高Na2O、Fe2O3、P2O5含量的高水平放射性废物,其中Na2O、Fe2O3、P2O5的总质量分数高达65%~88%,此外还含有一定量的重金属氧化物[9-11](如Bi2O3[12]、MoO3、MnO2、NiO)和少量锕系核素[13-14]。随着核电能源在我国能源供给占比的提高,核电废物的产量也将成倍增长,安全固化90SrF2或高Na2O、Fe2O3和P2O5含量的HLW具有广阔的应用前景。
卤化物和高Na2O、Fe2O3、P2O5含量的HLW在磷酸盐玻璃中的溶解度大,不易造成磷酸盐玻璃固化体分相,玻璃固化体熔融温度低于1 150 ℃,F元素的质量损失急剧降低,明显减弱了对固化设备的腐蚀和对环境的污染[2,6]。因此,与目前工业化应用的硼硅酸盐玻璃基质相比,磷酸盐玻璃尤其是含铁磷酸盐玻璃基质更适用于固化这两类废物。目前为止,用铁磷酸玻璃单独固化卤化物HLW和高Na2O、Fe2O3、P2O5含量的HLW已有部分研究,固化前者所得玻璃固化体主要有Fe2O3-卤化物-P2O5[6,15]和Fe2O3-B2O3-卤化物-P2O5体系[8],固化后者所得玻璃固化体有Fe2O3-P2O5(IP)[12]、Na2O-Fe2O3-P2O5(SIP)[12]、PbO-Fe2O3-P2O5(LIP)等体系[9-11]。这些玻璃固化体的化学稳定性好,但废物包容量普遍<20%(质量分数)[6,12],若提高废物掺量,玻璃固化体热稳定性不满足HLW固化要求;若降低废物掺量,则需要深埋处理的玻璃固化体体积激增,废物处理成本增加。为实现90Sr和F的同时固化,需尽量降低玻璃固化体的熔融温度,目前文献基本采用两步熔融法来实现。此法先在较高温度(1 200~1 300 ℃)下熔融得到均匀的玻璃基质,然后将其磨成粉与模拟废物混合,再在较低温度(950~1 050 ℃)下二次熔融后得到玻璃固化体[15-17]。两步熔融法虽然能降低熔融温度,然而其能耗高,工艺复杂,不利于批量处理HLW。
高Na2O、Fe2O3、P2O5含量的HLW中的Na2O能有效降低磷酸盐玻璃的黏度和熔融温度,Fe2O3对提高磷酸盐玻璃耐水性和降低热膨胀系数有利,P2O5是玻璃网络形成体。如果将两类废物按一定比例混合,补充一定量的Na2CO3、Fe2O3、P2O5等原料,用简化的制备工艺(一步熔融法)来制备以SrF2、Na2O、Fe2O3、P2O5为主要组成的高稳定性玻璃固化体从理论上分析是可行的,但相关研究目前尚未见文献报道。玻璃固化体配方的确定是HLW玻璃固化的核心技术,本文研究了SrF2-Na2O-Fe2O3-P2O5体系玻璃的制备及表征,旨在为高废物包容量、高稳定性且联合固化了上述两类HLW的玻璃固化体的配方设计提供理论指导。此外,本研究对探明氟磷酸盐玻璃组成-结构-性能的内在联系有重要意义。
1 实 验
1.1 样品制备
将SrF2、Na2CO3、Fe2O3、P2O5、H3BO3、MoO3等原料(均为分析纯)按表1中的化学计量比混合,研磨均匀制得玻璃配合料。考虑到P2O5在玻璃熔制过程中的挥发损失,根据经验配料时过量5%(质量分数)。将配合料置于刚玉坩埚中,缓慢升温至450 ℃并保温1 h,随后坩埚加盖继续升温至1 000 ℃并在此温度下保温0.5 h得到熔体,熔体经浇筑成型、退火后得到玻璃。对于部分样品,本研究还通过对其进行晶化热处理来制得相应的微晶玻璃样品。
1.2 样品表征
采用深圳达宏美拓数显密度仪(Dahometer, DA-600M型)测定玻璃的密度(ρ),精确到0.01 g/cm3,两次测试取平均值。采用Axiosmax型X射线荧光光谱仪测定玻璃的实际化学组成,为避免高温熔融玻璃粉制样过程中F、P等元素的质量损失,XRF测试采用室温硼酸压片制样技术。采用Bruker D8 Advance型X-射线衍射仪对样品进行物相鉴定,2θ角扫描范围为10°~80°,扫描步长为0.02°,Cu靶,入射波长为0.154 06 nm。采用美国Nicolet Nexus型红外光谱仪测定玻璃的红外光谱(IR)。采用德国NETZSCHDIL 402C型热膨胀仪获得玻璃的热膨胀曲线,根据热膨胀曲线确定样品的热膨胀系数(coefficient of thermal expansion, CTE)。本文取各样品室温~300 ℃的平均热膨胀系数(α室温~300 ℃)来比较CTE值随样品组分的变化规律。根据CTE曲线还可以确定玻璃的转变温度(Tg(Dil))和软化温度(Tf),其中Tf值为CTE最大值所对应的温度,Tg(Dil)值为CTE值突变时所对应的温度,将曲线转折点两侧的直线外延,两条外延线的交点即为Tg(Dil),Tg(Dil)和Tf的取值误差为±5 ℃。采用NETZSCH404PC型差热分析仪测定玻璃的差热分析曲线(DTA),升温速率为10 ℃/min,氩气气氛,温度范围为室温~1 000 ℃。通过DTA曲线可以获得玻璃转变温度(Tg(DTA))、开始析晶温度(Tc)和析晶峰值温度(Tp)。Tg(DTA)和Tc分别取DTA曲线中吸热峰和第一个析晶放热峰的初始温度,将两个峰初始点两侧的直线外延,外延线的交点即为Tg(DTA)和Tc,Tg(DTA)、Tc和Tp的取值误差为±5 ℃。Tc与Tg(DTA)的差值即为样品的热稳定性参数(KA)值。
根据溶解速率法测定玻璃在去离子水中的浸出速率(DRWater),DRWater值越小说明耐水性越好。将玻璃加工成规则的长方体(20 mm×10 mm×10 mm)悬挂于特氟龙瓶中,用120 mL去离子水将其浸没,螺旋加盖后置于烘箱中,90 ℃保温7 d。DRWater=ΔW/At,式中ΔW是玻璃腐蚀前后的质量差(g),A为表面积(cm2),t为腐蚀时间(min),DRWater值取两次测试的平均值。本研究还根据放射性废物固化体耐水性测试方法(ASTM C1285-14标准中的产品一致性测试方法(product consistency test, PCT))测定各元素的归一化浸出率NLi(g/m2)。将颗粒粒径为75~150 μm的玻璃粉末与去离子水以每克粉末加10 mL去离子水的比例在反应釜中混合,密封后将反应釜置于90 ℃烘箱中保温7 d。NLi=Ci/[(SA/V)×fi],式中Ci为浸出液中各元素的浓度(g/L),利用PerkinElmer公司Optima 8000型电感耦合等离子体发射光谱仪(ICP-AES)测得;fi为粉末中各元素的质量分数,由XRF测得;SA为玻璃粉的总表面积(m2);V为浸出液体积(L)。根据玻璃粉的比表面积SAsp(m2/g)结合浸泡试验过程中每克粉末加10 mL去离子水,计算出SA/V值。本文计算得到A1、A3、A5样品的SA/V值分别为1.81 m2·L-1、1.64 m2·L-1和1.58 m2·L-1。ASTM C1285-14标准中假定玻璃粉末为理想的球形,并利用平均筛分粒度(d=1.12×10-4m)以及各玻璃样品的密度带入公式SAsp=6/ρd算得SAsp值。因ICP-AES不能准确测定浸出液中F元素的浓度,本研究未计算该元素的归一化质量损失。
2 结果与讨论
2.1 玻璃形成能力及实际组成
本研究制备了A、B两个系列的7个玻璃样品,样品中SrF2的摩尔分数为20%~40%,其详细配方见表1,宏观形貌照片如图1所示。A系列样品中,当SrF2的摩尔分数不高于30%时(A1~A3),样品均匀、不开裂且有玻璃光泽,无不熔物;当SrF2的摩尔分数高于30%时(A4、A5),样品失去玻璃光泽且表面分布少量白点。B系列样品均匀,有玻璃光泽。图2是所有样品的XRD谱。从图2可知,除了A4和A5外,其他样品均为玻璃态;A4和A5的XRD谱非常相似,样品的析晶度较高,主要析出Sr2P2O7晶相,此外还有少量Sr5Fe3F19晶相。上述结果表明A系列样品组分的成玻能力随SrF2含量的升高或随P2O5/SrF2摩尔比的降低而逐渐降低;B系列样品组分的成玻能力较强,用摩尔分数为5%的B2O3或者MoO3来取代A1中的P2O5不会降低成玻能力。表2列出了A1、A3和A5这3个样品中各元素的理论质量百分比,以及通过XRF测定的各元素的实际质量百分比。实测结果中包含多种低含量的杂质元素,各样品中杂质元素的总质量分数在1.6%~1.8%,主要来源于原料以及氧化铝坩埚(玻璃液对坩埚的腐蚀使熔体中混入一定量的Al2O3)。综合分析这3个样品中各元素的实测和理论质量百分比发现:玻璃中Sr、Na、Fe元素的含量变化较小,表明其在玻璃熔制过程中的质量损失小;F元素的实际含量明显低于理论值;P和O元素的实测值均高于理论值。

表1 样品配方、熔制结果、密度及浸出速率Table 1 Composition, melting result, density and dissolution rate of samples

表2 A1、A3和A5样品的理论组成及实测组成Table 2 Theoretical composition and actual composition of A1, A3 and A5 samples
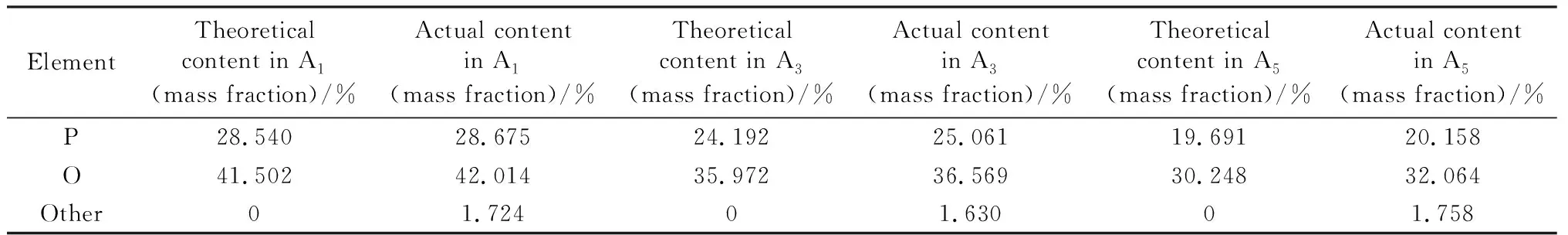
续表

图1 样品的宏观形貌照片Fig.1 Macro-morphological images of samples

图2 样品的XRD谱Fig.2 XRD patterns of samples
从XRF测试结果来看,即使将样品的熔制温度降低至1 000 ℃,保温时间缩短至0.5 h,A1、A3和A5中的F亦有30%~34%的质量损失。文献研究表明F的质量损失现象在氧氟玻璃的制备过程中非常普遍,其含量受玻璃组成及熔制条件的影响较大。比如,Ehrt等[18]制备的MgF2-(0.4AlF3+0.6CaF2)-Sr(PO3)2和ZnF2-AlF3-Pb(PO3)2玻璃中F的质量损失随玻璃组成的变化在30%~40%变动。800 ℃保温0.5 h制备的40(PbF2+CdF2)-60PbGeO3/(GeO2+PbO)和40PbF2/CdF2-60PbGeO3/(GeO2+PbO)玻璃中F的质量损失因玻璃组成的不同在13%~55%(摩尔分数)范围内波动;800 ℃保温不同时间(5 min、10 min、15 min、30 min)制得的20PbF2-20CdF2-60PbGeO3玻璃中F的质量损失因熔融时间的不同在5%~28%(摩尔分数)波动[19]。磷酸盐玻璃中掺入F会使玻璃网络结构解聚,部分P—O—P键断裂,桥氧转变为非桥氧,从而影响玻璃的物理和化学性能[1,18]。因此,熔制过程中F的质量损失会影响玻璃结构和性能的可重复性。如何减少玻璃制备过程中的F的质量损失有待进行深入研究。系统研究SrF2-Na2O-Fe2O3-P2O5玻璃组成及制备工艺的优化,可以使玻璃熔融温度进一步降低,熔融保温时间尽可能缩短,最终达到降低F的质量损失的目的。
2.2 耐水性
本研究制备的A3~A5样品的DRWater值均在10-8g·cm-2·min-1数量级,其他样品在10-7g·cm-2·min-1数量级(见表1)。随着P2O5/SrF2摩尔比的降低,A系列样品的DRWater值从10-7g·cm-2·min-1降低至10-8g·cm-2·min-1数量级,耐水性明显增强,说明通过降低P2O5的含量能显著提高磷酸盐玻璃的耐水性。对于A系列样品中耐水性相对较差的A1,通过用摩尔分数为5%的B2O3、MoO3取代A1中的P2O5来改善玻璃的耐水性,然而其DRWater值降幅较小,耐水性提高不显著,这可能与取代量较低有关。硼硅酸盐玻璃固化体是当前工业化处置高水平放射性废物所得的固化体,美国太平洋西北国家实验室制备的CVS-IS硼硅酸盐玻璃固化体的DRWater值为2.6×10-8g·cm-2·min-1[13]。文献[20]用Fe2O3-B2O3-P2O5玻璃基质固化模拟高钠高水平放射性废物,制得Na2O-B2O3-Fe2O3-Al2O3-P2O5体系玻璃固化体的DRWater值在10-8g·cm-2·min-1数量级。本研究制备的SrF2含量为30%~40%(摩尔分数)的A3~A5玻璃样品的耐水性与CVS-IS固化体以及文献[20]制备的磷酸盐玻璃固化体的耐水性相当,说明这些样品有良好的耐水性。
根据ASTM C1285-14标准测定了A1、A3和A5固化体中主要元素的归一化浸出率(见表3)。3个样品中P和Na的浸出率较高,Sr次之,Fe最低。虽然玻璃中Fe2O3的含量(摩尔分数为10%)较高,但浸出液中Fe元素的浓度非常低,这与文献[13,15]研究结果一致。3个样品中阳离子的归一化浸出率总和为0.241 1~0.538 4 g·m-2。
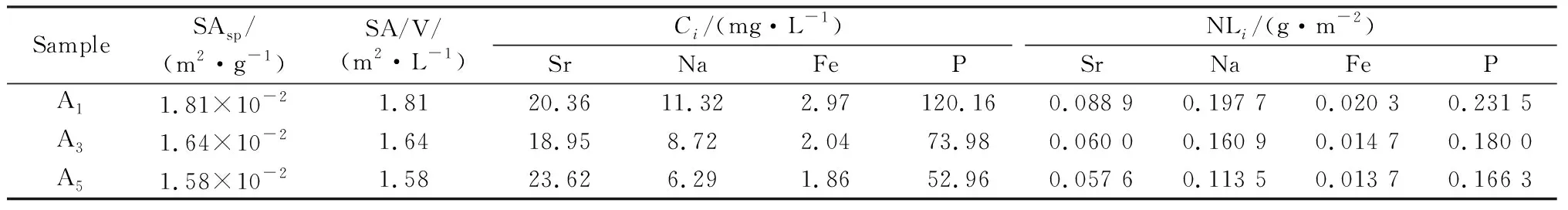
表3 A1、A3和A5样品浸出液中主要元素的浓度及其归一化浸出率Table 3 Concentration and normalized leaching rate of main elements in leaching solution of A1, A3 and A5 samples
2.3 热性能
图3是样品的CTE曲线,根据CTE曲线获得的α室温~300 ℃、Tg(Dil)和Tf值列于表4中。样品的DTA曲线见图4,根据DTA曲线获得的Tg(DTA)、Tc和Tp值以及计算得到的KA值亦列于表4中。KA值是衡量玻璃热稳定性的重要参数,KA值越大,热膨胀系数越小则玻璃的热稳定性越好,通常KA>100 ℃说明热稳定性良好[21-23]。从表4可知,随着P2O5/SrF2摩尔比的降低,A1~A5玻璃的α室温~300 ℃值从10.9×10-6℃-1小幅增加至12.6×10-6℃-1,而Tc、Tp和KA值均急剧降低,具体表现为Tc从680 ℃降低至553 ℃,Tp从722 ℃降低至590 ℃,KA从216 ℃降低至77 ℃。α室温~300 ℃、Tc、Tp、KA值的变化趋势均说明A系列样品的热稳定性随P2O5/SrF2摩尔比的降低而显著降低,样品的抗析晶能力明显减弱,此结果与样品的XRD测试结果一致,表现为低P2O5/SrF2摩尔比的A4和A5样品中析出较多晶体。在B1基础上,用摩尔分数为5%的B2O3或MoO3取代P2O5,玻璃的热膨胀系数稍微降低,而Tg(Dil)、Tf、Tc值略有增大,说明样品的热稳定性及抗析晶能力有小幅提高。A系列样品的Tg(Dil)、Tg(DTA)和Tf值随P2O5/SrF2摩尔比的降低未呈现规律性的变化,但总体呈增大的趋势。
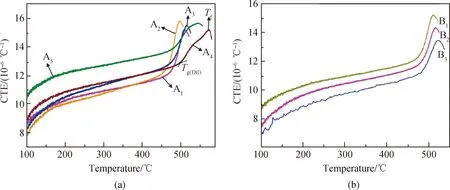
图3 样品的热膨胀曲线Fig.3 CTE curves of samples
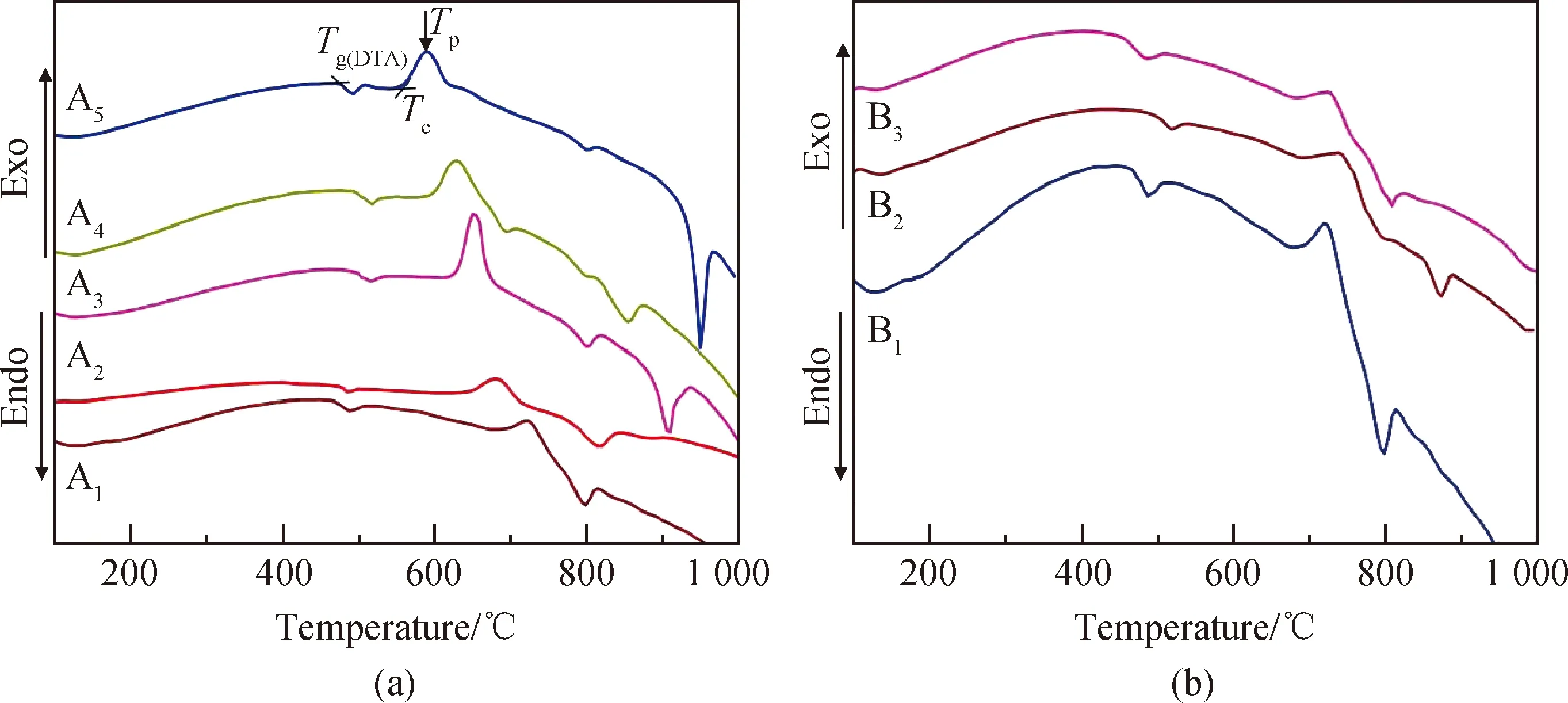
图4 样品的DTA曲线Fig.4 DTA curves of samples

表4 样品的热膨胀系数,特征温度和KA值Table 4 CTE, characterization temperature and KA values of samples
前期研究[21-22]表明,降低P2O5的含量或增大Fe2O3的含量均有利于降低玻璃的热膨胀系数。然而,A1~A5样品在P2O5含量降低的情况下其α室温~300 ℃值仍呈明显增大的趋势,这就说明增加SrF2含量能显著提高玻璃的热膨胀系数。本研究所制备的样品的α室温~300 ℃值为(9.7~12.6)×10-6℃-1,虽高于硅酸盐玻璃的热膨胀系数,却明显低于多数氟磷酸盐玻璃的热膨胀系数,比如MnF2-ZnF2-NaPO3体系玻璃的α50~200 ℃=(18.8~22.6)×10-6℃-1[24],这归因于本研究制备的样品中含有较高含量的Fe2O3(摩尔分数为10%)以及含量适中的P2O5(摩尔分数为45%~60%)。
与本研究制备的SrF2-Na2O-Fe2O3-P2O5氟磷酸盐玻璃相比,固化了两类真实高水平放射性废物的玻璃固化体中除了含有SrF2、Na2O、Fe2O3和P2O5这4种主要成分外,还有一些“杂质”,如Bi2O3、MoO3等。因本研究制备的样品中仅引入摩尔分数为10%的Na2O,且高Na2O、Fe2O3、P2O5含量高水平放射性废物中杂质组成仅占其质量的12%~35%[9-14],真实废物玻璃固化体可近似看成是SrF2-Na2O-Fe2O3-P2O5体系的玻璃。将B3和B1的KA值进行对比,发现SrF2-Na2O-Fe2O3-P2O5玻璃中掺入MoO3能明显提高玻璃的热稳定性,在MoO3掺杂的ZnO-Fe2O3-Al2O3-P2O5玻璃[25]的性能研究中也发现了这一现象。此外,在SrF2-Fe2O3-P2O5玻璃中掺入一定含量的Bi2O3能显著提高玻璃的化学和热稳定性[1]。因此,固化真实废物的玻璃固化体的稳定性可能会高于SrF2-Na2O-Fe2O3-P2O5玻璃。
2.4 结构表征
样品的红外光谱如图5所示,为便于样品之间结构的比较,图5还包含了F40(40Fe2O3-60P2O5, 摩尔分数)玻璃的红外光谱。F40玻璃的红外光谱来源于文献[21],因其O/P摩尔比为3.5,此玻璃具有典型的焦磷酸盐玻璃的结构,其基本结构单元为Q1四面体(Q代表PO4四面体,1表示属于每个PO4四面体的桥氧数为1)。从图4可知,A1~A3和B2~B3样品在1 273 cm-1、1 074 cm-1、903 cm-1、746~768 cm-1、481~488 cm-1处均有强吸收,1 273 cm-1处的吸收峰归因于O—P—O的非对称伸缩振动(vas(PO2))[26-27],而1 074 cm-1处的吸收峰归因于PO4四面体中(PO3)2-端基的非对称伸缩振动(vas(PO3)2-)[28-29],903 cm-1和746~768 cm-1处的吸收峰分别归因于P—O—P键的非对称伸缩振动(vas(P—O—P))和对称伸缩振动(vs(P—O—P))[26,29],481~488 cm-1处的吸收峰是P—O—P键的弯曲振动导致的[29]。
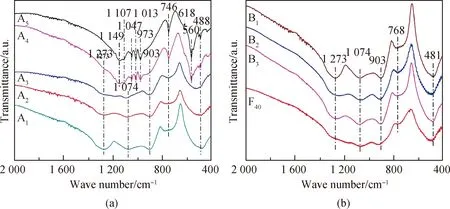
图5 样品和F40玻璃的红外光谱Fig.5 IR spectra of samples and F40 glass
前期研究[29]表明,典型的偏磷酸玻璃结构样品在1 273 cm-1、1 074 cm-1和903 cm-1处有强吸收峰且其相对强度基本相当,此外在746~768 cm-1和481~488 cm-1处亦有较强的吸收,比如A1和A2样品。通常偏磷酸盐玻璃P—O—P键的含量较高,玻璃的热稳定性好但耐水性较差,A1和A2样品的性能符合此规律。随着P2O5/SrF2摩尔比降低,(O+F)/P摩尔比逐渐增加,玻璃网络结构解聚,P—O—P键含量降低,Q1四面体含量逐渐升高(氟磷酸盐玻璃中Q代表P(O+F)4四面体),而Q2四面体的相对含量逐渐降低,红外光谱上1 273 cm-1、903 cm-1和746~768 cm-1处吸收峰的相对强度逐渐降低,1 074 cm-1处的吸收峰发展成最强峰,481~488 cm-1的峰向高波数方向移动[29]。F40玻璃和A3样品的红外光谱非常相似,两者为典型的焦磷酸盐玻璃结构,这解释了A3样品的高化学稳定性。对于B2和B3样品,其1 273 cm-1处吸收峰的强度虽较B1有所减弱但并未成为肩峰,且903 cm-1和746~768 cm-1处的吸收峰仍然很强,481~488 cm-1处的吸收峰亦未向高波数方向移动。因此,B2和B3样品具有偏磷酸盐和焦磷酸盐玻璃之间的过渡态结构,两个样品中Q2和Q1四面体并存,且Q2四面体为优势结构单元,这也是两者耐水性稍高于B1的原因。
对于A4和A5样品,其红外吸收峰中出现了一些较尖锐的吸收峰,这是样品中析出晶体所致。两者在488 cm-1处的吸收很弱,而在560 cm-1处出现了强吸收峰(归因于P—O—P键的弯曲振动(δ(O-P-O))[29]),746 cm-1处吸收峰变得窄而尖锐,1 273 cm-1和903 cm-1处吸收峰变成肩峰。从这些峰的变化大致推断两样品中的优势结构单元为Q1四面体。虽然A4和A5样品中析出了较多的Sr2P2O7晶相,但样品中还有较多的残余玻璃相,为进一步确定两者的结构,对A4和A5样品进行晶化热处理,制得相应的微晶玻璃样品,微晶玻璃样品的XRD谱见图6。从图6可知,经过晶化热处理得到的A4和A5微晶玻璃中又析出了NaFeP2O7晶相,主晶相和次晶相均为焦磷酸盐晶相,进一步说明A4和A5样品中的优势结构单元是Q1四面体。A3~A5样品中的优势结构单元为Q1四面体,P—O—P键含量较低,因而样品具有良好的耐水性。
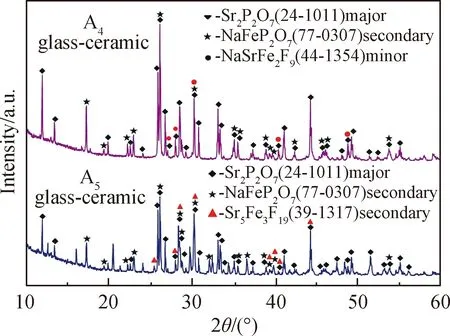
图6 A4和A5微晶玻璃的XRD谱Fig.6 XRD patterns of A4 and A5 glass-ceramics
3 结 论
(1)Q1四面体为优势结构单元的样品具有高化学稳定性,其中SrF2和Na2O摩尔分数高达45%~50%的A4和A5样品组分的析晶能力较强,析出较多焦磷酸盐晶相,样品的热稳定性差。SrF2-Na2O-Fe2O3-P2O5体系氟磷酸盐玻璃中,30SrF2-10Na2O-10Fe2O3-50P2O5中SrF2和Na2O的摩尔分数高达40%,成玻能力强,化学稳定性好,热稳定性明显优于大多数氟磷酸盐玻璃。30SrF2-10Na2O-10Fe2O3-50P2O5为高稳定性、高废物包容量的SrF2-Na2O-Fe2O3-P2O5玻璃固化体(联合固化90SrF2和高Na2O、Fe2O3、P2O5含量的废物)的组成设计提供强有力的依据。
(2)当熔制温度降低至1 000 ℃,熔融保温时间缩短至0.5 h,样品中的F亦有30%~34%的质量损失。如何减少SrF2-Na2O-Fe2O3-P2O5氟磷酸盐玻璃中F的质量损失有待进一步研究,比如系统研究SrF2-Na2O-Fe2O3-P2O5玻璃组成及制备工艺的优化,使玻璃熔融温度进一步降低,熔融保温时间尽可能缩短,最终达到降低F的质量损失的目的。
