人参皂甙-Rb1 通过促进神经元线粒体自噬治疗大鼠创伤性颅脑损伤的机制
2022-11-01邹树峰姜碧霞冯九庚陈伟
邹树峰 姜碧霞 冯九庚 陈伟,2
1.南昌大学第一附属医院 南昌 330008 2.同济大学附属上海东方医院(上海市浦东新区人民医院)
随着社会经济水平的提高,建筑业和交通工具的高速发展,创伤性颅脑损伤(traumatic brain injury,TBI)患者数量持续升高。TBI急性期出现的神经炎症反应导致的神经元损伤,是造成患者致残的重要因素之一[1]。线粒体损伤是炎症产生的重要原因之一,而人参皂甙中最主要的成分人参皂甙-Rb1(ginsenoside-Rb1,GS-Rb1)具有抑制损伤后炎症的作用[2-3]。线粒体自噬是细胞特异性清除体内受损线粒体,缓解凋亡通路激活的保护性反应。前期研究显示,GS-Rb1在神经系统损伤后具有抑制缝隙连接40(Connexin40,Cx40)蛋白,进而拮抗氧化应激的作用[4-5];研究还发现,TBI后Cx40的代谢与自噬相关[6]。这些结果提示,GS-Rb1的细胞保护效应很可能与线粒体自噬相关。本研究通过对线粒体自噬功能的调控,研究TBI后GS-Rb1神经元保护的具体途径,旨在探讨GS-Rb1对TBI治疗作用的具体机制,并为相关临床治疗奠定基础。
1 材料和方法
1.1 实验动物 雄性SD大鼠80只,体质量350~400 g,由南昌大学实验动物中心提供[实验动物使用许可证号:SYXK(赣)2020-0001]。实验期间以固体平衡饲料饲养,自由饮水,温度(22±2)℃,湿度(50±5)%。本研究经南昌大学第一附属医院实验动物伦理委员会批准(批准号:南昌大学第一附属医院医研伦2019年第41号)。
1.2 试剂及仪器 GS-Rb1购于上海邦景实业公司(批号:41753-43-9);细胞自噬阻断剂6-氨基-3-甲基嘌呤(3-methyladenine,3-MA)购于南京沃博生物科技有限公司(批号:5142-23-4);小鼠多克隆抗体神经元自噬相关轻链蛋白3-Ⅱ/轻链蛋白3-Ⅰ(light chain 3-Ⅱ/light chain 3-Ⅰ,LC3-Ⅱ/LC3-Ⅰ)、自噬接头蛋白(sequestosome-1,P62)、线粒体功能相关蛋白过氧化物酶体增殖物激活受体γ辅激活子-1 alpha(peroxisome proliferators-activated receptor γ coactivator-1 alpha,PGC-1α)、线粒体外膜转位蛋白20(translocase of outer mitochondrial membrane 20,TOM20)及凋亡相关蛋白B细胞淋巴瘤-2基因相关X蛋白(B cell lymphoma-2 associated X protein,Bax)、裂解的半胱天冬酶3(cleaved-cysteinyl aspartate specific proteinase 3,cleaved-caspase 3)均购于美国Abcam公司(批号:192890、207305、182733、32042、145641、214532);辣根酶标记二抗购于北京博奥龙免疫技术有限公司(批号:KLB124154);化学发光试剂盒购于北京中杉金桥生物科技有限公司(批号:3605071);超氧物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)检测试剂盒均购于北京索莱宝科技有限公司(批号:2190523、20211119、20180523)。PowerPacTMBasic型蛋白垂直电泳仪购于美国Bio-Rad公司;L8型UV762紫外光分光光度计为上海第三分析仪器厂产品。
1.3 动物模型制作 采用液压打击制作大鼠TBI模型。大鼠予异氟烷吸入持续麻醉,固定于立体实验台,常规消毒铺巾,于头部正中分层切开皮肤和骨膜,暴露右侧顶骨,于矢状缝旁3 mm,冠状缝后3.5 mm处,以开颅磨钻钻骨孔,暴露硬脑膜,于骨孔处放置与骨孔大小相同的小帽,固定液压管后,施行3个大气压(重型颅脑损伤标准)的液压击打。
1.4 分组及药物干预 80只SD大鼠被随机分为假手术组、TBI组、治疗(TBI+GS-Rb1)组、自噬阻断(TBI+GS-Rb1+3-MA)组。假手术组仅暴露硬脑膜而不进行击打,TBI组仅建模不予药物处理,治疗组和自噬阻断组采用液压击打建立TBI模型[7-8],按照前期实验方法,1 h后分别腹腔注射GS-Rb1(40 mg/kg)及GS-Rb1(40 mg/kg)+3-MA(30 mg/kg)[5-6],GS-Rb1以0.9%氯化钠溶液溶解。建模后48 h进行后续指标检测,每组取10只大鼠进行行为学检测,其余10只行其他检测。根据预实验及前期实验显示,为获得P值在0.05水平,1-β在0.20水平,根据Effect-Size计算出所需的每组动物数量为8(G-Power3.0),本研究为防止大鼠意外死亡引起样本量的不足,故各组样本量确定为10只。
1.5 大鼠神经损伤严重程度评分(neurological severity score,NSS)采用双盲法,具体方法如下:a.提鼠尾离地面约30 cm,观察前肢情况,正常大鼠两前肢对称地伸向地面,有左肩内旋,左前肢内收者,评为4分,否则评为0分。b.将动物置于平滑地板上,分别推左(或右)肩向对侧移动,检查抵抗运动的阻力。正常大鼠两侧阻力明显对称,右肩向左侧移动阻力下降时,根据下降程度的不同,评为0~3分。0分:双侧抵抗等同,正常;1分:左侧抵抗轻度下降;2分:左侧抵抗中度下降;3分:左侧抵抗力消失。c.将动物两前肢置于金属网上,观察两前肢的张力,正常大鼠两前肢张力明显对称,发现左前肢肌张力下降者,根据下降程度的轻重,评为0~3分。0分:正常;1分:肌力下降,但能抬离平面;2分:瘫痪,无法抬离平面,只能水平运动;3分:无任何活动。根据以上评分,满分10分,分数越高,说明动物的行为障碍越严重[7-8]。
1.6 苏木精-伊红(hematoxylin eosin,HE)染色观察神经元病理学改变 取损伤处海驱皮质组织标本,经包埋、切片、脱蜡、水化,使用苏木精染色5 min后以自来水冲洗,盐酸乙醇分化30 s,自来水浸泡15 min后以伊红染色2 min,梯度乙醇脱水,中性树脂封片,光镜下观察并拍照。
1.7 免疫印迹法检测神经元线粒体结构/功能相关蛋白表达 取损伤侧海马区皮质组织,裂解后提取总蛋白并定量,根据目标蛋白分子量不同,选择不同浓度的十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate -polyacrylamide gel electrophoresis,SDS-PAGE)分离,常规方法转印至硝酸纤维素膜上,封闭2 h后分别加入相应一抗anti-LC3-B(稀释比例:1∶1 000)、anti-P62(稀释比例:1∶1 500)、anti-PGC-1α(稀释比例:1∶1 000)、TOM20(稀释比例:1∶1 000)、anti-cleaved caspase 3(稀释比例:1∶1 000)、anti-Bax(稀释比例:1∶1 000),以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,一抗anti-GAPDH(稀释比例:1∶2 500)。4 ℃孵育过夜,洗涤后加入相应辣根过氧化物标记的二抗孵育,化学显影,扫描蛋白条带,采用Image J 1.36b软件进行分析。蛋白相对表达量以目标蛋白吸光度值/GAPDH吸光度值表示,以假手术组目标蛋白/GAPDH为100%,其余组与之进行比较。
1.8 氧化应激相关因子检测 取大鼠损伤侧海马区皮质组织,洗涤后充分匀浆,4 ℃下10 000 r/min离心10 min,取上清液,分别采用黄嘌呤氧化酶法、硫酸代巴比妥法、二硫代硝基苯甲酸缩合法,分别检测SOD活性、MDA及GSH水平,以假手术组为100%,其余组与之比较。
1.9 统计学分析 使用SPSS 22.0和Graph Prism统计软件进行统计学分析。符合正态分布的连续型变量以表示,多组间比较采用方差分析,其中任意两组间比较采用最小显著差异(least significant difference,LSD)-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠NSS评分比较 与假手术组比较,TBI组NSS升高;与TBI组比较,治疗组的NSS明显降低(P<0.05)。当采用自噬抑制剂3-MA后,可明显阻断GS-Rb1的神经功能保护作用(P<0.05)。见图1。
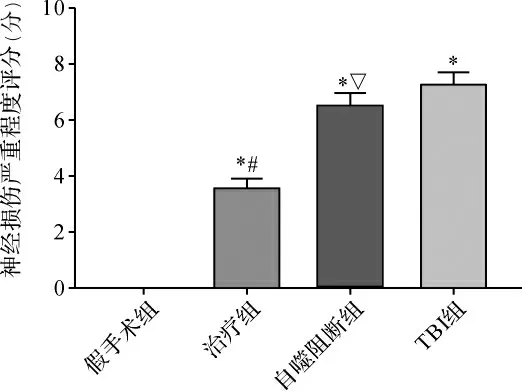
图1 各组大鼠NSS比较Fig.1 Comparison of NSS in each group
2.2 各组大鼠神经元形态学比较 假手术组大鼠神经元形态正常,轮廓清晰,圆润饱满,细胞核位于中央。TBI组损伤处神经元萎缩,轮廓不清,组织纹理紊乱。治疗组的神经元受损程度明显缓解。采用自噬抑制剂3-MA后,可明显阻断GS-Rb1对神经元形态保护作用。见图2。
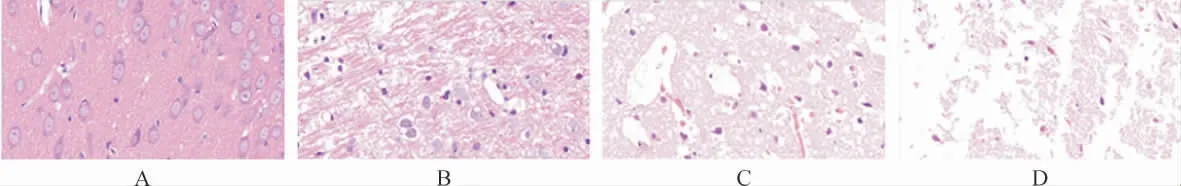
图2 各组大鼠海马神经元病理病理形态学观察(HE染色,200×)Fig.2 Pathological changes of hippocampal neuron in each group(HE staining,200×)
2.3 各组大鼠神经元自噬相关蛋白表达比较 与假手术组比较,TBI组自噬明显受到抑制(P<0.05)。与TBI组比较,其余两组干预后自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ的比例明显升高,P62表达明显降低(P<0.05),证明GS-Rb1能够增强自噬。自噬抑制剂3-MA则可明显抑制自噬蛋白的表达及自噬反应(P<0.05)。见图3。

图3 各组大鼠自噬相关蛋白表达比较Fig.3 Comparison of autophagy related protein expression in each group
2.4 各组大鼠神经元线粒体形态/功能相关蛋白表达比较 与假手术组比较,TBI组神经元线粒体相关蛋白PGC-1α及TOM20明显下调(P<0.05),而GS-Rb1可明显上调损伤后神经元PGC-1α及TOM20的表达(P<0.05),自噬抑制剂3-MA可明显抑制同时此种效应(P<0.05)。见图4。
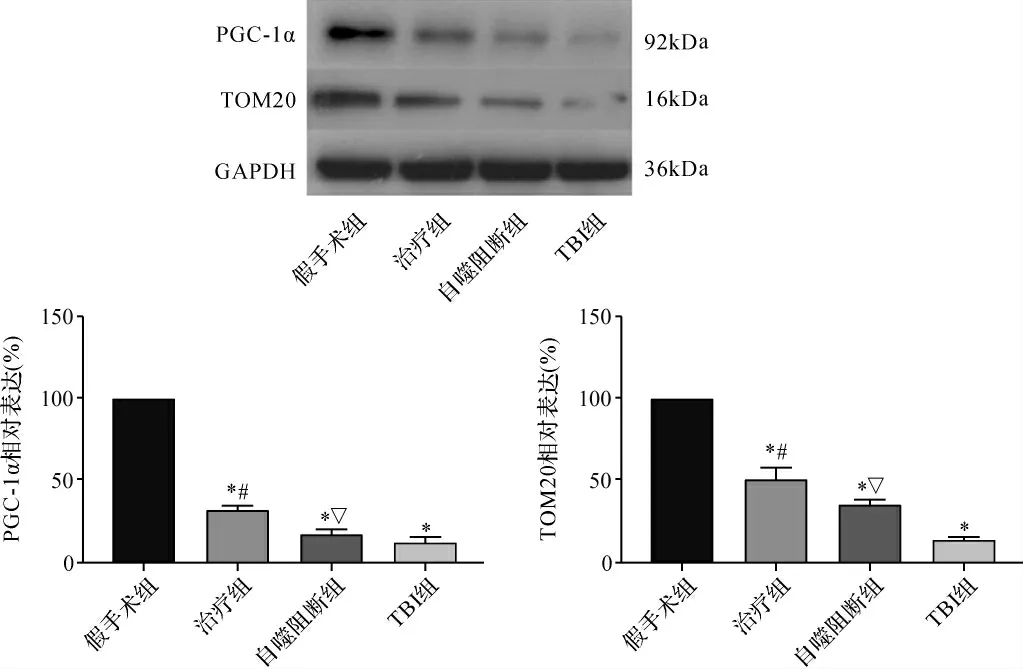
图4 各组大鼠PGC-1α和TOM20蛋白表达比较Fig.4 Comparison of PGC-1α and TOM20 protein expression in each group
2.5 各组大鼠神经元凋亡比较 与假手术组比较,TBI组凋亡相关蛋白Bax及cleaved-caspase 3表达明显升高(P<0.05)。与TBI组比较,GS-Rb1可明显降低促凋亡蛋白Bax及cleaved-caspase 3表达(P<0.05)。当给予自噬抑制剂3-MA后,则可明显抑制此种效应(P<0.05)。见图5。
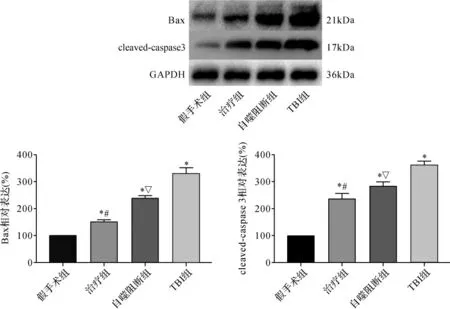
图5 各组大鼠凋亡相关蛋白表达比较Fig.5 Comparison of apoptosis related protein expression in each group
2.6 各组大鼠神经元氧化应激反应比较 与假手术组比较,TBI组SOD活性及GSH水平降低,而MDA水平明显升高(P<0.05)。与TBI组比较,治疗组MDA水平降低,GSH水平升高,SOD活性升高(P<0.05)。自噬抑制剂3-MA可明显阻断GS-Rb1抑制氧化应激的效应(P<0.05)。见图6。

图6 各组大鼠SOD、GSH及MDA表达比较Fig.6 Comparison of SOD,GSH and MDA expression in each group
3 讨论
TBI的发病机制较为复杂,目前认为氧化应激因子的激活可能与脑损伤密切相关[9]。前期研究发现,TBI后Cx40蛋白的异常表达和氧化应激因子的表达密切相关[4],而氧化应激的产生则与线粒体-内质网系统功能紊乱相关。因此笔者推测,线粒体-内质网系统功能保护可能在TBI的治疗中具有重要的作用。
人参皂甙(ginsenoside,GS)是人参最主要的活性成分。研究证明,GS具有抗炎、抗氧化及降低脂质代谢产物的作用[10]。Rb1作为GS中含量最多的成分,受到越来越多的重视。前期研究发现,GS-Rb1在脑缺血再灌注损伤后可抑制氧化应激因子尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1(nicotinamide adenine dinucleotide phosphate oxidase 1,NOX1)、NOX2、NOX4及炎症因子白介素-1β(interleukin-1β,IL-1β)的表达,并上调细胞骨架蛋白紧密连接蛋白-1(zonula occluden-1,ZO-1)、闭合蛋白(occludin)的表达,具有神经功能保护作用[11]。研究显示,GS-Rb1可能通过降低Cx40的表达,抑制TBI后的氧化应激[4-5,12],但尚未对其中具体机制进行深入分析,仍需要进一步明确GS-Rb1参与抑制氧化应激的具体途径。
自噬作为真核生物细胞的重要代谢途径,能够降解一些错构的蛋白质以及受损的细胞器,对维持细胞稳态起着重要的作用。线粒体自噬是目前研究较多的一种自噬形式,是选择性清除受损线粒体的过程。线粒体被称为细胞的“Power house”,参与了细胞的各种生物过程,包括三磷酸腺苷产生、钙稳态、细胞凋亡及活性氧(reactive oxygen species,ROS)产生,因此线粒体损伤影响巨大,受损的线粒体可导致细胞凋亡,增强氧化应激损伤[13]。研究显示,自噬早于凋亡的出现,并可通过清除受损的线粒体而抑制凋亡[14]。近年来笔者团队的研究也证实,自噬可清除氧化应激的促进因子Cx40[6]。以上均提示,线粒体自噬可能通过抑制氧化应激下游的炎性产物增多,从而起到细胞保护作用。本研究中,GS-Rb1可明显上调神经元LC3-Ⅱ/LC3-Ⅰ的比例、下调P62的表达,说明整个自噬过程通畅,也证明GS-Rb1与自噬的诱导相关。进一步观察到,线粒体功能/结构蛋白PGC-1α、TOM20表达均明显上调,这提示线粒体的功能及数量得到明显保护。继续观察下游凋亡途径时发现,凋亡促进因子Bax及cleaved-caspase 3表达也较TBI组明显降低,使用自噬抑制剂时可明显阻断GS-Rb1的效应。这均说明,GS-Rb1的神经元保护效应与线粒体自噬的激活直接相关。
氧化应激可能与线粒体-内质网功能损伤后ROS增多密切相关。本研究证实,GS-Rb1在增强自噬的基础上,也可以明显降低氧化应激因子MDA水平,并可升高抗氧化应激因子GSH的水平及SOD的活性。而使用自噬抑制剂后,可逆转GS-Rb1抗氧化应激损伤的作用。形态学观察也证实,自噬抑制剂可明显降低GS-Rb1对神经功能及神经元形态的保护作用。以上的研究结果均证实,GS-Rb1对受损神经元功能及形态的保护作用与诱导线粒体自噬、缓解氧化应激损伤有关。
综上所述,本研究说明TBI后GS-Rb1对神经元的保护效应可能与线粒体自噬的激活、线粒体功能的保护,以及对凋亡及氧化应激的抑制有关。在此基础上,将进一步研究GS-Rb1对自噬相关基因及信号传导通路的影响,为了解GS-Rb1的细胞保护机制及TBI的治疗奠定基础。
