苦丁茶提取物的分离纯化、鉴定及不同萃取部位活性分析
2022-10-31邹成梅史硕硕
邹成梅,厉 莉,史硕硕,胡 婷
(武汉工程大学环境生态与生物工程学院,湖北 武汉 430205)
苦丁茶是一种常见饮用茶,其中冬青科的大叶冬青苦丁茶味甜茶香,被誉为最理想的饮用苦丁茶。现代医学表明苦丁茶具有清热解毒、生津止渴、杀菌消炎等作用,并越来越受到人们的重视。苦丁茶中包含多酚、黄酮、三萜、生物碱、皂苷、可溶性多糖等丰富的化合物,大量的研究表明多酚黄酮类物质包括降脂、降血糖,抑制癌细胞增长等活性,有研究已经报道了患糖尿病和高血糖小鼠在给药苦丁茶多糖后,一定治疗周期内能较好的降低体内的血糖水平,并提高糖尿病小鼠的葡萄糖耐受量。郑姣等在高胆固醇血败症损害小鼠的保护机制作用中发现,苦丁茶的生物活性物质皂苷能通过降低胆固醇减轻脂质过氧反应实现对小鼠的保护作用。但这些大部分都停留在简单的混合物活性研究,对其的进一步分离纯化还研究较少,仅有较少的主要成分分离研究被报道,如倪帅帅对苦丁茶进行了纯化分离,研究分离出的化学成分与牛血清蛋白间的相互作用,认为黄酮类物质与牛血清蛋白的相互作用明显大于皂苷类物质,证实山奈素和槲皮素与胰脂肪酶分子之间的作用为典型的疏水作用力。耿江枫以胰脂肪酶抑制活性为指标,对苦丁茶进行分离鉴定,得到了5 个三萜类皂苷单体化合物,证实了这类三萜类皂苷结构的细微变化对胰脂肪酶抑制活性影响不大。
目前分离鉴定单一化合物较为困难,所以多用几种分离手段联用的方式对混合物进行分离。常采用柱层析法、高效液相色谱等方法,再与质谱、核磁共振波谱(nuclear magnetic resonance,NMR)联合使用,可以进一步确定分离物的化学结构。研究显示高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)和NMR可对覆盆子酒渣中两种不同纯度矢车菊素-3-葡萄糖苷(93.46%)和矢车菊素-3-芸香糖苷(94.16%)花青素分离鉴定,评估不同类别花青素对肿瘤细胞的抑制活性。实现毛竹叶发酵真菌产物的乙酸乙酯提取物中抗癌化合物的准确分析,进一步与其他技术的联用,广泛应用于代谢组学的组分分析中。
苦丁茶乙醇提取物的系统分离纯化及其结构分析还较少,限制了苦丁茶相关产品的开发与研究,也对进一步的药效学和药理学研究,以及识别潜在的药物靶点存在较大阻碍。因此本实验不仅对苦丁茶采取不同极性的有机试剂分级萃取,分别进行抗氧化活性筛选、评价抗补体活性及通过癌细胞抑制作用考察各部位的活性情况,还结合上述的分离、鉴定技术,实现各单体化合物的结构鉴定,以期在明确苦丁茶主要功能活性的基础上对其进一步的开发利用,也为以后苦丁茶在药效学和药理学的研究提供理论基础。
1 材料与方法
1.1 材料与试剂
大叶冬青苦丁茶产于浙江绍兴新昌县。
溶血素、豚鼠血清、绵羊红细胞(生化试剂) 广州齐云生物有限公司;DMEM高糖培养基、磷酸盐缓冲液(phosphate buffer saline,PBS)(生化试剂) 美国Gibco公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、无水乙醇、抗坏血酸、磷酸氢二钠、磷酸二氢钠(分析纯) 广州东巨实验仪器有限公司;甲醇、石油醚、乙酸乙酯、正丁醇、铁氰化钾、三氯化铁(均为分析纯) 天津市福晨化学试剂厂。
1.2 仪器与设备
U-3310型紫外分光光度计 日立科学仪器(北京)有限公司;1260型高效液相色谱仪、DRX-400型核磁共振波谱仪 安捷伦科技(中国)有限公司;solariX质谱仪德国Bruker公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;TG16-WS台式高速离心机湖南湘仪实验室仪器开发有限公司;BSA224S赛多利斯电子天平 苏州金钻称重设备系统开发有限公司;DHG-9246A电热恒温鼓风干燥箱 上海龙跃仪器设备有限公司;RE-2000B旋转蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 苦丁茶乙醇粗提及分级萃取
1.3.1.1 苦丁茶乙醇粗提物制备
称取5 kg干燥的苦丁茶粉末,分成3 份加入10 倍量的75%乙醇溶液,采用加热回流的方式充分多次提取,每次提取30 min,提取结束后过滤混合提取液,在40 ℃减压旋蒸浓缩,浓缩的苦丁茶乙醇粗提物放置备用。
1.3.1.2 分级萃取
分级萃取依赖于有机溶剂对提取物中各类成分溶解度的不同实现,参考文献[14]方法稍作修改。将粗提物用1.5 L甲醇溶液溶解,溶解完成后依次加入等体积的4 种有机溶剂(石油醚、乙酸乙酯、正丁醇、水)对4 个极性部位萃取,萃取过程中,使粗提物溶液与有机溶剂充分混匀,静止至完全分层后分离萃取溶剂,重复萃取3 次。萃取结束后,利用溶剂的沸点不同,使用旋转蒸发将不同萃取部位溶液浓缩为浸膏状,以除去萃取剂的影响,采用真空冷冻干燥技术干燥样品。
1.3.2 抗氧化活性
1.3.2.1 总还原力
参考文献[15]方法稍作修改。取待测样液1 mL,先后加入0.2 mo1/L PBS 2.5 mL,1% KFe(CN)溶液2.5 mL,摇晃均匀50 ℃保持20 min,迅速冷却加入2.5 mL 10%三氯乙酸溶液,反应停止。量取上清液2.5 mL,依次加入2.5 mL蒸馏水、0.5 mL 0.1% FeCl溶液,混匀静置10 min,于700 nm波长处测吸光度,空白组以蒸馏水代替样液,吸光度越高还原力越强。VC为对照,按式(1)计算总还原力:

式中:为加入样品时的吸光度;为蒸馏水吸光度。
1.3.2.2 DPPH自由基清除能力
参考文献[16]方法稍作修改。量取DPPH自由基标准液(无水乙醇配制)1.5 mL于试管内,加入不同浓度的0.5 mL样品溶液,以无水乙醇代替样品溶液为空白组,无水乙醇代替DPPH自由基样液为本底对照,室温25 ℃静置30 min,于517 nm波长处测吸光度,按式(2)计算DPPH自由基的清除率:

式中:为加入样品溶液时的吸光度;为无水乙醇代替DPPH自由基时的吸光度;为无水乙醇代替样品时的吸光度。
1.3.2.3 超氧阴离子自由基清除能力
试管中加入50 mmol/L 的Tris-HCl 缓冲溶液(pH 8.2)2.3 mL,再加入预先配制的不同浓度的样品溶液0.5 mL,在25 ℃水浴20 min,加入0.2 mL 25 ℃保温的10 mmol/L邻苯三酚溶液,混匀后蒸馏水补至12 mL,25 ℃水浴中反应4 min,适量滴加8 mol/L HCl溶液保证反应停止,空白对照为Tris-HCl缓冲液,蒸馏水代替邻苯三酚溶液作为本底对照组,于325 nm波长处测定吸光度。吸光度越低,清除超氧阴离子自由基效果越好。样品对超氧阴离子自由基清除率按式(3)计算:
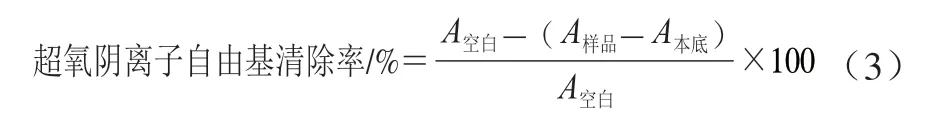
式中:为加入样品溶液时的吸光度;为蒸馏水代替邻苯三酚时吸光度;为Tris-HCl缓冲液吸光度。
1.3.3 抗补体活性
参考文献[17-18]方法稍作修改。配制不同浓度样品溶液待用,制备致敏绵羊红细胞和选择1∶80的豚鼠血清浓度进行抗补体活性测试。已确定的1∶80豚鼠血清200 μL分别与200 μL不同浓度样品溶液混合,再加入致敏绵羊红细胞200 μL,37 ℃水乳保温20 min,离心10 min后取上清液100 μL,于405 nm波长处测定吸光度,肝素钠为对照,按式(4)计算抑制率:

式中:为加入样品溶液时的吸光度;为肝素钠吸光度。
1.3.4 MTT法测提取物对细胞增殖的抑制作用
参考文献[19-20]方法稍作修改。实验采用MTT法测定对人乳腺癌细胞MCF-7抑制率,选择0.25%胰蛋白酶对细胞消化,消化结束后吹散均匀,接种在96 孔板中细胞密度为每孔8×10个细胞,培养至细胞贴壁之后,保留沉淀。加入不同浓度的样品溶液,完全培养基为空白对照,每组设5 个复孔,接续培养24 h之后,观察细胞形态并拍照。去掉细胞上清液,避光条件下加入DMEM基础培养基(含有10% MTT)200 μL,37 ℃、CO培养箱中孵育4 h,去掉培养液,加入150 μL DMSO,充分振荡以溶解结晶物,于570 nm波长处测定吸光度,5-氟尿嘧啶作为对照,按式(5)计算细胞抑制率:
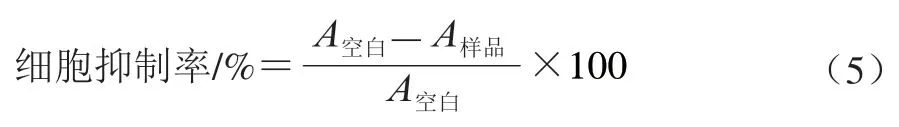
式中:为加入样品溶液时的吸光度;为不加样品溶液的完全培养基吸光度。
1.3.5 分离纯化
根据实验结果在4 个极性部位的萃取中,选择乙酸乙酯相萃取物进行后续分离纯化。将萃取物溶解,采用特定目数的硅胶放置,使有机溶剂完全挥发,样品凝结成颗粒状备用。氯仿-甲醇按体积比100∶0、98∶2、95∶5、90∶10、85∶15、80∶20、50∶50和0∶100八个梯度洗脱,洗脱液减压浓缩收集。其中,98∶2(A)部分经ODS柱层析,甲醇-水梯度洗脱,得到A1、A2、A3、A4四个组分,A1、A2、A4组分由Sephadex LH-20柱层析、自然挥干、重结晶的方式得到化合物C1、C2,其中A4组分在纯化过程并未得到化合物。95∶5(B)部分经Sephadex LH-20反复凝胶柱层析后,得到化合物C3。90∶10(C)部分经ODS柱层析,甲醇-水梯度洗脱,得到化合物C4、C5、C6。85∶15(D)部分经Sephadex LH-20凝胶柱层析后,得到D1、D2、D3、D4四个组分,由D1、D2、D3三个组分通过不同的分离方式得到对应的化合物C7、C8、C9。80∶20(E)部分经过小硅胶柱层析梯度洗脱后,得到E1、E2、E3、E4四个组分,E2经过半制备液相分离得到了化合物C10、C11。
1.3.6 结构鉴定
通过质谱和核磁共振得到相应的电喷雾离子源(electron spray ionization,ESI)-MS、H-NMR和C-NMR数据,从数据中可推测知化合物的分子质量及化学键组合,结合文献对比确定单一化合物的名称。
色谱条件:色谱柱为C柱(4.6 mm×250 mm,5 µm),流动相为甲醇-0.5%醋酸,检测波长为260 nm,流速为0.6 mL/min。
质谱条件:离子源为E S I,负离子扫描,电压3 kV;传输线温度275 ℃;离子源温度200 ℃;母离子/285;激活电压1.5 V;扫描质量为/100~1 000。
1.4 数据分析
2 结果与分析
2.1 体外抗氧化活性评价
2.1.1 总还原力
由图1可见,苦丁茶粗提物和4 个极性部位的还原能力随着样品质量浓度在0.05~0.8 mg/mL范围内的增加而变化,呈上升趋势,最高值为2.672±0.05。VC的还原能力最强,而乙酸乙酯部位在样品质量浓度为0.4~0.8 mg/mL时和VC重合,表明分级萃取过程中乙酸乙酯部位的总还原能力极强,总还原能力排序为VC>乙酸乙酯>粗提物>正丁醇>水>石油醚,乙酸乙酯部位与各部位的总还原力存在显著差异(<0.05)。产生该结果的原因可能是萃取剂极性大不相同,苦丁茶在萃取过程中由于相似相溶的原理,有效成分会根据极性的不同而分离在不同萃取剂中,从而导致所含有效成分含量也不相同。结果表明苦丁茶中具有较强抗还原力的有效成分可能集中在中等极性的乙酸乙酯部位。
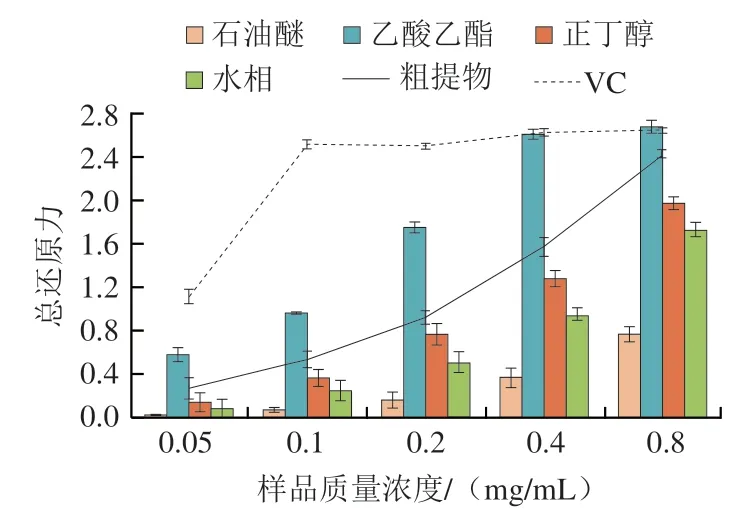
图1 苦丁茶乙醇粗提物与4 个部位的总还原力Fig.1 Total reducing power of the ethanol extract from I.latifolia Thunb.and its four fractions
2.1.2 清除DPPH自由基
由图2可以看出,各不同样品对DPPH自由基的清除率排序为VC>乙酸乙酯>粗提物>水>正丁醇>石油醚,总体表现为随样品质量浓度的增加而增大。不同部位样品清除率的变化趋势有明显区别,其中VC和乙酸乙酯部位在样品质量浓度为0.2 mg/mL后两者基本一致,且清除率最高都能达到90%以上,最大值分别为(97.18±1.97)%、(95.52±0.89)%。这可能是乙酸乙酯相能很好地萃取出提取物中的酚类物质,酚类物质往往会表现出较强的自由基清除能力,这与Nurraihana等对玉米须乙酸乙酯部位进一步分析证明玉米须的乙酸乙酯部位是酚类物质的最好来源结论一样。在相同实验浓度下,乙酸乙酯部位与石油醚的DPPH自由基清除率存在较大差异,这可能是由于石油醚萃取时通常为脂类物质,而苦丁茶中具有的脂类活性物质较少所导致。
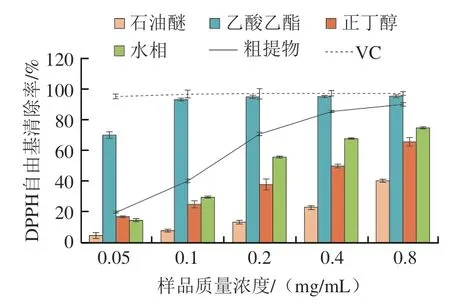
图2 苦丁茶乙醇粗提物和4 个部位对DPPH自由基的清除能力Fig.2 DPPH radical scavenging capacity of the ethanol extact from I.latifolia Thunb.and its four fractions
2.1.3 清除超氧阴离子自由基
由图3可知,乙酸乙酯部位对超氧阴离子自由基的清除能力最强,随着样品质量浓度的增加清除率增大,最高值为质量浓度1.0 mg/mL的(93.80±2.51)%,但低于对照组VC 在质量浓度1 mg/mL 时的清除率(95.37±0.21)%。剩下的石油醚、正丁醇、水相部位样品对超氧阴离子自由基的清除能力均小于乙醇粗提物的最大清除率(61.20±2.19)%,具有一定的超氧阴离子自由基清除能力,但总体清除率较低。对超氧阴离子自由基的清除能力排序为VC>乙酸乙酯>粗提物>正丁醇>石油醚>水相,乙酸乙酯部位与各萃取部位清除能力具有显著差异(<0.05)。DPPH自由基清除率和超氧阴离子自由基清除率排序不同,可能在于萃取过程中,不同极性的萃取剂会萃取出不同极性和不同含量的有效活性成分,有效活性成分之间由于含量和极性的不同,彼此之间的相互作用关系发生变化,使得两者的清除率大小排序有所差异。而由于抗氧化机理的不同,在不同抗氧化体系中所需的活性成分结构也会有差别。综合3 种评价结果可以看出苦丁茶醇提物分级萃取后的乙酸乙酯部位富集较多化学成分,有希望分出具有抗氧化能力的植物化学成分。

图3 苦丁茶乙醇提取物和4 个部位对超氧阴离子自由基的清除能力Fig.3 Superoxide anion radical scavenging capacity of the ethanol extract from I.latifolia Thunb.and its four fractions
2.2 抗补体活性评价
补体具有很多的生物学功能,在免疫应答上有较强的执行性。但过度的激活体内补体会导致炎症的发生,从而引发一系列疾病的发生。由图4可知,苦丁茶粗提物和4 个极性部分均表现出了抗补体活性,且出现量效关系,其中乙酸乙酯部位的抗补体活性最佳,在质量浓度1 mg/mL时达到最大值(79.67±0.99)%,与相同质量浓度下正丁醇部位的抗补体活性(29.27±0.64)%相差较明显,具有显著差异(<0.01),但低于质量浓度1 mg/mL时的肝素钠溶血抑制率(97.07±0.39)%,而正丁醇和水相则在实验质量浓度0.05~1 mg/mL内均表现出相对较低的溶血抑制作用。综合整体实验结果可知抗补体活性排序为肝素钠>乙酸乙酯>石油醚>粗提物>正丁醇>水。由此可知乙酸乙酯部位可能是抗补体活性物质集中部位,这与岳秀洁的辣木叶黄酮粗提物分级萃取后各部位的抗活性评价结果相同。
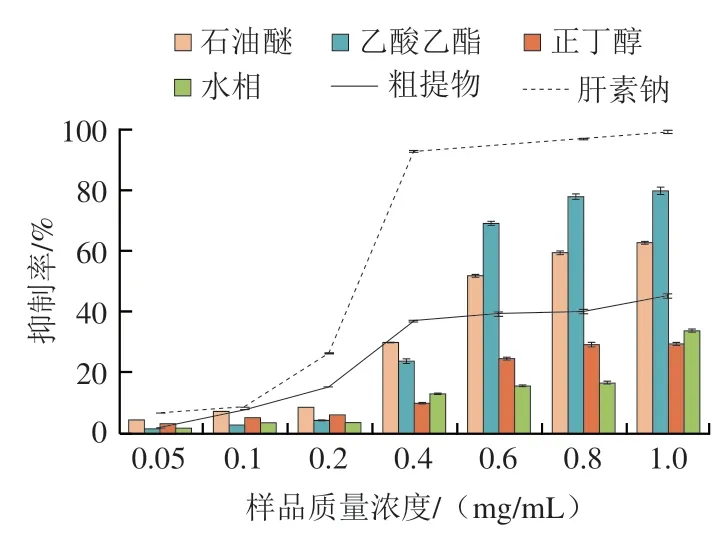
图4 苦丁茶乙醇提取物和4 个部位对补体溶血体系的抑制作用Fig.4 Anti-complementary activity of the ethanol extract from I.latifoliaThunb.and its four fractions
2.3 MTT法测提取物对细胞增殖的抑制作用
从粗提物和各极性部位对MCF-7增殖抑制作用结果(图5),可以发现除乙酸乙酯萃取部位产生较强的抑制作用外,其他部位效果一般,在样品质量浓度为200 μg/mL时,萃取的MCF-7增殖抑制作用排序为5-氟尿嘧啶>乙酸乙酯>粗提物>水>石油醚>正丁醇。乙酸乙酯萃取部位的抑制率达到(54.8±0.26)%,能较好抑制MCF-7细胞的增殖,同浓度条件下,粗提物也显现出一定的抑制作用,但两者与对照组均存在明显不足。正丁醇、水相、石油醚萃取部位对MCF-7细胞的抑制作用都小于30%,表现出中等的细胞毒性。结果表明苦丁茶抑制癌细胞增殖的活性物质可能集中于乙酸乙酯部位。

图5 苦丁茶乙醇提取物和4 个极性部位对MCF-7细胞的增殖抑制作用Fig.5 Inhibitory effects of the ethanol extract from I.latifoliaThunb.and its four fractions on the growth of MCF-7 cells
2.4 乙酸乙酯相分离得到的化合物结构鉴定
通过表1中ESI-MS、C-NMR、H-NMR数据,结合化合物的外观及化学性质,确定化合物结构:

表1 C1~C3化合物结构分析Table 1 Structural analysis of compounds C1-C3
C17.52(1H,d,=15.9 Hz)与6.24(1H,d,=1 5.9 Hz)提示有反式烯键,分析数据7.0 2(1H,d,=1.9 Hz)、6.93(1H,dd,=1.9 Hz,8.2 Hz)存在苯环及偶合关系,将其核磁数据与文献[23]的数据比对,确定C1为咖啡酸乙酯。
C2呈现白色粉末状,该化合物的熔点为230~234 ℃,在着色剂硫酸-香草醛下显红色斑。核磁数据与文献[24]进行对比,核磁共振数据与熊果酸一致。
C3为白色粉末状,核磁共振数据与文献[25]对比,确定C3化合物为绿原酸。
通过表2中ESI-MS、C-NMR、H-NMR数据,结合化合物的外观及化学性质,确定化合物结构:
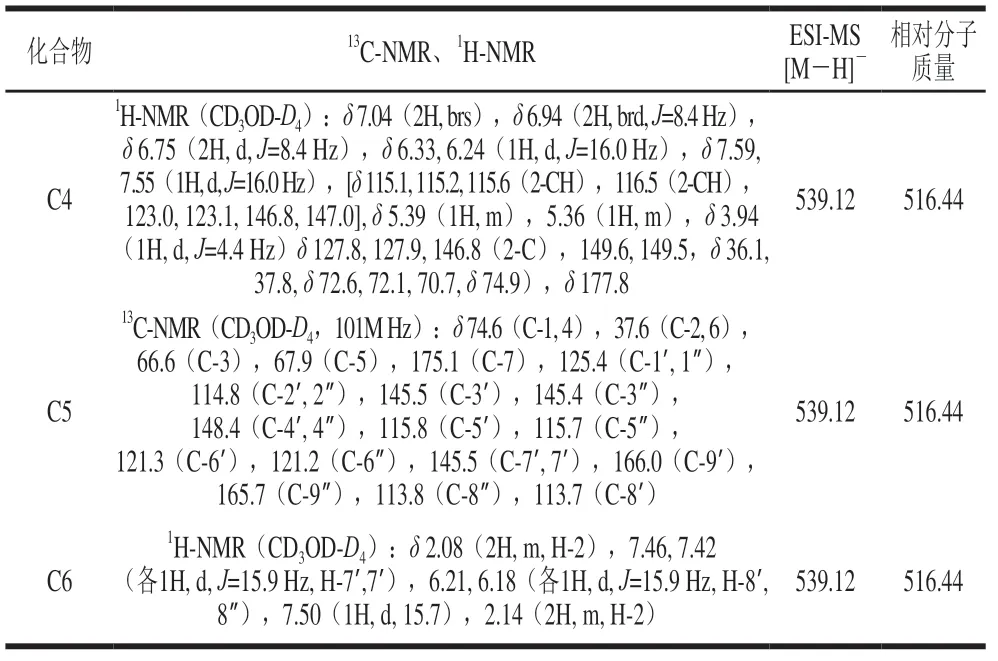
表2 C4~C6化合物结构分析Table 2 Structural analysis of compounds C4-C6
C4为白色粉末状,在254 nm波长处有蓝色荧光,可与FeCl-甲醇溶液反应显黄绿色,有酚羟基的存在。C4的1H-NMR中给出了两组咖啡酰基质子的特征信号7.04(2H,brs),6.94(2H,brd,=8.4 Hz),6.75(2H,d,=8.4 Hz)和两组AB型的反式烯质子信号6.33、6.24(各1H,d,=16.0 Hz)和7.59、7.55(各1H,d,=16.0 Hz),C-NMR在114~169间给出了10 个不饱和的次甲基碳,这些与奎尼酸的结构相似,查询文献[26]数据比对,确定为3,5--二咖啡酰基奎尼酸。
C5和C6分子质量均与C4相同,其中C5可看出明显的二取代咖啡酰基奎尼酸和酰化位移,C-3、C-4酰化位移,推测可能为C4同分异构体,与文献[27-28]对比,确定为3,4--双咖啡酰基奎尼酸和4,5--双咖啡酰基奎尼酸。
通过表3中ESI-MS、C-NMR、H-NMR数据,结合化合物的外观及化学性质,确定化合物结构:

表3 C7~C11化合物结构分析Table 3 Structural analysis of compounds C7-C11
C7为黄色无定型粉状,与硫酸-香草醛显黄色、三氯化铁-铁氰化钾和盐酸-镁粉有阳性反应,提示含有酚羟基可能为黄酮类物质,核磁数据与文献[29]对比后可确定该化合物为杨梅苷。
C8能与10%HSO-乙醇溶液显色为紫色,且为白色粉,数据显示该化合物含7 个伯碳、8 个仲碳、6 个叔碳和9 个季碳。数据结果与文献[30]数据对比可确定C8为19羟基熊果酸。
C9为浅黄色粉末,易溶于水、甲醇等极性溶剂,FeCl反应显蓝色,与表没食子儿茶素没食子酸酯标品在相同条件下同时点板比对,多种展开条件Rf值和显色情况均一致,将其核磁数据与文献[31]对比,化合物C9鉴定为表没食子儿茶素没食子酸酯。
C10核磁数据分析存在咖啡酰基质子、反式烯质子,10 个不饱和的碳氢和6 个芳香季碳,且在氢谱图3.60处显示有一个甲氧基的信号存在,经与文献[32]比对后,确定C10为3,4--二咖啡酰基奎宁酸甲酯。
C11为微黄色粉末,其核磁数据分析显示存在2 个咖啡基,1 个奎宁酸六元环和1 个甲氧基片段,将其核磁数据对比文献[33],确定为3,5--二咖啡酰基奎宁酸甲酯。
3 结论
对苦丁茶采取不同极性的有机试剂分级萃取,分别进行抗氧化活性筛选、评价抗补体活性及通过癌细胞抑制作用考察各部位的活性情况。结果表明苦丁茶乙醇提取物及其4 个萃取部位均具有抗氧化活性,乙酸乙酯部位的总还原力、DPPH自由基和超氧阴离子自由基清除率均为最高,最大值分别为2.672±0.05、(95.52±0.89)%、(93.80±2.51)%。乙酸乙酯部位抗补体活性在质量浓度1 mg/mL时达到最大值(79.67±0.99)%,与相同质量浓度下正丁醇部位的抗补体活性(29.27±0.64)%相差较明显,具有显著差异(<0.01)。乙酸乙酯萃取部位能较好地抑制MCF-7的增殖,抑制率达到(54.8±0.26)%,实验结果表明苦丁茶粗提取物在分级萃取后,更多的活性物质集中在乙酸乙酯部位,并在苦丁茶乙酸乙酯部位中分离鉴定了11 个单体化合物。通过对苦丁茶不同极性部位的活性研究和乙酸乙酯部位单体化合物的分离鉴定,为以后进一步确定小分子物质与活性关系的研究提供了良好的实验基础,同时也对苦丁茶的综合开发利用和对天然食用资源的活性的深入研究具有重大意义。
