体外消化和结肠发酵对不同采收期坛紫菜中酚类物质生物可及性和肠道菌群的影响
2022-10-31郭莹莹尹大芳王联珠许加超
田 雨,郭莹莹,李 娜,尹大芳,王联珠,,许加超,
(1.中国海洋大学食品科学与工程学院,山东 青岛 266101;2.中国水产科学院黄海水产研究所,山东 青岛 266071)
紫菜()是我国具有重要经济价值的大型海藻之一,富含蛋白质、多糖、矿物质和多酚等物质。目前我国栽培的紫菜主要分为坛紫菜()和条斑紫菜()两种,其中坛紫菜主要产于我国的福建、广东和浙江等地,以国内消费为主,常见的商品形式为干坛紫菜及冲泡类汤料。坛紫菜的生长和采收季节性非常强,福建地区一般在9月份开始苗帘下海,10月份左右进行采收,采收期可以一直持续到翌年的2月份。初次采收的坛紫菜称为头水紫菜最为珍贵,之后一般每隔15~20 d左右采收一次。有研究认为不同采收期的紫菜在营养品质方面存在差异,一般随采收期的延伸紫菜营养品质逐渐降低。
酚类物质是从植物中发现的一大类次生代谢产物,主要包括酚酸和类黄酮两大类,藻类、水果和蔬菜等是酚类物质的天然来源。藻类中酚类物质的研究大多集中于提取方法、结构测定,对于功能活性主要局限于抗氧化测定方面。由于酚类物质往往含有一个或多个极易被氧化的酚羟基结构,使得其具有较强的抗氧化和清除自由基能力,酚类物质的摄入可以保护机体免受自由基和过氧化产物的损伤,因此藻类中酚类物质被认为是其抗氧化能力的主要贡献者。但在胃肠道条件下酚类物质的稳定性和生物可及性都会受到影响,此外一些在胃肠道中不被消化的酚类物质还可能会进入结肠被肠道菌群分解代谢。生物可及性即食物中营养成分在进入胃肠道消化过程中从食物基质中释放出来并可能被吸收的比例,常采用体外模拟消化进行评估。这是评估食物营养的一个重要因素,不同的食物基质和食物成分的差异都会导致生物可及性的变化。
坛紫菜作为我国主要食用的一类红藻,含有丰富的酚类物质,煮制是其主要的加工食用方法。本研究探究煮制后坛紫菜经体外消化发酵后酚类物质(总酚和总黄酮)的变化。紫菜中含有丰富的酚类物质,因此本实验探究不同采收期坛紫菜煮制后酚类物质经体外模拟消化后的生物可及性和抗氧化活性(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除活性和铁氰化钾还原活性),并进一步探究坛紫菜的摄入对肠道菌群和肠道微环境的调节作用,旨在为坛紫菜的消费选择及品质评价提供科学参考。
1 材料与方法
1.1 材料与试剂
样品:早期紫菜(2020年10月4日采收一水紫菜,XP1)、中期紫菜(2020年11月17日采收四水紫菜,XP4)、末期紫菜(2021年1月12日采收七水紫菜,XP7)。
-淀粉酶、胃蛋白酶、胰酶、吐温80、VK、胆汁盐、DPPH 美国Sigma公司;氯化钙、盐酸、蛋白胨、酵母提取物、氯高铁血红素、磷酸二氢钠、磷酸氢二钠、氯化钠、-半胱氨酸盐酸盐 国药集团化学试剂有限公司。
1.2 仪器与设备
LRH-150 B 生化培养箱 广东医疗器械厂;Spectramax i3x酶标仪 美国Molecular Devices公司;L-8800型高速氨基酸自动分析仪 日本日立公司;7900电感耦合等离子体质谱仪 美国安捷伦公司。
1.3 方法
1.3.1 试样处理
原始试样:干坛紫菜直接粉碎后,过40 目筛,密封保存于-18 ℃。
煮制试样:取40 g干坛紫菜,浸没于1 L沸水中煮沸5 min,捞出控水后,再冷冻干燥,粉碎过40 目筛,密封保存于-18 ℃。
1.3.2 体外模拟消化和结肠发酵
1.3.2.1 体外模拟消化
体外消化过程参照INFOGEST方法,对煮制后坛紫菜进行口腔、胃和小肠3 个阶段的体外模拟消化。
口腔阶段:称取1.5 g坛紫菜样品与3.5 mL的蒸馏水涡旋混合1 min,以5 mL蒸馏水作为空白对照(BLK),添加模拟唾液4 mL、0.3 mol/L CaCl溶液0.025 mL、-淀粉酶(1 000 U/mL)0.75 mL,加水补充溶液至10 mL。37 ℃孵育5 min。
胃阶段:将4 mL模拟胃液添加到前一阶段的消化液中,用HCl溶液将pH值调节至3.0,再加入0.3 mol/L CaCl溶液0.005 mL、胃蛋白酶溶液(60 000 U/mL)0.667 mL和超纯水补充溶液至20 mL,将混合物在37 ℃孵育2 h。
小肠阶段:将8 mL模拟小肠液添加至前一阶段的消化液中,用NaOH溶液将pH值调节至7.0,加入133.2 mmol/L胆盐溶液3 mL、0.3 mol/L CaCl溶液0.04 mL,胰酶溶液(800 U/mL)2.5 mL和超纯水补充至40 mL,将混合物在37 ℃孵育2 h。
反应结束后,将消化液转移至1 000 Da透析袋中,于100 mL 10 mmol/L NaCl透析液中,在4 ℃条件下透析24 h。透析液-18 ℃保存,用于抗氧化活性、总酚和总黄酮含量测定;透析袋内残渣冷冻干燥用于后续结肠发酵实验。
1.3.2.2 体外模拟结肠发酵
体外结肠发酵过程参照Pérez-Burillo等方法并略作修改。
基础培养基:2.0 g蛋白胨,2.0 g酵母提取物,0.02 g氯高铁血红素,0.5 g-半胱氨酸盐酸盐,0.5 g胆汁盐,0.1 g NaCl,0.04 g KHPO,0.04 g KHPO,0.01 g MgSO·7HO,0.01 g CaCl·6HO,2 g NaHCO,1.0 mL刃天青溶液(0.1 g/100 mL),2.0 mL吐温80,10 µL VK,将pH值调节至7.4±0.2后,定容至1 L,并在121 ℃高压灭菌20 min。
肠道菌群来源:收集2 名女性和1 名男性(3 名志愿者的年龄范围20~25 岁,至少3 个月以上都没有胃肠道疾病或接受抗生素治疗,自愿在身体和精神上参与该实验)的新鲜粪便,将收集的粪便样品等量混合,以32%(/)的比例加入预还原的磷酸盐缓冲液(phosphate buffered saline,PBS)(0.1 mol/L,pH 7.4)进行混合,经8 层灭菌纱布过滤至锥形瓶中,置于冰上备用。
将消化样品(2 g/100 mL)和菌液(10%)添加至基础培养基,菊粉(INK)作阳性对照,蒸馏水(BLK)作阴性对照。37 ℃孵育,分别于0、6、12 h和24 h后取样,并于冷冻离心机中以500 r/min离心3 min,收集紫菜沉淀。上清液12 000 r/min离心2 min,收集沉淀的细菌用于DNA提取和16S rRNA测序;收集发酵上清液用于短链脂肪酸(short chain fatty acids,SCFAs)、总酚和总黄酮含量测定。
1.3.3 酚类物质测定
准确称取200 mg坛紫菜样品浸没于10 mL甲醇-水(80∶20,/)溶液中,超声提取30 min,12 000 r/min离心10 min。再加入10 mL甲醇水,重复提取1 次。合并提取液,并定容到20 mL。采用Folin-Denis法测定总酚含量;采用NaNO-Al(NO)法测定总黄酮含量。总酚、总黄酮生物可及性按下式计算:
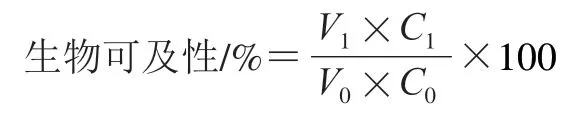
式中:为消化透析液总体积/mL;为透析液中物质质量浓度/(mg/mL);为煮制坛紫菜提取液总体积/mL;为提取液中物质质量浓度/(mg/mL)。
1.3.4 抗氧化活性测定
1.3.4.1 DPPH自由基清除能力
将100 µL 透析液与100 µL DPPH-乙醇溶液(0.1 mmol/L)涡旋混合,于黑暗中室温孵育30 min,在517 nm波长处测定吸光度。
1.3.4.2 ABTS阳离子自由基清除能力
将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液1∶1混合,在黑暗中室温反应12~16 h。用5 mmol/L PBS(pH 7.4)稀释获得ABTS阳离子自由基溶液。将20 µL透析液与180 µL ABTS阳离子自由基溶液涡旋混合,静置6 min后在734 nm波长处测定吸光度。
1.3.4.3 铁氰化钾还原能力
将0.2 mL透析液、0.5 mL PBS(0.2 mol/L,pH 6.6)和0.2 mL 1%铁氰化钾溶液混合50 ℃水浴20 min,再加入1 mL 10% TCA溶液涡旋混合,8 000 r/min离心5 min。取离心上清液0.5 mL,加入0.5 mL蒸馏水和0.1 mL 0.1%的三氯化铁溶液,摇匀静置10 min,在700 nm波长处测定吸光度;取离心后上清液0.5 mL,加入0.6 mL蒸馏水,摇匀静置10 min,在700 nm波长处测定吸光度。
1.3.5 SCFAs和支链脂肪酸(branched chain fatty acids,BCFAs)含量测定
9.2 mol/L HSO溶液0.16 mL、发酵上清液0.8 mL和2-乙基丁酸0.04 mL混合,4 ℃酸化30 min。向离心管中加入0.8 mL乙酸乙酯,涡旋振荡1 min,8 000 r/min离心5 min,取上清液用于进样。
仪器条件:采用配备有氢火焰离子化检测器的Agilent 7890B气相色谱仪,DB-WAX毛细管色谱柱(30 m×0.53 mm,1 µm);载气为氮气,19 mL/min的恒定流速和1∶10的分流比,氢气和空气的流速分别为40 mL/min和400 mL/min;进样量为1 µL;检测器和进样的温度均为250 ℃;色谱柱升温程序为90 ℃保持2 min,以15 ℃/min速率升温至200 ℃。
1.3.6 DNA提取和16S rRNA测序
使用DNA Stool Mini Kit提取DNA。使用通用引物扩增细菌16S rRNA基因的V3-V4区。通过2%琼脂糖凝胶电泳确认分离的DNA,Qubit进行定量。通过Illumina MiSeq平台对纯化的DNA扩增子进行高通量测序和生物信息学分析。
1.4 数据分析
采用SPSS 22.0进行方差和显著性分析,<0.05,差异显著。采用Origin 2020进行绘图。
2 结果与分析
2.1 不同采收期坛紫菜总酚含量及体外消化后生物可及性
原始坛紫菜中总酚含量为6.66~7.53 mg/g(没食子酸当量计,下同),随采收期的延伸坛紫菜中总酚含量呈现先减少后增加的趋势(表1)。XP1中总酚含量最高,XP4中总酚含量显著降低至6.66 mg/g,XP7中总酚含量有所增加,为6.95 mg/g。酚类物质作为次生代谢产物可以帮助藻类克服恶劣天气适应周围环境,因此其含量的变化可能受水/空气温度、水域环境、光照、采收次数等多种因素的综合作用。本实验测定的坛紫菜总酚含量与邱小明采用响应面法测得的坛紫菜中总酚的最大提取率6.78 mg/g相似,其含量与卷心菜、芦笋、枸杞等食物含量相当,是酚类物质较好的食物来源。

表1 不同采收期坛紫菜煮制前后总酚含量及其消化后释放量Table 1 Changes in contents and bioaccessibility of total phenols in P.haitanensis harvested at different times after cooking and digestion
煮制后坛紫菜中总酚含量为6.47~7.61 mg/g,与原始坛紫菜相比较,煮制后XP1和XP4中总酚含量略有增加,分别为7.61 mg/g和6.76 mg/g,但XP7中总酚含量降低为6.47 mg/g,煮制后XP1中总酚含量仍最高。虽然煮制过程导致坛紫菜中总酚含量有所变化,但由于总酚耐热,且煮制过程会导致多酚氧化酶失活,使得总酚的降解受抑制。因此短时间的煮制对坛紫菜中总酚含量无显著影响。
煮制坛紫菜经过体外消化后,消化液中总酚含量均有不同程度的增加,XP1和XP4分别为7.98 mg/g和7.12 mg/g,略高于消化前的总酚含量。XP7消化液中总酚含量显著增加为7.57 mg/g,生物可及性高达117.03%。体外消化后总酚具有极高的生物可及性(104.80%~117.03%),可能是由于在胃肠道消化酶和胆汁盐的作用下,导致坛紫菜细胞结构被破坏,坛紫菜中一些与蛋白、多糖、纤维等物质结合不易释放的结合酚类物质被释放出来。但由于不同采收期坛紫菜间基质的差异,导致在消化过程中酚类物质的生物可及性有所差异。而Afonso等研究测定翅藻和糖海带中总酚的生物可及性分别为24.71%和18.99%。这表明坛紫菜中多酚类物质较为稳定,在经过胃肠道消化作用后仍具有极高的吸收率。
2.2 不同采收期坛紫菜总黄酮含量及体外消化后生物可及性
干坛紫菜中总黄酮含量约为1.15~1.88 mg/g(视黄醇当量计,下同),总黄酮含量随采收期的延伸而下降(表2),XP1和XP4中总黄酮含量分别为1.88 mg/g和1.66 mg/g,显著高于XP7中总黄酮含量(1.15 mg/g)。陈利梅采用超声辅助双水相法对条斑紫菜中总黄酮的提取量为1.48 mg/g,与本实验测定的坛紫菜总黄酮含量相似。经煮制后XP4中总黄酮含量(1.24 mg/g)显著降低,XP1和XP7中总黄酮含量有一定增加,分别为2.37 mg/g和1.26 mg/g。
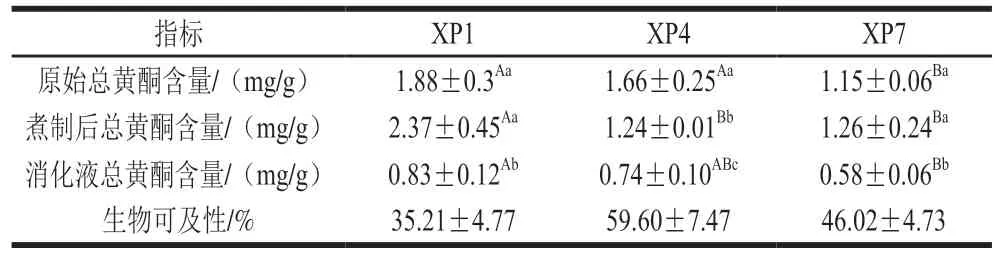
表2 不同采收期坛紫菜煮制前后总黄酮含量及其消化后释放量Table 2 Changes in contents and bioaccessibility of total flavonoids in P.haitanensis harvested at different times after cooking and digestion
体外消化后,坛紫菜中释放的总黄酮含量显著降低。XP1释放的总黄酮含量最高为0.83 mg/g,XP4次之为0.74 mg/g,XP7释放的总黄酮含量最低为0.58 mg/g,不同采收期坛紫菜基质间存在差异,因此导致坛紫菜中总黄酮在消化过程中的释放存在差异。坛紫菜中总黄酮生物可及性较低,约为35.21%~59.60%,王小超等研究测定的蜂花粉中总黄酮也表现出较低的生物可及性(27.32%~37.63%)。向卓亚等对藜麦中总黄酮的生物可及性研究也表明受小肠消化阶段的pH值影响,导致总黄酮的生物可及性较低。此外总黄酮与消化过程中添加的蛋白酶或坛紫菜消化过程中释放蛋白质相互作用也可能导致总黄酮生物可及性降低。
2.3 不同采收期坛紫菜消化液抗氧化活性
自由基会对生物大分子(蛋白质、脂质、糖类、核酸等)产生氧化修饰,从而导致细胞结构及功能被破坏。因此自由基的过量存在对人体健康有极大威胁,导致心血管、炎症、癌症等疾病发生概率增加,并加速人体衰老。研究认为藻类中酚类物质的含量与藻类的抗氧化性之间存在相关性,其在贡献电子后使得自由基转变为稳定的中间体,有效的在细胞和生理水平上防止氧化。
DPPH自由基和ABTS阳离子自由基是两种比较稳定的自由基,被广泛用于评价天然产物的抗氧化活性。如表3所示,随采收期的延伸,坛紫菜消化液的DPPH自由基清除能力逐渐降低为46.70%~53.82%,XP1抗氧化能力最强,XP4次之为50.86%,XP7抗氧化能力最低。坛紫菜消化液的ABTS阳离子自由基清除能力(30.68%~32.65%)显著高于空白对照(16.27%),XP1的ABTS阳离子自由基清除能力最高为32.65%,但与XP4(30.68%)和XP7(30.99%)间无显著差异。

表3 不同采收期坛紫菜消化液抗氧化活性Table 3 Antioxidant activity of digest of P.haitanensis harvested at different times %
所有样品都表现出较低的铁氰化钾还原活性,且XP7的铁氰化钾还原活性(7.13%)显著低于XP1(9.45%)和XP4(9.45%)。这可能是由于铁氰化钾还原能力测定的是抗氧化剂作为电子供体,减少Fe的能力。坛紫菜经体外消化后其消化液是一个复杂的体系,消化产物中对DPPH自由基和ABTS阳离子自由基的清除以及Fe的还原起作用的物质间存在差异,导致坛紫菜消化产物在不同的抗氧化模型中表现出的抗氧化能力存在明显差异。
经体外模拟消化后不同采收期坛紫菜消化液抗氧化活性均极显著高于空白对照组。这可能是由于消化作用促进了坛紫菜中多糖、总酚、总黄酮和氨基酸等物质的释放从而导致其抗氧化活性显著提升。由于坛紫菜经消化后的消化液属于一个复杂的体系,虽然酚类物质被认为是其抗氧化能力的主要贡献者,但其抗氧化活性可能还受到体系中其他物质的影响,导致抗氧化活性变化与酚类物质含量变化并不完全一致,但根据显著性分析可以看出酚类物质含量和抗氧化活性均随采收期的延伸呈现出下降趋势,XP1消化液表现出最高的抗氧化活性。
2.4 结肠发酵后发酵液中总酚和总黄酮含量
坛紫菜在经胃肠道消化后,消化残渣进入结肠进行发酵。如表4所示,发酵液中含有较高含量的总酚(3.67~4.81 mg/g)。同一发酵时间下,XP1发酵液中总酚含量(4.26~4.81 mg/g)显著高于XP4(3.67~3.85 mg/g)和XP7(3.73~3.77 mg/g)发酵液,这可能是由于肠道菌群发酵促进了坛紫菜中结合酚的释放。但随发酵时间的延长,坛紫菜发酵液中总酚含量虽略有变化,但在整个发酵过程中总酚含量的变化并不显著。释放的总酚似乎并不能被肠道菌群代谢,且在发酵液中并未检测到总黄酮的存在。有研究表明发酵液中大多数可代谢的酚类物质在开始发酵后的5 h内已完成代谢,但本研究并没有测定发酵前5 h发酵液中酚类物质的变化,因此坛紫菜中酚类物质在结肠中的代谢还需要更多的研究。

表4 不同采收期坛紫菜发酵过程中总酚含量Table 4 Total phenolic contents in P.haitanensis harvested at different times during in vitro colonic fermentation mg/g
2.5 SCFAs分析
不同采收期的坛紫菜样品发酵液中乙酸浓度均在结肠发酵12 h后达到最高水平,为23.93~25.54 mmol/L,在后续的发酵过程中乙酸浓度(19.80~22.22 mmol/L)显著下降(图1A)。乙酸是本实验发酵液中含量最丰富的SCFAs,肠道菌群产生的乙酸主要是穿过肠上皮,从而进入外周循环系统发挥作用,且可通过中央稳态机制穿越血脑屏障来降低食欲。

图1 不同采收期坛紫菜发酵液SCFAs含量Fig.1 Contents of SCFAs during fermentation of P.haitanensis harvested at different times
肠道菌群产生的丙酸主要在肝脏中进行代谢,经过草酰乙酸转化、单磷酸腺苷活化的蛋白激酶活化可促进肝脏中脂肪酸的氧化。丁酸是肠上皮细胞的主要能量来源,有助于维持肠上皮和屏障功能完整。相较于乙酸,坛紫菜的添加对丙酸和正丁酸含量的增加有明显促进作用。与空白对照相比,坛紫菜的添加导致丙酸和正丁酸含量在6 h处出现显著增加,在后续的发酵过程中其含量无明显变化,这表明肠道菌群的初期发酵底物有助于丙酸和正丁酸的产生。经体外结肠发酵6 h后,XP1中丙酸和正丁酸含量(16.20 mmol/L 和8.13 mmol/L)略高于XP4(12.30 mmol/L和6.52 mmol/L)和XP7(12.66 mmol/L和6.53 mmol/L),XP1作为发酵底物对丙酸和正丁酸的产生更显著。正戊酸含量在发酵6 h处有增加,但在整个发酵过程中正戊酸含量和变化很小,浓度约为0.3 mmol/L,大约仅占发酵液中总SCFAs含量的1%。
2.6 BCFAs分析
BCFAs被认为是支链氨基酸被肠道细菌发酵的特征产物。由图2可以看出,相较于空白对照组,坛紫菜的添加对异丁酸、异戊酸的产生有显著抑制作用。随发酵过程的进行,XP1和XP4发酵液中BCFAs含量在24 h处出现显著增加,而XP7发酵液中BCFAs含量在12 h处就发生了明显增加。在发酵过程中,XP1和XP4可以在更长时间上抑制BCFAs的产生。BCFAs含量的增加可能与发酵后期底物中可发酵碳水化合物含量较低有关,导致细菌通过发酵蛋白质或氨基酸获得能量,从而导致BCFAs含量增加。但其浓度的增加仅是细菌蛋白发酵的标记物,不可以作为结肠健康的标记物。
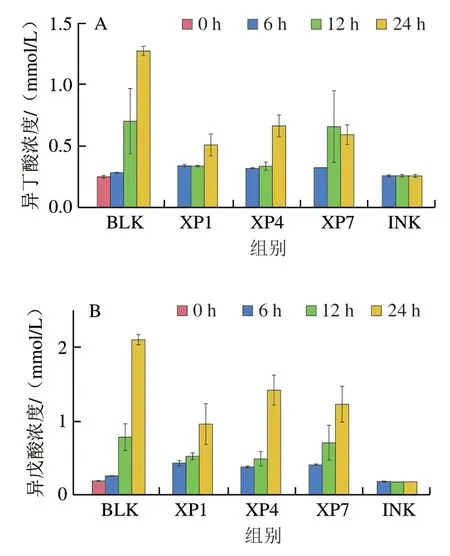
图2 不同采收期坛紫菜发酵液BCFAs含量Fig.2 Contents of branched chain fatty acids during fermentation of P.haitanensisharvested at different times
2.7 坛紫菜对肠道菌群的调节作用
由图3 A 可以看出,肠道菌群组成主要分为Firmicutes、Bacteroidetes、Proteobacteria和Fusobacterieta 4 个门类。Bacteroidetes是人体肠道内菌群数量最大的细菌门类之一,大约占肠道内细菌总量的30%,其含有更多编码多糖利用位点和水解酶的基因,可以降解膳食中人体胃肠道不能够降解的多糖和纤维类物质。有研究发现多糖片段的水解大多发生在Bacteroidetes的周质空间,这一现象进一步证实了Bacteroidetes对多糖的高效利用。坛紫菜的添加导致Bacteroidetes相对丰度随发酵时间的延长呈现先减少后增加的趋势,这可能是由于坛紫菜中多糖或膳食纤维类物质的消耗主要发生在6~24 h处。Bacteroidetes相对丰度显著增加表明其可能是坛紫菜中碳水化合物消耗的主要响应者。坛紫菜的添加导致在发酵6 h内,Firmicutes相对丰度显著增加,在后续的发酵过程中相对丰度急剧下降。本研究Firmicutes的降低主要受和主导。从图3B可以看出,坛紫菜发酵6 h后,发酵液中相对丰度显著增加,且其相对丰度与采收期呈正相关。可利用阿拉伯糖、葡萄糖、蔗糖等多种糖类发酵产生的乙酸和丙酸,其相对丰度与糖尿病的发生发展密切相关。相较于2型糖尿病患者或糖尿病前期人群,健康人群肠道菌群中相对丰度往往较高。发酵前期的急剧增加可能是由于坛紫菜中游离单糖等易代谢碳水化合物被消耗,且在发酵6h后可以发酵液中丙酸含量也显著增加。在发酵6 h后,易代谢碳水化合物减少,此时发酵多糖、膳食纤维等物质的相对丰度开始增加。与坛紫菜组不同,INK组发酵前期(0~6 h)相对丰度显著增加,发酵后期(12~24 h)相对丰度显著增加。
能发酵蛋白质产生乙酸和少量的琥珀酸,但不发酵碳水化合物,其相对丰度在中期和末期坛紫菜发酵24 h后显著增加(图3C),的相对丰度增加表明肠道菌群开始发酵蛋白,这与发酵液中BCFAs含量在24 h处开始显著增加的变化一致;、随发酵时间延长而逐渐增加,且其相对丰度随采收期的延伸而逐渐降低。坛紫菜的添加导致相对丰度在发酵6 h后显著增加,但在发酵时间延长至12 h后,发酵液中相对丰度显著降低。主要分解乳糖和蛋白质,可以产生细菌素,抑制有害菌定植,刺激免疫球蛋白产生,增强宿主免疫力,对人体健康起着十分重要的作用。

图3 坛紫菜体外发酵过程中微生物群落变化Fig.3 Changes in microbial community during in vitro fermentation of P.haitanensis
3 结论
通过体外模拟消化和结肠发酵探究不同采收期坛紫菜酚类物质的含量、生物可及性和抗氧化活性间的差异,以及坛紫菜对肠道菌群的调节作用。结果表明短时间煮制对坛紫菜中的总酚含量无显著影响,但中期坛紫菜经煮制后总黄酮含量显著降低。体外消化后,坛紫菜中总酚表现出极高的生物可及性,而总黄酮生物可及性较低。消化后坛紫菜消化液均表现出良好的抗氧化活性。对不同采收期坛紫菜而言,头水坛紫菜在总酚和总黄酮含量、体外消化后的释放量以及抗氧化能力方面均显著高于中期和末期坛紫菜。
体外消化后的消化残渣通过接种肠道菌群模拟体外结肠发酵。乙酸是发酵液中含量最丰富的SCFAs,其在发酵12 h后达到最高水平。坛紫菜的添加对于丙酸和正丁酸含量的增加有明显的促进作用,且头水坛紫菜对丙酸和正丁酸产生的促进作用略高于中期和晚期坛紫菜。相较于中期和末期坛紫菜,头水坛紫菜对BCFAs的生成具有更明显的抑制作用。坛紫菜的添加促进了、和等有益菌的生长,对肠道菌群有明显的调节作用。综上所述,头水坛紫菜在酚类物质的生物可及性、抗氧化活性、SCFAs的产生和肠道菌群的调节等方面均具有更优异的表现。
