罗非鱼蛋白-乳清蛋白复合乳液负载β-胡萝卜素的研究
2022-10-29林琼妮陈艾霖刘嘉怡林玉锋周春霞
林琼妮,陈艾霖,刘嘉怡,林玉锋,周春霞,2*
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研究中心,广东 湛江 524088;2.南方海洋科学与工程广东省实验室(湛江),广东 湛江 524088)
β-胡萝卜素是亲脂性色素,是一种可预防癌症和心血管疾病的高效抗氧化剂[1]。然而β-胡萝卜素含有不饱和共轭双键,稳定性差,易受到紫外线、高温和有氧环境的影响而降解[2],其溶解性低和细胞渗透性差等也会导致人体吸收利用低,严重限制了其在食品加工中的应用。如何提高β-胡萝卜素的稳定性及生物利用率是其应用过程中亟待解决的问题。水包油乳液体系能够隔绝氧气,保护色素免受降解,同时可以提高亲脂性物质的生物利用率。蛋白质和变性淀粉等大分子乳化剂稳定的乳液均表现出良好的抗氧化特性[3-4]。吐温20、辛烯基琥珀酸酯、乳清分离蛋白(whey protein isolate,WPI)等乳化剂通过高压均质制备的β-胡萝卜素纳米乳液稳定性好,且WPI纳米乳液中β-胡萝卜素的降解最慢[5],WPI也可以体外调节β-胡萝卜素的生物利用率[6]。罗非鱼分离蛋白(tilapia protein isolate,TPI)是一种氨基酸种类齐全,易于消化吸收的优质蛋白,但因其溶解性和稳定性较差,导致了其乳化活性和乳化稳定性都较差,因此TPI在食品乳液中的应用极少[7]。
研究表明,混合蛋白可避免单一蛋白的营养不足,提高体系的溶解性、稳定性和营养价值[8]。与单一蛋白乳液相比,复合蛋白乳液作为一种递送体系在结构稳定性和抵抗环境压力方面更具优势,对所包埋的生物活性物质具有一定的控释能力、对敏感的亲脂性活性成分具有更好的保护作用[3]。以酪蛋白酸钠与乳铁蛋白包埋ω-3脂肪酸制备的复合乳液具有良好的物理稳定性,比单纯用酪蛋白酸钠为乳化剂制备的乳液氧化稳定性有明显改善[9]。复合蛋白乳液相对于单一蛋白乳液更适用于生物活性物质在人体消化道内的释放和吸收[10]。此外,乳液的稳定性还与蛋白质的酸碱处理及热处理等有关。热处理后混合蛋白的二硫键含量增多、疏水性增强[11],用大豆蛋白和多糖制备的O/W乳液在热处理后贮藏稳定性显著提高[12]。在体外消化试验中,通过热处理制备的乳清蛋白微凝胶稳定的高内相乳液可以增加β-胡萝卜素的生物利用度[13]。在强碱条件下(pH12.0)处理的双蛋白复合物会经历显著的构象变化,使其具有平衡的氨基酸组成和优良的溶解性[14],Wang等[15]将大米蛋白和大豆蛋白于碱性条件下(pH12.0)溶解1 h后调至中性,其溶解性大大提高。因此,碱处理和(或)热处理可以提高乳液的稳定性。为此,本研究充分利用双蛋白的营养和功能特性优势,以单一蛋白(TPI、WPI)和混合蛋白作为乳化剂,高压均质制备负载β-胡萝卜素的复合蛋白乳液并对其进行热处理,研究乳液稳定性、抗氧化性及生物利用率,为β-胡萝卜素的稳态化研究及其功能乳液的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜活罗非鱼:市售;食品级乳清分离蛋白(蛋白质含量88.26%):天津米尔凯威进出口有限公司;β-胡萝卜素标品(HPLC≥90%)、胃蛋白酶(15 000 U/mg)、脂肪酶(30 000 U/g):上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐 [2,2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS]:上海阿拉丁生物科技有限公司;。
1.2 仪器与设备
PH S-3C精密pH计:上海雷磁仪器厂;TU-20HT恒温水浴锅:英国Bibby Scientific公司;UV-2550型紫外分光光度计:日本岛津公司;Avanti J-26sxp高速冷冻离心机:美国Beckman公司;NS810分光测色仪:深圳市三恩时科技有限公司;T18高速剪切分散均质机:德国IKA公司;FV3000激光扫描共聚焦显微镜:日本Olympus公司;NanoBrook Omni激光粒度仪:美国布鲁克海文仪器公司;AH-NANO超高压均质机:郑州科泰实验设备有限公司。
1.3 方法
1.3.1 罗非鱼分离蛋白的提取
取罗非鱼背部白肉搅碎,按料液比1∶9(g/mL)与冰蒸馏水混合均质2 min,pH值调至11.0,涡旋30 min后离心(10 000 r/min,20 min,4℃),将上清液 pH 值调至 5.5,再离心(10 000 r/min,20 min,4℃),取沉淀加冰水分散,调节pH7.0,透析后冷冻干燥备用。TPI的粗蛋白质质量分数为(90.05±0.39)%。
1.3.2 负载β-胡萝卜素的TPI-WPI复合乳液的制备
参照Cornacchia等[4]的方法并稍作修改。称取不同质量比(2∶1、1∶1、1∶2)的 TPI与 WPI分别配制成1 g/100 mL蛋白水溶液,搅拌2 h后,在碱性条件(pH11.0)下搅拌 1 h后调回中性条件(pH7.0),添加0.2 g/100 mL β-胡萝卜素于玉米油中,将水相与油相按9∶1混合,于12000r/min下均质分散2min,再用高压均质机于60MPa的条件下均质循环5次。将制备的乳液于65℃加热处理30min,取出冷却至室温并贮藏于4℃。乳液避光及低温(4℃)贮藏,以防β-胡萝卜素降解。
1.3.3 乳液粒径与电位的测定
乳液粒径与电位的测定参照Guan等[1]的方法并稍作修改。为了避免多重散射效应,先用蒸馏水将乳液稀释300倍并摇匀,以确保样品均匀分散,利用激光粒度仪及zeta电位仪测定其粒径和电位。每个样品至少测定3次,并取平均值。
1.3.4 乳液中β-胡萝卜素保留率的测定
参照冯鑫等[16]测定β-胡萝卜素标准曲线的方法,用正己烷配制 2 μg/mL~50 μg/mL 的 β-胡萝卜素标准溶液,以正己烷为空白,于450 nm测定其吸光值,并绘制标准曲线。
β-胡萝卜素保留率的测定:每个样品取0.5 mL,依次加入2.0 mL无水乙醇和3.0 mL正己烷,涡旋后静置10 min,将上层的正己烷吸出、收集于比色管中。再添加3.0 mL正己烷重复上述操作,将提取物合并,使体积达10 mL。于450 nm处测定吸光值。用β-胡萝卜素标准曲线算出β-胡萝卜素的含量,由公式(1)计算β-胡萝卜素的保留率。

式中:Ct为贮藏时间t时乳液的β-胡萝卜素的含量,μg/mL;C0为乳液中β-胡萝卜素的初始含量,μg/mL。
1.3.5 乳液抗氧化活性的测定
参照Guan等[1]的方法进行DPPH自由基清除能力的测定。以0.125 mmol/L的乙醇溶液配制DPPH溶液。取1 mL样品溶液和1 mL的DPPH溶液混合后离心,将混合物在黑暗中孵育30 min,于517 nm处测量吸光值并记为AE;取1 mL乙醇和1 mL的DPPH溶液混合,按上述操作并记为AD。DPPH自由基清除率按公式(2)计算。

参照陈雨桐[17]的方法进行ABTS+自由基清除能力的测定。将新制的ABTS溶液与2.45 mmol/L过硫酸钾混合,黑暗中放置16 h后稀释10倍备用。将0.1 mL样品与3 mL稀释的ABTS溶液混合后在黑暗中孵育10 min后,在734 nm处测量吸光度并记为AS。用蒸馏水代替样品测定空白并记为AW。ABTS+自由基清除率按公式(3)计算。

1.3.6 乳液中游离脂肪酸释放率的测定
乳液中游离脂肪酸释放率的测定参照Gomes等[2]的体外消化方案并稍作修改。胃消化阶段:取15 mL乳液加入15mL胃蛋白酶液(含2mg/mLNaCl、7mL/LHCl、0.32 mg/mL胃蛋白酶),用1.0 mol/L HCl或1.0 mol/L NaOH调pH2.0然后在37℃水浴反应2 h。肠消化阶段:将胃反应液用0.1 mol/L NaOH调pH7.0后加入3.5 mL 54 mg/mL的猪胆盐提取物后加入1.5 mL盐溶液(含 10 mmol/L CaCl2和 150 mmol/L NaCl),用0.1 mol/L NaOH调pH7.0后加入2.5 mL胰脂肪酶液(用0.1 mol/L磷酸缓冲溶液配制成75 mg/mL),在37℃水浴加热,记录在 30、60、90、120 min 时维持 pH7.0 所消耗的氢氧化钠溶液(0.1 mol/L)体积,从而测定其游离脂肪酸(free fatty acid,FFA)释放率,按公式(4)进行计算。

式中:V为中和产生的游离脂肪酸所需氢氧化钠溶液的体积,mL;m为氢氧化钠溶液的浓度,mol/L;W为初始脂质的总质量,g;M为玉米油的摩尔质量浓度,g/mol。
1.3.7 β-胡萝卜素生物利用率的测定
乳液按照1.3.6进行胃、肠模拟消化后,得到消化液,将消化液离心后得到胶束液。用注射器将胶束层取出并通过0.22 μm的滤膜过滤,测定胶束层的β-胡萝卜素含量,使用1.3.4中测定β-胡萝卜素质量浓度的方法测定胶束中β-胡萝卜素的质量浓度,并通过公式(5)计算β-胡萝卜素纳米乳液经消化后的生物利用率。

式中:C1为乳液中β-胡萝卜素质量浓度,μg/mL;C2为胶束中β-胡萝卜素质量浓度,μg/mL。
1.3.8 荧光显微镜观察
“双主体”。现代学徒制构建的是以“学校本位”和“企业本位”相结合的“双主体”人才培养模式,学校与企业共同承担育人责任,共同承担风险、共同培养人才。
参照陈恩民[18]的方法并稍作修改,利用荧光显微镜对5种乳液的微观形态进行观察。采用尼罗蓝染色液对乳液中的蛋白质染色,尼罗红染色液对乳液中的油滴染色,分别在激发波长633 nm、检测波长618 nm~710nm以及激发波长488nm、检测波长580nm~620nm的激光下观察。取30 μL乳液与10 μL尼罗红染液和10 μL尼罗蓝染液混合均匀,在暗处反应15 min后取10 μL混合液滴在载玻片上,盖上盖玻片,在100倍油镜下观察。
1.4 数据统计与分析
所有试验重复3次以上取平均值,利用SPSS软件对数据进行统计分析,显著性分析使用Duncan多重检验(P<0.05代表有统计学意义的水平),图形均采用Origin 9.0软件绘制,所有结果均为3个样本的平均值±标准差的形式表示。
2 结果与分析
2.1 负载β-胡萝卜素的TPI-WPI复合乳液的粒径
粒径是衡量乳液稳定的重要性能指标,乳液粒径越小,乳化效果越好,乳液稳定性越好[16]。图1所示为负载β-胡萝卜素的乳液粒径随贮藏时间的变化。

图1 负载β-胡萝卜素的TPI-WPI复合乳液粒径随贮藏时间的变化Fig.1 Changes in the particle size of TPI-WPI composite emulsion loaded with β-carotene with storage time
由图1可知,乳液粒径均随贮藏时间的延长而增大,是因为随着贮藏时间的延长,液滴间相互碰撞的概率变大,液滴发生聚集,粒径增大[5]。对比5种乳液,负载β-胡萝卜素的TPI乳液初始粒径最大(P<0.05),为(491.74±0.01)nm,4℃贮藏21 d其平均粒径增加幅度也最明显,表明TPI乳液不稳定,乳液液滴在重力作用以及布朗运动作用下聚集速度快,在一定程度上加速了液滴的快速絮凝[19]。TPI-WPI混合蛋白构建的负载β-胡萝卜素复合乳液粒径比TPI乳液粒径小,表明WPI的添加有利于提高乳液体系的稳定性,TPI-WPI复合抑制液滴聚集的空间位阻作用,降低了碰撞频率,液滴不易聚集[20];且随着混合蛋白体系中WPI比例的增加,复合乳液的粒径减小,表明WPI在油水界面的吸附能力更强,稳定油滴的能力更强[21],因为热处理会使蛋白质发生亚基的解离和分子的伸展,蛋白质与油滴结合作用会增强[22],使得液滴粒径减小,稳定性增强。因此,当TPI与WPI质量比为1∶2时,以混合蛋白为乳化剂构建的β-胡萝卜素复合蛋白乳液的粒径小,液滴聚集速度慢,体系稳定性较好。
2.2 负载β-胡萝卜素的TPI-WPI复合乳液的电位
电位是乳液的重要物理性质,乳液体系的静电相互作用反映乳液体系的电位稳定性。zeta电位与溶液中颗粒表面的电势有关,表面电势绝对值越大,静电排斥作用越强,颗粒对聚集的抵抗力越大,乳液的稳定性越好[1]。负载β-胡萝卜素的复合乳液的zeta电位见图2。

图2 负载β-胡萝卜素的TPI-WPI复合乳液的zeta电位Fig.2 The zeta potential of TPI-WPI composite emulsions loaded with β-carotene
如图2所示,所有的乳液电位均呈负值,表明蛋白质经均质和热处理后分子表面带净负电荷。在本试验条件下,乳液pH值为7.0,高于蛋白质的等电点(4.0~5.5)[9,19],蛋白质分子带负电荷。
5种乳液比较而言,TPI乳液表面电位的绝对值最小,为(21.94±0.46)mV(P<0.05),乳液颗粒之间电荷的相互作用小,油滴之间的静电排斥作用不足以克服范德华力和疏水吸引力,使界面蛋白吸附层对TPI的静电共吸附减弱,从而导致油滴聚集,难以维持稳定的结构,粒径较大,乳液不稳定[20],与粒径检测结果一致。以混合蛋白为乳化剂构建的β-胡萝卜素复合乳液电位绝对值明显大于TPI乳液的电位绝对值(P<0.05),zeta电位绝对值提高,油滴的表面电荷增大,混合蛋白经过高压均质处理后蛋白质的构象会更加稳定,蛋白颗粒减小而更容易折叠,并且能快速在油-水界面上达到稳定,这有助于增加液滴间的排斥作用并防止液滴聚集,提高体系的稳定性[20]。随着混合蛋白WPI比例的增加,乳液体系的电位绝对值增大(P<0.05),主要是因为WPI为乳液颗粒间提供了相对较强的电荷排斥作用,颗粒不易聚集,乳液较为稳定[2]。TPI与WPI质量比为1∶2时,负载β-胡萝卜素的复合乳液表面电位绝对值达(28.23±0.56)mV,比其他质量比的混合蛋白(TPI∶WPI=1∶1 或 2∶1)乳液空间位阻更大,有效降低乳液液滴的活动性,碰撞频率更小,液滴聚集速度更慢,液滴更小,乳液更稳定[4]。
2.3 负载β-胡萝卜素的TPI-WPI复合乳液的直观图及β-胡萝卜素保留率

图3 负载β-胡萝卜素的TPI-WPI复合乳液的直观图Fig.3 Pictorial image of TPI-WPI composite emulsion loaded with β-carotene
如图3(a)和 3(b)所示,贮藏时间延长乳液颜色明显变浅,说明β-胡萝卜素在贮藏过程中有降解。TPI乳液稳定性较差,贮藏21 d后底部明显析出了水层,乳液分层快慢与乳液液滴大小有关,乳液粒径的大小影响乳液的絮凝和聚集,粒径越大,聚集和絮凝越快,乳液越容易分层;WPI乳液中β-胡萝卜素明显破乳,出现色素漂浮的现象,说明乳清分离蛋白的亲脂性不高,对脂溶性生物活性物质β-胡萝卜素的负载能力不强;而混合蛋白(TPI∶WPI=2∶1、1∶1、1∶2)乳液在贮藏21 d后均无水层析出和色素漂浮等相分离现象,可能是由于混合蛋白中WPI的添加会提高乳液的稳定性,且TPI亲脂性高于WPI,负载β-胡萝卜素的能力更强,因此不会出现水层析出以及色素漂浮的现象,表明 3 种质量比(TPI∶WPI=2∶1、1∶1、1∶2)的混合蛋白乳液体系比较稳定且能较好地保护色素。
β-胡萝卜素对光和氧非常敏感,而乳液的特定结构可以在一定程度上阻止分子氧与β-胡萝卜素的接触,提高β-胡萝卜素的稳定性。将乳液在4℃贮藏21 d,检测5种乳液在贮藏期间β-胡萝卜素的保留率,结果见图4。

图4 负载β-胡萝卜素的TPI-WPI复合乳液的实物图及β-胡萝卜素的保留率Fig.4 Retention rate of β-carotene and visual image of TPI-WPI composite emulsion loaded with β-carotene
由图4可知,5种蛋白乳液中β-胡萝卜素的保留率均随贮藏时间的延长而下降,但贮藏21 d后乳液中β-胡萝卜素的保留率均大于40%。乳液中的蛋白质经热处理后结构会展开,其构象会发生重排,且混合蛋白经碱处理后表面疏水性也会增强[11],因此脂溶性β-胡萝卜素的保留能力会得到提高。比较分析发现,贮藏5 d~21 d,WPI乳液体系中β-胡萝卜素的保留率最低,可能是因为WPI表面亲水基团的比例较高[6],而β-胡萝卜素为脂溶性色素,与亲水基团较多的乳化剂结合能力更弱,因此β-胡萝卜素降解更快。在贮藏3 d后,复合蛋白乳液中β-胡萝卜素的保留率明显高于WPI乳液中β-胡萝卜素的保留率(P<0.05),这是因为混合蛋白中的TPI是通过极端碱性条件提取的,表面疏水性增大[24],亲脂性增强,保留β-胡萝卜素的能力更强。且随着混合蛋白中TPI比例的增加,复合乳液中β-胡萝卜素的保留率提高,鱼蛋白在一定程度上可抑制β-胡萝卜素降解,能够起到保护油滴的作用,与β-胡萝卜素形成复合物,保护β-胡萝卜素免于降解[25]。因此,从色素稳定性的角度分析,当TPI与WPI按2∶1混合时,复合乳液对β-胡萝卜素的保护效果更好。
2.4 负载β-胡萝卜素的TPI-WPI复合乳液的抗氧化活性
β-胡萝卜素的抗氧化活性在制备过程中会下降或消失,进而导致其生物利用率降低,因此,研究TPIWPI混合蛋白对β-胡萝卜素活性的影响具有重要意义。不同抗氧化方法的测定原理不同,单一的测定方法无法准确地评定物质的抗氧化活性。因此本试验采用两种方法来评价β-胡萝卜素的抗氧化活性。DPPH自由基清除率、ABTS+自由基清除率均是比较灵敏的方法之一,都是通过测定样品清除自由基后吸光度的变化来评测样品的抗氧化能力[14]。负载β-胡萝卜素的TPI-WPI复合乳液抗氧化活性的变化见图5。

图5 负载β-胡萝卜素的TPI-WPI复合乳液抗氧化活性的变化Fig.5 Changes in the antioxidant activity of TPI-WPI composite emulsion loaded with β-carotene
由图5可知,在贮藏21 d后,DPPH自由基清除能力及ABTS+自由基清除能力减弱,乳液负载的β-胡萝卜素有所损失,抗氧化活性降低,表明β-胡萝卜素随着贮藏时间的延长而降解。其中,WPI乳液贮藏21 d后,其 DPPH 自由基清除率为(41.23±0.62)%,ABTS+自由基清除率仅有(27.56±1.07)%,反映了β-胡萝卜素在WPI乳液中降解更快,其测定结果与β-胡萝卜素的保留率一致,可能是因为WPI表面亲水基团的比例较高,亲脂性较弱,而β-胡萝卜素为脂溶性色素,两者的结合能力较弱,β-胡萝卜素不能得到很好的保护,因此降解更快,抗氧化活性更弱。而负载β-胡萝卜素的TPI-WPI复合乳液的DPPH自由基清除率、ABTS+自由基清除率变化较为缓慢,贮藏21 d后其自由基清除率显著高于WPI乳液(P<0.05),说明混合蛋白对β-胡萝卜素的保护作用比单一WPI更强,与乳液中β-胡萝卜素保留率的变化趋势一致,因为TPI亲脂性能力更强,对β-胡萝卜素的保留能力更强,β-胡萝卜素降解程度更低[24],因此其对DPPH自由基和ABTS+自由基清除率更高,乳液抗氧化活性更强。当TPI与WPI的质量比为2∶1时,负载β-胡萝卜素的复合乳液贮藏21 d后DPPH 自由基清除率达到(48.52±0.08)%、ABTS+自由基清除率达到(40.11±0.57)%,比其他质量比的混合蛋白(TPI∶WPI=1∶1、1∶2)乳液的 DPPH 自由基率、ABTS+自由基清除率更强,抗氧化活性更高,负载β-胡萝卜素的能力更出色,β-胡萝卜素能够得到更好的保护。
2.5 负载β-胡萝卜素的TPI-WPI复合乳液的游离脂肪酸释放率
在乳液体系中,油-水界面上蛋白质分子吸附形成吸附膜,而蛋白的组成会影响胰脂肪酶与油滴界面的接触,从而影响油脂的消化[6]。在体外模拟胃肠道消化过程中,胰脂肪酶将乳液中的甘油三酯分解生成大量的甘油二酯、甘油一酯和游离脂肪酸[26],加入氢氧化钠中和游离脂肪酸,将体系维持在中性的环境,比较单一蛋白(TPI、WPI)和混合蛋白(TPI∶WPI=2∶1、1∶1、1∶2)对乳液脂肪消化、β-胡萝卜素运载以及消化吸收的影响,结果见图6。
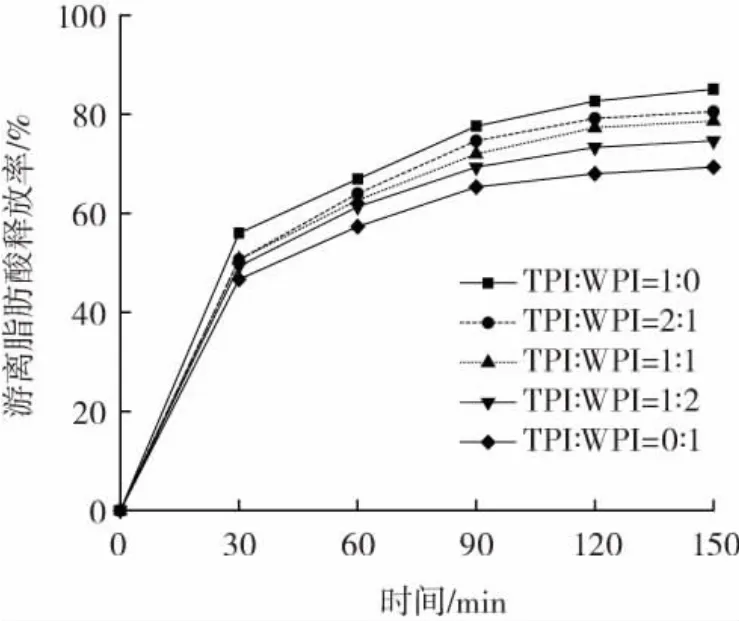
图6 负载β-胡萝卜素的TPI-WPI复合乳液的游离脂肪酸释放率Fig.6 Release rate of free fatty acids of TPI-WPI composite emulsion loaded with β-carotene
由图6可知,经过胃和小肠阶段的体外模拟消化后,5种乳液的消化速率和游离脂肪酸释放率大小顺序一致,为 TPI-WPI(1∶0)>TPI-WPI(2∶1)>TPI-WPI(1∶1)>TPI-WPI(1∶2)>TPI-WPI(0∶1)。WPI相对于TPI界面吸附膜在消化过程中形成的多肽甚至更小的肽段更多,液滴发生了聚集,减小了油脂的总表面积[27],导致游离脂肪酸释放率更低。WPI乳液中β-胡萝卜素被包裹在高电荷稳定的体系中,阻断了与消化液的接触,导致消化率降低[28]。与WPI乳液比较,混合蛋白(TPI∶WPI=2∶1、1∶1、1∶2)乳液游离脂肪酸释放率更高,可能是因为TPI易消化的特点,也使其更容易被胃蛋白酶解离为肽,具有更高的水解性。且随着混合蛋白体系中TPI比例的增加,游离脂肪酸释放率增大,可能是因为随着液滴大小的增加,在含有大油滴的乳液中,每单位液滴表面积吸附的脂肪酶分子可能比含有较小油滴的多,可用的脂肪酶数量增加,构建的乳液体系能更加有效地提高油脂的消化速率[29]。
2.6 负载β-胡萝卜素的TPI-WPI复合乳液的生物利用率
乳液体系所包埋的脂溶性生物活性物质功能因子,在模拟肠消化的阶段中,玉米油被水解,包埋在乳液中的生物活性物质功能因子会连续不断地从玉米油中释放出来,并溶解在胆汁盐胶束中,进而被小肠吸收[7],有研究表明像β-胡萝卜素这种脂溶性生物活性物质以胶束的形式被人体小肠摄取、转运、吸收是必不可少的步骤[10]。消化过程中TPI-WPI复合乳液在胃阶段时界面蛋白开始水解,经小肠消化后油脂开始水解,β-胡萝卜素暴露出来,从而可被人体所吸收。负载β-胡萝卜素的TPI-WPI复合乳液中β-胡萝卜素的生物利用率见图7。

图7 负载β-胡萝卜素的TPI-WPI复合乳液中β-胡萝卜素的生物利用率Fig.7 Bioavailability of β-carotene in TPI-WPI composite emulsion loaded with β-carotene
由图7可知,TPI、TPI-WPI(2∶1)、TPI-WPI(1∶1)、TPI-WPI(1∶2)、WPI构建的乳液中β-胡萝卜素的生物利用率分别为(33.25±0.24)%、(27.93±0.22)%、(27.54±0.32)%、(24.76±1.14)%、(20.89±0.72)%。有研究表明,胆盐等可与原有乳化剂发生竞争性取代后吸附在乳滴表面,从而影响脂溶性活性物质胶束的形成[30]。TPI乳液包埋的β-胡萝卜素具有较高的生物利用率,是因为在消化过程中鱼蛋白可被消化液中各种消化酶酶解成多肽,减小了界面层的厚度,更易于发生竞争吸附,被油脂、胆盐等替换[25]。随着混合蛋白体系中TPI比例的增加,复合蛋白乳液中β-胡萝卜素的生物利用率提高,游离脂肪酸的水解程度与生物活性物质的生物利用率呈正相关,体系中胶束的形成与体系中脂肪水解的程度有关,脂肪水解程度越高,体系中胶束越容易形成,β-胡萝卜素生物利用率越高。当TPI与WPI的质量比为2∶1时,负载β-胡萝卜素的复合蛋白乳液作为一种传递体系在结构稳定性和抵抗环境压力方面更具优势,生物活性物质与外界环境接触机会减少,被包埋的生物活性物质稳定性提高,且对所包埋的生物活性物质具有一定的控释能力、对敏感的亲脂性活性成分具有更好的保护作用,其生物利用率也会随着提高。
2.7 负载β-胡萝卜素的TPI-WPI复合乳液的微观结构
为便于观察,使用尼罗红染液对样品中的油脂进行染色、尼罗蓝染液对样品中的蛋白质进行染色后,利用荧光显微镜检测的方法观察油脂以及蛋白质制成乳液后的情况,其结果如图8所示,其中,红色部分为油滴,绿色部分为蛋白质。

图8 负载β-胡萝卜素的TPI-WPI复合乳液的形貌图Fig.8 Morphology of TPI-WPI composite emulsion loaded with β-carotene
由图8可知,液滴基本上都是呈现球形,且油滴被乳液蛋白质包封[18]。TPI乳液液滴聚集,液滴呈簇状,颗粒较大且不规则,表明TPI乳液不稳定。随着混合蛋白体系中WPI比例的增加,乳液颗粒变小,更加分散,蛋白质的空间位阻较大,有效降低乳液液滴的活动性,减少碰撞合并的几率,乳液呈现稳定的状态,且分散相表面覆盖了致密的蛋白质分子层,阻止了蛋白在乳液界面的有效伸展,表面的蛋白质分子含量逐渐减少,蛋白质吸附膜变薄[19],因此观察到的微观图颗粒更小,更加分散,与粒径检测结果一致。由此说明混合蛋白乳液相对于TPI乳液更有利于液滴的分散,乳液更加稳定。当TPI与WPI的质量比为1∶2时,以混合蛋白为乳化剂构建的β-胡萝卜素的复合乳液颗粒更小,更加分散,由此进一步表明乳液的稳定性好。
3 结论
本试验比较单一蛋白(TPI、WPI)和混合蛋白(TPI∶WPI=2∶1、1∶1、1∶2) 作为乳化剂构建的 β-胡萝卜素复合蛋白乳液的稳定性、抗氧化活性及体外消化速率。当TPI与WPI的质量比为1∶2时,负载β-胡萝卜素的复合蛋白乳液粒径最小(P<0.05)、电位的绝对值最大(P<0.05),形态颗粒越分散,物理稳定性更高。当TPI与WPI的质量比为2∶1时,在模拟胃消化过程中具有较高的消化速率,在肠消化过程中更有利于消化,游离脂肪酸释放率越高,且其乳液包埋β-胡萝卜素的生物利用率更高,对疏水活性物质具有更好的保护作用;贮藏21 d后,复合蛋白乳液对β-胡萝卜素的保留率最高(P<0.05),DPPH自由基清除能力及ABTS+自由基清除能力最大(P<0.05),体系的抗氧化活性最强。研究结果为混合蛋白构建稳定的乳液体系及其活性成分的递送提供了基础。
