肥胖小鼠肠道菌群对半乳甘露聚糖的响应与筛选
2022-10-29于颖任昕淼付晓丹肖梦诗程佳莹朱常亮牟海津
于颖,任昕淼,付晓丹,肖梦诗,程佳莹,朱常亮,牟海津*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266071;2.南昌大学食品科学与技术国家重点实验室,中国-加拿大食品科学与技术联合实验室(南昌),江西省生物活性多糖重点实验室,江西 南昌 330047)
半乳甘露聚糖是一种植物来源的异质多糖,由甘露糖主链和半乳糖侧链组成,目前,用于商业生产的半乳甘露聚糖主要包括瓜尔豆胶、塔拉树胶和西拉角豆[1-2]。其中瓜尔豆胶在食品领域应用较广泛,但黏度过高的特点影响了其在体内的代谢和作用发挥,目前,对其降解后的低分子量半乳甘露聚糖(galactomannan polysaccharides,GMPS)功能活性关注较多。GMPS作为水溶性纤维,可促进肠胃蠕动,改善肠道微环境,缓解慢性功能性肠病[3]。其可溶性纤维可形成凝胶,在胃中排空缓慢,使饱腹感增加,在饮食中添加可降低食欲,有助于减肥和预防肥胖[3-4]。GMPS通过增加胆汁酸的排泄和减少肠肝胆汁酸,促进以胆固醇为原料的胆汁酸的形成,从而降低肝游离胆固醇浓度[5]。抗糖尿病评估研究表明,GMPS可以诱导餐后胰岛素浓度升高,通过改善胰岛素抵抗起到抗糖尿病作用[4]。
人类肠道是一个由1 000多种微生物组成的复杂生态系统,微生物的数量级高达1014[6]。人类和其共生菌群构成了一个超级有机体,肠道菌群是一个“被忽视的人体器官”[7]。肠道微生物基因组编码的基因数量远多于人类,因此其具有多种代谢潜力,可以发酵不易被人体消化的食物,如多糖[8]。在过去的几十年里,越来越多的研究表明,肠道微生物及其代谢物在肥胖和相关疾病的发病机制中具有重要作用[9]。粪便移植研究表明,转移瘦者的肠道菌群至患有代谢综合征的肥胖患者中,可提高患者的胰岛素敏感性[10]。由此可见,肠道微生物是饮食与人类健康之间的重要枢纽。
双歧杆菌(Bifidobacterium)是革兰氏阳性厌氧微生物,是肠道菌群中最丰富的微生物之一,属于肠道有益菌[11]。基因组学的分析表明,双歧杆菌编码与碳水化合物降解和吸收的基因数量比大部分肠道微生物更多,这使它们具备较强的代谢复杂碳水化合物的能力[12]。双歧杆菌与人体健康息息相关。研究表明,与健康受试者相比,肥胖或2型糖尿病患者肠道内的双歧杆菌丰度显著降低[13]。假长双歧杆菌(Bifidobacterium pseudolongum)是肠道内丰度较高的双歧杆菌,其在各种宿主中的平均相对丰度为13.1%[14]。目前,一些研究已揭露假长双歧杆菌的益生潜能。已发现假长双歧杆菌的干预可降低高脂饮食小鼠体内甘油三酯的水平[15]。假长双歧杆菌与菠萝蜜种子来源的抗性淀粉相互作用,显著降低高脂饮食小鼠的体重和血清脂质水平,对小鼠肝脂肪变性有治疗作用[16]。但与目前已实现商业化应用的双歧杆菌相比,假长双歧杆菌的功能和性质研究还远远不足。
多糖与肠道菌群的相互作用是其发挥益生作用的主要机制,但目前关于GMPS对肥胖小鼠肠道菌群的调节,以及与其高响应的肠道微生物研究较少。本研究通过体外模拟肠道环境的方式,将GMPS与肥胖小鼠粪便共培养,探究其对肥胖小鼠肠道菌群结构的影响,并从粪便及培养液中进行高响应有益菌株的筛选,为新型益生菌和合生元的开发提供参考。
1 材料与方法
1.1 材料与试剂
正常小鼠粪便、肥胖小鼠粪便均来源于中国海洋大学应用微生物学实验室造模小鼠[17]。
瓜尔豆胶粉:青州荣美尔生物科技股份有限公司;复合聚糖酶:中国海洋大学应用微生物学实验室自制;短链脂肪酸(short chain fatty acids,SCFAs)标准品(乙酸、丙酸、异丁酸、正丁酸、异戊酸、正戊酸)、分子量标准品(670、410、150、21、5 kDa的葡聚糖):美国Sigma Aldrich Chemical公司;SCFAs标准品(甲酸、乳酸):日本Tokyo Chemical Industry;单糖标准品(鼠李糖、葡萄糖醛酸、半乳糖醛酸、木糖、阿拉伯糖、岩藻糖、甘露糖、葡萄糖和半乳糖):上海梯希爱公司。标准品均为色谱纯。
0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS):8 g NaCl、0.2 g KCl、1.44 g Na2HPO4、0.24 g KH2PO4溶于800 mL蒸馏水中,用HCl调节溶液pH值至7.4,最后加蒸馏水定容至1 L。
细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit):天根生化科技(北京)有限公司;乳双歧杆菌M1、植物乳杆菌R1为中国海洋大学应用微生物学实验室保藏菌种。
改良的BS培养基:10 g/L蛋白胨、5 g/L肝浸粉、3 g/L牛肉浸粉、5 g/L酵母浸粉、8 g/L胰酪蛋白胨、0.5 g/L 可溶性淀粉、1 g/L NaCl、1 g/L KH2PO4、1 g/L K2HPO4、0.01 g/L FeSO4·7H2O、0.005 g/L MnSO4、0.5 g/L L-半胱氨酸盐酸盐、10 g/L GMPS、50 mg/L莫匹罗星锂盐(上述试剂为分析纯),调节pH值为7.2±0.1。固体培养基在此基础上加入20 g/L琼脂。培养基配制完成后使用氮吹仪通氮气以除氧,随后在高压蒸汽灭菌锅中115℃灭菌30 min。
1.2 仪器与设备
RV-605型双层玻璃反应釜:上海亚荣生化仪器厂;HH.CP-7型恒温培养箱:上海博迅实业有限公司;LAQU Atwin-pH-22型手持pH计:HORIBA科学仪器事业部;DC150型氮吹仪:杭州佑宁仪器有限公司;1260 Infinity高效液相色谱:美国Agilent公司;GeneAmpPCR仪:美国ABI公司;Centrifuge 5430R型高速冷冻离心机:德国Eppendorf公司;FDU-1200型真空冷冻干燥机:东京理化机械株式会社;QuantusTM荧光计:上海普洛麦格生物制品有限公司。
1.3 方法
1.3.1 半乳甘露聚糖的制备
将瓜尔豆胶粉溶解于水中,使用盐酸调节pH值至4.0左右,按照质量分数为2%的酶与底物的比值加入复合聚糖酶,搅拌均匀,以180 r/min在反应釜中酶解6 h,酶解温度55℃。酶解液离心10 000 r/min离心20 min,得到上清液,随后上清浓缩冷冻干燥得到试验所用GMPS。
1.3.2 半乳甘露聚糖分子量及单糖组成的测定
分子量分布通过高效液相色谱(high performance liquid chromatography,HPLC)法测定,色谱条件如下:色谱柱为TSKgel G4000PWXL;检测器为示差检测器;流速为0.4 mL/min;流动相为200 mmol/L NaNO3、10 mmol/L NaH2PO4;柱温为 25 ℃;进样量为 20 μL。制备样品单糖组成通过PMP柱前衍生法方法测定[18],色谱条件如下:色谱柱为Agilent Eclipse XDB-C18柱;检测器为紫外检测器(245 nm);流速为0.8 mL/min;流动相为83%KH2PO4(0.05 mol/L,pH6.9)和17%色谱级乙腈;柱温为25℃;进样量为10 μL。
1.3.3 粪便的活化及与半乳甘露聚糖共培养
模拟肠道培养基的配制及菌悬液的制备参照文献[18]。取正常小鼠粪便和肥胖小鼠粪便,置于无菌0.01 mol/L PBS,涡旋振荡后静置30 min,取上层菌悬液待用。肥胖小鼠菌悬液分别接种至无GMPS培养基(MC组)及添加10 g/L GMPS的培养基(GMPS组),正常小鼠菌悬液接种至无GMPS培养基(NC组)进行对照,均按照体积分数为5%的接种量进行接种,37℃厌氧培养48 h。
1.3.4 培养液pH值变化与短链脂肪酸的测定
培养过程从0 h开始,每隔12 h取样,用手持pH计测定其pH值变化。取0、12、48 h样品,4℃、8 000 r/min离心10 min,取上清液参照文献[17]测定SCFAs积累水平。色谱条件:色谱柱为KC-811+KC-G 6B;检测器为紫外检测器(210 nm);流速为0.8 mL/min;柱温为55℃;流动相为0.01 g/100 mL磷酸溶液(pH2.1);进样量为20 μL。每组每个时间段取3个平行进行测定。
1.3.5 培养液16S rRNA测序及菌群多样性分析
取48h培养液菌体沉淀进行16SrRNA分析(n=7)。样品DNA的提取按照细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit)说明书进行操作。提取DNA的纯度和完整性分别使用NanoDrop2000和琼脂糖凝胶电泳检测;通过PCR对DNA的16S rRNA基因的V3-V4可变区进行扩增,所用引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’) 和 806R (5’-GGACTACHVGGGTWTCTAAT-3’)。将回收纯化后的PCR产物用QuantusTM荧光计进行检测定量,使用NEXTFLEX Rapid DNA-Seq Kit建立合格文库。最终的产物使用Illumina MiSeq PE300平台进行测序和分析。对于相似度大于97.0%的样品Reads,使用Usearch软件对其进行聚类、获得OTU;使用QIIME2软件,对样品α多样性和β多样性进行评估,分析样品内物种丰富度、均匀度和多样性等信息。
1.3.6 双歧杆菌的初步筛选
从GMPS干预后的小鼠粪便样品中筛选双歧杆菌。样品接种于改良的BS培养基中,37℃厌氧培养48 h。富集菌液在改良的BS固体培养基上多次划线以得到纯化的单菌落。通过革兰氏染色和果糖-6-磷酸磷酸酮酶(fructose-6-phosphate phosphoketonase,F6PPK)酶活反应检测[19],其中革兰氏阳性和F6PPK阳性(F6PPK酶活性反应后为红色)的单菌落初步鉴定为目标双歧杆菌。
1.3.7 筛选菌株的分子鉴定与分型
DNA的提取方法参照1.3.5。以筛选菌株DNA为模板,通过PCR扩增获得细菌16SrDNA序列。所用引物为 27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-TACGGYTACC TTGTTACGACTT-3')。扩增产物经测序,在 NCBI数据库(https://blast.ncbi.nlm.nih.gov/)中通过BLAST工具进行比对分析。同种菌株通过BOXPCR进一步分型[20],并与乳双歧杆菌M1、植物乳杆菌R1对照,证明分型方法的可信性。从NCBI数据库中获取与筛选菌株相似度高的模式菌株的16S rDNA序列,使用MEGA 7软件构建筛选菌株的系统发育树。
1.3.8 筛选菌株的形态学观察
将过夜培养、经筛选得到的双歧杆菌菌液离心(8 000 r/min,10 min),沉淀菌体用 0.01 mol/L PBS洗涤3次。将菌体通过2.5%(体积分数)戊二醛固定。
1.4 数据处理与分析
实验结果均表示为平均值±标准差。采用SPSS 17.0对各时间点或不同组的pH值变化、SCFAs产生量、α多样性指数的显著性差异进行单因素方差分析(one-way ANOVA)判断(Tukey’s检验)。使用Kruskal-Wallis检验和FDR校正计算所有组菌群数据在门、目和属水平上的差异。通过主成分分析(principal component analysis,PCA)、主坐标分析(primary coordinate analysis,PCoA)、非度量多维尺度分析(non-metric multidimensional scale analysis,NMDS)反映 β 多样性分析的差异。*表示差异显著(p<0.05);**表示差异极显著(p<0.01)。
2 结果与分析
2.1 GMPS的分子量分布及单糖组成
制备的GMPS分子量分布见图1。

图1 GMPS分子量分布HPLC图谱Fig.1 HPLC profile of molecular weight distribution of GMPS
制备的GMPS分子量基本在20 kDa以下,其中2 kDa~10 kDa部分占比74.27%。瓜尔豆胶原料具有超高黏度,但经过酶解后的样品黏度基本完全消失,证明本试验采用的复合聚糖酶具有显著的底物酶解活力。
GMPS的单糖组成如图2。

图2 单糖组成的HPLC图谱Fig.2 HPLC profile of monosaccharide composition
由图2可知,GMPS主要含有甘露糖及半乳糖,其摩尔比为1.75∶1,与报道的瓜尔豆胶单糖组成相似。
2.2 短链脂肪酸的产生
混菌培养过程中的pH值变化及SCFAs浓度见图3。


图3 粪便体外发酵过程中pH值及SCFAs积累水平Fig.3 The pH and concentration of SCFAs during the in vitro fecal fermentation
如图3所示,GMPS可提高培养液中SCFAs积累水平,降低培养液pH值。随着培养时间延长,GMPS组SCFAs的浓度逐渐增加。对不同时间点SCFAs组成分析可发现,主要产物是甲酸、乙酸、丙酸和乳酸。GMPS组在前期SCFAs产生速度较快,总SCFAs浓度从0 h时的3.56 mmol/L增加到12 h时的21.05 mmol/L,到48 h时增加至27.37 mmol/L。其中,浓度最高的为甲酸和乙酸,在培养至48 h时浓度可分别达到9.60 mmol/L和9.66 mmol/L。SCFAs作为菌群产生的活性代谢产物,一方面可以通过降低肠道内pH值来影响肠道环境,另一方面可以为结肠黏膜上皮细胞供能[21]。乙酸是大多数肠道微生物代谢多糖的终产物,它与脂肪细胞上的G蛋白偶联受体43结合后,可以抑制胰岛素信号传导、刺激胰高糖素样肽-1和肽YY的分泌,从而发挥抑制脂肪累积及抑制食欲的作用[22-23]。丙酸在肠道中可以通过抑制食欲、调节肠道糖异生来调节能量稳态[24-25]。乳酸是调节肠道稳态的重要代谢产物,具有调节饱腹感以及作为脑-肠轴中的细胞间信使的作用[26]。
2.3 GMPS对小鼠粪便菌群多样性的影响
2.3.1 测序数据质量评估
从3组(共21个样品)中获得917 620条raw read,质控后获得180 852条有效序列(effective read),其平均长度为426 bp。以97.0%的一致性为条件进行聚类,共获得178 767个分类操作单元(operational taxonomic unit,OTU)。随着测序深度的增加,稀释曲线逐渐趋于平缓,这说明测序深度达到实验要求。
2.3.2 α多样性和β多样性分析
图4为不同分组的α多样性和β多样性分析。

图4 α多样性和β多样性分析Fig.4 Effects of GMPS on alpha diversity and beta diversity
α多样性是物种丰度和多样性的体现,衡量指标包括Chao1指数、Ace指数、Shannon指数、Simpson指数、Coverage指数等[27]。分析结果表明,GMPS对肥胖小鼠肠道菌群丰富度(Chao1指数)、多样性(Shannon指数、Simpson指数)有显著影响。与NC组相比,MC组Ace指数和Chao1指数降低,Shannon指数和Simpson指数升高(p<0.01),说明高脂模型组小鼠菌群丰度降低,多样性升高。与MC组相比,GMPS的干预显著降低了Chao1指数、Shannon指数和Simpson指数(p<0.01)。小鼠体内实验也表明,多糖干预后会对肠道菌群的丰富度及多样性产生影响。Zhang等[28]通过研究菊粉对2型糖尿病小鼠的干预发现,菊粉同样显著降低了小鼠肠道菌群的Chao1和Shannon指数(p<0.05)。β多样性分析一般通过PCA及PCoA等方法反映样本间的差异性。PCA(图4e)及 PCoA(图4f)表明,MC 组与NC组之间菌群结构存在差异,且GMPS干预后改变了肥胖小鼠粪便菌群组成,并区别于MC组。基于β多样性的NMDS显示,NC组与MC组、NC组与GMPS的样品分布没有重叠,MC组与GMPS组存在小部分重叠,进一步验证了上述结果(图4g)。
2.3.3 GMPS对肠道菌群组成的影响
2.3.3.1 对门、目、属水平的影响
为进一步分析GMPS对肥胖小鼠肠道菌群的影响,分别在门、目、属水平上分析了各组小鼠肠道菌群的变化,如图5所示。

图5 GMPS干预对肠道菌群结构的影响Fig.5 Effects of GMPS on the intestinal microbial composition
在门水平上检测到4种菌群(图5a):厚壁菌门(Firmicutes)、拟杆菌门 (Bacteroidets)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)。MC组与GMPS组中厚壁菌门均表现出较高的相对丰度。与NC组相比,MC组拟杆菌门相对丰度降低,GMPS处理则进一步降低了拟杆菌门丰度(p<0.05)。目前,厚壁菌门与拟杆菌门丰度比值常被用作肠道菌群失衡的标志。大多数研究认为,诸如糖尿病等代谢紊乱疾病,其患者体内拟杆菌门丰度低而厚壁菌门丰度较高[29]。但也有研究表明,糖尿病患者肠道菌群中厚壁菌门丰度降低,拟杆菌门丰度升高,而且丰度的变化和血糖浓度有关[30]。与MC组相比,GMPS组的变形菌门相对丰度降低(p<0.05);而放线菌门相对丰度显著提高,由1.11%增加至6.27%(p<0.01)。典型的有益菌如双歧杆菌,是放线菌门的重要成员。而变形菌门常被认为有致病性,其分类下包含较多产脂多糖(lipopolysaccharide,LPS)的微生物,而LPS是促进肥胖产生的机制之一[8]。
在目水平上,不同组别表现出明显的菌群结构差异(图5b)。NC组优势菌为拟杆菌目(Bacteroidales)、肠杆菌目(Enterobacteriales)和乳杆菌目(Lactobacillales)。MC 组优势菌为梭菌目(Clostridiales)、肠杆菌目、拟杆菌目等。GMPS组优势菌为乳杆菌目、肠杆菌目、双歧杆菌目(Bifidobacteriales)。同样,在属水平上,不同组别菌群结构差异明显(图5c)。NC组优势菌为拟杆菌属(Bacteroides)、肠杆菌属(Enterobacter)、乳球菌属(Lactococcus)。MC组优势菌为大肠杆菌属(Escherichia)、梭菌属(Clostridium)、拟杆菌属。GMPS组优势菌为肠球菌属、大肠杆菌属、双歧杆菌属(Bifidobacterium)。与NC组相比,MC组拟杆菌属、肠杆菌属、乳球菌属相对丰度显著降低,梭菌属、肠球菌属相对丰度显著升高(p<0.01)。而GMPS处理后,提高了肠球菌属、双歧杆菌属相对丰度,降低了副杆菌属(Parabacteroides)、梭菌属、气单胞菌属(Aeromonas)、摩氏根菌属(Morganella)的相对丰度(p<0.01)。
研究表明,在肥胖机体中双歧杆菌属、肠球菌属的丰度降低[25]。双歧杆菌是目前广泛研究并应用的肠道有益菌,基因组中存在丰富的编码碳水化合物活性酶及专门的摄取、转运复杂碳水化合物的相关基因,具有优秀的多糖降解能力。不少研究已揭示了双歧杆菌与肥胖的关系。肥胖或超重儿童较高的体重指数与他们肠道内双歧杆菌丰度的减少有关[31]。灭活的长双歧杆菌可改善肥胖糖尿病小鼠的血糖异常并减轻脂肪组织的重量[32]。在随机双盲实验中,双歧杆菌的施用改善了日本健康成年人的内脏脂肪堆积[33]。肠球菌作为乳酸菌中广泛应用于食品、微生态制剂和饲料添加剂中的益生菌,可以调整肠道菌群平衡,抑制致病菌黏附定植,调节宿主免疫[34]。本研究结果表明,GMPS干预可以使有益的肠球菌和双歧杆菌的丰度升高,并降低条件致病菌如Aeromonas、Morganella的丰度。
2.3.3.2 组间差异性分析
LEfSe(LDA>4.0)以及Anova方差分析结果见图6、表1。
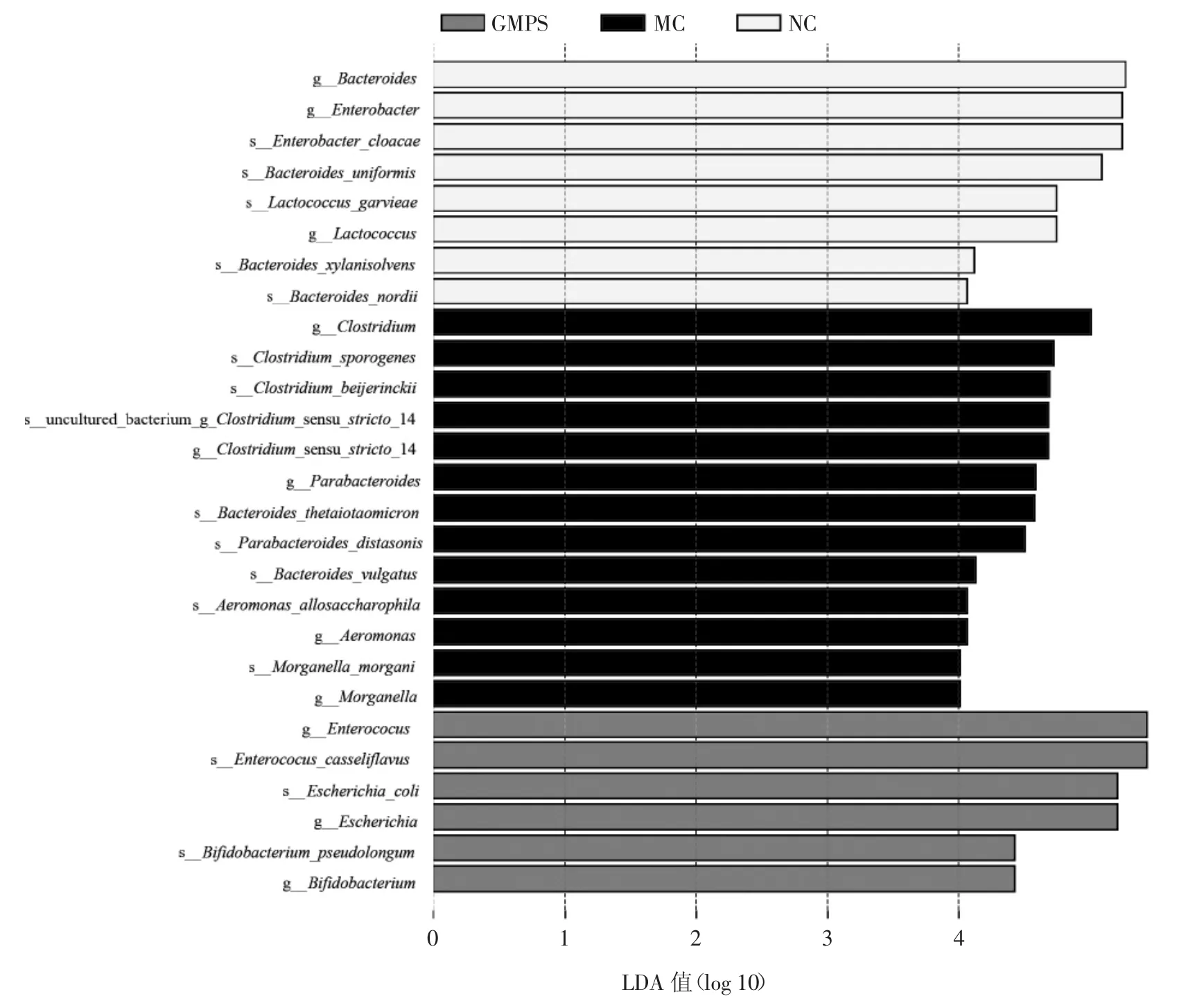
图6 各组菌群丰度的差异性分析Fig.6 Differential analysis of abundance in each group

表1 各组菌群丰度的Anova方差分析Table 1 Anova analysis of abundance in each group
由图6可知,NC组差异显著的分类群主要属于拟杆菌属、肠杆菌属、乳球菌属;MC组为梭菌属、拟杆菌属、副拟杆菌属、气单胞菌属、摩根氏菌属;GMPS组为肠球菌属、大肠杆菌属及双歧杆菌属。结合Anova方差分析(表1),在种水平丰度上NC组有显著优势的为单形拟杆菌(B.uniformis)、阴沟肠杆菌(E.cloacae)、格氏乳球菌(L.garvieae);MC组为拜氏梭菌(C.beijerinckii);GMPS 组中假长双歧杆菌(B.pseudolongum)则为优势菌。由上述结果可推断,在小鼠肠道菌群中,假长双歧杆菌是对GMPS高响应的菌株。目前,关于假长双歧杆菌的研究表明,除具有改善肥胖的作用外,在Dong等[35]研究新生儿黄疸与肠道菌群的关系实验中,同样发现假长双歧杆菌相对丰度的增加与黄疸风险降低相关。在临床前的实验肿瘤模型中,假长双歧杆菌的代谢产物肌苷可通过特异性激活辅助性T淋巴细胞1细胞,增强免疫检查点阻断治疗的治疗效果,最终明显缩小肿瘤模型体积[36]。此外,特定种类功能性碳水化合物如阿拉伯木聚糖、甘露低聚糖、低聚果糖、抗性淀粉等都可选择性地促进肠道内假长双歧杆菌丰度的升高[37-40]。低聚果糖和单月桂酸甘油酯已被证明能够改善炎症、肥胖和代谢紊乱,且这种改善同肠道中假长双歧杆菌丰度的升高呈正相关[41-42]。
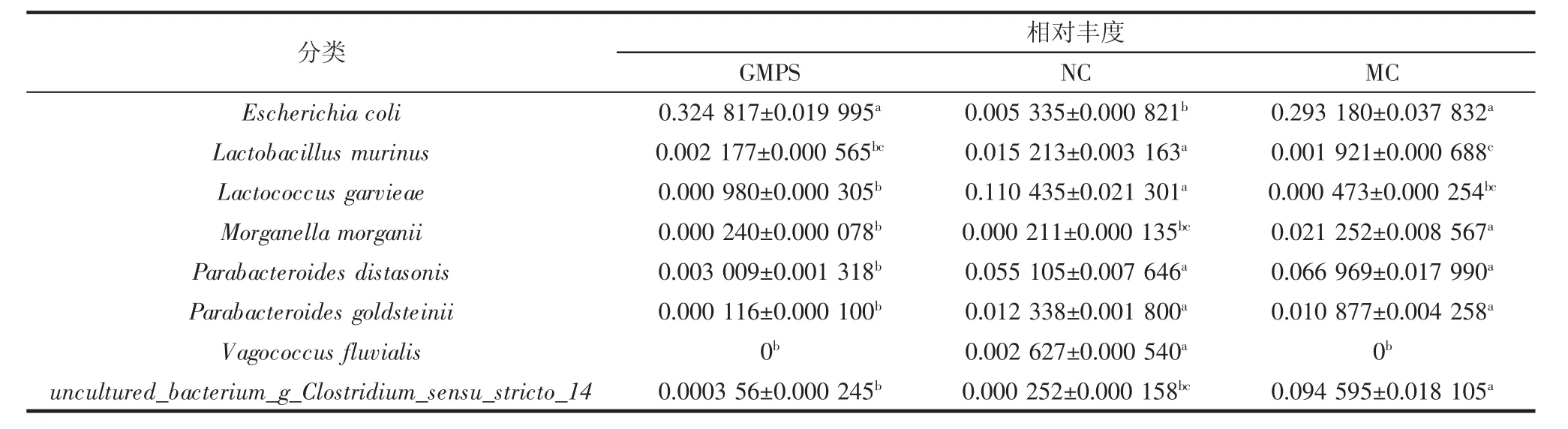
续表1 各组菌群丰度的Anova方差分析Continue table 1 Anova analysis of abundance in each group
2.3.4 功能预测分析
京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路功能预测结果见图7。

图7 KEGG功能差异柱形图Fig.7 Difference of KEGG function
如图7所示,与NC组相比,MC组肠道菌群的脂质代谢(lipid metabolism)、碳水化合物代谢(carbohydrate metabolism)、核苷酸代谢(nucleotide metabolism)、其他次生代谢产物的生物合成(biosynthesis of other secondary metabolites)及多糖生物合成和代谢(glycan biosynthesis and metabolism)等代谢通路中功能基因丰度降低。GMPS的干预升高了碳水化合物代谢、次生代谢产物的生物合成、核苷酸代谢等相关功能基因的丰度,推测GMPS干预能够恢复肠道菌群对碳水化合物的代谢能力进一步调节肠道微生态系统。
2.4 双歧杆菌的筛选与形态分析
通过BS培养基筛选得到98个单菌落,革兰氏染色观察和F6PPK酶活检测筛选出76个革兰氏阳性且F6PPK酶活阳性的菌株。将76株菌株进行16S rDNA比对鉴定,结果见图8。

图8 筛选菌株的分子鉴定Fig.8 Molecular identification of selected strains
由图8可知,这些菌株与假长双歧杆菌存在最高的相似度(≥99%)。其中有26株成功鉴定为假长双歧杆菌,命名为YY-1至YY-26。将上述26株菌进行BOX-PCR分型,结果如图8a所示,根据电泳条带的图谱,判断主要有5株不同的假长双歧杆菌。将其构建系统进化树,如图8b所示,系统发育分析显示这5株菌的进化关系非常接近,与B.pseudolongum PNG-209G之间具有高度相似性,在发育关系中较密切。以上结果证明,所筛选菌株均为假长双歧杆菌,证实了菌群多样性的分析结果。GMPS与假长双歧杆菌之间良好的互作关系也是后续研究值得挖掘的切入点。
筛选得到的假长双歧杆菌菌株的典型形态如图9所示。

图9 所筛选的假长双歧杆菌菌株的典型形态Fig.9 Cellular morphology of selected B.pseudolongum by scanning electron microscope
由图9可知,菌株呈杆状,菌体长度不一,大部分为短杆状,长度范围1.5 μm~3.0 μm。细胞有轻微的弯曲,部分中间膨大,两头较尖,大多聚集在一起或成对出现。
3 结论
本研究将瓜尔豆胶酶解后制备得到的GMPS干预肥胖小鼠肠道菌群后,选择性地促进了对其利用能力较强的肠道微生物的生长。与正常小鼠相比,肥胖小鼠肠道菌群梭菌属相对丰度增加,拟杆菌属、乳球菌属相对丰度降低,而GMPS的干预可降低肥胖小鼠肠道菌群中梭菌属及条件致病菌气单胞菌、摩氏根菌属的丰度,并增加乳酸产生菌肠球菌和双歧杆菌的丰度,证明GMPS的干预有望对肥胖小鼠肠道微生态紊乱产生一定的调节作用。而且,GMPS干预后导致粪便中假长双歧杆菌丰度大幅上升并成为优势菌群之一,表明假长双歧杆菌对GMPS具有高度响应性;假长双歧杆菌丰度的增加很可能与GMPS缓解肥胖导致的肠道微生态紊乱有密切关系。目前,尽管有关假长双歧杆菌的益生和降血脂等功能已有初步研究,但其调控肥胖机体的肠道微生态的机制尚不清楚,与半乳甘露聚糖等非消化性碳水化合物之间的互作机制也缺乏系统研究。因此,本研究为假长双歧杆菌与益生元的互作研究提供新的视角,并为新型合生元产品的开发提供科学依据。
