蓝舌病病毒NS4重组蛋白的纯化及多克隆抗体的制备
2022-10-28马骥李芳林俊泓刁洋娟易华山胡庭俊
马骥,李芳,林俊泓,刁洋娟,易华山,,胡庭俊*
(1.广西大学动物科学技术学院,广西 南宁 530005;2.重庆市大足区动物疫病预防控制中心,重庆 大足 402360;3.重庆纳比微特检测技术服务有限公司,重庆 荣昌 402460;4.西南大学动物医学院,重庆 荣昌 402460)
蓝舌病病毒(Bluetonguevirus,BTV)是呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)的虫媒病毒,由库蠓(Culicoides)等节肢动物传播,主要感染反刍动物(牛、羊、鹿等),导致蓝舌病(Bluetongue,BT),多表现为亚临床症状,严重时引起口唇发绀、出血、溃疡、面部水肿等,以绵羊病症重且死亡率较高[1, 2]。BTV的成熟病毒粒子为二十面体对称的圆形无囊膜(Non-enveloped)颗粒,基因组由双链RNA(Double-stranded RNA,dsRNA)组成,共10条分节段的dsRNA编码7种结构蛋白(VP1-VP7)和6种非结构蛋白(NS1-NS4、NS3a、NS5)[3-5]。NS4由编码VP6的Segment-9中的重叠ORF编码,长度为77~79个氨基酸且基本不随血清型的变化而变化,存在亮氨酸拉链(Leucine zipper)与驱动核定位的氨基酸残基[3]。NS4在BTV感染细胞的胞浆与胞核中均表达,并与细胞质中的脂滴和核仁存在共定位,还能与dsRNA结合使其不被脱氧核糖核酸酶降解[4]。NS4并不是BTV复制所必需的,但缺失NS4的BTV-8在绵羊体内的毒力减弱[6]。针对感染BTV NS4缺失突变株的转录组分析表明,与野生型相比,BTV NS4缺失突变株中与IFN通路相关的102个基因上调,是一种干扰素通路的拮抗剂[6]。目前,针对BTV NS4拮抗IFN机制的研究主要包括构建BTV NS4缺失株的转录组分析或拮抗IFN信号通路蛋白与BTV NS4的作用靶点等[6,7]。研究表明,NS4以剂量依赖的方式损害IFN信号转导,虽然其单独表达不影响IFN激活的STAT1的磷酸化,但NS4与NS3的共表达可能发挥协同作用而调控STAT1磷酸化、二聚化等[7,8]。
多克隆抗体(polyclonal antibody, pAb)是针对多种抗原决定簇的多种抗体的混合物,相比单克隆抗体而言,pAb也具有制备周期短、成本及技术技能低、稳定性好等优点,并且pAb能识别多个抗原表位而具有良好的特异性[9]。本课题组在前期对BTV NS4真核表达拮抗宿主天然免疫的机制进行了研究[10],在此基础上,为深入研究BTV NS4重组蛋白免疫原性,本研究进一步对融合蛋白pET-32a-NS4纯化后,免疫新西兰大白兔制备多克隆融合抗体,为研究BTV NS4蛋白的功能及基于BTV NS4检测方法研究提供基础。
1 材料与方法
1.1 试剂与仪器
免疫用新西兰大白兔由重庆腾鑫生物技术有限公司提供,NS4蛋白由笔者纯化保存备用,96孔板(9017,美国Costar)。弗氏完全佐剂、弗氏不完全佐剂均购于Sigma公司;Blue Plus®Protein Marker(14-160 kD)购自全式金生物公司;氯化钠(NaCl)、磷酸氢二钠(Na2HPO4·12H20)等常规试剂均为国产分析纯。低温高速离心机(Allegra X-30R,美国BECKMAN)、多功能酶标仪(TECAN Infinite 200 PRO,瑞士/TECAN),其他仪器设备由重庆市兽医科学工程中心提供。
1.2 重组蛋白的纯化及鉴定
取在最佳诱导条件下(37 ℃,0.8 mmol/L IPTG,6h)诱导的菌液各20 mL,3 000 r/min离心5 min后,保留沉淀;1×PBS重悬后,超声裂解0.5 h;4 000 r/min离心10 min(4 ℃)以分离上清液及沉淀;上清液在0.22 μm过滤器过滤后,作为对照备用。利用低压层析系统,将破碎后的上清溶液加入(流速为0.5 mL/min)Ni-IDA Binding-Buffer预平衡的Ni-IDA Sepharose Cl-6B亲和层析柱,直至流出液的OD280值到达基线。用Ni-IDA Washing-Buffer(20 mM Tris-HCl,20 mM咪唑,0.15 M NaCl,pH 8.0)以1 mL/min流速冲洗,直至流出液OD280值到达基线。使用Ni-IDA Elution-Buffer(250 mM咪唑,其余与Washing-Buffer相同)以1 mL/min的流速洗脱目标蛋白,并收集流出物,透析过夜,收集透析液进行SDS-PAGE(12%)分析。孵育一抗THETM His Tag鼠源单克隆抗体孵育2 h;二抗HRP标记山羊抗小鼠IgG(H+L)(1∶3 000)孵育1 h;PBST洗涤后观察结果。
1.3 包涵体蛋白pET-32a-NS4的复性与浓度测定
在最佳诱导条件下诱导表达的pET-32a-NS4,通过离心之后加入15 mL的裂解液,并将其置于冰水混合物中进行超声破碎。破碎后,在4 ℃ 14 000 r/min离心20 min后取沉淀。使用包涵体洗涤液(20 mM Tris,1 mM EDTA,2 M尿素,1 M NaCl,1% Triton X-100,pH 8.0)清洗包涵体3次;溶解缓冲液(20 mM Tris,5 mM DTT,8 M尿素,pH 8.0)溶解包涵体,4 ℃过夜;4 ℃,14 000 r/min离心15 min;将上述溶液滴加到20 mM Tris-HCl、0.15 M NaCl、pH 8.0缓冲液中,逐渐倍数稀释并慢慢拌混,将蛋白溶液置入透析袋于20 mM Tris-HCl、0.15 M NaCl、pH 8.0溶液中透析过夜。重组蛋白pET-32a-NS4浓度按照BCA方法测定试剂盒说明书测定蛋白浓度。
1.4 NS4多克隆抗体的制备
将纯化的BTV NS4蛋白与完全弗氏佐剂等体积混合充分乳化,于新西兰兔背部皮下多点注射进行免疫,每只 200 μg。首免后第15、30 天用相同剂量与等量弗氏不完全佐剂乳化后加强免疫 2 次。三免后第 14天从心脏采血,血液在 37 ℃静置 3 h 后,置于4 ℃析出血清,分离血清,-80 ℃保存备用。取部分使用ELISA方法检测NS4蛋白的效价,如果效价大于预期(1∶50 000),则可进行血清收集。
1.5 抗体纯化与鉴定
将NS4蛋白和琼脂糖凝胶偶联制作为抗原亲和提纯层析纯化,用PBS(pH=7.4)稀释NS4蛋白抗原,混匀后在96孔板中每一个孔内依次加入100 μL,包被过夜;弃去包被液,PBST 洗3次,200 μL/孔。在滤纸上轻轻拍干后,每孔加入200 μL封闭液,37 ℃封闭1 h;弃去内液,PBST 洗1次,200 μL/孔;将待测血清稀释后加入板中,每孔100 μL,37 ℃孵育1 h。取出酶标板,弃去内液,PBST 洗3次,200 μL/孔。山羊抗兔-HRP(1∶50 000)稀释后,在黑暗环境下每孔中加入100 μL,37 ℃避光孵育1 h。取出酶标板,弃去内液,PBST 洗3次,200 μL/孔。每孔先加入100 μL TMB显色液,37 ℃避光显色15 min。每孔加入100 μL HCl(1 M)溶液,终止反应,波长为450 nm测定OD值。以OD450值>0.3且P/N>1.2判断兔血清产生效价的判定条件,利用BCA浓度测定试剂盒对纯化的抗体进行浓度测定及SDS-PAGE电泳和考马斯亮蓝染色检测纯化的抗体。
1.6 重组蛋白与多克隆抗体Western blot鉴定
将pET-32a-NS4表达产物SDS-PAGE电泳后转至PVDF膜,碎冰中200 mA恒流转膜40 min,加入封闭液4 ℃封闭过夜。先用His单克隆抗体(1∶2 000)稀释或用本课题组制备的NS4多克隆抗体(1∶1 000)与纯化的重组蛋白,4 ℃孵育过夜,PBST洗6次,辣根过氧化物酶标记山羊抗兔IgG(H+L)(二抗)以1∶3 000比例稀释,室温孵育1 h,PBST洗6次,显影,使用超高灵敏度化学发光检测仪FUSION FX-XT分析重组蛋白。
2 结果
2.1 重组蛋白pET-32a-NS4的纯化鉴定
为获得纯度较高的重组蛋白,将pET-32a-NS4破碎后分离上清和沉淀,沉淀经Ni柱亲和纯化后SDS-PAGE电泳显示目的条带大小约27 kD(图1)。

A,M:蛋白质分子质量标准;1:pET-32a空载体未诱导;2:pET-32a-NS4诱导后;3:pET-32a-NS4诱导破碎后上清;4:pET-32a-NS4诱导破碎后沉淀;B,1-8:纯化洗脱样品。
2.2 纯化后的重组蛋白鉴定
重组蛋白pET-32a-NS4经Ni柱亲和纯化后,通过SDS-PAGE电泳检测发现在27 kD间有蛋白条带(图2A)。经Western blot鉴定有相同大小蛋白条带,与预期结果相符(图2B)。

A,M:蛋白质分子质量标准;1:0.5 mg/mL BSA;2:纯化后样品;B,M:蛋白质分子质量标准;1、2:纯化后样品。
2.3 抗体鉴定
设定的P/N判定值>1.2,通过ELISA检测NS4抗体效价在1∶512 000以上(图3)。按照BCA浓度测定试剂盒测定纯化后的抗体浓度为1.0 mg/mL,体积为12 mL。

图3 pET-32a-NS4重组蛋白免疫后抗体效价
对纯化的抗体进行SDS-PAGE电泳和考马斯亮蓝染色后,仅见到单条的55 kD抗体重链,表明所得抗体的纯度较高,并且通过灰度分析纯化后的抗体纯度大于85%(图4)。以最终获得的12 mL纯化抗体,除去损耗,乘以相应的纯度,纯化抗体得率达到8.0 mg以上。
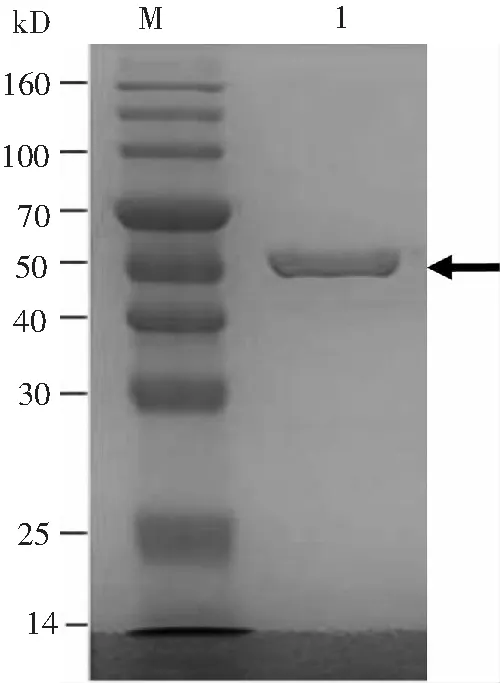
M:蛋白质分子质量标准;1:抗体纯化分析。
2.4 重组蛋白的Western blot分析
结果如图5所示,在27 kD处可见目的条带,与预期大小一致,表明纯化NS4蛋白多克隆抗体与pET-32a-NS4重组蛋白产生特异性反应。

M:蛋白分子质量标准;1:空白对照;2:0.8 mmol/L诱导6 h产物;3:上清蛋白;4:沉淀蛋白。
3 讨论
BTV NS4作为蓝舌病病毒的非结构蛋白,在拮抗宿主细胞IFN反应与BTV的免疫逃避中发挥重要的功能[6]。本课题组在前期研究中对BTV NS4进行了序列分析,并发现BTV NS4在HEK-293T细胞内表达显著下调仙台病毒诱导的RIG-Ⅰ、MDA5、TRAF6、IRF9、ISG15和IFN-β基因mRNA表达[10, 11]。目前,李一经等[12,13]对25型BTV VP2和VP7蛋白进行单克隆抗体的制备研究。张国芮等[14,15]对BTV VP6和VP7蛋白进行多克隆抗体的制备。张璐及张国芮等[16,17]利用pET-30a表达BTV NS1截短蛋白及 NS2蛋白进行了多克隆抗体的制备研究;车永军等[18]对BTV NS3进行截短表达与多克隆抗体的制备研究,为建立基于结构蛋白的ELISA检测方法及其基因功能研究奠定了基础。而BTV NS4基因在不同血清型BTV氨基酸序列高度保守,是病毒早期感染的诊断靶标[3, 6]。
目前,在动物病毒性疾病监测、净化中,急需基于病毒非结构蛋白的ELISA检测方法,以鉴别野毒感染和疫苗免疫抗体。因此,本研究进一步对构建的BTV NS4原核表达载体pET-32a-NS4在37 ℃,0.8 mmol/L IPTG,诱导6h,超声破碎裂解菌体后,纯化的融合蛋白pET-32a-NS4,免疫新西兰大白兔,成功获得BTV NS4多克隆抗体,效价在1∶512 000以上,具有较好的特异性反应,对进一步研究BTV NS4基因功能及建立基于非结构蛋白的ELISA检测方法奠定了基础。
