CO2和甲醇直接合成碳酸二甲酯催化剂研究进展
2022-10-28邓志勇王馨雨李文杰林慧博钟雨浠毛志毅
邓志勇,王馨雨,刘 源,李文杰,林慧博,钟雨浠,毛志毅
(成都信息工程大学 资源环境学院 中-塞环境与能源“一带一路”联合实验室,四川 成都 610225)
CO2是一种温室气体,其过量排放引发的温室效应已经严重地影响到了人类的生存环境。然而,CO2也是重要的碳源,在有机合成中有着广泛的应用,如图1所示[1]。碳捕集与利用(Carbon capture and utilization,CCU)技术可以有效捕获CO2并转化为高附加值化学品和燃料,如甲醇、乙醇和碳酸二甲酯(Dimethyl carbonate,DMC)等[2-3]。其中DMC于1992年在欧洲注册登记为非毒性化学品,被誉为绿色合成化学的“基石”。DMC中含有羰基、羧基、甲基、甲氧基和甲氧基羰基等官能团,广泛应用于农药、医药、塑料、染料、电子化学品和食品添加剂等领域[3-5]。利用CO2和甲醇合成DMC被认为是将CO2清洁转化为绿色化学品的重要途径之一。

图1 CO2在有机合成中的应用[1]Fig.1 Application of CO2 in organic synthesis[1]
DMC的合成方法主要包括光气法、酯交换法、甲醇氧化羰基化法、尿素醇解法以及CO2直接合成法等[1-2,4]。其中,光气法使用有毒的光气作为反应物,环境污染严重并且副产物氯化氢会腐蚀反应设备,已逐渐被淘汰。酯交换法技术成熟,是目前国内外生产DMC的主要方法,但该技术的原料来源受到石油行业限制,且联产的乙二醇或丙二醇对产能也有一定制约作用。甲醇氧化羰基化法是一种热门研究方法,已有万吨级装置在建和开车的报道[6],然而该方法使用的催化剂昂贵,且部分催化剂对设备有一定腐蚀性。尿素醇解法具有较好的应用前景,已有千吨级中式装置开车的报道[7],然而反应生成的氨气会抑制反应平衡向右移动,导致产率较低。CO2与甲醇直接合成DMC具有反应原子经济、副产物少等优点,是一种可持续发展的绿色经济路线,已成为近年来研究的热点。然而,该反应存在受热力学限制而无法自发进行、CO2难以活化等问题。因此,设计和开发高效催化剂以降低反应能垒是研究者关注的重点之一。
本文首先介绍CO2和甲醇直接合成DMC的反应机理,然后重点对CO2和甲醇直接合成DMC的催化剂研究进展进行综述,讨论不同催化剂的催化效果及其可能的反应机理,以期为同类技术研究提供参考。
1 CO2和甲醇直接合成DMC机理研究
CO2和甲醇直接合成DMC的反应方程式如式(1)。在t= 0~800 °C,p= 0.1 MPa条件下,该反应的吉布斯自由能(ΔG)均为正,反应的平衡常数K值也很小,说明该反应是非自发反应。只有降低反应体系的ΔG才能使反应正向进行[8]。通过计算发现,当t= 800 °C时,p≥ 2.41×105MPa,该反应体系的ΔG才小于0,反应才会有自发正向进行的趋势,然而如此大的压力是很难实现的,因此需要改变反应历程,才能使反应体系的ΔG小于0,从而在热力学上可行[9]。

CO2不含孤电子对且性质稳定,在反应过程中不易被催化剂活化,导致反应活性低,因此CO2的活化是影响反应速率的关键因素。其活化机理可分为两类,即直接活化CO2和先活化甲醇再活化CO2
[10-11]。直接活化CO2的催化反应机理(如有机金属类催化剂催化反应机理)如图2所示。反应过程中催化剂带负电的烷基向CO2的空反键轨道提供电子,导致其分子结构发生弯曲,伴随着C—O键的伸长,生成[CO2]-,从而实现CO2的活化。进一步在催化剂的协同作用下,与甲醇耦合生成DMC。
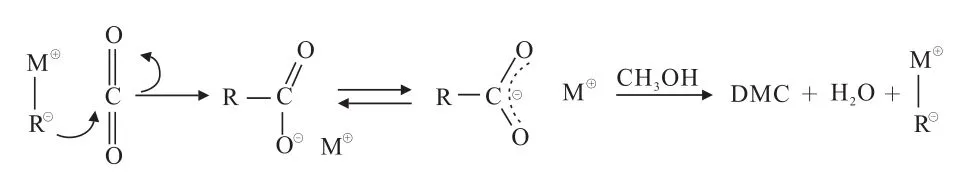
图2 直接活化CO2催化反应机理[11]Fig.2 Catalytic mechanism of direct activation of CO[11]2
先活化甲醇再活化CO2的催化反应机理(如金属氧化物和杂多酸催化剂等Brønsted催化剂反应机理)如图3所示。甲醇首先在催化剂表面被活化,生成MeO-和H+,MeO-再进攻CO2生成中间体[MeOCOO]-,最后再与MeO-结合生成DMC。
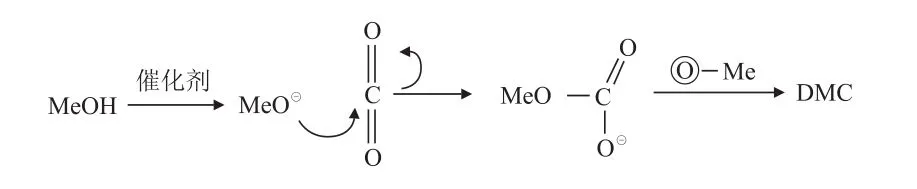
图3 先活化甲醇再活化CO2的催化反应机理[9]Fig.3 Catalytic mechanism of activation methanol before activation of CO[9]2
2 CO2和甲醇直接合成DMC催化剂研究进展
CO2与甲醇直接合成DMC使用的催化剂主要包括烷氧基类催化剂、碱金属催化剂、活性组分负载型催化剂、单金属氧化物催化剂催化剂、复合金属氧化物催化剂和金属有机框架材料(MOFs)新型催化剂等,以下将重点对相关催化剂研究进展进行综述。
2.1 烷氧基类催化剂
在CO2和甲醇直接合成DMC的催化剂体系中,烷氧基类催化剂是最早被研究的。KIZLINK[12]合成了一系列Bu2SnX2(X = OMe、OEt和OBu)催化剂,在反应温度为 100~150 °C,CO2压力为 0.5~1.0 MPa,反应时间为12~27 h的条件下,Bu2SnX2具有良好的催化活性,DMC收率能达到80%。然而,反应生成的水会造成烷氧基类催化剂中毒,加速催化剂的失活[13]。因此在反应体系中添加脱水剂不仅能够避免催化剂的失活,还能促进反应平衡的正向移动,从而提高催化效率[14]。常用的脱水剂为2,2-二甲氧基丙烷(DMP)、1,1,1-三甲氧基甲烷(TMM)以及2-氰吡啶等[15-17]。为了进一步探究烷氧基类催化剂催化CO2和甲醇直接合成DMC的反应机理,ANDRADE等[18]采 用 密 度 泛 函 理 论(Density functional theory,DFT)方法研究了催化CO2和甲醇直接合成DMC的热力学和动力学参数,图4为[Me2SnO]2催化CO2和甲醇直接合成DMC的催化循环示意。从图4中可以看出,[Me2SnO]2将甲醇活化形成甲氧基(步骤(i));然后CO2插入到Sn—OMe中,形成活性中间体[Me2Sn(OMe)OCO2Me]2(步骤(ii));最后活性中间体与甲醇反应生成DMC(步骤(iii))。

图4 [Me2SnO]2催化CO2和甲醇合成DMC的催化循环[18]Fig.4 Catalytic cycle of DMC synthesis from CO2 and methanol with [Me2SnO]2 as catalyst[18]
2.2 碱金属催化剂
碱金属催化剂具有毒性小、廉价易得等优点。FUJITA[19]研究了不同碱金属的碳酸盐(K2CO3、KHCO3、Na2CO3、Li2CO3、BaCO3和CaCO3等)作为催化剂时,DMC产量随碱金属离子的变化规律。当采用K2CO3作为催化剂时,DMC产量最高(4.04 mmol),但副产物二甲醚的物质的量浓度较高,这与金属离子的半径和酸碱性有一定的关系。HONG等[20]也发现了同样的规律,采用不同的碱金属作催化剂时,DMC的收率顺序为K > Na > Li。当采用K2CO3为催化剂,在反应温度为 130~140 °C和CO2压力为20 MPa、添加助剂CH3I和脱水剂DMP时,DMC收率达到最大值12%(物质的量分数)。该催化剂催化合成DMC的机理可以概括为3个步骤:(1)甲醇在碱性催化剂作用下活化分解为甲氧基和H+;(2)甲氧基与CO2生成中间体[CH3O(CO)O]-;(3)中间体[CH3O(CO)O]-与CH3+在一定条件下反应生成DMC。当CH3I作为助剂时,可以为步骤(3)提供CH3+,有助于中间体转化为目标产物DMC。
2.3 负载型催化剂
负载型催化剂是一类应用广泛的催化剂。HAN等[21]采用等体积浸渍法制备了Cu-Ni/硅藻土催化剂,研究了在硅藻土中掺杂不同碱土金属(Li、Na、K和Cs)对催化活性的影响。在反应温度为120 °C和CO2压力为 1.0 MPa的催化反应条件下,15%(Cu-Ni)-2%Cs2O/硅藻土(w(CuO) +w(NiO) = 15%、Cu与Ni原子比为 2:1且w(Cs2O) = 2%)为催化剂时,甲醇的转化率最高(9.22%),DMC的选择性为85.9%,这是因为碱土金属弱的相互作用、强的给电子能力以及碱土金属的加入不仅有助于Cu-Ni在硅藻土载体表面的纳米级分散,还有助于Cu-Ni晶格的极化和缺陷的产生。近年来,石墨烯因其具有较高的热稳定性和良好的电子转移能力,能够促进金属纳米颗粒的分散,被认为是一种良好的载体材料[22-23]。DEERATTRAKUL等[24]通过两步水热还原法制备了Cu-Ni/石墨烯气凝胶催化剂。研究发现,负载量为15%(质量分数)的Cu-Ni/石墨烯气凝胶催化剂表现出最高的催化性能,甲醇转化率为18.5%,DMC收率为25%。BIAN等[25]利用多壁碳纳米管(MWCNTs)作为载体,采用等体积浸渍法制备了双金属Cu-Ni/MWCNTs催化剂。研究发现活性金属均匀分布在MWCNTs表面上,Cu、Ni和Cu-Ni合金的协同效应有助于CO2和甲醇合成DMC,在反应温度 120 °C,压力 1.2 MPa条件下,甲醇转化率为4.5%,DMC的选择性为85%。此外,分子筛也可用作载体,CHEN等[26]采用浸渍法制备了分子筛负载Cu-Ni双金属催化剂,当反应温度为 120 °C、CO2压力为1.1 MPa时,DMC的选择性和收率分别为86.0%和5.0%。钟顺和等[27-29]研究了不同有机金属(Ni(OMe)2、Ti2(OMe)4和Sn2(OMe)2Cl2)活性组分负载在SiO2载体上的催化反应性能。采用定态进样法进行程序升温表面反应红外在线分析(TPSR-IR)和程序升温表面反应质谱在线分析(TPSR-MS)等对反应过程进行了表征分析,发现CO2在催化剂表面存在桥式和甲氧基碳酸酯两种吸附态,并认为甲氧基碳酸酯吸附态的形成是生成DMC的关键。
2.4 单金属氧化物催化剂
金属氧化物催化剂因同时具有氧化还原和酸碱的性质,在催化方面有着非常广泛的应用。常用于CO2和甲醇直接合成DMC的金属氧化物催化剂有V2O5
[30]、CeO2[31]和ZrO2
[32]等。其中,CeO2、ZrO2因其丰富的氧空位缺陷和表面酸碱性等特点而表现出较好的催化活性。ZHAO等[33]采用原位傅里叶红外光谱(FTIR)研究了不同形貌(棒状、立方体和八面体)的纳米CeO2表面对反应性能的影响。研究发现,其催化性能顺序为棒状>八面体>立方体,这是因为CeO2表面的羟基基团和CO2吸附类型对催化活性有显著影响,棒状纳米CeO2表面具有丰富的羟基基团,同时有利于生成双齿碳酸脂物种。WANG等[34]采用水热法合成了4种不同形貌(纺锤状、棒状、立方体和八面体)的纳米CeO2,在反应温度为 140 °C、CO2压力为 5 MPa的条件下,纺锤状的纳米CeO2催化活性最好,DMC产量为 1.38 mmol。这是因为催化活性与催化剂形貌、晶面和表面酸碱性有关,其中CeO2(111)晶面和大量的酸碱活性位是纺锤状纳米CeO2具有高催化活性的主要因素。WANG等[35]采用硬模板法合成单壳层和多壳层的CeO2中空纳米球,研究发现在多壳层纳米球的中空内部可以形成高反应物浓度和高活性位点密度的反应区域,能够促进CO2吸附活化。金属氧化物表面酸碱性催化作用来自于Lewis酸碱位,在CO2和甲醇直接合成DMC中主要分为3个步骤[36]:首先甲醇在CeO2表面吸附,形成甲氧基物种;随后O2插入到甲氧基中形成单甲基碳酸酯中间物种;最后单甲基碳酸酯与另一分子甲醇反应生成DMC。表面酸碱性的增加能够明显提高催化剂的活性,通过更好吸附活化甲醇和CO2,从而提高CO2转化率、甲醇选择性与DMC收率[37]。
与CeO2类似,ZrO2也被广泛用作单金属氧化物催化剂。AKUNE等[38]采用水热法制备了具有高比表面积(168 m2/g)的纳米ZrO2。纳米ZrO2晶粒尺寸随着水热温度的升高而增加。在120 °C下合成的纳米ZrO2表现出较好的催化活性,DMC产量为 0.163 mmol。IKEDA等[39]采用H3PO4对ZrO2进行改性,引入的Brønsted酸位有助于甲醇的活化,进而提升催化性能。当反应温度为150 °C时,与未改性的ZrO2相比,H3PO4改性催化剂的DMC产量是未改性催化剂的4倍。H3PO4改性的ZrO2表面同时具有Lewis酸位和Brønsted酸位。作者采用漫反射傅立叶变换红外光谱研究了其可能催化机理,如图5所示。首先,甲醇在催化剂的碱性位吸附,载体表面的t-OH和b-OH将甲醇活化为t-OCH3和b-OCH3。随后,CO2与t-OCH3反应生成甲氧基碳酸酯,而CO2与和b-OCH3不发生反应。最后,甲醇在酸性位活化为CH3+,CH3+与甲氧基碳酸酯反应得到目标产物DMC。

图5 ZrO2和H3PO4/ZrO2催化甲醇和CO2合成DMC的机理[39]Fig.5 Mechanism for DMC synthesis from methanol and CO2 catalyzed by ZrO and HPO/ZrO[39]2342
2.5 复合金属氧化物催化剂
单金属氧化物催化剂在催化合成DMC时表现出了较高的催化活性,但是甲醇转化率无明显提升,金属表面酸碱性的调控对DMC收率有着重要作用。通过制备方法对形貌结构的改变、掺杂不同杂多酸或者金属氧化物等,可以对催化剂的表面酸碱性进行调控[40-41]。
张国强等[42]通过共沉淀法制备了一系列不同Mn掺杂量的Ce1-xMnxO2催化剂,通过X射线衍射(XRD)、氮气吸/脱附、透射电子显微镜(TEM)、X射线光电子能谱(XPS)和程序升温脱附(TPD)等研究了Ce1-xMnxO2的表面性质。结果表明,Mn离子进入CeO2晶格中形成固溶体,随着Mn掺杂量增加,催化剂表面弱酸碱位数量逐渐降低,中强酸碱和强酸碱位数量增加,催化剂表面氧空位含量呈先增加后减少的变化趋势。当Mn掺杂量较少时,催化剂表面Mn2+比例较高,有利于Ce4++ Mn2+→ Ce3++ Mn3+反应的进行,促进催化剂表面氧空位生成;进一步提高Mn掺杂量时,催化剂表面Mn4+比例提高,有利于Ce3++ Mn4+→ Ce4++ Mn3+反应的进行,导致催化剂表面氧空位含量减少。当Mn掺杂量为1.7%(原子比)时,催化剂的催化活性最佳(11.25 mmol/g)。将Ti、La和Zn等金属掺杂到金属氧化物催化剂中,能够显著地增强该催化剂表面酸碱性位数量和氧空位含量[43-44],从而增强其氧化还原反应能力、提高催化剂的稳定性。FU等[45]发现在CeO2中掺杂适量TiO2,能够显著提高催化剂表面中强酸碱性位点数量,从而提高其催化活性,其中Ti0.04Ce0.96O2纳米棒催化剂具有较高的活性,甲醇转化率为5.38%,DMC选择性为83.1%。MARCINIAK等[46]发现少量Cu负载到CeO2会增加氧空位,从而提高DMC选择性。LIU等[47]采用水热法制备了一系列Zr掺杂的CeO2纳米棒,ZrO2的掺杂能显著提高CeO2的热稳定性和氧化还原性能,当n(Zr)/n(Ce) = 0.1 时,甲醇转化率达到最大值0.65%,DMC产量达到最大值14.2 mmol/g。LIU等[48]通过共沉淀法制备了CaO掺杂的CeO2催化剂,CaO的掺杂有助于提高催化剂表面的酸碱位和氧空位含量,当Ca的质量分数为1.5%、反应温度为 140 °C和反应压力为 3 MPa时,DMC产量最高,为 2.47 mmol/g。CHEN等[49]通过共沉淀-涂敷法制备了蜂窝陶瓷负载的整体式催化剂ZnxCe1-xO2,当x= 0.10、反应温度为 160 °C和反应压力为2.4 MPa时,甲醇转化率达到20.5%,DMC选择性达到82.1%。这是因为与颗粒催化剂相比,整体式催化剂具有较高的比表面积、高的氧空位浓度以及能即时将生成的水移除等优点。
2.6 MOFs新型催化剂
近年来,MOFs因具有金属结点、配体结构可调、比表面积大以及结构多样等特点,在催化领域引起研究者们的关注[50-51]。VERMA等[52]通过设计新型配体,合成了一系列钛基MOFs材料(Ti-ZFF、Ti-ZMF、Ti-ZTF和Ti-ZTBF),其中Ti-ZTBF具有较高的比表面积(811.36 m2/g)。当甲醇用量为 5 mL、Ti-ZTBF用量为 100 mg、CO2压力为 0.2 MPa且反应温度为25 °C时,有微量的DMC生成;继续升高反应温度至 50 °C、75 °C和 100 °C时,DMC收率分别为1.5%、9.0%和16.0%。进一步升高反应温度、反应压力或增大催化剂用量,DMC收率变化不大。当Ti-ZTBF作催化剂时,可以有效降低反应温度和压力。XUAN等[53]采用水热合成法制备了三氟乙酸修饰的金属有机框架材料UiO-66。三氟乙酸修饰可以提高甲醇的转化率和DMC的选择性,这是因为三氟乙酸修饰可以增加催化剂的Lewis酸性位、Lewis碱性位和末端羟基,此外还可以提高孔隙率。XUAN等[54]合成了一系列锆基金属有机框架催化剂MOF-808-X(X为n(ZrOCl2·8H2O):n(均苯三甲酸)),并将其用于催化CO2和甲醇合成DMC,系统考察了MOF-808-X合成过程中n(ZrOCl2·8H2O):n(均苯三甲酸)对MOF-808-X催化剂组成、比表面积、孔道结构以及酸碱位点数量的影响,探讨了MOF-808-X催化剂物化性质与其催化性能之间的关系。结果表明,通过调控n(ZrOCl2·8H2O):n(均苯三甲酸),可以减少堵塞在MOF-808-X微孔中未反应的配体均苯三甲酸或氧化锆原子簇的量,增加MOF-808-X的比表面积、微孔孔径以及酸碱位点数量,从而显著提升MOF-808-X催化剂的催化活性。当n(ZrOCl2·8H2O):n(均苯三甲酸) = 4 时,MOF-808-4催化剂具有最大的比表面积和微孔孔径,以及最多的酸碱性位点,因而表现出较高的催化活性。
3 结语与展望
CO2和甲醇直接合成DMC是一条可行的路线。从长远来看,该路线是清洁转化CO2的有效途径之一。但由于受热力学的限制,CO2的活化仍然是相当长一段时间内研究的关键点。烷氧基类催化剂具有反应条件温和和甲醇转化率高等优点,同时也面临着催化剂失活等问题,虽然可以添加脱水剂促进反应平衡的移动,但需要增加脱水剂分离工序。碱金属催化剂相对廉价,但其副产物较多。负载型催化剂具有较好的甲醇转化率,但DMC选择性需要进一步提高。金属氧化物和复合型金属氧化物催化剂是近些年的研究热点,研究者围绕制备方法改进、助剂添加和催化剂结构调变等开展了大量的研究工作,但是其甲醇转化率仍有待进一步提高。在当前机理模型研究较少的情况下,可采用热力学理论计算、先进的原位表征技术以及密度泛函理论计算等综合手段对其机理进行研究,以强化对该类反应本质的认识。MOFs作为一种新型的催化材料,在CO2和甲醇合成DMC中显示了一定的催化效果,但仍有待进一步深入研究。
