草果三种真菌性叶部病害病原鉴定及生物学特性测定
2022-10-28包玲凤杨群辉施竹凤杨明英杨济达朱红业何永宏杨佩文
包玲凤,杨群辉,张 庆,施竹凤,杨明英,杨济达,朱红业,何永宏,杨佩文
(1. 云南农业大学植物保护学院,昆明 650201; 2.云南省农业科学院农业环境资源研究所,昆明 650205)
【研究意义】草果(AmomumtsaokoCrevost et Lemarie)是姜科(Zingiberaceae)豆蔻属(Amomum)多年生草本植物,主要分布在云南省、广西省、贵州省等热带和亚热带高海拔阴暗潮湿地区[1-2]。云南是草果主产区之一,其种植面积占全国总面积的95%以上[3-4]。草果不仅是一味常用的可食用香料,还可用于治疗疟疾、消化不良、腹痛恶心等病症,具有生物和药理活性,其挥发油具有开发植物源杀菌剂的潜力[5-6]。由于草果生长环境条件的特殊性和局限性,以及剧增的市场需求量,使得野生草果种质资源急剧减少,目前主要依赖人工林下栽培种植。在草果种植业的发展中,由于受自然气候条件的影响,以及种植管理模式等方面的不足,导致草果各类病虫害的问题日益凸显。【前人研究进展】已有研究表明,云南省药用植物栽培区的草果病害种类主要有线虫、叶斑病[7]、叶瘟病[8]、疫病[9]和萎蔫病[10]等。2013年,林丽飞等[11]首次报道了寄生于云南草果根际土壤的2种环科线虫。目前,国内外关于草果真菌性叶部病害的研究报道还较少。2005年,张云霞等[7]首次报道了由姜叶点霉(Phyllostictazingiberi)引起云南省红河州屏边县草果叶斑病,并对病原物的形态结构作了详细描述,随后研究者们又针对该病害提出了科学有效的化学防治措施[12]。草果叶斑病与姜叶斑病在症状上十分相似,仅在病原菌分生孢子大小上稍有区别。2013年,章一鸣等[8]首次发现了绿春县草果种植区内由变异梨孢(PyriculariavariabilisBus-saban)引起的一种侵染性病害,并将其命名为叶瘟病。【本研究切入点】目前,国内外尚未有关于炭疽属(Colletotrichumsimmondsii)对草果危害的研究报道,虽有变异梨孢(P.variabilisBus-saban)侵染草果引起叶瘟病、姜叶点霉(P.zingiberiHori)侵染草果引起叶斑病的研究报道,但研究者们仅对该病害的症状、病原物形态及发生危害情况作了描述,并未对病原物的详细分类信息和生物学特性进行系统鉴定分析。【拟解决的关键问题】本研究通过对草果真菌性叶斑病3种病原菌进行单孢分离培养、致病性测定、形态学观察、多基因系统发育分析以及测定其生物学特性,明确3种病原物的组成及其详细分类,探索病害发生过程和流行的环境因子,为草果叶部病害的进一步研究和防控提供科学依据。
1 材料与方法
1.1 供试材料
从云南省怒江傈僳族自治州福贡县草果种植基地(98°80′76″E、27°04′67″N)采集典型病样,保存至冰盒内带回实验室。通过组织分离法获得单孢菌株CG-N01、CG-N02、CG-N03,菌株保存于云南省农业科学院农业环境资源研究所。试验仪器包括一次性培养皿、无菌操作台、酒精灯、手术刀、镊子、Nikon Eclipse E200荧光生物显微镜等。
1.2 试验方法
1.2.1 致病性测定 据柯赫氏法则,选择草果健康新鲜的叶片,通过无伤接种法接种带菌菌饼,无菌水处理作为空白对照,于恒温培养箱中(25 ℃)保湿培养,定期观察并记录草果叶片发病情况,每个处理4次重复。培养至病症显现,再次采用组织分离法分离发病部位病斑上的病原物。
1.2.2 形态特征观察 在无菌条件下,取纯化后的单孢菌饼(5 mm)接种至PDA平板培养基上,在25 ℃恒温避光培养箱内培养,待菌落形成,观察并记录。菌株产孢后,在Nikon Eclipse E200荧光生物显微镜下观察病原菌的产孢结构和分生孢子的形态,并测量大小。
1.2.3 多基因系统发育分析 DNA提取参照试剂盒进行,采用真菌通用引物扩增rDNA-ITS[13]、β-tubulin(tub2)[14]、LSU[15]、tef-1α[16]片段。PCR反应体系(30 μL):10 mmol/L 10×PCR buffer 3.0 μL、2 mmol/L dNTPs 2.0 μL、5 U/μLTaq酶0.5 μL、10 mmol/L正向引物和反向引物各1.0 μL、DNA模板1.5 μL,ddH2O 21.0 μL。rDNA-ITS反应程序:95 ℃预变性3 min;95 ℃变性1 min,52 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃ 延伸10 min,4 ℃保温。LSU反应程序:95 ℃预变性1 min;95 ℃变性30 s,50 ℃退火1 min,72 ℃延伸90 s,共35个循环;72 ℃延伸10 min,4 ℃保温。tub2反应程序:95 ℃预变性3 min;94 ℃变性1 min,55 ℃退火50 s,72 ℃延伸1 min,30个循环;72 ℃ 延伸10 min,4 ℃保温。tef-1α反应程序:94 ℃预变性5 min;94 ℃变性30 s,63 ℃退火55 s,72 ℃延伸90 s,10个循环;94 ℃变性30 s,53 ℃退火55 s,72 ℃延伸90 s,36个循环,72 ℃ 延伸7 min,4 ℃保温。所得产物经琼脂糖凝胶电泳纯化,并在凝胶成像分析系统中观察,回收后送至生工生物工程(上海)股份有限公司测序。将测序结果提交至GenBank数据库中进行比较分析,选择参比菌株,通过软件MEGA 7.0构建系统发育树。
1.2.4 生物学特性测定 以PDA培养基为基础培养基,分别测定不同温度、光照、pH对病原菌生长的影响。温度共设置9个梯度:5、10、15、20、25、28、30、32、35 ℃; pH设置8个梯度:4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0;光照设置:25 ℃ 24 h全暗、12 h光照/12 h黑暗、24 h光照。在无菌条件下,将纯化后的单孢菌饼(5 mm)接种至平板中央,培养5 d后测量菌落直径,培养15 d后计数各处理的孢子数,每个处理重复4次。
1.3 数据分析与统计
使用软件Excel 2021整理数据;软件SPSS 18进行方差分析,Duncan进行差异显著性检验,P<0.05为显著性差异;采用Sigma Plot 12.5进行绘图。
2 结果与分析
2.1 病害症状与致病性测定
采用单孢培养法分离培养采集到的11份草果叶部病害样品,最终获得纯化单孢菌株3株,分别将其编号为CG-N01、CG-N02、CG-N03。致病性测定试验结果表明, 3株病原菌均能侵染草果,并引起健康草果植株发病,且病害症状与田间病状相一致。据柯赫氏法则,菌株CG-N01被确定为草果叶瘟病致病菌(图1-A,1-D),菌株CG-N02被确定为草果叶斑病致病菌(图1-B,1-E)。草果健康叶片接种CG-N03菌株并感病后,发病初期叶片出现近似圆形或不规则的病斑,中央呈白色、凹陷,边缘褐色,发病后期较严重时,病斑有穿孔,叶片逐渐褪色且边缘枯黄萎缩;当培养环境相对潮湿时,病斑表面橙黄色小点逐渐变为黑色小点,即病原菌的分生孢子堆。这与田间发病症状一致(图1-F),从接种发病部位可再分离得到先前的接种菌,空白对照见图1-G。根据以上结果,可初步将纯化单孢菌株CG-N03确定为草果炭疽病致病菌。
2.2 病原菌鉴定结果
2.2.1 形态特征观察 由图2可知,菌株CG-N03于25 ℃避光培养5 d后,病原菌落呈圆形,菌落中心呈橙黄色,周围呈灰色,边缘浅褐色,气生菌丝浓密呈绒毛状,具明显轮纹;背面中心处呈橙黄色,周围呈浅褐色,边缘深褐色,菌落直径4.75~5.45 cm(图2-I,2-J);培养15 d后,菌落表面形成少量橙黄色小点(分生孢子堆),呈不规则排列,无特殊气味;菌株CG-N03的成熟分生孢子呈无色透明梭形,分生孢子内有油滴3~5个,大小(8.37~14.14)μm ×(4.19~5.60)μm,孢子平均大小为11.04 μm×4.25 μm;分生孢子梗单生,不分枝,越靠近顶端颜色越浅,基部呈褐色;草果叶片接种病原菌并发病时,菌株CG-N03在叶表面产生黑色小点(分生孢子),其形态大小与纯化菌株培养结果一致(图2-K,2-M)。综上,可将单孢菌株CG-N03初步确定为炭疽属(C.simmondsii)。
2.2.2 分子生物学鉴定和系统发育进化树 菌株CG-N01的rDNA-ITS、LSU和tef-1α的目的基因片段分别为489 bp(登录号:MN596209)、901 bp(登录号:MN689811)和475 bp(登录号:MN696687),菌株CG-N02的rDNA-ITS、LSU和tef-1α的目的基因片段分别为517 bp(登录号:MN596212)、997 bp(登录号:MN650644)和529 bp(登录号:MN696686),菌株CG-N03的rDNA-ITS、LSU和tef-1α的目的基因片段分别为560 bp(登录号:MN596210)、926 bp(登录号:MN650645)和738 bp(登录号:MN696688)。经GenBank数据库中相关种属基因序列比较分析后,菌株CG-N01、CG-N02和CG-N03分别与梨孢属(Pyriculariacostina)、茎点霉属(Phomamatteuciicola)和炭疽属(C.simmondsii)具较高同源性,挑选亲缘性较高的菌株作为参比菌株,构建系统发育进化树(图3~5)。
菌株CG-N01-ITS(Accession No. MN596209)、CG-N01-LSU(Accession No. MN689811)、CG-N01-EF1(Accession No. MN696687)分别与参比菌株PyriculariacostinaCMUZP0003(Accession No. AY265329)、PyriculariaoccidentalisCBS 365.90(Accession No. MH873902)、PyriculariaborealisCBS 461.65(Accession No. KM009198)的相似性达98.77%、99.33%、96.83%;结合形态特征鉴定结果,可将单孢菌株CG-N01鉴定为梨孢属(P.costina)。菌株CG-N02-ITS(Accession No. MN596212)、CG-N02-LSU(Accession No. MN650644)、CG-N02-EF1(Accession No. MN696686)分别与参比标准菌株PhomamatteuciicolaWYJYKDS239(Accession No. MH368529)、PhomamatteuciicolaWYJYK03(Accession No. MK287844)、Phomasp. FJ-2(Accession No. KJ669188)的相似性达99.80%、99.78%、99.43%;结合形态特征鉴定结果,可将单孢菌株CG-N02鉴定为茎点霉属(P.matteuciicola)。菌株CG-N03-ITS(Accession No. MN596210)、CG-N03-LSU(Accession No. MN650645)、CG-N03-BT(Accession No. MN696688)分别与参比标准菌株ColletotrichumsimmondsiiBRIP 28519(Accession No. GU183354)、ColletotrichumsimmondsiiCBS 122122(Accession No. MH874724)、ColletotrichumsimmondsiiBRIP 28519(Accession No. GU183289)的相似性达99.82%、99.78%、97.29%;结合形态特征鉴定结果,可将单孢菌株CG-N03鉴定为炭疽属(C.simmondsii)。
2.3 菌株生物学特性测定
2.3.1 温度对菌株菌丝生长和产孢的影响 由图6可知,当温度在10~35 ℃时,CG-N01、CG-N02和CG-N03菌株菌丝均能正常生长,并且形成分生孢子;当培养温度≤10 ℃时,菌株CG-N01和CG-N02菌丝不再生长,且无分生孢子形成,菌株CG-N03菌丝能正常生长但产孢量较少;当培养温度≥35 ℃时,菌株CG-N01菌丝不能正常生长且无分生孢子形成。菌株CG-N01菌丝生长和孢子形成的最适培养温度为28 ℃,菌落直径和产孢量分别为3.45 cm和2.30×107/(spore·mL);菌株CG-N02和CG-N03菌丝生长和孢子形成的最适培养温度为25 ℃,菌落直径分别为4.52、5.06 cm,产孢量分别为3.56×107、3.81 ×107/(spore·mL)。
2.3.2 pH对菌株菌丝生长和产孢的影响 如图7所示,当pH介于4.0~11.0时,菌株CG-N01、CG-N02和CG-N03能正常生长和产孢。菌株CG-N01在pH 6.0时菌落直径最大,产孢量最高,分别为3.78 cm和1.66×107/(spore·mL);菌株CG-N02 在pH 7.0、pH 8.0时菌落直径最大,分别为5.27、5.15 cm,pH 7.0时产孢效果最好,为4.42×107/(spore·mL);菌株CG-N03在pH 6.0~8.0时菌落直径最大,为4.42~5.31 cm,pH 7.0时产孢量最高,为3.49×107/(spore·mL)。菌株CG-N01最适培养pH 6.0,菌株CG-N02和CG-N03最适pH为7.0。
2.3.3 光照对菌株菌丝生长和产孢的影响 由表1可知,光照对CG-N01、CG-N02和CG-N03 3株病原菌菌丝生长影响较大,对CG-N01产孢量无明显影响,对CG-N02和CG-N03产孢量影响显著。其中,光照黑暗交替(12 h光照/12 h黑暗)和全光照条件下菌株CG-N01菌丝生长和产孢量最佳,菌落直径分别为3.53和3.47 cm,产孢量分别为1.67×107、1.62×107/(spore·mL);全黑暗条件下,菌株CG-N02菌丝生长最快,菌落直径为4.53 cm,而光照黑暗交替其分子孢子萌发率最高,产孢量为4.31×107/(spore·mL);全光照条件和光照黑暗交替(12 h光照/12h黑暗)条件下菌株CG-N03菌丝生长最快,菌落直径分别为5.32和5.19 cm,光照黑暗交替条件则有利于其分生孢子形成,产孢量为4.81×107/(spore·mL)。
3 讨 论
炭疽属(C.simmondsii)是一类重要的植物致病菌,其寄主范围较广,可危害辣椒[17]、草莓[18-19]、芹菜[20]、红花[21]等经济作物和油料作物,炭疽病感染植株后表现症状一般为叶斑、叶枯等,病情严重时直接影响其产质量。本研究中通过分析测试将炭疽属(C.simmondsii)确定为草果炭疽病病原物,这也是国内外关于炭疽属侵染草果并引起炭疽病的首次研究报道。章一鸣等[8]发现姜叶点霉(P.zingiberiHori)能侵染草果并导致叶斑病,张云霞等[7]报道了变异梨孢(P.variabilisBus-saban)引起草果叶瘟病,笔者从具有典型病状草果植株叶片上分离到病原物,并通过致病性测定和分子生物学鉴定,明确梨孢属(P.costina)和茎点霉属(P.matteuciicola)能分别侵染草果健康叶片组织,并引起叶瘟病、叶斑病。目前,国内外有关于梨孢属、茎点霉属和炭疽属生物学特性的研究尚未见报道,在致病菌株生长和产孢的最佳条件方面,不同菌株的生物学特性存在一定的相似性和差异性,为破解此类疑惑还需进一步研究探索。
rDNA-ITS基因序列在真菌种属系统学中的广泛运用,为病原真菌相关物种的分类鉴定及系统进化分析提供了强有力的证据。但rDNA-ITS也存在一定的局限性,由于绝大多数的近缘种或集合种构建的系统发育进化树在某些关键节点上的支持率较低,不能准确识别和分类鉴定[22]。随着分子生物学的飞速发展,研究者们对病原物的分类鉴定不再只依赖于单基因系统发育分析,多基因序列分析(Multigene sequence analysis)已成为植物病原菌分类鉴定可信度较高的技术手段[23]。李河等[24]采用形态学鉴定和rDNA-ITS、CAL和GAPDH多基因谱系分析方法对油茶炭疽病病原物进行分类鉴定,结果表明分离得到的23株病原菌均为果生刺盘孢菌(C.fructicola),为油茶炭疽病的系统防治提供了科学依据。为对海南橡胶树炭疽菌复合群进行种属的详细分类鉴定,林春花等[25]运用rDNA-ITS、CHS-1、GAPDH、ACT、GS和Ap MAT 6个基因序列进行多基因系统发育分析,为胶孢炭疽菌的分类鉴定提供了理论依据。代永东等[26]结合nr SSU、LSU、tef-1α、rpb1、rpb2 多基因序列和GenBank数据库中棒束孢属(Isaria)及近缘物种的分子序列,对棒束孢属进行系统发育分析,明确相关种属间的差异性和相似性,为此类微生物的分类鉴定提供充足的科学依据。本研究采用rDNA-ITS、LSU、tub2和tef-1α 4个基因序列对分离自草果植株叶部病害标样进行多基因序列分析,快速准确地了解病原物的详细分类信息,为此类病原物的分类鉴定提供充足的理论基础。
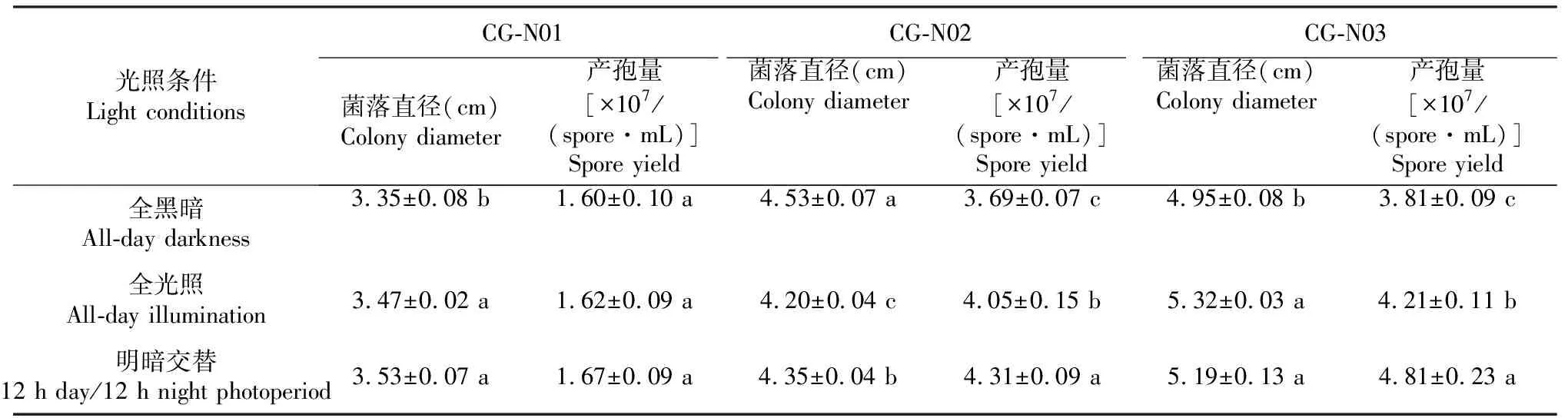
表1 不同光照条件下菌株菌丝生长和产孢结果
据梨孢属、茎点霉属和炭疽属生物学特性测定结果表明,在黑暗潮湿条件下可促进菌株菌丝生长和分生孢子形成,说明此类环境有利于草果叶瘟病、叶斑病和炭疽病的发生流行,湿润多雨是此类病害为害的主要环境因子。怒江傈僳族自治州属于低纬高原季风气候,具有独特的立体气候条件,湿润多雨,适宜梨孢属、茎点霉属和炭疽属生长繁殖,因此草果各类叶部病害发生流行的潜在危险性较高。草果多生长于温暖潮湿且避阴的山区气候环境,而阴暗的环境条件又有利于茎点霉属和炭疽属分生孢子的快速萌发,郁闭度较高的区域有利于草果叶部病害的发生流行。综上,应合理控制草果植株的种植密度,调整适宜的郁闭度,保持草果种植地透光通风率,加强排水管理,定期清除种植地块内的病枯叶,减少病原菌的侵染源;增施有机肥,草果植株生长旺盛,增强植株抗病抗逆性能。草果叶片被侵染发病时,大部分病原物从气孔处开始侵染,严重时整个叶片枯黄脱落,甚至植株死亡,对草果植株的老叶造成严重损害,而新叶发病率在感病初期相对较低,后期较为严重[27],这与本研究室内草果致病性测定结果相一致。在草果种植过程中,夏季高温多雨,土壤水分较高,此时草果生长旺盛,但也是叶部病害高发期,因此很有必要通过控制草果的种植密度和苗圃的温湿度,提高植株间的透光性和通风能力,可在草果叶片、花序上喷洒一定量0.5%的波尔多液保护植株[28];必要时需科学合理的喷洒杀菌药剂,如代森锌、百菌清、多菌灵等[29],预防病害的发生流行,保证草果种植产业的绿色稳定发展。
4 结 论
通过形态学与分子生物学鉴定,确定云南草果叶瘟病致病菌为梨孢属,叶斑病致病菌别为茎点霉属和炭疽属。病原菌菌丝生长和产孢明显受温度、pH和光照条件影响。
