益生菌冰淇淋对人体口腔菌群的影响
2022-10-28张露婷刘榉元赵雯杨晔铭冯荻蔡冬燕杨铭张健
张露婷, 刘榉元, 赵雯, 3, 杨晔铭, 冯荻, 蔡冬燕, 杨铭, 张健
(1.北京食品营养与人类健康高精尖创新中心, 北京 100048;2.北京工商大学, 北京 100048;3.内蒙古伊利实业集团股份有限公司, 呼和浩特 010110)
0 引言
人体口腔内定植有约700种微生物, 它们“把守”着人体消化道的入口, 是人体的第二大共生菌群[1]。这些微生物与食物、口腔分泌物和免疫系统共同影响和调节口腔微环境, 与人体的口腔健康和多种疾病相关[2]。口腔菌群失衡是龋齿和牙周疾病的直接诱因[3]与口腔癌发病相关[4]。一定条件下, 口腔菌群进入下游消化道, 会改变肠道菌群组成和结构[5], 引起和加速Ⅰ型糖尿病[6]、食道癌[7]、肠炎[8]、便秘[9]、结肠癌[10]、胰腺癌[11]和肝病[12]的发生和发展。口腔菌群进入血液, 还会诱发局部或周身免疫反应[13];另外, 口腔菌群代谢产生的亚硝酸盐和氮氧化物能够维持血压稳定, 是高血压治疗的潜在新靶点[14]。因此, 明确口腔菌群及其动态变化规律, 调控口腔菌群组成和代谢成为改善宿主健康和相关疾病治疗的新策略[15]。
高糖食物是影响口腔菌群的主要因素之一[16]。2019年, 国家卫生健康委办公厅印发的《健康口腔行动方案(2019-2025年)》指出“口腔健康是全身健康的重要组成部分”, 强调减少高糖食品摄入[17]。其中“糖”指的是食品加工中常用的蔗糖、葡萄糖、果糖和麦芽糖等高热量甜味剂。研究发现, 含有这些糖类的食物在进入口腔后, 会被变异链球菌和血链球菌等微生物利用, 合成包覆于牙齿和口腔黏膜表面的生物膜[18], 隔绝氧气, 促使定植于生物膜下的产酸厌氧菌迅速繁殖, 最终形成口腔病原菌群落, 诱发龋齿和牙周炎等疾病[19]。这一过程中, “高糖食物促进生物膜形成、打破产酸微生物和产碱微生物(如唾液链球菌和内氏放线菌)数量与组成的平衡”是诱发宿主多种口腔疾病的原因[20]。研究人员还发现蔗糖的口腔菌群破坏性强于单糖, 二者混合对口腔菌群的破坏更强, 更易诱发牙齿和口腔疾病[21]。
益生菌同样喜欢“吃”糖, 具有竞争性消耗碳源、分泌抗菌肽、抑制口腔病原菌繁殖和破坏生物膜形成的功能[22], 因此在高糖食物中加入益生菌, 通过其对口腔菌群的调节功能, 减少和防治高糖食物诱发的口腔疾病成为领域的研究热点之一[23]。近期研究发现鼠李糖乳杆菌通过在口腔长期定植(4周), 能够降低口腔菌群的整体丰度和变异链球菌的数量[24]。含有双歧杆菌的口含片可以缓解牙龈炎, 减少牙垢的形成[25]。干酪乳杆菌发酵饮料能够抑制口腔变异链球菌生长及其生物膜形成[26]。另外基于12组益生菌与口腔健康的研究结果显示, 乳杆菌对口腔菌群的调节和牙周疾病的治疗效果最好[27]。
冰淇淋是一种典型的高糖食品, 加工中为了降低浆料冰点和提升甜味, 会加入质量分数超过15%的蔗糖、果糖、葡萄糖、麦芽糖或乳糖等高热量甜味剂, 这导致口腔变异链球菌的多种糖基转移酶同时被激活、高效合成生物膜, 极易形成口腔病原菌群落。本研究利用筛选出的具有较强变异链球菌及生物膜抑制活性的植物乳杆菌K25[28]和鼠李糖乳杆菌GG, 分别发酵制作酸奶冰淇淋。考察富含糖分的益生菌冰淇淋对口腔菌群组成和结构的影响。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌GG菌株实验室保藏, 分离自市售伊利低温酸乳;植物乳杆菌K25实验室保藏, 分离自西藏灵菇;口腔致病菌变异链球菌1.3771购于中国普通微生物菌种保藏中心。
生牛乳, 北京大兴黎明奶牛场;脱脂乳粉, 恒天然有限公司;稀奶油, 雀巢(中国)有限公司;白砂糖、瓜尔豆胶、卡拉胶、羟甲基纤维素钠, 河北百味生物科技有限公司(食品级);单双硬脂酸甘油酯、双乙酰酒石酸酯, 丹尼斯克(中国)有限公司;BHI液体培养基, 海博生物科技有限公司。
1.2 仪器与设备
CR21GⅢ立式高速冷冻离心机, 日本HITACHI公司;MLS-3750高压蒸汽灭菌器, 日本三洋公司;U3900紫外分光光度计, 日本HITACHI公司;S20数显pH计, 梅特利-托利多仪器有限公司;DV-III Ultra黏度计, 美国Brookfield公司;THZ-D电热恒温培养箱, 上海一恒仪器科技有限公司;DNA提取试剂盒, 德国Qiagen公司。
1.3 实验方法
1.3.1 益生菌冰淇淋制作
冰淇淋分为3个实验组, 基础配料相同, 见表1, 区别为普通冰淇淋组未添加益生菌、K25冰淇淋添加植物乳杆菌K25(活菌数8.48 log cfu/mL)、LGG冰淇淋添加鼠李糖乳杆菌GG(活菌数8.65 log cfu/mL), 流程如下:
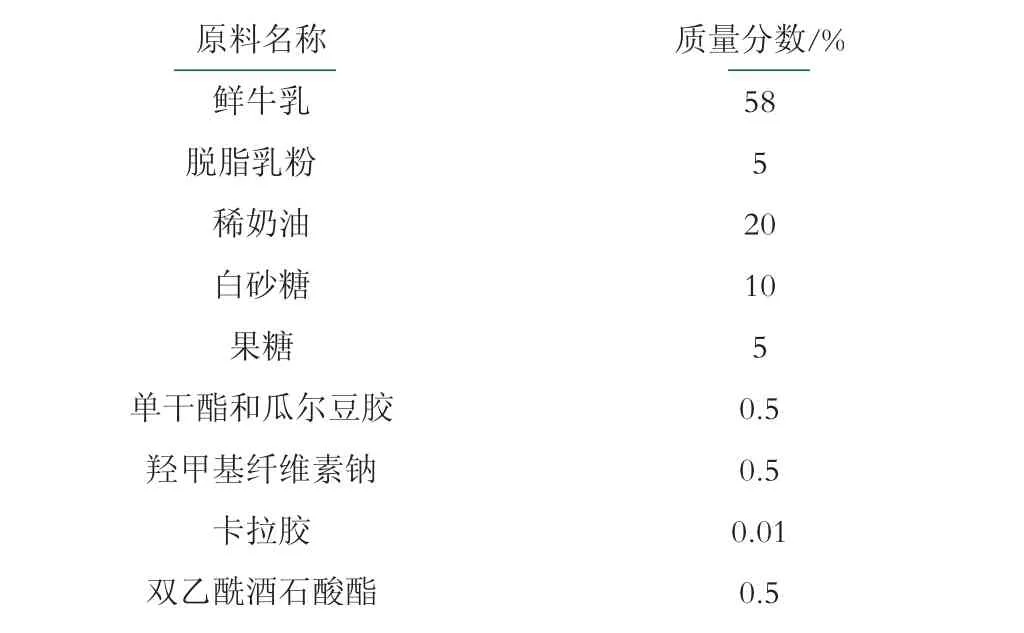
表1 冰淇淋基础配料表
浆料→均质(压力15 MPa)→巴氏杀菌(72℃, 5 min)→降温(37~40℃)→添加益生菌(接种量1%)→发酵(37℃, 6 h)→老化(4℃, 4 h)→凝冻(-5~8℃, 15~20 min)→硬化(-25℃, 5 h)。
1.3.2 冰淇淋理化指标的测定
冰淇淋理化指标检测方法参考之前实验方法[28], 略有修改如下。
pH值的测定, 取10 g冰淇淋浆料样品, 加入20 mL去离子水, 充分混匀, 加入两滴酚酞指示剂, 用标准浓度为0.1 mol/L NaOH滴定。滴定酸度(°T)为1 g冰淇淋浆料消耗浓度为0.1 mol/L NaOH的毫升数, 消耗1 mL浓度为0.1 mol/L的NaOH相当于1 °T。pH采用pH计测定。
冰淇淋中还原糖、脂肪和蛋白质含量的测定采用国标GB5413-2010中的乳制品检测方法, 方法如下:
还原糖含量测定方法:冰淇淋中的还原糖(乳糖等)经提取后, 利用高效液相色谱柱分离, 用示差折光检测器或蒸发光散射检测器检测, 外标法进行定量。乳糖的含量按以下公式进行计算:
乳糖含量/%=(乳糖标准液浓度×样品定容体积×100×乳糖标准液稀释倍数)/(冰淇淋质量×1000)
脂肪含量测定方法:用乙醚和石油醚抽提冰淇淋的碱水解液, 通过蒸馏或蒸发去除溶剂, 测定溶于溶剂中的抽提物的质量, 根据以下公式进行计算:
脂肪含量/%=(冰淇淋中抽提物质量-水中抽提物质量)/冰淇淋质量×100
蛋白质含量测定方法:先分别测定出冰淇淋总的总固体含量、脂肪含量, 再用总固体减去脂肪和蔗糖等非乳成分含量, 根据以下公式进行计算:
蛋白质含量/%=冰淇淋中总固体含量-冰淇淋中脂肪和蔗糖含量
膨胀率的测定, 分别称取100 mL体积的冰淇淋浆料和等体积的成品, 根据下列公式对软冰淇淋的膨胀率进行计算:
膨胀率/%=(冰淇淋浆料质量-相同体积冰淇淋质量)/相同体积冰淇淋质量×100
1.3.3 冰淇淋浆料对变异链球菌生长和生物膜形成的影响
本部分参考之前的研究方法[29], 略作修改。简述如下, 将发酵后的冰淇淋浆料离心获得上清液, 0.22μm滤膜过滤, 取5 mL过滤后上清与等体积的BHI液体培养基混合, 将变异链球菌以2%比例接种于混合培养基中37℃培养48 h, 每4 h取样检测600 nm波长处的光密度(OD)值。每组3平行, 绘制变异链球菌生长曲线, 确定冰淇淋浆料对变异链球菌生长特性的影响。
利用BHI液体培养基将活化好的变异链球菌的菌液浓度调整到1.0×108CFU/mL, 取100μL过滤后的冰淇淋上清液与等体积BHI菌液混合, 加入到96孔微量板中。37℃培养24 h后, 弃掉孔中培养液, 加入等体积0.1 mol/L PBS清洗3次, 弃掉PBS, 加入200μL 95%甲醇, 固定15 min, 弃掉, 室温下自然晾干。每孔加入150μL 2%的结晶紫溶液, 染色10 min, 用去离子水清洗3次, 室温下自然晾干。加入200μL质量分数33%的冰醋酸将结晶紫洗脱下来, 取150μL转入新的96孔板中, 630 nm测OD值, 生物膜抑制率计算公式如下(以BHI液体培养基为对照)。
生物膜抑制率(%)=(1-OD样品/OD对照)×100
1.3.4 冰淇淋浆料对变异链球菌黏附性的影响
参照文献[28]中的方法进行细菌的黏附性实验。取2 mL冰淇淋浆料上清液和2 mL变异链球菌菌悬液混匀后, 加入到倾斜30 °的玻璃试管中, 静置, 37℃厌氧培养24 h。分别收集试管中紧密黏附、松散黏附和未黏附于试管壁的细菌, 收集方法参考周智等[30]的方法。将收集好的菌悬液分别加入96孔微量板中, 每孔加200μL, 用PBS调零, 用酶标仪测定每孔630 nm波长处的吸光度, 空白BHI培养基和冰淇淋浆料上清混合液为对照, 按下式计算细菌黏附率。
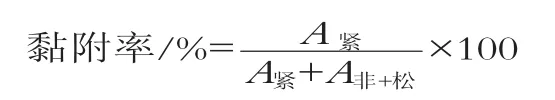
式中:A紧密黏附菌悬液的吸光度, A非+松非黏附和松散黏附菌悬液的吸光度。
1.3.5 益生菌冰淇淋对人体口腔菌群的影响
研究选取12位22~24周岁健康的受试者, 无口腔和常见代谢性疾病(高血压、糖尿病、胃肠炎等), 受试前30 d用相同的漱口水和牙膏每日早晚清洁口腔, 受试期间禁止食用其它冷饮类及高糖(折合蔗糖含量>7%)食品或补充剂。一周内不进食乳制品与发酵食品, 受试者在样品收集当天清晨不清洁口腔、不进食, 样品收集时间为早8点, 分别在未食用冰淇淋、连续食用普通冰淇淋7 d后、连续食用K25冰淇淋7 d后、连续食用LGG冰淇淋7 d后收集唾液样品2 mL冻藏, 用于提取基因组。实验过程中, 受试者每人每天一次性进食150~200 mL冰淇淋, 在连续食用一种冰淇淋7 d后, 要求受试者停止进食冰淇淋、恢复正常饮食至少10 d, 进入下一组冰淇淋实验。样品编号见表2。

表2 受试者信息及样品编号
唾液微生物DNA样本的提取:唾液样品的DNA的方法参照DNA提取试剂盒的指示说明进行。具体操作流程为:取1~100μL唾液样品于1.5 mL离心管中, 加入10μL细胞裂解液与100μL缓冲液, 充分混匀。56℃孵育10 min, 离心除水滴。加入50μL乙醇, 涡旋15 s, 室温孵育3 min后离心除水滴。将所有溶解物转移至QIAump MinElute Column中, 离心。加入500μL缓冲液洗涤两次后, 14 000 rpm离心3 min, 使膜充分干燥。加入50μL洗脱液, 室温下孵育5 min, 14 000 rpm离心1 min, 确保DNA完全洗脱。
16S rDNA V3~V4区片段扩增及Illumina双末端检测:以稀释后的基因DNA为模板, 使用KAPA HiFi Hotstart ReadyMix PCR Kit进行PCR, 2%琼脂糖凝胶电泳检测PCR产物, AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物。回收后, 利用Thermo NanoDrop 2 000紫外微量分光光度计和2%琼脂糖凝胶电泳对PCR产物进行质检, Qubit进行文库定量。对样品进行混合后, Illumina HiSeq PE250进行上机检测。测序及序列比对分析工作委托锐羿生物科技有限公司完成。微生物多样性数据分析采用在线分析工具Microbiome-Analyst(https://www.microbiomeanalyst.ca/)完成。
1.3.6数据统计
采用SPSS13.0软件进行数据统计处理, P<0.05表示差异显著。应用CANOCO 4.5统计分析软件对口腔菌群进行冗余分析(Redundancy analysis, RDA)。
2 结果与分析
2.1 K25益生菌冰淇淋的基本理化特性
冰淇淋产品的基本组成、酸度、膨胀率等指标是评价益生菌冰淇淋产品的主要指标[31]。本实验对冰淇淋产品理化指标的测定结果如表3所示。K25和LGG冰淇淋与普通冰淇淋的蛋白质和脂肪组成无显著差异(P>0.05), 还原糖含量分别下降了2.85%和3.68%, 表明益生菌发酵会消耗浆料中的糖分, 相应的增加冰淇淋浆料中的酸含量, K25和LGG冰淇淋比普通冰淇淋的滴定酸度分别高12 °T和17 °T。K25与LGG冰淇淋的膨胀率比普通冰淇淋高8.07%和13.54%, 这主要是因为2株乳杆菌高产黏性胞外多糖[32], 多糖会与乳蛋白弱交联[33], 增加浆料的黏度, 提高膨胀率[34]。目前, 益生菌冰淇淋的菌株添加方式有两种, 一为接种发酵, 另一种为添加含活菌的菌粉, 前者对冰淇淋品质有一定影响如本实验, 后者大批量生产成本较高[35]。K25和LGG冰淇淋中的活菌数分别为8.48 log cfu/mL和8.65 log cfu/mL(P<0.05), 符合益生菌食品要求。

表3 冰淇淋理化指标
2.2 冰淇淋对变异链球菌生长特性的影响
变异链球菌(Streptococcus mutans)是人体口腔的主要病原微生物, 通过分泌胞外多糖和黏蛋白与Bifidobacterium spp., Scardovia spp.和Actinomyces spp.等共同在口腔内形成病原生物膜, 黏附于牙齿、舌头和口腔表面, 是导致龋齿和牙周炎的主要病原微生物[36]。研究将冰淇淋浆料上清与变异链球菌培养液混合, 考察了3种冰淇淋浆料上清对变异链球菌生长特性的影响。结果如图1所示, K25和LGG冰淇淋均能不同程度地延缓变异链球菌进入对数生长期, 减慢变异链球菌的增殖速率, 降低变异链球菌活菌数量。相比普通冰淇淋, K25冰淇淋和LGG冰淇淋组在变异链球菌培养终点(32 h)的OD值分别为下降了22%和38%(P<0.05), K25冰淇淋浆料对变异链球菌抑制率低于其已报道MRS培养上清的抑制活性(~70%)[28]。这可能与培养基质的组成和发酵程度有关, 冰淇淋中糖含量较高, 变异链球菌喜糖, 且冰淇淋浆料发酵时间6 h, 短于之前的16~18 h(P<0.05)。本实验证明K25和LGG发酵的冰淇淋浆料具有较强的变异链球菌生长抑制活性。
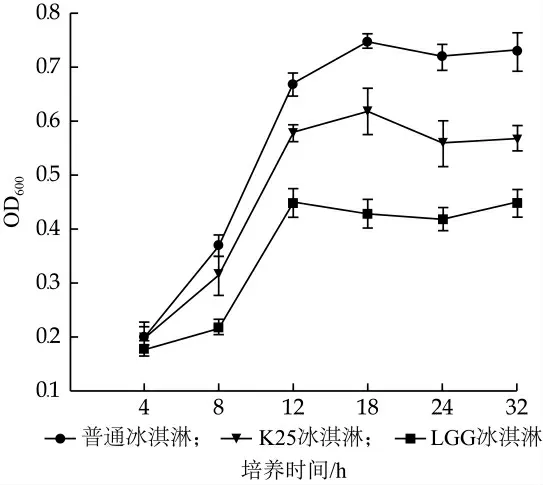
图1 冰淇淋浆料对变异链球菌生长的影响
2.3 冰淇淋对变异链球菌生物膜形成的影响
口腔菌群主要存在于口腔表面的生物膜中[37], 变异链球菌借助生物膜黏附于口腔和牙齿表面形成病原微生物群落[38]。研究考察了冰淇淋浆料对变异链球菌生物膜形成的影响, 结果如图2所示。3种冰淇淋对变异链球菌的生物膜抑制率均为负值, K25冰淇淋组和LGG冰淇淋组生物膜量比普通冰淇淋组分别降低了22.3%和17.15%(P<0.05), 表明食用3种冰淇淋都会导致口腔变异链球菌生物膜的形成, 但K25冰淇淋和LGG冰淇淋生物膜形成量比普通冰淇淋少。这与已报道的培养基中K25菌株生物膜正向抑制率约40%~60%存在较大差异[28]。变异链球菌生物膜的形成与培养基质中糖的含量和组成有关。研究显示, 虽然过高的糖浓度(40%)对变异链球菌生物膜的合成有抑制作用, 但在0~20%糖浓度下, 变异链球菌能够高效合成生物膜[39], 且随着糖含量的增加, 变异链球菌的抗逆性逐渐增强[40]。Nagasawa研究还发现, 果糖和蔗糖在诱导变异链球菌生物膜合成上具有协同效应[41], 通过同时刺激变异链球菌葡萄糖和果糖转移酶的表达, 加速生物膜的合成[42]。本实验冰淇淋浆料上清中果糖、蔗糖和乳糖总质量百分比达17%, 远高于报道的培养基生物膜抑制实验中2%的糖浓度, 这可能是导致差异的主要原因, 该结果也反映出针对冰淇淋基质研究生物膜形成的必要性。
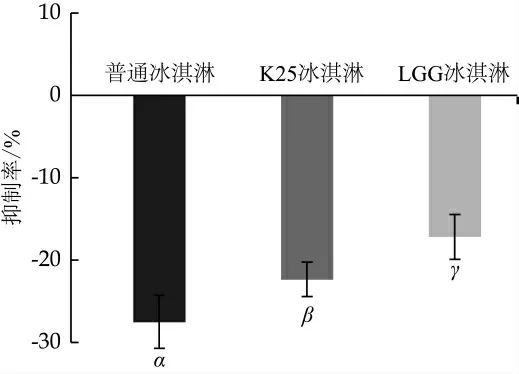
图2 冰淇淋浆料对变异链球菌生物膜形成的影响
2.4 冰淇淋对变异链球菌表面黏附能力的影响
黏附是变异链球菌口腔定植的基础。3种冰淇淋对变异链球菌光滑表面的黏附影响如图3所示, 普通冰淇淋浆料中的变异链球菌黏附率为61.29%, 高于K25冰淇淋的43.21%和LGG冰淇淋的35.19%。这表明K25和LGG发酵的冰淇淋浆料能有效降低变异链球菌的黏附。黏附于牙齿表面是病原微生物破坏口腔健康的第一步, 口腔医学常采用改变牙齿表面特性的方法降低变异链球菌的黏附[43]。益生菌主要通过抑制变异链球菌活性和生物膜的形成来降低其黏附能力[44]。K25冰淇淋和LGG冰淇淋降低变异链球菌的黏附的结果与前述二者对变异链球菌及其生物膜抑制活性研究结果一致。
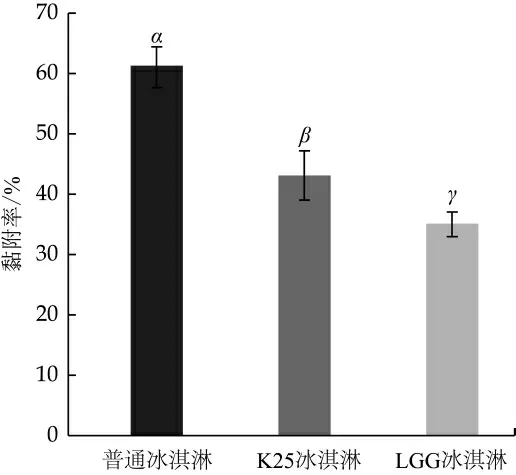
图3 冰淇淋浆料对变异链球菌黏附能力的影响
2.5 益生菌冰淇淋对口腔菌群的影响
为进一步明确益生菌冰淇淋对口腔菌群的影响, 研究采集、分析了12名受试者(A, B, C, D, E, F, G, H, I, J, K, L)未食用冰淇淋、食用普通冰淇淋、食用K25冰淇淋和食用LGG冰淇淋后人体唾液中细菌组成和丰度的变化, 研究实验分组及样品详细信息见表2。
2.5.1 冰淇淋对受试者口腔菌群整体影响分析
个体唾液微生物组具有较好的时间稳定性被证明能有效表征口腔菌群的多样性[45]。研究对48个唾液样本中的细菌组16S rDNA的V3-V4区测序, 共获得1752416条reads, 平均36508 reads/样, OTU数量801个。将总量低于4, 流行度(prevalence)低于10%的OTU去除后, 获得OTU312个, 以下分析皆以处理后的OUT数据开展。Chao1、observed_species和稀释曲线如图1, 显示样品中的绝大部分微生物已经被捕获, 结果具有代表性。
冰淇淋对口腔菌群alpha多样性的影响如图4(a)所示, 普通冰淇淋组>未食用冰淇淋组>K25冰淇淋组>LGG冰淇淋组, 表明食用普通冰淇淋后口腔菌群的多样性会增加, 而食用含有含有益生菌K25或LGG的冰淇淋后口腔菌群的多样性均降低。口腔菌群的Beta多样性(PCoA)分析显示如图4(b), Axis1和Axis2在水平和垂直方向分别能够解释39%和27.6%的样品间的菌群差异(P<0.001), 正常人口腔菌群(Normal)样品所示主要沿Axis2分布, 在Axis1水平方向变化较小, 食用普通冰淇淋(IceCream)和K25冰淇淋(K25-IceCream)后样品主要沿Axis1分布, 表明口腔菌群发生了显著改变, LGG冰淇淋组(LGGIceCream)口腔菌群的变化介于二者之间, 略偏向于未食用冰淇淋组人群。益生菌影响口腔多样性的能力主要与其抑菌谱有关, 抑菌谱广的益生菌一般会降低菌群的多样性。本实验中的LGG菌株抑菌谱较广, 对变异链球菌、沙门氏菌、金黄色葡萄球菌、志贺氏菌、大肠杆菌、Candida albicans[46-47]等均具有较好的抑制活性, 因此可以显著减少口腔细菌总数, Rungsri等人有关LGG发酵乳对口腔菌群的营养研究也证实了这一点[48]。K25菌株抑菌谱相对较窄, 目前仅发现对变异链球菌具有较好的抑制活性, 这可能是造成LGG冰淇淋组口腔菌群多样性降低的幅度大于K25冰淇淋组的原因。
基于样品的Bray-Curtis距离的Ward聚类法分析结果也表明, 冰淇淋和益生菌对受试者口腔菌群具有显著影响, 不同受试者在食用相同的冰淇淋后口腔菌群表现出了较高的相似性, 如图4(c)。聚类后将受试样本分为3层分支4大组, 各组中的样本吃几乎都是同一种冰淇淋, 第一层级分支可将受试样本分为食用冰淇淋和未食用冰淇淋两大类, 第二层级将受试样本进一步分为食用普通冰淇淋和含有K25或LGG益生菌的冰淇淋。一些受试个体口腔菌群表现出了较高的稳定性如C1、C2、C3和D3、D4分类后样本间离较近, 表明不管使用哪种冰淇淋其口腔菌群变化不大, 但总的来看, 冰淇淋和益生菌对口腔菌群变化起到了关键作用。Belstrm等研究也显示个体口腔菌群具有较大的特异性和稳定性[45]。
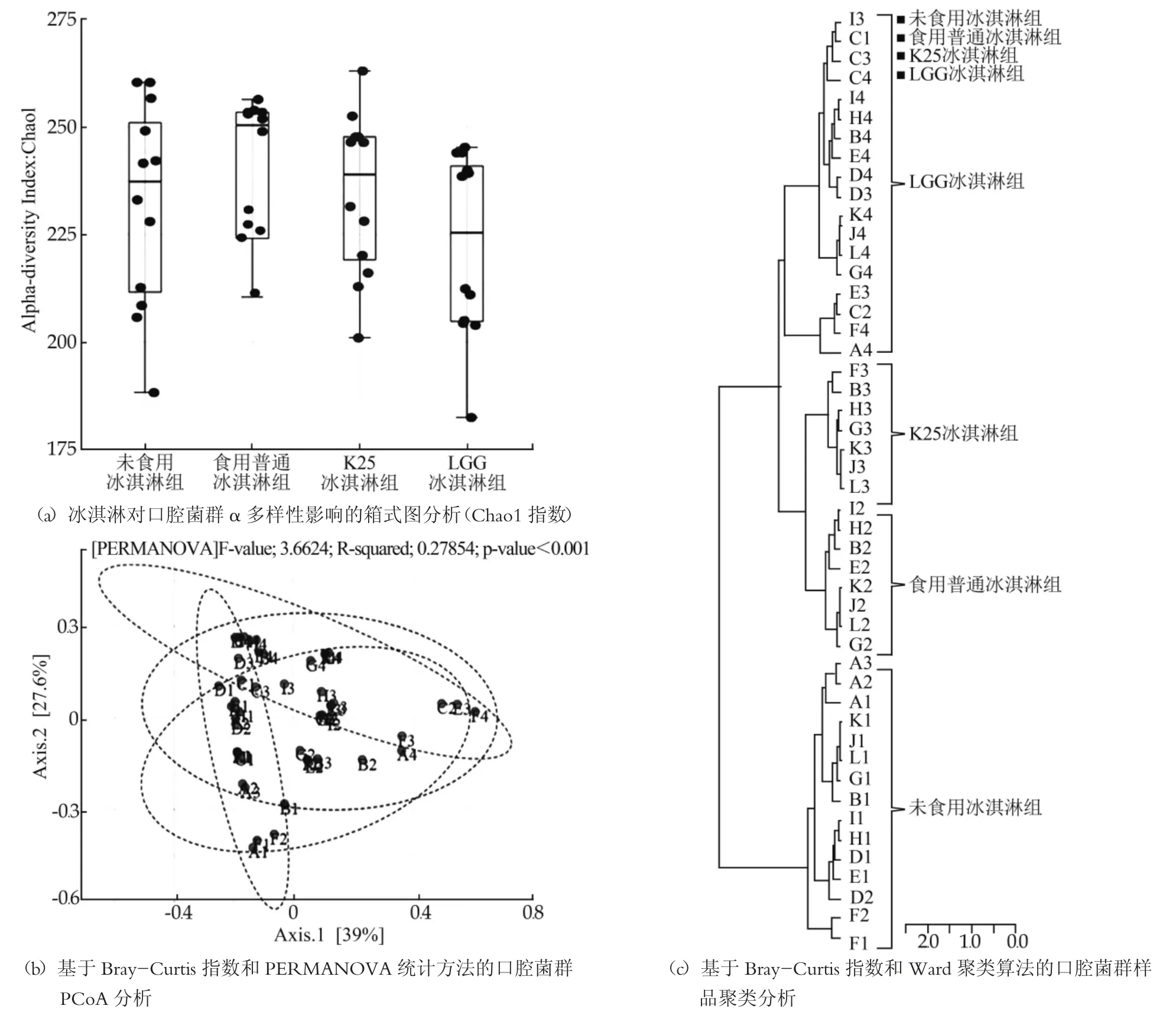
图4 口腔菌群的整体变化
2.5.2 RDA分析益生菌冰淇淋对口腔菌群的影响
为了明确菌株和冰淇淋等环境因素各自对口腔菌群的影响, 研究采用RDA限制性分析方法研究了植物乳杆菌K25、鼠李糖乳杆菌GG和冰淇淋等各因素对口腔菌群属水平的影响, 结果如图5所示。Axis1解释了变量间差异的60.67%, Axis2解释了20.14%, 统计检验P<0.05。通过限定在Axis1上的解释度>20%, 我们确定了112个关键的属。分析它们与食用冰淇淋和益生菌的关系可发现, 冰淇淋和菌株K25与口腔中绝大多数的菌群丰度正相关, 表现为大部分菌群分布于二者所在的第一象限, 同理LGG菌株和不食用冰淇淋因素会降低口腔菌群的丰度, 这与前述alpha多样性的分析相符。进一步比较菌株K25和LGG对其它菌属的影响的显著性(见表4)发现, K25对低丰度菌属的影响较大, LGG对高丰度菌属的影响较大, LGG对口腔的核心菌群(见表1)中的Veillonella, Streptococcus, Anoxybacillus, Tepidimonas, Porphyromonas和Comamonas有显著影响(P<0.05)。另外LGG与Streptococcus丰度负相关, 显示LGG益生菌冰淇淋可能对由Streptococcus mutans引起的口腔菌群失调和疾病具有一定的干预效果[49]。

表4 菌株K25和LGG与口腔菌群(属)丰度相关性分析

图5 益生菌冰淇淋对口腔菌群影响的冗余分析
2.5.3 益生菌冰淇淋对口腔菌群的影响模式(门、属水平)
在明确益生菌和冰淇淋因素对口腔菌群组成和多样性的影响后, 我们尝试通过比较受试者个体口腔高丰度菌在门和属水平上的变化, 研究益生菌冰淇淋对口腔菌群的影响模式。由图6所示, 12名受试者不同时间点口腔菌群由15个菌门构成, 其中丰度较高的菌门有7个, 占口腔菌群总丰度的98.76%, 依次为Firmicutes(34.03%), Proteobacteria(26.23%), Bacteroidetes(19.18%), Actinobacteri(7.08%), Deinococcus(5.89%), Fusobacteria(3.99%)和Candidatus(2.36%)。Firmicutes, Bacteroidetes, Actinobacteri, Deinococcus_Thermus, Fusobacteria, Candidatus_Saccharibacteria。观察12名受试者各菌门丰度变化发现, 食用普通冰淇淋和K25冰淇淋后口腔中的Firmicutes, Proteobacteria, Actinobacteria和Deinococcus菌门的丰度增加, Bacteroidetes和Candidatus菌门的丰度降低;而食用LGG冰淇淋后口腔中的Proteobacteria菌门丰度增加, 而Firmicutes, Bacteroidetes和Candidatus菌门丰度降低, 即LGG冰淇淋具有独特的菌群调节模式。另外, LGG菌株自身为Firmicutes菌门, 摄入富含该菌株的冰淇淋后, Firmicutes丰度反而降低, 表明LGG冰淇淋一定对同为Firmicutes菌门的其它菌株产生了强抑制作用。
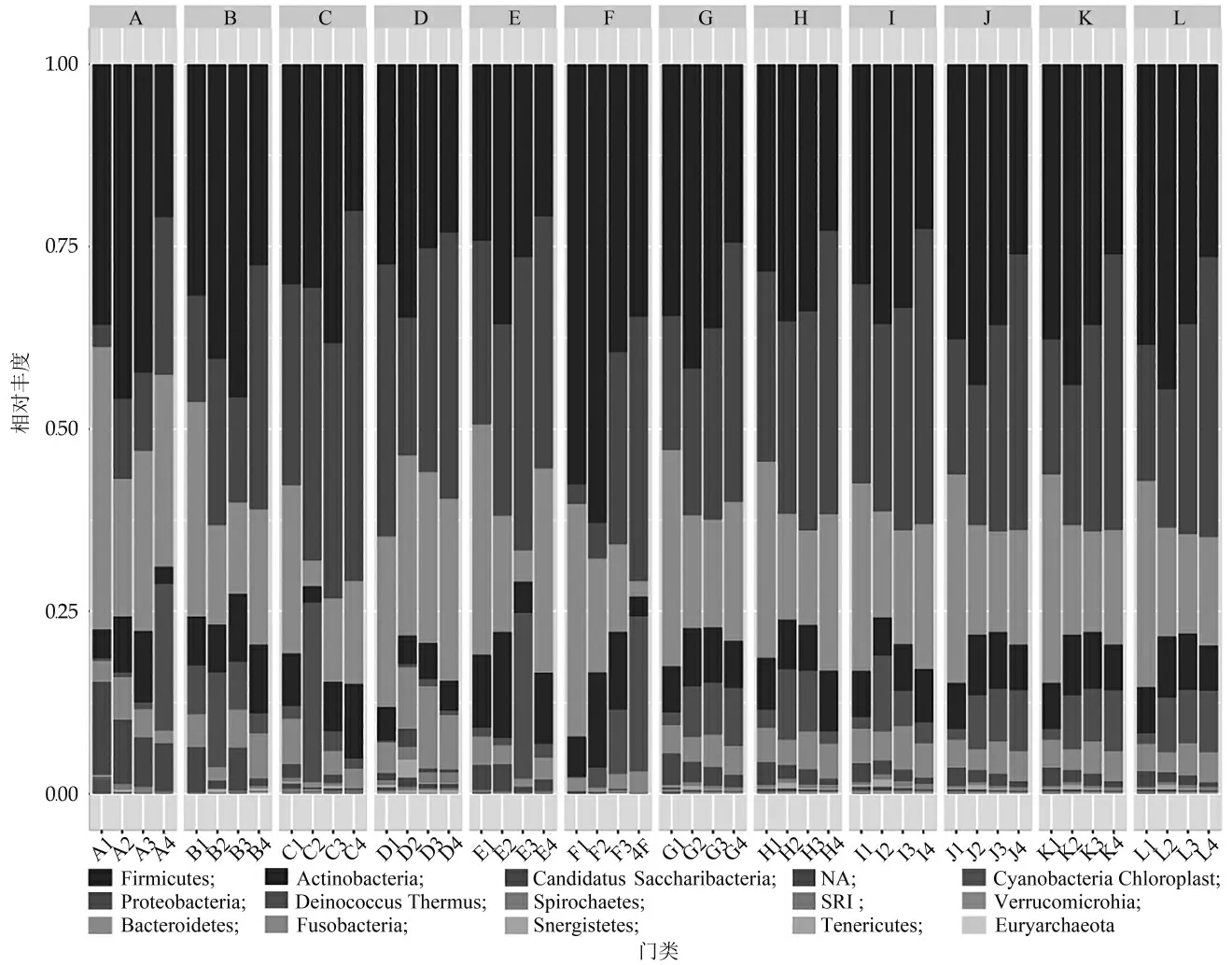
图6 口腔菌群组成和相对丰度的柱状堆积图(门)
研究证明Firmicutes在口腔组织表面和唾液微生物群落中占主导地位, 其次是Proteobacteria, Bacteroidetes, Actinobacteri和Fusobacteria[50]。门水平的变化是由专性厌氧菌属Fusobacterium, Prevotella,和Treponema等相对丰度的增加所驱动。牙菌斑分类群分布更为均匀, 主 要 为Firmicutes, Bacteriodetes,, Actinobacteria, Proteobacteria和Fusobacteria等菌门。本研究受试者食用益生菌冰淇淋后口腔高丰度菌门与之保持一致。
口腔菌群在属和种水平上与健康和多种疾病相关[51]。因此, 我们分析了益生菌冰淇淋对12位受试者口腔高丰度菌属(平均相对丰度>1%)的影响, 如图7所示, 高丰度菌属有15个, 占口腔菌群总丰度的87.03%, 依次为Streptococcus(12.06%), Veillonella(11.62%), Prevotella(11.41%), Haemophilus(10.30%), V29(8.58%), Thermus(5.77%), Neisseria(5.26%), Rothia(4.39%), Anoxybacillus(4.30%), Tepidimonas(2.69%), Porphyromonas(2.63%), Saccharibacteria(2.23%), Fusobacterium(2.23%), Actinomyces(1.79%)和Leptotrichia(1.77%)。结合表4可知, K25冰淇淋在属水平上对高丰度菌属的影响不显著;而LGG冰淇淋能显著降低Veillonella和Streptococcus的丰度, 增加Anoxybacillus和Tepidimonas丰度(P<0.05), 显示出在属水平上也具有较强的口腔菌群调节能力, 这与前述RDA分析的结果一致。研究表明, Streptococcus是与口腔健康相关的主要菌属, 这与先前对口腔健康个体唾液样本进行的研究一致[52]。对Streptococcus和Veillonella两个高丰度菌属的抑制作用解释了为什么摄入LGG冰淇淋后, Firmicutes菌门丰度反而降低, 因为3者同属于Firmicutes菌门, LGG对Veillonella和Streptococcus的强抑制作用抵消了自身对Firmicutes菌门丰度的贡献。本研究采集食用冰淇淋后不同时间点的样本进行菌群分析, 表明食用不同冰淇淋后不同时间对于口腔菌群的组成变化没有显著差别。Belstrom在研究中也表明, 唾液微生物群的组成基本上没有变化[53], 即口腔健康与不同的唾液细菌的特征相关, 与采样时间无关[52,54]。

图7 口腔菌群组成和相对丰度的柱状堆积图(属)
尽管口腔菌群构成个体差异较大, 但Veillonella是绝大多数人口腔中丰度最高的菌群, 这也被众多研究所证明[55], 它的核心功能是合成众多口腔菌群生长必须的血红素, 对口腔菌群的稳定具有重要作用[56]。LGG冰淇淋对该菌属具有显著抑制作用, 解释了其较强的降低口腔菌群多样性的作用。Porphyromonas和Tepidimonas是与牙周炎发病相关的菌属, Porphyromonas gingivalis, Tannerella forsythia和Treponema denticola被合称为“Red complex”[57], 可在慢性牙周炎患者口腔同时分离到3者[58], 其中Porphyromonas gingivalis是3者中的核心病原菌, 它能够刺激巨噬细胞, 过度激活固有免疫系统, 使其攻击口腔菌群, 导致口腔菌群紊乱和炎症[59]。Anoxybacillus是口腔的常见菌属, 在母体的口腔、羊水和肠道中具有较高丰度, 是婴幼儿早期获得的口腔菌群之一[60], 但其与人体健康和疾病的关系还不明确, Jiang等在健康猪口腔中发现了大量该菌属[61]。LGG冰淇淋在多个受试者中, 变现出对上述高丰度核心菌群的相似影响规律, 显示其能够定向的调节口腔菌群, 尤其对龋齿和牙周炎相关菌群可能具有较好的干预能力。
3 结论
体外研究显示, K25冰淇淋和LGG冰淇淋均能显著降低变异链球菌活性、抑制其生物膜形成和表面黏附。冰淇淋能够在短时间内显著改变食用者口腔的菌群结构导致多样性增加, 仅LGG能有效降低冰淇淋对口腔菌群多样性的影响, 食用K25冰淇淋和普通冰淇淋会增加口腔菌群多样性。Beta多样性结果也显示LGG冰淇淋组的口腔菌群结构与未食用冰淇淋组相近。RDA分析显示, K25冰淇淋对低丰度菌属影响更大, 而LGG冰淇淋对高丰度菌属影响更大(P<0.05), LGG主要通过降低核心菌Veillonella的丰度来调节口腔菌群。总的来看, 含有益生菌K25和LGG的冰淇淋表现出了定向调节口腔菌群能力, 对龋齿和牙周炎相关菌群(Streptococcus等)表现出了较强的抑制作用, 其中LGG的作用更强。
