野生薄皮木组培快繁体系优化
2022-10-28朱飞雪寇艳玲常介田河南农业职业学院郑州451450
郭 丽, 朱飞雪, 寇艳玲, 常介田(河南农业职业学院, 郑州 451450)
薄皮木(LeptodermisoblongaBunge)为茜草科(Rubiaceae)野丁香属(Leptodermis)落叶小灌木,在我国主要分布在华北,西至陕西汉中,南至河南北部。薄皮木根系发育快,入土深度可达1~1.5 m,故其具有较强的抗旱耐寒能力,适应能力强,一般生于海拔1 300 m以下的石质山坡上。薄皮木花期6~9月,花繁枝多,花色鲜艳、花期长、花香四溢,是一种极具观赏价值的野生乡土植物,可作为观赏、绿化、盆景等栽培。但野生薄皮木仍处于野生状态,未能开发利用,限制了其推广应用的速度和地域范围。
目前国内外学者对于野生薄皮木的研究主要集中在其化学成分及抗炎活性的研究[1-2],种子萌发特性[3-4],叶表皮形态特征[5-6]等方面。由于薄皮木是一种野生观赏植物,传统的繁殖方法是采用种子繁殖和扦插繁殖,但是种子繁殖萌芽率低且不能稳定保持母本性状[4],扦插和埋条繁殖率低[7]。组织培养技术具有后代遗传稳定、繁殖速度快和繁殖系数高等特点[8],因此,运用组织培养技术可以快速繁育与母本性状一致的良种,并且在短时间内能得到大量无菌苗及种质资源的保存。耿宵等[9]以野生观赏植物薄皮木茎段为外植体,最适诱导培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L,最适增殖培养基为MS+6-BA 5.0 mg/L+NAA 0.1 mg/L,初步建立野生薄皮木组培体系。但是原产地不同,不同品种间诱导率、增殖率和生根率不同,植物生长调节剂的种类、浓度配比不固定,从而导致不同品种快繁体系关键技术存在差异性。因此,针对不同野生植物优良品种建立相应的组培快繁体系是必要的。本研究以野生薄皮木带芽茎段为外植体,以6-BA(6-苄氨基嘌呤)、NAA(萘乙酸)、IBA(吲哚丁酸)、ZT(玉米素)设置不同的浓度配比,研究其对不定芽诱导、增殖、生根的影响,确立野生薄皮木组培快繁过程中不同时期的最适培养条件,建立野生薄皮木组织培养再生体系,从而为其大规模繁育、引种驯化、栽培等提供一定的理论基础和技术支持,并为野生植物资源早日在园林中推广应用提供科学依据。
1 材料和方法
1.1 试验材料
供试材料野生薄皮木采自太行山深处的林州石板岩地带,种植于河南省农业高新科技园区试验基地,在河南农业职业学院组织培养实验室进行试验。
1.2 外植体处理
采集生长良好的薄皮木带腋芽茎段,去除叶片,将嫩枝剪成带有2~4个腋芽的小段。将其放入烧杯中,加入少许洗洁精并在烧杯上面盖一层纱布,自来水流水冲洗30 min,然后用无菌水冲洗3~4遍,将供试材料放入超净工作台备用。
1.3 外植体消毒与启动培养
将清洗晾干的茎段分别用不同消毒剂组合进行消毒处理(表1),再用无菌水冲洗5~6次后接入MS培养基上,接种时将茎段两端剪掉,防止茎段两端被消毒剂毒害,影响外植体的正常生长[10]。每个处理接种30瓶,每瓶接种1个茎段。20 d后统计成活率、污染率、死亡率。
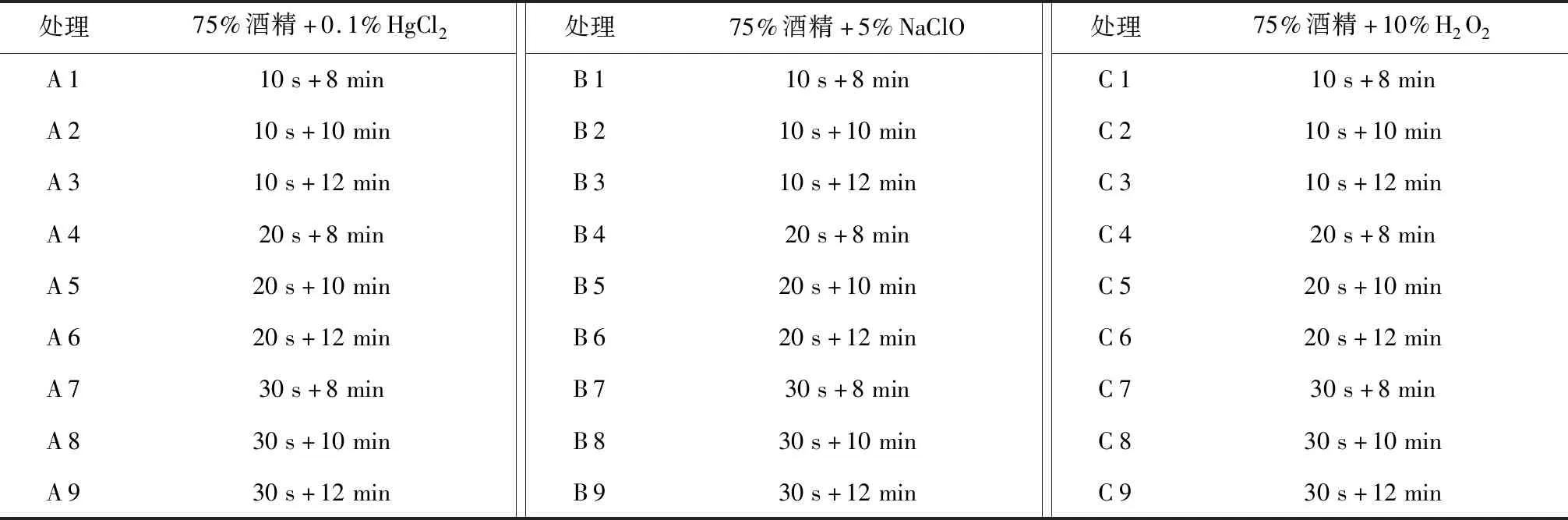
表1 不同消毒剂处理时间Table 1 Different disinfectant treating time
1.4 增殖培养
待初代培养的幼芽长至1~2 cm时,将其切下接种在添加6-BA(0.5、1、2、3、5 mg/L)、NAA 0.1 mg/L、ZT(0.5、1、2、3 mg/L)激素的MS培养基上进行增殖培养。每个处理接种30瓶,每瓶接种1个外植体,30 d后统计各处理芽的增殖率及幼芽生长状况。
1.5 生根培养
当增殖培养基上的幼芽长至2~3 cm时,将其切至生根培养基进行生根诱导试验,以1/2 MS为基本培养基,添加NAA 0.1 mg/L、NAA 0.5 mg/L、IBA 0.1 mg/L、IBA 0.5 mg/L、IBA 0.1 mg/L+NAA 0.05 mg/L、IBA 0.1 mg/L+NAA 0.1 mg/L不同浓度激素。每个处理接种15瓶,每瓶接种2个芽体。30 d后统计各处理的生根率及根的生长状况。
1.6 炼苗移栽
选用生根培养60 d后生长健壮、根系发育良好的组培苗进行炼苗移栽。30 d后统计成活率。
1.7 培养条件
诱导和增殖培养基以MS为基本培养基,生根培养基以1/2 MS为基本培养基,其中添加琼脂6 g/L,蔗糖30 g/L,pH=5.8,分别加入不同浓度激素配比。培养室温度为(25±1)℃,光照时间16 h,光照强度2 500 lx。
污染率(%)=(污染的外植体数/接种的总外植体数)×100%;
萌芽率(%)=(萌芽外植体数/接种的总外植体数)×100%;
未萌芽率(%)=(腋芽未萌发的外植体数/接种外植体数)×100%;
增殖系数=增殖芽数/接种芽数;
生根率(%)=(生根苗数/接种苗数)×100%。
1.8 数据统计
试验数据采用Excel 2007数据分析工具进行单因素方差分析, Duncan新复极差法(LSR)进行多重比较分析,所有测定结果用平均值和标准误来表示。
2 结果与分析
2.1 消毒剂种类和消毒时间对外植体萌芽的影响
消毒剂种类和消毒时间不同,对外植体萌芽效果不同。将外植体放入不同种类消毒剂,经过不同消毒时间处理后,其萌芽率、污染率和未萌芽率存在显著差异(表2、表3、表4)。
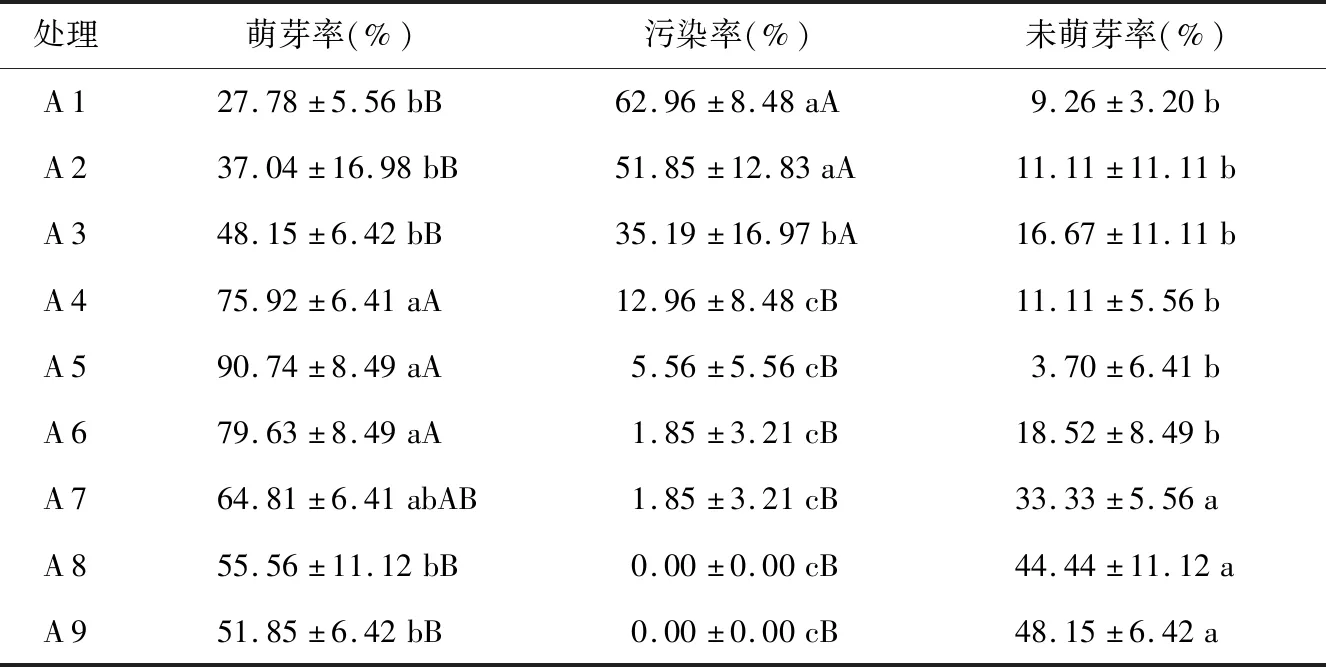
表2 不同酒精、HgCl2处理时间对野生薄皮木茎段萌芽的影响Table 2 Effects of different alcohol and HgCl2 treatment time on the growth of wild Leptodermis oblongaBunge. stem segment
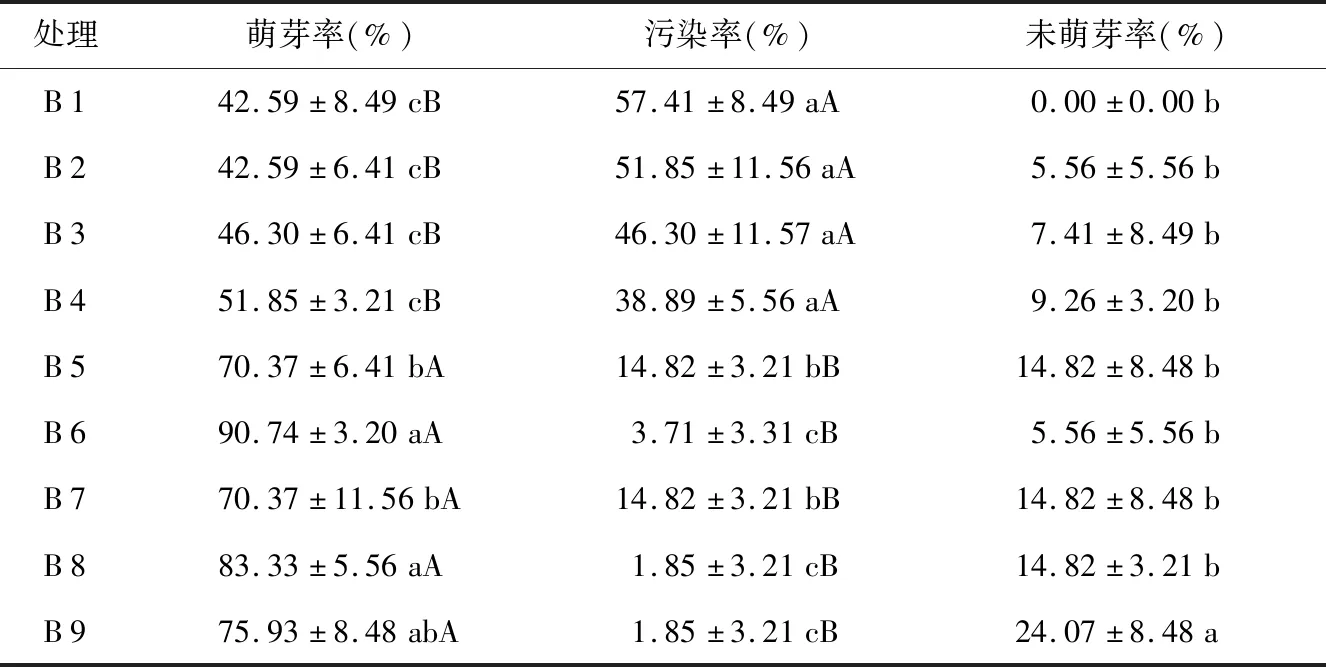
表3 不同酒精、NaClO处理时间对野生薄皮木茎段萌芽的影响Table 3 Effects of different alcohol and NaClO treatment time on the growth of wild Leptodermis oblonga Bunge. stem segment
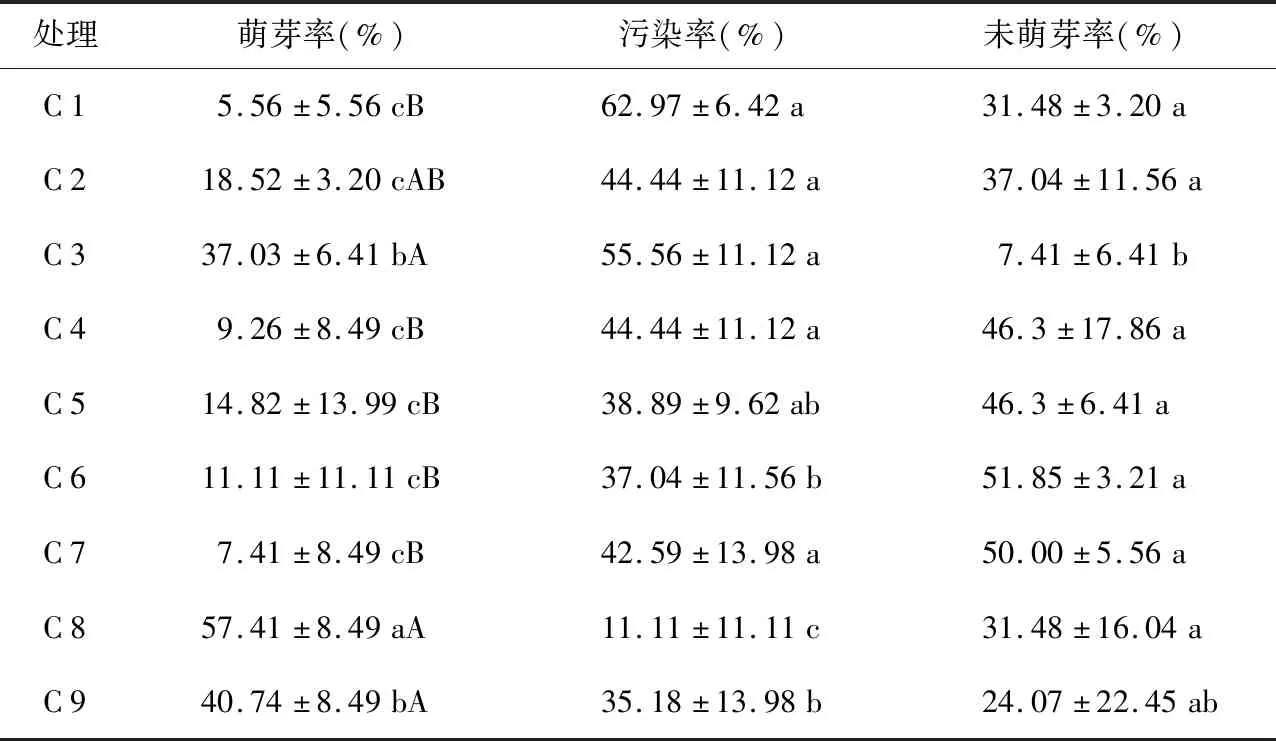
表4 不同酒精、H2O2处理时间对野生薄皮木茎段萌芽的影响Table 4 Effects of different alcohol and H2O2treatment time on the growth of wild Leptodermis oblongaBunge. stem segment
从表2可知,酒精和HgCl2消毒时间的长短对外植体萌芽都有显著影响。随着酒精和HgCl2消毒时间的延长,外植体萌芽率呈先升后降的趋势,外植体的污染率呈下降趋势,当酒精消毒时间为30 s时,外植体未萌芽率显著高于酒精消毒时间10 s和20 s。表明酒精消毒可有效抑制外植体的污染,但消毒时间过长会对外植体造成毒害作用,酒精消毒相同时间下,HgCl2消毒时间过长会对外植体萌芽造成抑制作用。当酒精消毒时间为20 s和HgCl2消毒时间为10 min时,外植体萌芽率为90.74%,且此条件下污染率较低,为5.56%;当外植体酒精消毒30 s和HgCl2消毒10 min、12 min时,虽然污染率为0,但其萌芽率显著低于A 5。因此,酒精消毒20 s和HgCl2消毒10 min为外植体消毒最佳组合。
从表3可知,除B 9外,随着酒精和NaClO消毒时间的延长,萌芽率呈上升趋势。随着酒精和NaClO消毒时间延长至30 s和12 min时,虽然与酒精和NaClO消毒时间20 s和10 min的萌芽率差异不显著,但从数据分析看,其萌芽率开始降低,且未萌芽率与其他处理存在显著性差异。NaClO消毒时间8 min时,污染率高,萌芽率低。NaClO消毒12 min、酒精消毒20 s时,萌芽率达到90.74%,且此条件下污染率较低,为3.71%,未萌芽率5.56%。因此,NaClO 12 min和酒精20 s为消毒最佳组合。
从表4可知,酒精和H2O2处理对野生薄皮木茎段消毒效果不佳,整体萌芽率低,污染率和未萌芽率高,在野生薄皮木茎段消毒中不适合应用。
2.2 不同生长调节剂对不定芽增殖的影响
将未污染、生长一致初代培养的茎段(图1 A)接至添加不同浓度和不同生长调节剂的MS培养基上。由表5可知,不同培养组合上的不定芽长势不同。当在培养基中加入0.5 mg/L 6-BA和0.1 mg/L NAA时,侧芽生长慢,无增殖现象;当在培养基中加入1.0 mg/L 6-BA和0.1 mg/L NAA时,侧芽生长较慢,基本无增殖现象;当6-BA浓度增大至2.0 mg/L时,侧芽生长速度加快,第5天有侧芽萌发;当6-BA浓度增大至5.0 mg/L时,侧芽生长速度加快,茎段膨大,叶片黄绿色,且叶片玻璃化,再生芽生长势差(图1 D),说明激素浓度过高,会对侧芽产生一定的毒害作用,试验发现,此浓度新发侧芽叶片上还有愈伤发生。6-BA 3.0 mg/L增殖系数无6-BA 5.0 mg/L高,但它们之间无显著差异,而且侧芽生长正常,叶片绿色(图1 B、C)。在6-BA和NAA生长调节剂组合中,以添加6-BA 3.0 mg/L和0.1 mg/L NAA的培养基(图1 E)为理想增殖培养基。
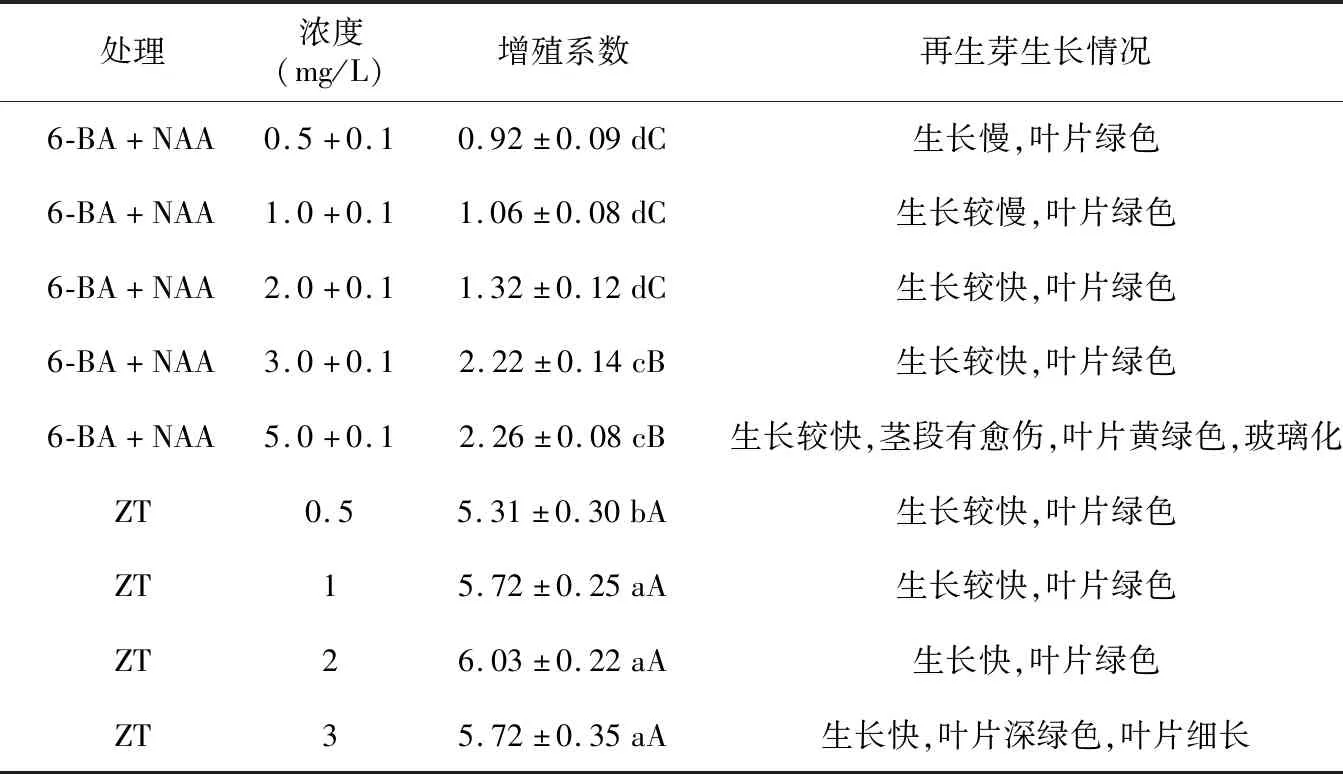
表5 不同生长调节剂对增殖培养的影响Table 5 Effects of different plant growth regulators on the proliferation culture
在6-BA和NAA植物生长调节剂组合中发现,6-BA浓度低,增殖系数低,6-BA浓度高时又发生玻璃化和叶片生长不正常现象,且增殖系数不高。预备试验发现,ZT增殖系数较好,且单独使用ZT增殖效果好。通过添加ZT试验发现,侧芽增殖系数高,随着ZT浓度的增大,在ZT 2.0 mg/L时出现峰值,随着ZT浓度加大,增殖系数呈下降趋势。ZT 1.0 mg/L和2.0 mg/L增殖系数无显著差异,使用不同浓度ZT的侧芽生长势均好。因此,从经济价值和使用效果综合考虑,以MS+ZT 1.0 mg/L(图1 F)为野生薄皮木最佳增殖培养基。
2.3 不同植物生长调节剂浓度对组培苗生根的影响
生根培养以1/2 MS为基本培养基,添加不同浓度IBA或NAA及二者组合。由表6可知,植物生长调节剂及浓度不同,对野生薄皮木组培苗生根效果不同。在添加NAA的培养基中,组培苗无生根现象,生根率0。在添加IBA的培养基中,生根组培苗根系细而长,有侧根生成,在添加0.1 mg/L IBA的培养基中,其根长大约2 cm,茎基部形成块状愈伤时,无根形成,生根率60%(图1 G);当IBA浓度为0.5 mg/L时,其生根率降低,根少、细而长。在NAA和IBA组合试验中发现,其生根效果比单独使用一种植物生长调节剂生根率高,在IBA 0.1 mg/L和NAA 0.05 mg/L时,生根率100%,根系粗壮,根长适中,有侧根,生长健壮(图1 H)。当IBA浓度为0.1 mg/L和NAA浓度为0.1 mg/L时,随着植物生长调节剂浓度的增加,生根率降低,根粗壮而短,生长慢。因此,野生薄皮木最佳生根培养基为1/2 MS+IBA 0.1 mg/L+NAA 0.05 mg/L。

注:A为初代培养;B~D为增殖培养初期;E~F为增殖培养中期;G~H为生根培养;I为移栽组培苗。图1 野生薄皮木组织培养过程Fig.1 Tissue culture of wild Leptodermis oblonga Bunge.
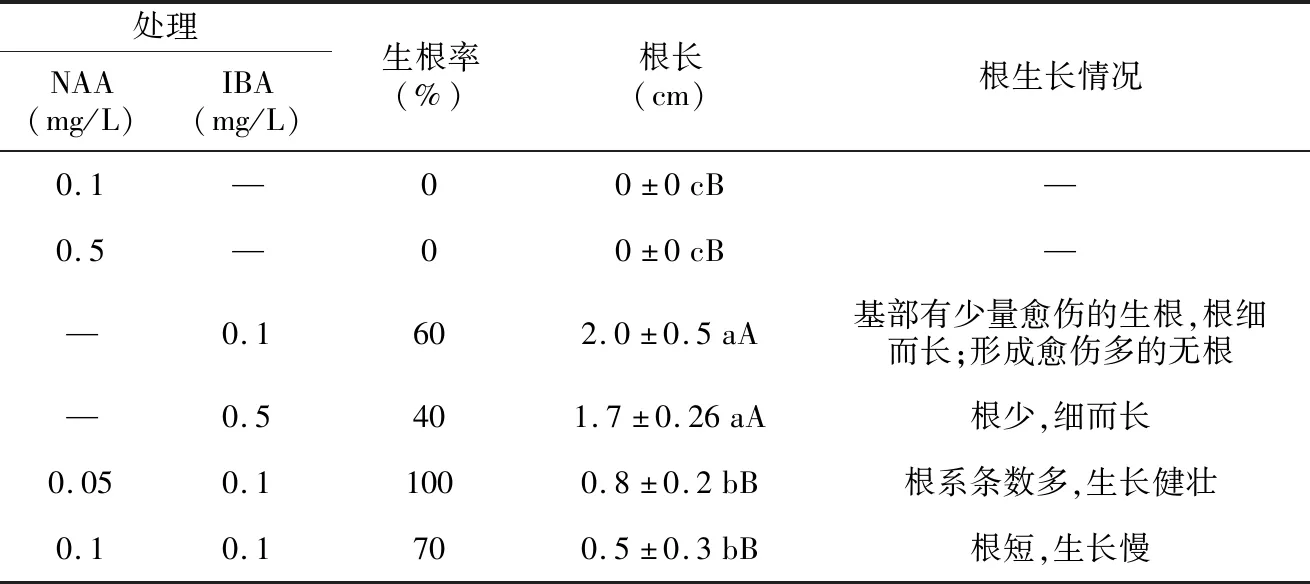
表6 不同浓度NAA和IBA对组培苗生根的影响Table 6 Effects of different NAA and IBA concentrations on rooting culture
2.4 组培苗成活率
将野生薄皮木生根组培苗移至室温、自然光下经过5 d驯化炼苗后,将苗取出,取出时小心不要伤根,洗净根部培养基,移栽至草炭∶蛭石∶珍珠岩=3∶1∶1消毒后的基质中,栽好后先放在遮荫的环境中,等缓苗后进行正常环境条件管理,60 d后植株生长良好,移栽成活率达90%以上(图1 I)。
3 结论与讨论
外植体消毒是获得无菌材料的关键因素,选择不同的消毒剂种类和消毒时间尤为重要[11-12]。目前,常用的消毒剂有酒精、0.1%HgCl2、NaClO(2%~5%)和10%H2O2等。由于酒精具有使植物材料表面浸湿的作用,常与其他消毒剂配合使用,但70%~75%的酒精穿透力强,也很易杀死植物细胞,所以酒精消毒浸泡时间不宜过长,因此,本试验酒精消毒时间设置为10 s、20 s和30 s三个梯度,分别与HgCl2、NaClO和H2O2配合使用。选择茎段作为外植体,应选择茎段达到中度木质化[13],木质化程度高低都不利于芽的萌发,外植体采集时间以春秋季节污染率低于夏冬季节[14]。野生薄皮木外植体消毒试验发现,5月份用75%酒精和5%NaClO溶液消毒外植体,75%酒精20 s和5%NaClO 12 min可以有效控制外植体污染率,而8月份和11月份用75%酒精30 s和5%NaClO 20~30 min进行外植体消毒,其污染率达到50%~60%。在三组消毒组合中,H2O2与酒精消毒外植体最高萌芽率为57.41%;75%酒精20 s与0.1%HgCl210 min消毒外植体茎段最高萌芽率为90.74%;75%酒精20 s与5%NaClO 12 min消毒外植体茎段最高萌芽率为90.74%。但由于HgCl2在消毒中会有残留,对植物材料有毒害作用,且会污染环境[15]。因此,本试验得出野生薄皮木茎段消毒最佳组合为75%酒精20 s+5%NaClO 12 min。此外,试验发现,野生薄皮木茎段2%NaClO消毒效果不及5%NaClO,这可能是野生薄皮木茎段为木本,需要消毒剂浓度高的原因。
外植体的萌发受年龄、生理状态、采集时期等多种因素有关[16]。试验发现,春季外植体萌芽率高,这可能是处于萌动状态的外植体容易诱导萌芽。植物生长调节剂种类及浓度对不定芽的诱导和增殖具有很大影响。离体培养常用的植物生长调节剂有6-BA、NAA、IAA、GA3等[17],一般认为6-BA利于不定芽外植体的分化。因此,本试验选用在MS培养基中加入6-BA和NAA两种植物生长调节剂。通过5组不同植物生长调节剂浓度对比试验发现,两种植物生长调节剂的配比对不定芽的增殖系数不高,植物生长调节剂浓度低时,几乎无增殖现象;植物生长调节剂浓度高时,增殖系数增高,当6-BA浓度达到5 mg/L时,增殖系数为2.26,但出现侧芽叶片黄绿色,玻璃化现象严重,侧芽叶片上有愈伤发生。在MS培养基中加入ZT进行预备试验发现,ZT浓度0.1 mg/L和0.2 mg/L时芽的增殖效果不佳,因此设置ZT浓度梯度从0.5 mg/L开始,ZT 1 mg/L增殖系数为5.72,ZT 2 mg/L增殖系数为6.03,当ZT浓度增加至3 mg/L时,增殖系数降低,说明植物生长调节剂浓度过大时,对侧芽的增殖有抑制作用。在添加ZT的增殖培养基中,侧芽增殖效果显著,叶片绿色,无玻璃化现象。由于ZT 1 mg/L 和ZT 2 mg/L增殖系数差异不显著,综合各种因素,野生薄皮木侧芽增殖培养以MS+ZT 1 mg/L为 最佳培养基。这与肖海峻等[18]利用ZT对于蓝莓茎段侧芽增殖研究结果一致。
生根培养是组织培养的重要一步,只有能正常生根的幼苗才能最终形成完整的植株[19]。植物组织培养生根培养常以1/2 MS为基本培养基,NAA和IBA在生根诱导中应用较多,通常较低浓度生长素利于外植体生根,浓度过高则抑制生根。本试验以单独使用NAA则无根系的生成,生长素IBA在多种植物不定根诱导中起到较好的作用[20]。试验表明,IBA生根作用较强,但根系细而长,在转接培养时,根系易脱落;NAA和IBA配合使用,则发根数量多且根系粗壮,这与黄烈健等[21]对马大杂种相思生根研究结果一致。
半木质化带芽茎段是野生薄皮木再生体系的适宜外植体材料,诱导腋芽萌芽率为90.74%。带芽茎段适宜的消毒方法为先用75%酒精消毒20 s,再用5%NaClO消毒12 min。野生薄皮木再生体系适宜增殖培养基为MS+ZT 1 mg/L,适宜生根培养基为1/2 MS+IBA 0.1 mg/L+NAA 0.05 mg/L。生根苗移栽炼苗后,适宜栽培基质为草炭∶蛭石∶珍珠岩=3∶1∶1,能获得90%以上的成活率。
