铝胁迫对燕麦种子萌发及幼苗生长的影响
2022-10-31陈仕勇周青平西南民族大学青藏高原研究院四川成都6004西南民族大学畜牧兽医学院四川成都6004
汤 霞, 陈仕勇, 周青平(.西南民族大学青藏高原研究院, 四川 成都 6004;.西南民族大学畜牧兽医学院, 四川 成都 6004)
铝是地壳中含量最高的金属元素,在中性土壤环境中主要以铝硅酸盐和氧化物的形式存在[1]。当土壤pH<5时,铝会以具有毒性的铝离子形式存在[2]。土壤中的铝离子会损害和阻碍植物根系生长。酸性土壤在世界可耕地面积中占比为30%~40%[3],土壤酸化的原因包括自然酸化和人为导致的酸化[4]。自然酸化包括土壤母质本身呈酸性、植物分泌有机酸、微生物分泌物导致土壤呈酸性等;人为酸化例如施用肥料、作物连作等[5]。南方农区酸性土壤问题较严重,目前通过施用土壤改良剂改良土壤的酸碱度,但时效短且对深层土壤没有效果,长期施用会使得土壤结构遭到严重破坏[6]。筛选评价植物的耐铝特性及相关机理对解决土壤酸铝毒害问题具有重要意义。
目前国内外关于植物铝胁迫的研究包括对同种植物不同程度铝胁迫的研究[7-8],同一植物不同种质资源间对不同浓度的铝胁迫反应[9],同种植物已知铝抗和铝敏感品种间形态及生理间差异[10-11],主要涉及生长及生理指标,包括萌发指标、生长指标、渗透调节物质、抗氧化酶活性、耐胁迫基因等。铝胁迫以多种方式影响植物的生理和分子机制,大多数植物铝中毒的常见现象是抑制根的生长。铝的毒害会导致株高根长降低、丙二醛含量增加、抗氧化酶活性变化等,会对植物的生长发育产生显著影响。铝敏感品种和耐铝品种的生理指标存在较大差异[12],对其生理指标的测定可用于鉴定植物耐铝性的高低。
燕麦(AvenasativaL.)是禾本科燕麦属一年生栽培作物,主要种植于河北、甘肃、内蒙古、青海、四川及东北等地区,燕麦已经成为青藏高原高寒地区高产优质人工草地建设中的主要草种之一,并取得了良好的经济生态效益[13],燕麦因其优质的营养品质及耐性成为南方的经济作物,种植广泛;而南方农区酸性土壤问题严重,所以研究燕麦抗铝品种筛选具有十分重要的意义。目前关于燕麦抗逆性研究主要包括盐碱胁迫[14-15]、干旱胁迫[16-17]等方面,关于燕麦在铝胁迫条件下种子萌发及苗期生长发育的影响鲜有报道。本试验研究了不同浓度铝胁迫对5个燕麦品种种子萌发和苗期生长的影响,综合评价品种的抗性,得到较为耐铝的品种,有利于燕麦在酸性土壤中得到更好的利用,以期为燕麦的抗逆栽培,耐铝品种的筛选和培育提供理论依据,为酸铝土壤改良提供优良的种质资源。
1 材料与方法
1.1 试验材料
试验材料为“莫妮卡”“梦龙”甜燕2号“牧王”“摄政王”共5个燕麦品种。“莫妮卡”“梦龙”“摄政王”购自北京百斯特草业有限公司,甜燕2号购自北京佰青源公司,“牧王”购自北京正道种业有限公司。
1.2 试验设计
试验于2021年3—4月进行,试验条件为光照16 h(23 ℃),黑暗8 h(20 ℃),前期已通过预试验完成试验浓度的筛选。选取籽粒均匀一致且饱满的燕麦种子,2%的次氯酸钠消毒10 min,蒸馏水充分冲洗,消毒且浸泡后的种子均匀置于垫有2层滤纸的萌发盒中,添加15 mL不同浓度(Al3+浓度为0、2.5、5、10、20 mmol/L)的AlCl3溶液于萌发盒中(pH=4.5)。每盒30粒种子,每个处理设3个重复,2 d更换一次滤纸,每天记录种子发芽数及幼苗生长情况。
1.3 试验方法
1.3.1种子萌发参数的测定
发芽势(%)=(前5 d发芽种子数/供试种子数)×100%;
发芽率(%)=(前10 d发芽种子数/供试种子数)×100%。
以胚根为种子长径1/2时判定为萌发。
1.3.2生长指标的测定
试验处理第10天,每个萌发盒选取10株均匀一致的幼苗,测量幼苗的根长和株高,再把幼苗分为地上和地下两部分,用万分之一的天平(0.000 1 g)称量幼苗的根重和茎叶重,并进行根系扫描。105 ℃杀青15 min,75 ℃烘干48 h,天平称其根与茎叶干重。计算根冠比、株高抑制率、根长抑制率。
1.3.3生理指标的测定
试验处理10 d后,取植株幼苗,采用试剂盒处理(购自苏州科铭技术有限公司)并用Varioskan LUX酶标仪测定根尖丙二醛(MDA)含量及根尖过氧化氢酶(CAT)活性。
1.3.4测定根尖铝含量
苏木精染色法[18]。染色后采用分光光度计测定A490的吸光值OD490。并对染色后的根尖采用显微照相系统进行放大拍照。
1.3.5测定根尖细胞质膜完整性
伊文思蓝染色法[18]。染色后采用分光光度计测定A600的吸光值。并用显微照相系统进行放大拍照。
1.3.6抗铝毒的评价方法
采用隶属函数法[1],以5个燕麦品种在不同浓度Al3+处理下的根长、株高、根干重、根鲜重、MDA含量、CAT活性、铝含量、伊文思蓝摄取量作为指标进行综合评价。
D1=(Xi-Xmin)/(Xmax-Xmin)
式中,Xi为第i个指标值,Xmax为所有品种第i个指标的最大值,Xmin为所有品种第i个指标的最小值。如果测定指标与植物的耐铝性呈负相关,则用反隶属函数计算。
D2=1-(Xi-Xmin)/(Xmax-Xmin)
计算出各隶属函数值,并进行隶属函数平均值计算比较,平均值越大说明该牧草的抗铝毒能力越强。
1.3.7数据处理及分析
采用Excel 2019软件处理数据,采用SPSS 24.0软件进行单因素方差分析。
2 结果与分析
2.1 铝胁迫对燕麦种子发芽势和发芽率的影响
由图1可知,“莫妮卡”的发芽率随着Al3+浓度的升高呈先降后升的趋势,仅对照组与10 mmol/L的处理组差异显著(p<0.05)。“梦龙”的对照组发芽率与2.5、20 mmol/L的处理组差异显著(p<0.05)。“牧王”对照组与处理组的发芽率均无显著差异。“摄政王”的发芽率仅对照组与20 mmol/L铝溶液处理差异极显著(p<0.01),其他各浓度间均无显著性差异。试验中燕麦的发芽势与发芽率变化趋势趋于一致,铝胁迫对5个燕麦品种的发芽势、发芽率均没有较显著的抑制作用。
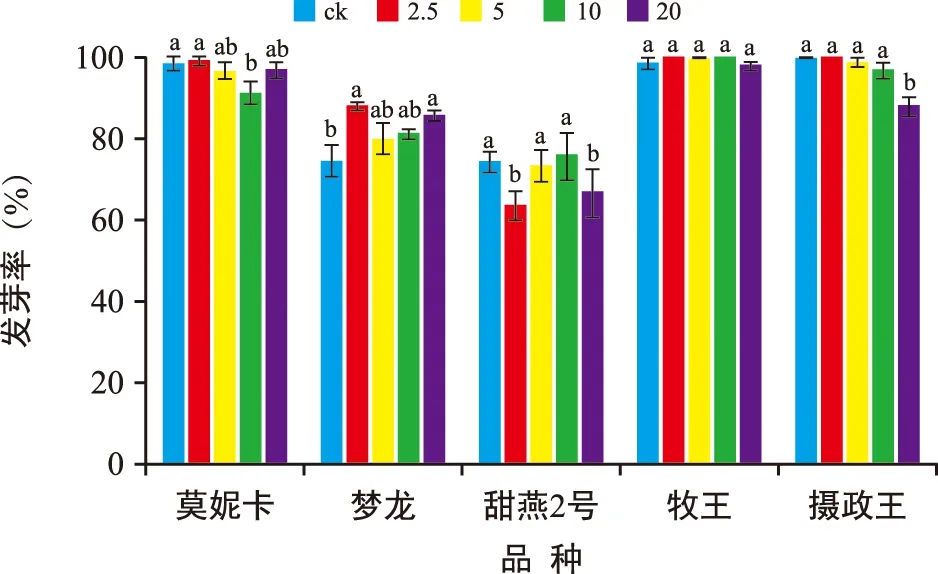
注:不同小写字母表示不同Al3+浓度处理间差异显著(p<0.05)。下同。图1 铝胁迫对燕麦种子发芽率的影响Fig.1 Effect of aluminum stress on seed germination rate of oat
2.2 铝胁迫对燕麦幼苗生长指标的影响
2.2.1铝胁迫对燕麦幼苗株高及根长的影响
燕麦在Al3+胁迫下生长受到抑制(图2),随着Al3+浓度的增加,5个燕麦品种的株高、根长都呈降低的趋势(图3),各品种间株高、根长存在差异,不同品种的不同浓度间差异显著(p<0.05)。其中“梦龙”“摄政王”对照组株高与处理组差异极显著(p<0.01)。甜燕2号、“牧王”的对照组株高与5、10、20 mmol/L的处理组差异极显著(p<0.01)。
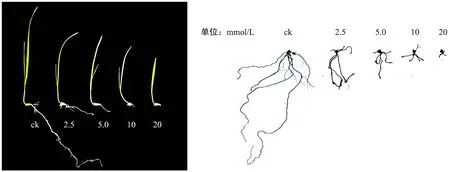
图2 不同浓度铝胁迫对燕麦形态、根系的影响Fig.2 Effects of different concentrations of aluminum stress on morphology and root system of oat
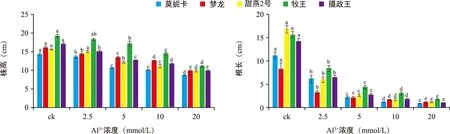
图3 铝胁迫对5个燕麦品种株高、根长的影响Fig.3 Effects of aluminum stress on plant height and root length of oat
随着铝胁迫程度加重,燕麦的株高抑制率与根长抑制率逐渐上升,对根的抑制程度大于株高(图4)。在Al3+浓度为20 mmol/L时,5个燕麦品种的平均株高、根长降到最低,其株高抑制率也达到了最大值,分别为39.946%、38.661%、36.571%、42.713%、42.13%,“牧王”的株高抑制程度最明显,其次为“摄政王”,而抑制程度最不明显的为甜燕2号。其根长抑制率也在20 mmol/L时达到了最大值,分别为92.72%、86.24%、93.38%、89.00%、93.16%,甜燕2号的根长抑制程度最明显,其次为“摄政王”,抑制程度最不明显的为“梦龙”。
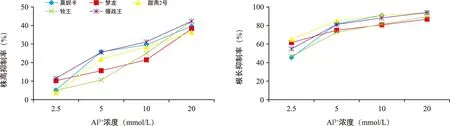
图4 铝胁迫对5个燕麦品种株高抑制率、根长抑制率的影响Fig.4 Influence of aluminum stress on inhibition rate of plant height and root length
2.2.2铝胁迫对燕麦幼苗鲜重及干重的影响
燕麦各品种的根及茎叶的干鲜重对铝胁迫做出了响应,随着铝胁迫程度加大,根鲜重及根干重呈下降的趋势。“梦龙”根干鲜重的对照与各处理组差异显著(p<0.05)。甜燕2号的对照组根鲜重及根干重与各处理组差异极显著(p<0.01)。根鲜重及干重随着Al3+浓度的增加呈下降的趋势,但在10 mmol/L的胁迫下,出现升高趋势,这可能是燕麦自身的耐铝机制导致的。铝胁迫导致“牧王”的根鲜重及干重下降,且对照与各处理组差异显著(p<0.05)。“摄政王”根鲜重逐渐下降,各浓度间差异显著(p<0.05),并呈现随浓度升高逐渐降低的趋势。随着铝胁迫的加重,各品种的茎叶重有不同程度的变化,鲜重主要呈现下降的趋势,“莫妮卡”“梦龙”甜燕2号在个别浓度存在上升的趋势,而“牧王”“摄政王”的干重出现逐渐上升的趋势,个别浓度出现下降现象,这可能与其耐铝机制有关。
铝胁迫处理对各品种的根冠比均产生显著的影响。随着Al3+浓度的增加,5个燕麦品种的根冠比均呈现下降趋势。由表1可知,铝胁迫对燕麦根系生长的抑制作用大于对其地上部生长的抑制作用。各处理组与对照组根冠比差异显著(p<0.01),随着浓度的增大,根冠比的降幅减小。“梦龙”和甜燕2号在受到浓度为2.5 mmol/L的铝胁迫时根冠比急速下降,甜燕2号及“牧王”在10 mmol/L时根冠比呈小幅度的增高。其中“牧王”的根冠比在受到铝胁迫时降幅最小。
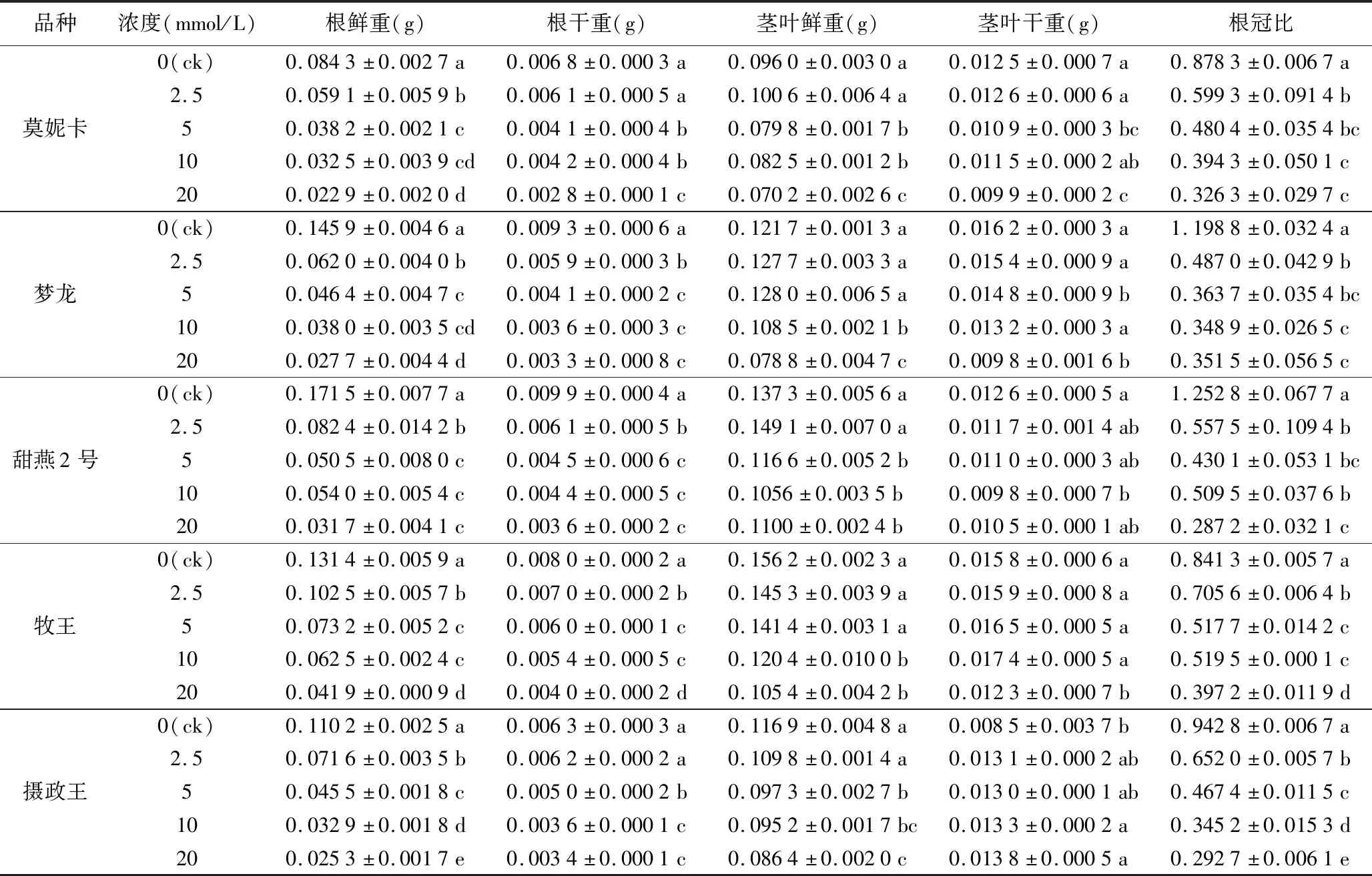
表1 铝胁迫对燕麦干重、鲜重及根冠比的影响Table 1 Effects of aluminum stress on dry weight, fresh weight and root-shoot ratio of oat
2.3 铝胁迫对燕麦幼苗生理指标的影响
2.3.1铝胁迫对燕麦根系MDA含量的影响
MDA是膜脂过氧化的产物,在受到胁迫时会产生,因此可以用来检测铝胁迫导致燕麦膜脂过氧化程度。由图5可知,与对照相比,铝胁迫显著提高了燕麦根系的MDA含量(p<0.01)。随着Al3+浓度的升高,5个燕麦品种的MDA含量也逐渐升高,其中“牧王”在20 mmol/L时较对照增长最少。“莫妮卡”“梦龙”“牧王”对照组与各处理组差异极显著(p<0.01),各处理组间差异极显著(p<0.01)。甜燕2号对照与各处理组差异极显著(p<0.01)。2.5 mmol/L铝胁迫下,“摄政王”的MDA含量较对照组减少,其余4个品种均呈现上升趋势。“牧王”“摄政王”在Al3+10 mmol/L时膜脂过氧化程度最严重,“莫妮卡”、甜燕2号在Al3+20 mmol/L时膜脂过氧化程度最严重。
2.3.2铝胁迫对燕麦根系CAT活性的影响
CAT属于抗氧化酶,可以消除游离氧自由基,减轻胁迫危害。铝胁迫会激发抗氧化酶系统,在受到铝胁迫时,各品种燕麦的CAT活性产生不同的响应,且变化幅度在不同品种间存在差异。“莫妮卡”在5、10、20 mmol/L处理时,浓度越高CAT活性越大,且对照组与各处理组及各处理组间差异极显著(p<0.01)。“牧王”“摄政王”各处理组的CAT活性均高于对照组,且各组之间差异极显著(p<0.01)。各品种均呈先升后降的趋势,“梦龙”在2.5 mmol/L时达到峰值,其他的品种均在20 mmol/L达到最大值(图5)。
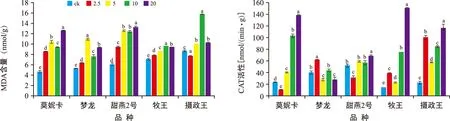
图5 铝胁迫对燕麦MDA含量及CAT活性的影响Fig.5 Effects of aluminum stress on MDA and CAT of oat
2.4 铝胁迫对燕麦根尖铝含量的影响
燕麦在不同浓度的铝胁迫处理下根尖Al3+含量有不同程度的积累。图6显示,“莫妮卡”的根尖铝含量最高,其次为“梦龙”,最少的为“牧王”。各处理组中的Al3+含量均高于对照组,除“摄政王”外其他品种的对照与各处理组间差异极显著(p<0.01)。同一浓度的铝胁迫处理时,“莫妮卡”的Al3+含量均高于其他4个燕麦品种。“莫妮卡”甜燕2号“牧王”在浓度为10 mmol/L处理时Al3+含量最高,在20 mmol/L的Al3+铝胁迫处理时出现了下降的趋势。“梦龙”“摄政王”在浓度为20 mmol/L处理下根尖Al3+含量出现猛增趋势,此时浓度达到最高(p<0.01)。“摄政王”根尖Al3+含量随Al3+胁迫浓度升高而升高。
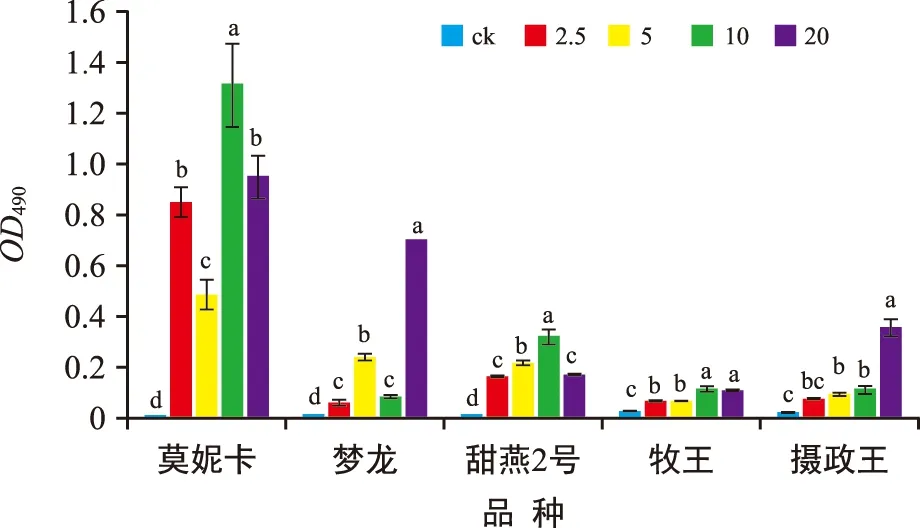
图6 铝胁迫对燕麦根尖铝含量的影响Fig.6 Effect of aluminum stress on aluminum content in root tips
2.5 铝胁迫对燕麦幼苗根尖细胞质膜的影响
细胞质膜完整性受损程度可通过检测细胞的伊文思蓝染料(一种非浸透性染料)相对摄取量来评价。从图7可以看出,通过对染色后吸光值的检测发现各品种处理组的伊文思蓝含量均高于其对照组。“莫妮卡”对照组与处理组差异极显著(p<0.01),仅5 mmol/L与10 mmol/L的处理组间差异不显著(p>0.05)。“牧王”对照及各处理组间差异极显著(p<0.01),各处理组间除了2.5 mmol/L与5 mmol/L处理组之间的差异不显著外,其他均显著。“摄政王”对照及各处理组间差异极显著(p<0.01),但10 mmol/L与20mmol/L处理组之间差异不显著(p>0.05)。“摄政王”经伊文思蓝染色结果如图8所示,铝胁迫对根尖产生了较大的影响,根尖表面形态各异。对照组根尖表面完好,吸附的染料很少。经过铝胁迫处理,根尖表面吸附大量的染料,根表面粗糙不平。
图7 铝胁迫对燕麦根尖细胞质膜透性的影响Fig.7 Effect of aluminum stress on plasma membrane permeability of root tip cells
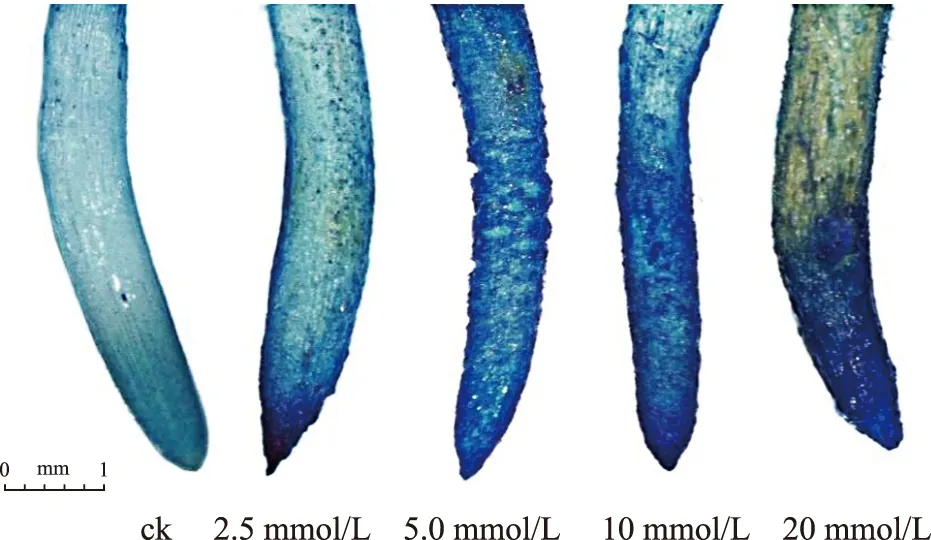
图8 经伊文思蓝染色后的燕麦根尖Fig.8 The root tips of oats stained with Evans blue
2.6 抗铝毒综合评价
通过隶属函数对供试燕麦所测指标进行了抗铝综合评价,结果(表2)表明“摄政王”的得分最高,对铝胁迫抗性最强,其次是“牧王”,而甜燕2号得分最低为0.405 375,抗铝性最弱,5份材料的抗铝性顺序为:“摄政王”>“牧王”>“莫妮卡”>“梦龙”>甜燕2号。
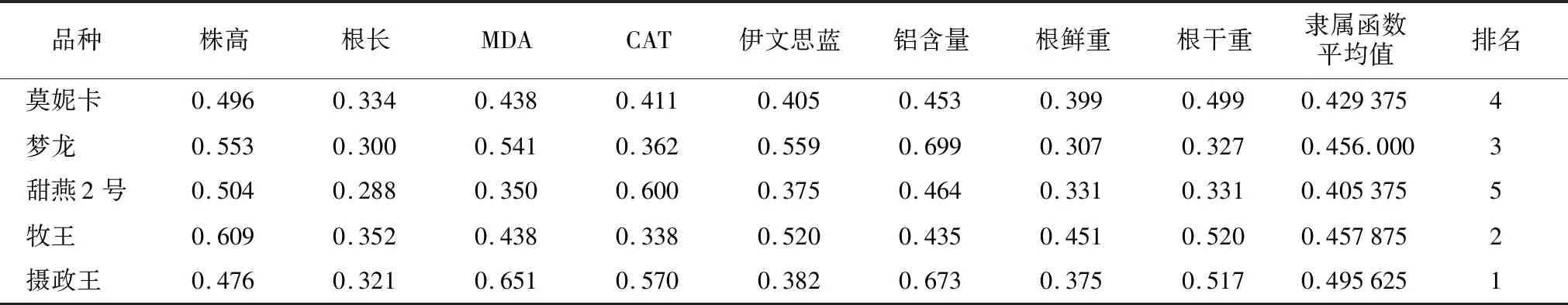
表2 燕麦抗铝胁迫隶属函数比较Table 2 Comparison of membership functions of resistance to aluminum stress in oats
3 讨论与结论
种子萌发及幼苗生长是植物生长能否顺利进行的关键,酸性土壤中植物对铝胁迫响应的研究至关重要。发芽势及发芽率是对种子萌发测定的重要指标。本研究表明,铝胁迫对试验所用5个燕麦品种的发芽势及发芽率存在一定的影响,对发芽率及发芽势的影响趋近相同。当Al3+浓度为2.5 mmol/L时,“牧王”的发芽指数呈上升的趋势,而在浓度增高后表现出下降的趋势,这与初晓辉等[19]对多花黑麦草的研究结果相似,张鹤山等[20]对荞麦发芽指标的研究也得到相似结果;而“摄政王”在2.5 mmol/L时呈下降的趋势,随后增高,这可能与其对铝胁迫的适应性有关;其他3个品种逐渐降低,这与刘鹏等[21]对望江南和光头稗的研究相似。说明同种植物的不同品种表现出对铝胁迫的不同响应,显示出燕麦各品种不同的耐受性[22]。从种子萌发指标来看,燕麦种子萌发对铝胁迫有一定的耐受性,4个浓度的铝胁迫处理组均未对燕麦种子的萌发产生较多的显著性影响。从已报道的铝胁迫研究中发现,牧草间铝胁迫浓度存在差异,如鸭茅采用0~100 μmol/L[23],垂穗披碱草为0~1.5 mmol/L[1],苜蓿0~500 μmol/L[24]、大麦0~200 μmol/L[25],从试验中所用的铝胁迫浓度来看,燕麦相对较高,对于铝胁迫有较高的抵抗能力,可将燕麦与其他植物进行比对研究。
植物的生长指标可以较直观地表现出其受影响程度。本研究发现,5个燕麦品种的生长指标对不同浓度的Al3+胁迫做出了不同的响应。随着Al3+浓度升高,株高、根长呈下降趋势(p<0.05),对根的抑制比株高更为显著,这与前人的研究结果基本一致。根系作为植物直接接触铝毒的器官最先受到胁迫[11],对铝胁迫的反应,包括细胞死亡、损伤和恢复,均发生在根尖区,胁迫抑制根尖的细胞分裂及伸长[26],根对铝胁迫的空间表达也值得进一步研究。
MDA含量在一定程度上能反映膜脂过氧化水平和膜结构的受害程度[26],本试验结果显示,随着铝胁迫程度的加重,5个燕麦品种中MDA含量整体上升,与对照组相比,处理组的MDA含量显著升高(p<0.05),说明在铝胁迫时植物根部细胞膜受到损伤,但各品种的最高点有所不同,品种不同,细胞质膜遭到的破坏程度不一样。植物在遭受逆境胁迫时会通过自身的调节作用来抵抗胁迫,例如根系分泌的有机酸与Al3+形成螯合物,降低毒性[26]、利用抗氧化酶来清除自由基[14]。酶活性越高,消除自由基的能力也越强,牧草的抗逆性也越强[28]。本研究显示,各品种燕麦CAT含量存在一定的波动幅度,这可能与品种自身的抗铝机制有关,超过了自身的氧自由基清除能力[29],抗氧化保护系统的抵抗修复能力达到了阈值。
本研究显示,根尖铝含量随着Al3+浓度升高而下降,这可能是由于燕麦幼苗根在受到铝胁迫的刺激下做出了一些生理生化的适应性反应来阻止Al3+的侵入,而随着浓度的升高,其适应性达到阈值,无法再抵抗Al3+的侵入,因而造成根尖铝含量的重新上升。各处理组的伊文思蓝摄取量均高于对照组,说明铝胁迫导致了细胞膜结构破坏,部分燕麦品种根尖伊文思蓝摄取量呈先上升后降低的趋势,且根尖表面粗糙不平,可能是受铝毒害严重细胞大量死亡脱落的结果[18]。
酸性条件下当Al3+富集到一定浓度会对植物造成影响,而这一浓度可以用来对植物耐铝品种进行筛选,通过对不同品种间施以不同浓度的铝胁迫可以进一步得到用以筛选耐铝品种与不耐铝品种的Al3+浓度,南方酸性土壤较多,本研究可以为后续其他燕麦品种间的耐铝性筛选及燕麦在南方土壤的应用选择提供一定的理论依据。综上所述,不同燕麦品种在形态特征和生理特性上对铝胁迫存在相同和不同的生长及生理响应策略,植物的铝胁迫耐性仅用单一指标评价不可靠,通过隶属函数对5个燕麦品种幼苗期的抗铝性进行综合评价,得出其对铝胁迫的耐受性依次为“摄政王”>“牧王”>“莫妮卡”>“梦龙”>甜燕2号。
