稗18-WJJ-Ec种群对五氟磺草胺的靶标抗性机制
2022-10-28黄启超顾琼楠褚世海陈安安李儒海孙正祥
黄启超, 顾琼楠, 褚世海, 陈安安, 李 林, 李儒海, 孙正祥
(1.长江大学农学院,湖北荆州 434025; 2.湖北省农业科学院植保土肥研究所/农业农村部华中作物有害生物综合治理重点实验室/农作物重大病虫草害防控湖北省重点实验室,湖北武汉 430064)
稗属(Beauv.)杂草是我国稻田恶性杂草之一,严重制约了我国水稻产量。目前,针对稻田稗属杂草主要以化学防治为主,国内用于防治稻田稗属杂草的除草剂主要有五氟磺草胺、乙草胺、丁草胺、丙草胺、二氯喹啉酸、双草醚、氰氟草酯等,其中三唑并嘧啶磺酰胺类的五氟磺草胺是目前较常用的除稗剂。五氟磺草胺是乙酰乳酸合成酶(ALS)抑制剂,由美国陶氏益农公司研发,于2008年进入我国市场,因其良好的除稗草效果而得到广泛推广使用。近年来,由于五氟磺草胺的长期单一使用导致多地稗草对其产生抗性,其中以湖北省稗草高水平抗性比例最高。2018年,马国兰等对我国7省共70个地区的稻田稗属杂草进行了五氟磺草胺抗性检测,结果表明50%地区稗属杂草对五氟磺草胺达到了高抗水平,47.1%地区稗属杂草对五氟磺草胺达到了中抗水平,抵抗水平稗属杂草地区只有2.9%,所有地区均无敏感稗属种群;其中,湖北、安徽、宁夏和黑龙江等4个省份的高水平抗性稗属种群发生情况最为严重。
杂草抗性机制主要包括靶标抗性机制和非靶标抗性机制,靶标抗性机制一般与相关靶标基因突变或过量表达有关,靶标基因的突变造成相关靶标蛋白3D结构或者电化学性质改变,导致靶标酶与除草剂亲和度降低,而靶标基因过量表达导致靶标酶含量提高,从而补偿除草剂的抑制;非靶标抗性的作用机制主要包括杂草对除草剂的解毒代谢增强、渗透减弱、吸收减少、传导变缓及屏蔽作用等。目前已报道的杂草ALS抗性突变位点有9个,其中已报道的稗属杂草ALS氨基酸序列抗性突变位点有Ala-122、Pro-197、Ala-205、Phe-206、Asp-376和Trp-574等,这6个位点的突变均使得稗属杂草对ALS抑制剂类除草剂产生了抗性。例如,Fang等发现稗(-)Ala-122-Val和Ala-205-Gly等2种靶标位点突变生物型均对五氟磺草胺产生了抗性,且2个突变型稗ALS离体活性均高于敏感种群。此外,Fang等还发现了抗五氟磺草胺稗ALS氨基酸序列Phe-206-Leu突变型,且该突变位点是1处新的ALS突变位点。Yang等在研究稗对五氟磺草胺和氰氟草酯的抗性机制中发现,稗Trp-574-Leu突变生物型对五氟磺草胺的抗性指数为65.84倍。Liu等发现了水稗()ALS2氨基酸序列拷贝Pro-197-Ser突变型,且该突变型水稗对部分ALS抑制剂产生了交互抗性,同时ALS离体活性比敏感种群高13.7倍。此外,2021年,Löbmann等首次发现并报道了稗ALS氨基酸序列中376位天门冬氨酸(Asp)突变成了谷氨酸(Glu)。Dalazen等在研究咪唑乙烟酸对稗降解增强相关基因差异表达的影响中发现,抗咪唑乙烟酸稗生物型细胞色素P450酶和谷胱甘肽S转移酶相关基因表达量均高于敏感种群,但基因表达量与敏感种群差异不显著,可能由非靶标抗性机制主导。
关于湖北省稗种群对五氟磺草胺靶标抗性机制的研究鲜有报道,目前仅在湖北省荆州市公安县发现ALS氨基酸序列Trp-574-Leu突变型稗。本研究拟通过测定稗18-WJJ-Ec种群对五氟磺草胺的敏感性及抗性机制,明确稗18-WJJ-Ec种群的抗性水平及靶标抗性机制,以期为湖北省稻田抗性稗的防除治理提供理论基础。
1 材料与方法
1.1 供试材料
供试植物:抗性稗于2018年9月采自湖北省武汉市江夏区金水试验农场水稻田;敏感型稗18-NJ种子由江苏省农业科学院植物保护研究所李永丰课题组提供。
供试药剂和试剂主要有25 g/L五氟磺草胺乳油[陶氏益农农业科技(江苏)有限公司]、97.1%五氟磺草胺原药(安徽星宇化工有限公司)、焦磷酸硫胺素(TPP,北京索莱宝科技有限公司)、黄素腺嘌呤二核苷酸钠盐(FAD,上海麦克林生化科技有限公司)、1-萘酚(上海麦克林生化科技有限公司)、肌酸(国药集团化学试剂有限公司)、乙偶姻(上海阿拉丁生化科技股份有限公司)、NuClean Plant Genomic DNA Kit(江苏康为世纪生物科技有限公司)、Cycle-Pure Kit(美国Omega Bio-Tek公司);TR251-50小量RNA提取试剂盒(北京天漠科技开发有限公司)、iTAPTM Universal SYBR® Green Supermix(美国Bio-Rad Laboratories公司)、5× All-In-One MasterMix(加拿大Applied Biological Materials Inc公司)、Zero Background pTOPO-TA(北京艾德莱生物科技有限公司)、Trans 5α Chemically Competent Cell(上海唯地生物技术有限公司)、Phanta® Max Super-Fidelity DNA Polymerase(南京诺唯赞生物科技股份有限公司)。
仪器设备主要有Optima XPN-100超高速冷冻离心机(美国Beckman Coulter公司)、东胜ETC811 PCR 扩增仪(北京东胜创新生物科技有限公司)、 Eppendorf Centrifuge 5810R冷冻离心机(德国Eppendorf 公司)、Bio-rad CFX Connect荧光定时定量PCR仪(美国Bio-Rad公司)、Biotek Epoch酶标仪(美国Biotek公司)、LAC-400-N人工气候箱(上海龙跃仪器设备有限公司)。
1.2 试验方法
1.2.1 剂量反应曲线测定 参照NY/T 1155.4—2006农药室内生物测定试验准则,将抗性稗18-WJJ-Ec种群和敏感稗18-NJ种群种子浸泡在100 mg/L赤霉酸溶液中,并于27 ℃光照培养箱中催芽24 h,然后分别播种在直径15 cm塑料盆(含4/5基质土)中,每盆50粒,均匀覆土1 cm,置于温室内培养,培养条件为白天温度 (27±5) ℃,夜间温度(20±5) ℃,相对湿度(75±5)%,自然光培养。稗2~3叶期时,每盆保留长势一致植株20株,待稗3叶1心时期,对抗性稗18-WJJ-Ec种群茎叶喷施4、8、16、32、64、128、256、512 g a.i./hm共8个浓度的五氟磺草胺,敏感稗 18-NJ 种群茎叶喷施五氟磺草胺浓度梯度为0.25、0.50、1.00、2.00、4.00、8.00、16.00、32.00 g a.i./hm,以清水处理作为对照,每个处理4个重复,施药21 d后测量每盆稗地上部分鲜质量。
1.2.2 稗基因序列测定 将稗18-WJJ-Ec种群和18-NJ种群种子分别播种在10 cm×10 cm×10 cm的塑料方盒中,于28 ℃,光暗1 ∶1,3 000 lx人工气候箱中培养至3叶1心期,以五氟磺草胺田间推荐剂量高量30 g a.i/hm茎叶喷施处理稗18-WJJ-Ec种群,稗18-NJ种群不处理,14 d后取存活稗幼嫩组织,采用NuClean Plant Genomic DNA Kit提取稗总DNA,每个种群提取10棵稗单株总DNA。根据NCBI登录的稗基因序列,采用Primer Premier 5.0设计稗基因全长扩增引物序列(上游引物:5′-G T C A T C G C C A A C C A C C T C T T C C-3′,下游引物:5′-C T G C C A T C A C C A T C C A G G A T C-3′)。PCR反应体系:DNA模板1 μL;2×Phanta Max Buffer 12.5 μL;dNTP Mix 0.5 μL;Phanta Max Super-Fidelity DNA Polymerase 0.5 μL;10 μmol/L上、下游引物各1 μL;dd HO补足至25 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性1 min,63 ℃ 退火50 s,72 ℃延伸2 min,35个循环;72 ℃终延伸10 min。PCR产物经凝胶电泳鉴定后,用Cycle-Pure Kit(Omega Bio-Tek公司)进行产物纯化回收,回收产物经过连接、转化、克隆至pTOPO Vector,37 ℃恒温培养12 h后,每个DNA样本挑取10个单克隆菌株培养扩繁,新鲜菌液经PCR扩增及凝胶电泳鉴定后送至湖北武汉擎科生物科技有限公司进行双向测序拼接。所测序列结果经BLAST比对验证后,用DNAMAN6.0软件进行比对分析。
1.2.3 稗ALS活性测定 采用Yu等的方法进行测定,按“1.2.2”节方法培养稗至3叶1心期,每个种群取幼嫩叶片3.0 g,液氮下研磨成细粉,准确称量2.0 g细粉转入离心管中,加入16 mL酶提取液(含10 mmol/L丙酮酸钠,0.5 mmol/L MgCl,0.5 mmol/L TPP,10 μmol/L FAD的0.1 mol/L pH值为 7.5的磷酸缓冲液),混匀后冰上放置10 min,用2层尼龙网纱布过滤,滤液于27 000、4 ℃下离心20 min,将上清液转入新离心管中,缓慢加入硫酸铵晶体(每1 mL粗酶液加0.313 g硫酸铵晶体),缓慢搅拌20 min,于27 000、4 ℃下离心 20 min,弃上清液,沉淀加入4.5 mL酶反应液(含200 mmol/L丙酮酸钠,20 mmol/L MgCl,2 mmol/L TPP,20 μmol/L FAD的0.05 mol/L pH值为 7.5的磷酸缓冲液)充分溶解得到粗酶液,并置于冰上备用。于1.5 mL离心管中,分别加入100 μL上述粗酶液和100 μL以 0.05 mol/L pH值7.5磷酸缓冲液配制的五氟磺草胺溶液(浓度梯度为0.01、0.10、1.00、10.00、100.00、1 000.00 μmol/L),充分混匀后37 ℃水浴暗反应1 h,加入8 μL 6 mol/L HSO,60 ℃水浴脱羧15 min终止反应,然后加入5.5% 1-萘酚(以2.5 mol/L NaOH配制)和0.55%肌酸各190 μL,60 ℃水浴显色15 min,冰浴1 min后低速离心,取200 μL上清液加入96孔酶标板中,测定值,以100 μL磷酸缓冲液代替五氟磺草胺作为空白对照,以提前加入8 μL 6 mol/L HSO的酶液作为背景对照。试验生物学重复2次,技术重复3次。以乙偶姻制作标准曲线,将反应液值换算成乙偶姻含量,计算五氟磺草胺对各种群稗离体ALS抑制中浓度(ED),并计算抗性指数()。
1.2.4 稗基因表达量测定 按“1.2.2”节方法培养稗至3叶1心期,以五氟磺草胺田间推荐剂量低剂量15 g a.i./hm茎叶喷雾处理,采用TRIZOL法,用TR251-50小量RNA提取试剂盒提取施药前和施药后1、3、5、7 d稗单株总RNA,用 5× All-In-One RT Master Mix反转录成cDNA后,采用Bio-rad CFX Connect荧光定时定量PCR仪进行稗基因相对表达量测定,以稗基因为模板设计RT-qPCR扩增引物(上游引物QALS-F:5′-A T C C G C A T T G A G A A C C T C C-3′,下游引物 QALS-R:5′-T C T T C T T G A T T G C T G C A C G T-3′),以肌动蛋白Actin作为内参基因(上游引物ACT-F:5′-C A C A C T G G T G T C A T G G T A G G-3′,下游引物ACT-R:5′-A G A A A G T G T G A T G C C A G A T-3′),采用2-ΔΔ法以敏感稗18-NJ种群未用药处理组作为对照组,分析计算稗基因相对表达量,试验生物学重复2次,技术重复3次。
1.3 数据处理
所有数据经Excel处理后,采用SigmaPlot 14.0软件Logistic模型计算五氟磺草胺对各稗种群的抑制中浓度(ED),拟合方程如式(1):
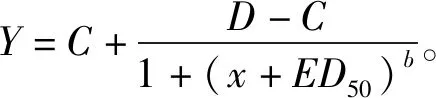
(1)
式中:表示除草剂剂量;为药剂处理与空白对照百分比;为斜率;为剂量反应下限;为剂量反应上限。
抗性指数按公式(2)计算:
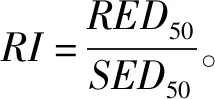
(2)
式中:为抗性指数;为抗性生物型的抑制中浓度;为敏感生物型的抑制中浓度。
抗性水平分级标准:敏感:≤2;低抗:2<≤6;中抗:6<≤12;高抗:12<。
2 结果与分析
2.1 剂量反应曲线测定
试验结果表明,五氟磺草胺对稗18-WJJ-Ec种群的抑制中浓度为20.54 g a.i./hm,对18-NJ的抑制中浓度为0.48 g a.i./hm,抗性稗18-WJJ-Ec种群相对敏感稗18-NJ种群的抗性指数达到42.79倍,属于高抗水平(表1、图1)。
2.2 稗ALS基因序列测定
通过BLAST对稗基因序列与GenBank收录的稗基因不同拷贝序列(登录号::KY071206.1;:KY071207.1;:KY071208.1)进行比对,相似度均在99%以上,扩增所得基因序列全部是稗基因序列。通过DNAMAN6.0软件将稗18-NJ种群各单株基因序列不同拷贝(、、)翻译成氨基酸后,与GenBank收录的敏感稗ALS氨基酸序列对应拷贝进行比对,未发现氨基酸位点突变。然后将抗五氟磺草胺稗18-WJJ-Ec种群各单株基因不同拷贝序列(、、)翻译成氨基酸后,与敏感稗18-NJ种群对应ALS氨基酸序列拷贝进行比对,发现1处已报道过的氨基酸突变位点,稗18-WJJ-Ec种群的 ALS氨基酸序列574位(以拟南芥ALS氨基酸序列编号为模板)密码子由TGG突变成了TTG,所编码的氨基酸由色氨酸(Trp)突变成了亮氨酸(Leu),且在稗18-WJJ-Ec种群ALS氨基酸序列的不同拷贝上均发现 Trp-574-Leu突变位点(图2)。此外,稗18-WJJ-Ec种群ALS氨基酸Trp-574-Leu突变主要发生在稗基因序列拷贝上,稗基因序列发生Trp-574-Leu突变频率为87.50%,而和基因序列拷贝发生Trp-574-Leu突变频率分别为5.88%、8.57%,结果表明稗18-WJJ-Ec种群对五氟磺草胺的抗性是由靶标位点突变引起的。

表1 稗对五氟磺草胺的敏感性

2.3 稗ALS活性测定
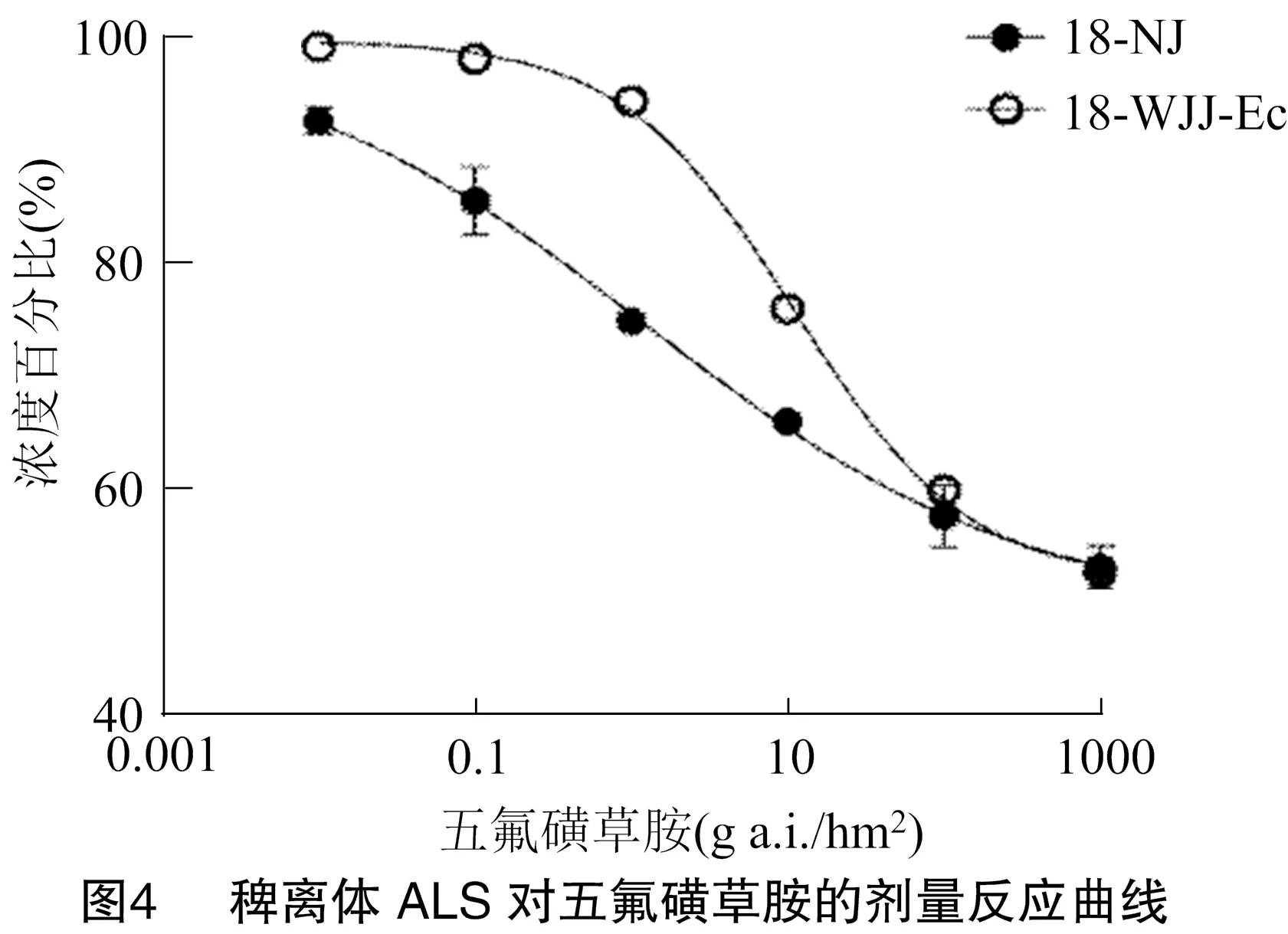
根据乙偶姻浓度梯度以及对应的吸光度,计算出乙偶姻的标准曲线(图3),线性拟合较好,可以将稗离体ALS活性吸光度换算成乙偶姻浓度,然后计算出五氟磺草胺对稗离体ALS的抑制中浓度。结果表明,在离体条件下,未用五氟磺草胺处理前,抗五氟磺草胺稗18-WJJ-Ec种群的ALS浓度(乙偶姻生成量)为32.82 μmol/L,而敏感稗 18-NJ种群的ALS浓度为19.83 μmol/L,稗18-WJJ-Ec种群的ALS浓度明显高于敏感稗18-NJ种群。五氟磺草胺对抗性稗18-WJJ-Ec种群离体ALS的抑制中浓度(ED)为11.09 μmol/L,对敏感稗18-NJ种群离体ALS的抑制中浓度为 1.24 μmol/L,稗18-WJJ-Ec种群相对敏感稗 18-NJ种群的抗性指数为8.28倍(表2、图4),表明稗18-WJJ-Ec种群ALS含量高于稗18-NJ种群,且离体ALS对五氟磺草胺的敏感性降低,靶标酶浓度及活性的增加参与了稗18-WJJ-Ec种群对五氟磺草胺的抗性机制。


表2 五氟磺草胺对稗离体ALS的抑制中浓度

2.4 稗ALS基因表达量测定
通过RT-qPCR荧光定量反应,用2-ΔΔ法以敏感稗18-NJ种群未用药处理组作为对照组计算分析各种群稗基因相对表达量,结果表明,经五氟磺草胺处理后,稗18-WJJ-Ec和18-NJ种群的基因表达量均呈先升高后降低趋势。药剂处理前,稗18-WJJ-Ec种群基因表达量是敏感稗18-NJ种群的1.58倍,基因表达量极显著高于18-NJ种群。药剂处理1 d后,稗18-WJJ-Ec和18-NJ 种群基因表达量均达到各自最大值,分别是对照的8.72倍和4.75倍,且稗18-WJJ-Ec种群基因表达量极显著高于敏感稗18-NJ种群,从处理3 d开始,稗18-WJJ-Ec种群基因表达量显著低于敏感稗18-NJ种群,结果表明稗18-WJJ-Ec种群存在靶标酶基因过量表达机制(图5)。

3 结论与讨论
由于五氟磺草胺作用位点单一,加上农户长期反复单一使用,以及施用方法不当等因素,使得抗五氟磺草胺稗属杂草的发生情况日益严重。本研究结果表明稗18-WJJ-Ec种群是18-NJ种群抗性指数的42.79倍,属于高抗水平,该结论与马国兰等的研究结果相似。
靶标位点突变是杂草对除草剂产生抗性的直接原因,不同突变位点使得杂草对不同作用机制的除草剂产生抗性。本研究中,稗18-WJJ-Ec种群 ALS氨基酸序列574位Trp突变成了Leu,导致稗18-WJJ-Ec种群对五氟磺草胺产生了抗性。Trp-574-Leu是杂草常见的基因突变方式,目前有关稗ALS氨基酸序列Trp-574-Leu突变生物型已有较多研究报道,其他稗属杂草有关ALS氨基酸序列Trp-574-Leu突变生物型的报道较少,目前报道的有水田稗()和水稗等。此外,稗作为六倍体植物,其基因序列存在3个不同的拷贝,即、和,研究表明和基因拷贝是所有物种的同源基因,而稗属杂草则是多了基因拷贝。稗属杂草的3个基因拷贝均参与了杂草的靶标抗性进化,而稗属杂草对除草剂抗性的高低,可能与靶标基因不同拷贝发生抗性位点突变频率有关。本研究结果表明,稗18-WJJ-Ec种群ALS氨基酸Trp-574-Leu突变主要发生在基因序列拷贝上。而Trp-574-Leu突变位点发生在稗基因不同序列拷贝上,是否会影响稗对五氟磺草胺的抗性,有待进一步研究确认。
杂草抗药性的产生,也可能由靶标酶基因表达量上调所介导,而在发生靶标抗性突变位点的杂草生物型中,靶标酶基因过量表达现象鲜有报道,此外有研究表明抗性种群靶标酶基因表达量也可能低于敏感种群。本研究结果表明,稗18-WJJ-Ec种群存在靶标酶基因过量表达机制,该结论与Yu等研究结果相似。靶标酶基因过量表达导致杂草靶标酶含量提高,从而对除草剂产生抗性,同时靶标酶活性的增强,也会提高杂草的抗药性。本研究结果表明,稗18-WJJ-Ec种群ALS含量提高,与本研究中靶标酶基因过量表达结果相符,此外,稗18-WJJ-Ec种群离体ALS对五氟磺草胺的敏感性降低,表明该种群ALS活性增强,该结论与Yu等的研究结果一致。
为了确定稗18-WJJ-Ec种群是否还存在非靶标抗性机制以及对其他相同作用机制或不同作用机制除草剂的抗性情况,后续可以开展对稗18-WJJ-Ec种群非靶标抗性机制以及交互抗性和多抗性的相关探究。此外,稗对五氟磺草胺的抗性高低,可能与抗性突变位点由稗基因不同拷贝携带有关,后续可以筛选出稗不同拷贝Trp-574-Leu纯合突变生物型,研究其相关抗性机制,同时探究稗对五氟磺草胺抗性的高低是否与基因不同拷贝的表达量以及稗基因不同拷贝携带Trp-574-Leu突变位点有关。
