枯草芽孢杆菌拮抗菌的筛选鉴定及其抑菌特性研究
2022-10-27郭丽丹张晓妍周婉婷张秀勤陈雨滢杨梓璐汪立平
郭丽丹,张晓妍,周婉婷,张秀勤,陈雨滢,杨梓璐,汪立平,2,3,
(1.上海海洋大学食品学院,上海 201306;
2.农业部水产品贮藏保鲜质量安全风险评估实验室,上海 201306;3.上海海洋大学食品热加工工程技术研究中心,上海 201306)
枯草芽孢杆菌()是一种革兰氏阳性菌,具有极强的抗逆性,一般的巴氏杀菌难以将其完全杀死。它作为一种常见的食品腐败菌,可以引起食品的腐败变质,进而导致一些食源性疾病,甚至会造成食物中毒。现有的应用于食品防腐领域的化学防腐剂,有着很大的潜在风险,国家食品防腐剂标准(GB 2760-2014)也对其使用进行了严格的限制,这进一步增加了食品防腐的难度。天然的生物防腐剂作为一种安全、高效的新型防腐剂,其相关研究已成为食品工业的一个研究热点。
现有研究表明,生存于特殊生态环境的乳酸菌能够分泌具有广谱抑菌性的抗菌肽,它是一种具有抗菌活性的小分子多肽类物质,其对常见腐败菌和病原菌均具有明显的抑制作用,且多具有良好的热稳定性,不会对人体造成危害,不易导致耐药性。目前,广泛应用的乳酸菌抗菌肽为乳酸链球菌素(Nisin),其已被50多个国家允许添加到食品当中,并且其也是唯一被美国食品药品监督管理局认可的抗菌肽。近年来,虽然国内外对于乳酸菌抗菌肽的研究众多,但鲜有研究关注于其对枯草芽孢杆菌的抑制作用,并且随着由枯草芽孢杆菌引起的食品污染事件的日渐增加,开发出一种对枯草芽孢杆菌具有抑制作用的新型抗菌肽就显得尤为重要。
产抗菌肽乳酸菌主要来自发酵食品、胃肠道、海洋、土壤等,其中发酵泡菜富含大量乳酸菌,可以保持长时间不变质,乳酸菌产的抗菌肽起到了相当大的作用。本研究以各地泡菜为原料,筛选出一株对枯草芽孢杆菌有强烈抑制作用的产抗菌肽乳酸菌,采用乙酸乙酯萃取法得到抗菌肽粗提物,并对其进行了抑菌特性的研究。本实验为该乳酸菌菌株的开发利用和该抗菌肽后续的深入研究与应用奠定了基础。
1 材料与方法
1.1 材料与仪器
农家自制泡菜样品 取自山东、上海、四川眉山、安徽、武汉、云南等地区;韩村天和腌制萝卜样品 山东威海;春顺酱腌菜 山东青岛;乐江金友邦酸菜 四川成都;巧媳妇腌制萝卜菜 四川眉山;蜀大娘腌制萝卜菜 四川绵阳;如意岛泡菜 辽宁铁岭,样品贮藏于4℃冰箱备用。
枯草芽胞杆菌(strain B39) 镇沅松子地绿色食品有限公司的胀袋泡菜样品分离所得;MRS肉汤干粉培养基 HKM;胰蛋白胨、葡萄糖、酵母粉、磷酸二氢钠、磷酸氢二钠、氯化钠、磷酸氢二钾等培养基成分和无水碳酸钙 国药集团;溶菌酶(≥2000 U/mg)、溴化乙啶(EB)、TAE 缓冲液、琼脂糖、Ezup柱式细菌基因组 DNA 抽提试剂盒、PCR相关试剂 上海生工;BCA蛋白浓度试剂盒北京索莱宝;革兰氏染色试剂盒 比克曼生物。
7200型紫外可见分光光度计 UNIC;A300型梯度PCR仪 LongGene;H2050R台式真空冷冻离心机 湖南湘仪;RV8V旋转蒸发仪 IKA;JY-SCZ2+电泳仪 北京君意东方;Gel Doc凝胶成像系统BIO-RAD;UV-6100紫外全波长扫描仪 上海美谱达仪器。
1.2 实验方法
1.2.1 产抗菌肽乳酸菌的筛选
1.2.1.1 菌株初筛 使用无菌生理盐水对泡菜样品进行梯度稀释,制成10、10和10菌悬液,各取100 μL注入含2%碳酸钙的MRS培养基无菌板中,摇匀后,置于37 ℃恒温培养箱培养48 h。然后,对产生溶钙圈的菌株进行多次筛选和纯化,选取单菌落接种到10 mL MRS液体培养基中,置于摇床中培养(37 ℃, 150 r/min, 24 h),得到种子液。种子液以2%接种量接入MRS液体培养基中,上述条件培养后得发酵液。将发酵液进行离心(8000 r/min, 4 ℃,15 min)获得上清液,使用0.22 μm的水滤膜对上清液进行过滤,获得无细胞发酵上清液(Cell free supernatants,CFS)备用。
1.2.1.2 菌株复筛 由于CFS中含有机酸、过氧化氢、抗菌肽等抑菌物质,可能对初筛结果造成影响,因此该研究通过排除有机酸、过氧化氢的影响来进行复筛。首先,将CFS等分为3份,一份不做任何处理;一份用NaOH调节pH至6.5,以排除有机酸的影响;一份在排除有机酸后,加入过氧化氢酶,调节pH至7.5,37 ℃恒温水浴4 h后,将pH调回6.5,以排除过氧化氢的影响。将三份CFS溶液置于4 ℃保存过夜,备用。
本实验采用双层琼脂扩散法进行复筛。首先,将枯草芽胞杆菌接种于LB培养基中,置于摇床(37 ℃, 150 r/min)中培养 12 h,获得 10CFU/mL 指示菌菌悬液;然后,向50 ℃,含0.75% 琼脂的LB培养基中加入1%(v/v)的指示菌菌悬液,将两者混匀后倒在素琼脂上,待培养基凝固后,使用打孔器均匀打下直径7 mm的圆孔,向每孔注入50 μL上述处理过的3种CFS溶液,在4 ℃条件下扩散2 h后,置于恒温培养箱(37 ℃)培养12 h。培养结束后,观察是否产生抑菌圈,并用游标卡尺测量抑菌圈大小。每组实验重复三次。
1.2.2 菌株的鉴定
1.2.2.1 形态学鉴定 采用平板划线法在MRS固体平板上多次纯化菌株,并观察其菌落形态,根据单菌落形态特征进行初步判断后,对其进行革兰氏染色,在光学显微镜下观察并记录其染色情况和菌体形态。
1.2.2.2 生理生化特征 根据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》方法,采用吲哚实验,过氧化氢实验、产酸产气、有无鞭毛以及碳水化合物发酵实验等对 1.2.1.2 抑菌实验中抑菌圈最大的乳酸菌菌株,进行生理生化鉴定。
1.2.2.3 分子生物学鉴定 基因组DNA提取:取1 mL菌液置于1.5 mL离心管中,按试剂盒的操作步骤提取总DNA。以总DNA作为模板,以27F(5'-A GAGAGTTTGGCTCAG-3')和 1492R(5'-GGTTAC TTGTTACG ATT-3')为引物进行PCR扩增。PCR扩增条件:94 ℃ 3 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃1 min,共 35 个循环,总体系为 25 μL。将琼脂糖凝胶电泳胶条放入EB染色液中染色20 min,观察电泳条带,最后将扩增后的产物送至上海生工进行测序。
16S rDNA序列分析:首先在NCBI使用BLAST对测序结果进行分析,找到同源性近的模式菌株序列;然后使用MAGE-X软件进行系统发育树的构建。最后,向GenBank数据库提交菌株的16S rDNA序列,获得登录号。
1.2.3 抗菌肽的粗提方法研究 抗菌肽常以微量级别存在于野生环境当中,粗提方法的选择和浓缩是纯化抗菌肽的关键。本研究以strain B39(10CFU/mL)为指示菌,采用1.2.1.2中的双层琼脂扩散法测定抑菌效果。以筛选出的菌株的CFS溶液500 mL作为原料进行抗菌肽的粗提,浓缩40倍后,探究了有机溶剂萃取法、硫酸铵沉淀法等方法的粗提效果。
1.2.3.1 有机溶剂萃取法 根据相似相容原理,使用乙酸乙酯、正丁醇对CFS进行萃取,以得到抗菌肽粗提取物。首先,两种有机溶剂分别与CFS溶液按1:1的比例充分混合后,提取有机相溶液,然后在真空旋转蒸发仪除去有机溶剂,保留沉淀。用 5 mmol/L PBS(pH6)重悬,最终体积浓缩40倍,获得抗菌肽粗提物溶液,置于4 ℃下,备用。
1.2.3.2 醇沉水提法 采用醇沉水提法提取抗菌肽。首先,将CFS在真空旋转蒸发仪(45 ℃)中浓缩10倍,向浓缩液中加入95%无水乙醇并搅拌均匀,保证最终溶液中无水乙醇的浓度为75%,然后在4 ℃ 下醇沉 12 h。最后,离心(4 ℃, 8000 r/min, 10 min)保留上清液,并在45 ℃条件下旋蒸浓缩4倍获得抗菌肽粗提物溶液,置于4 ℃下,备用。
1.2.3.3 硫酸铵沉淀法 根据4 ℃下硫酸铵饱和度表,向CFS中添加硫酸铵粉末至饱和度为60%、70%、80%、90%、100%。冰水浴搅拌溶解后,在4 ℃条件下,搅拌过夜。然后,离心(8000 r/min, 30 min)收集沉淀,向沉淀中加入5 mmol/L PBS(pH6),浓缩40倍,获得抗菌肽粗提物。
1.2.4 抗菌肽的特性研究
1.2.4.1 全波长扫描 使用BCA蛋白定量试剂盒测定抗菌肽溶液浓度,然后用无菌蒸馏水配制0.5 mg/mL经乙酸乙酯萃取的抗菌肽粗提物溶液,于200~800 nm波长范围内对其进行紫外光谱扫描分析。
1.2.4.2 抗菌肽产量与菌体生长的关系 将所得菌株按接种量2%(v/v)接种于MRS培养基,在37 ℃、150 r/min下培养24 h,每2 h取一次样,通过记录OD值,完成菌株生长曲线的绘制,同时记录pH的变化。使用strain B39作为指示菌,采用1.2.1.2中的双层琼脂扩散法检测各阶段抑菌效果,并绘制抑菌活性曲线。通过绘制菌体生长曲线与抑菌活性曲线,评价抗菌肽的产量与菌株生长的关系。
1.2.4.3 MIC的测定 采用二倍稀释法测定抗菌肽对枯草芽胞杆菌的最小抑菌浓度(The minimum inhibitory concentration, MIC)。MIC 具体的测定方法如下:首先,将512 μg/mL纯化的抗菌肽溶液用超纯水进行连续2倍稀释,以获得不同浓度的稀释液。然后,分别吸取不同浓度的稀释液50 μL等体积添加到含strain B39悬浮液(10CFU/mL)的96孔板中,37 ℃下培养12 h。具有最小抑菌效果的稀释液所对应的浓度即为最小抑菌浓度MIC。
1.2.4.4 时间杀菌曲线的绘制 将抗菌肽加入到strain B39悬浮液的对数中期(OD=0.6)溶液中,获得浓度为3 MIC的溶液, 以不加入抗菌肽的样品作为空白对照。将含有抗菌肽的菌悬液在37 °C下培养12 h,每小时取一次样,使用紫外-可见分光光度计在600 nm处记录菌体生长的变化,同时进行平板菌落活菌计数(CFU/mL),样品用无菌生理盐水稀释后,涂布PCA琼脂板上,于37 ℃下培养12 h,观察并统计活菌数。
1.3 数据处理
以上所测数据均设置3个平行,以平均值±标准差方式呈现。利用SPSS 25.0统计软件分别对数据进行处理与分析,Origin 9.0 软件绘制主成分图谱。
2 结果与分析
2.1 产抗菌肽乳酸菌的筛选
本研究共从泡菜样品中分离得到168株菌株,在经过筛选后,有8株菌株对枯草芽胞杆菌表现出明显的抑制效果,不同菌株的抑制效果如表1所示。在排除有机酸的影响后,抑菌圈均有些许的减小,但仍具有显著的抑菌活性。去除过氧化氢后,发酵液抑菌直径没有明显变化。其中,WUH3具有最强的抑制效果,CFS抑菌圈直径最大,在排除有机酸和过氧化氢的影响后,抑菌效果仍明显,抑菌直径可达25.13±0.10 mm。故选取WUH3作为目的菌株,进行后续试验。
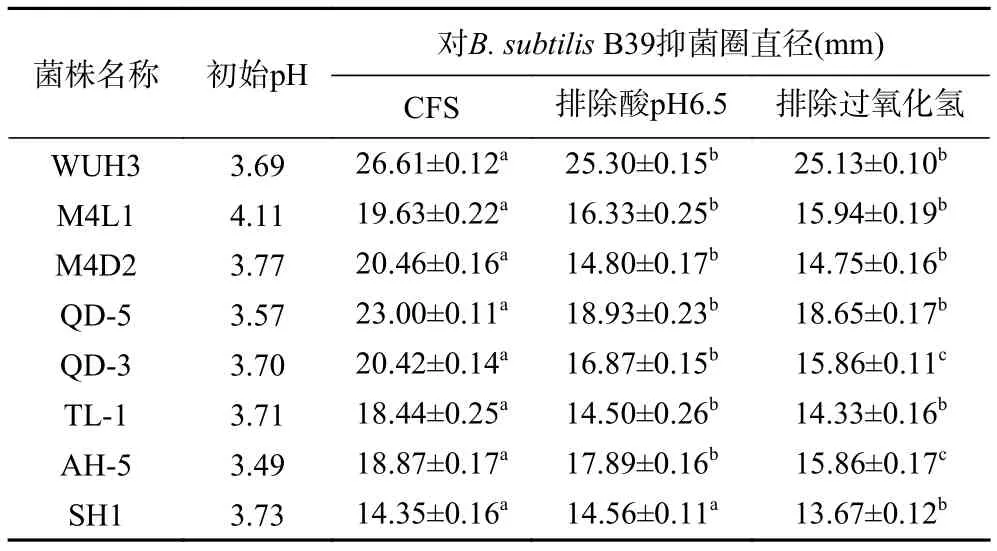
表1 优势菌对枯草芽胞杆菌的抑制作用Table 1 Inhibitory effect of dominant bacteria on B.subtilis strain B39
2.2 菌株的鉴定
2.2.1 形态学鉴定 在 MRS 固体培养基上用划线稀释法分离乳酸菌菌株。将接种后的培养基置于37 ℃培养箱内培养48 h,观察培养基表面形成的乳酸菌的形态,其结果如图1所示,菌落颜色为白色,形状为圆形,边缘为全缘,凸起,菌落直径在1~2 mm范围内。

图1 WUH3的形态学特征Fig.1 Morphological features of WUH3
2.2.2 生理生化特征 对菌株WUH3 进行生理生化实验鉴定,结果见表2。该菌株过氧化氢实验阴性、吲哚阴性、不产气、无鞭毛、不运动、不液化明胶、不还原硝酸盐;可以利用葡萄糖、蔗糖、果糖、半乳糖、鼠李糖、乳糖和木糖。将鉴定结果与《伯杰氏细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》中对乳杆菌的生理生化实验鉴定结果相对比,可初步鉴定所分离的菌株WUH3为乳杆菌属。

表2 菌株WUH3生理生化鉴定结果Table 2 Physiological and biochemical identification results of strain WUH3
2.2.3 分子生物学鉴定 如图2所示,WUH3的PCR扩增产物在1%(W/V)琼脂糖凝胶电泳中于1000~2000 bp处形成1条清晰的扩增条带。以乳杆菌属(spp.)中的模式菌株为参考菌,采用MAGE-X软件构建WUH3的系统发育树(图3)。根据构建的系统发育树,WUH3与植物乳杆菌()在同一分支,同时与戊糖乳杆菌()亲缘关系最近, 其次为植物乳杆菌阿根廷亚种(subsp.)。

图2 菌株WUH316S rRNA基因的PCR检测结果Fig.2 Electrophoresis pattern of PCR products of strain WUH3 16S rRNA gene
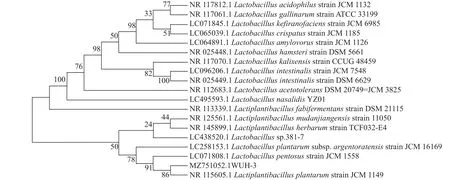
图3 基于16S rRNA基因序列构建的WUH3系统发育树Fig.3 Phylogenetic tree of WUH3 based on 16S rRNA gene sequence
通过菌落形态观察、分子生物学鉴定和系统发育树分析,表明菌株WUH3为,已获得其GeneBank数据库登录号为MZ751052.1。
2.3 抗菌肽的粗提方法研究
为了浓缩并最大程度地保留WUH3 CFS中抑菌物质的活性,本研究探索了不同的粗提方法。以strain B39为指示菌研究不同方法的粗提效果,其结果如表3所示。由表可知,乙酸乙酯的萃取效果最好,水相中仅有少部分抑菌活性物质残留,乙醇和正丁醇萃取过程中,抑菌物质活性损失较大,且有机相中保留的活性较低。在饱和硫酸铵沉淀实验中,浓度为70%和80%时沉淀效果最好,但还有一大部分抑菌物质残留在上清液中,未被提取出来。综合对比,抑菌物质提取率最大的是有机溶剂乙酸乙酯萃取法,其最大程度地保留了抑菌物质的活性,故本实验选择乙酸乙酯萃取作为后续实验抗菌肽的粗提方法。
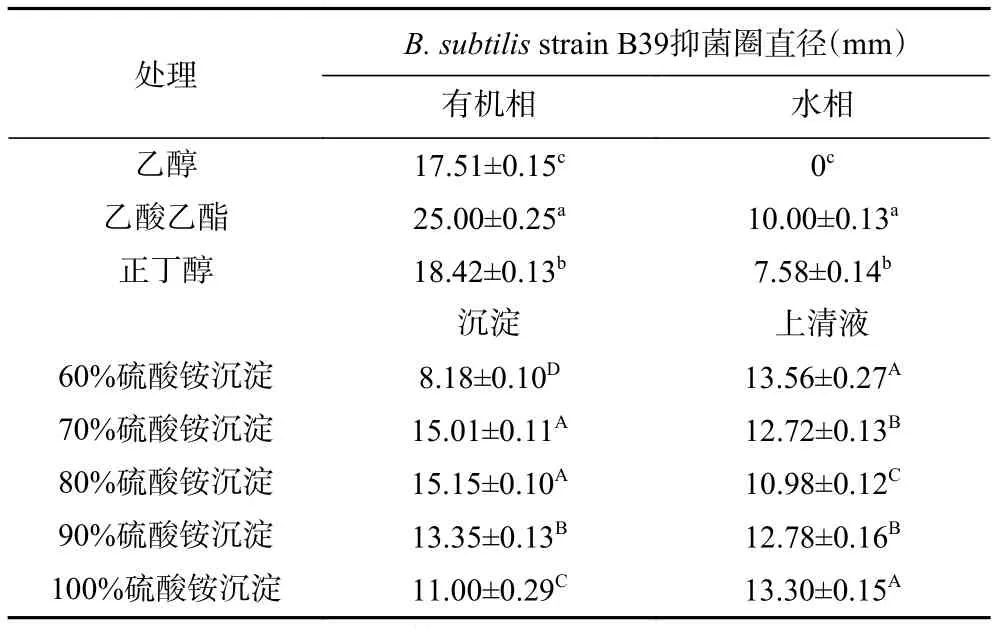
表3 不同粗提方法处理CFS后保留的抑菌活性Table 3 Reserved antibacterial activity of CFS treated by different crude extraction methods
2.4 抗菌肽的特性研究
2.4.1 全波长扫描 BCA蛋白浓度标曲为y=1.5314-0.0032,=0.9996。对粗提得到的抗菌肽进行紫外全波长扫描,其结果如图4所示。WUH3所产抗菌肽在280 nm附近有单的强吸收峰,这是肽键在远紫外区特有的吸收特征。进一步蛋白酶敏感实验结果表明,在经蛋白酶处理过后,粗提物抑菌活性消失,说明该抑菌物质具有蛋白类物质的特性,故证明所得抗菌肽为一种蛋白或多肽类物质。
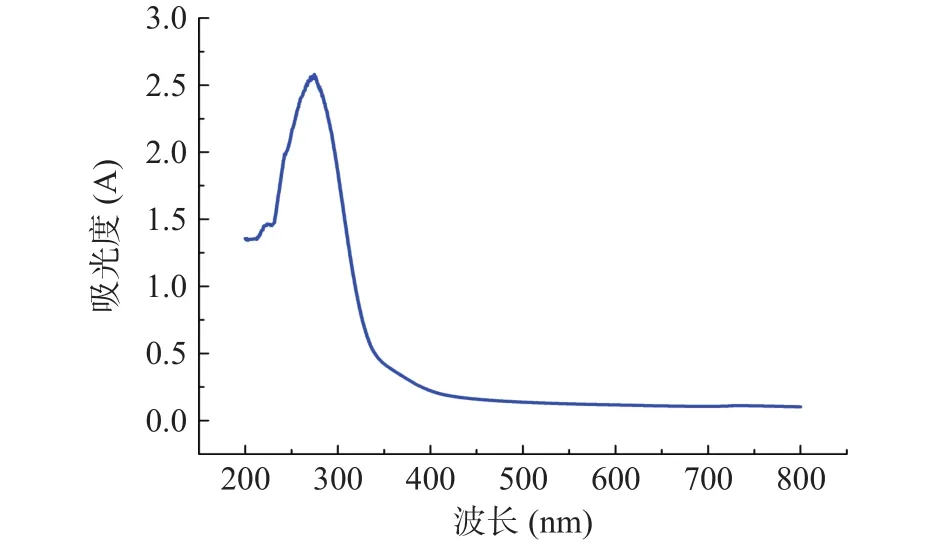
图4 L.plantarum WUH3所产抗菌肽粗提物的紫外全波长扫描图Fig.4 Ultraviolet full wavelength scanning of crude extracted AMP produced by L.plantarum WUH3
2.4.2 抗菌肽产量与菌体生长的关系 为确定WUH3生长过程中抗菌肽产量的变化,连续24 h监测菌体在MRS培养基中的吸光度值、pH和抗菌肽的抑菌活性。由图5可知,WUH3菌体在第6 h开始产生抗菌肽,之后,随时间的增加,其抑菌活性不断增加,在第18 h抑菌活性开始保持平稳。此时,通过OD监测得知,菌体的生长进入了稳定期。在菌体生长期间,整个菌体发酵液的pH不断地下降,证明WUH3在生长过程中会不断产生酸类物质直至稳定期。该结果表明,在菌体生长达到稳定期时,为抗菌肽的最佳收获时期。
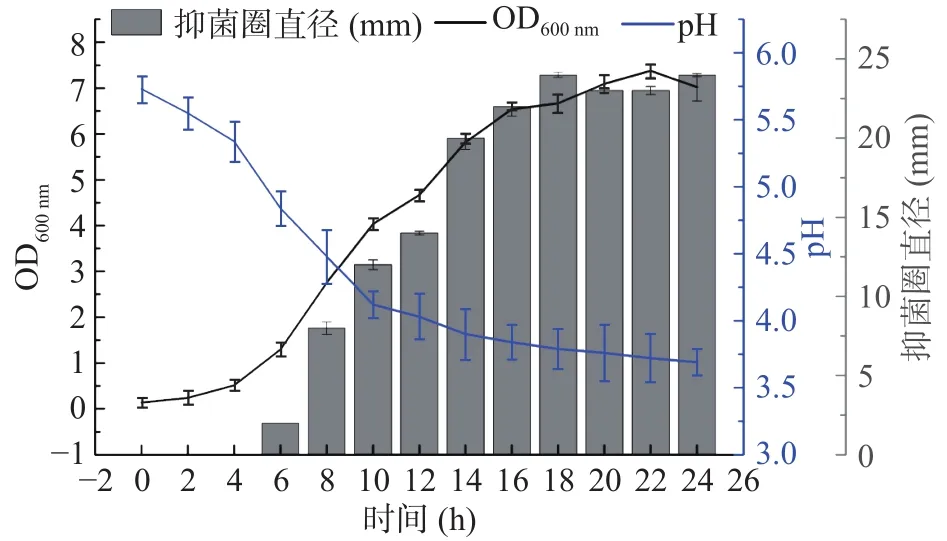
图5 L.plantarum WUH3的抗菌肽产量与菌株生长时间的相关性Fig.5 Correlation between the yield of AMP and the growth time of L.plantarum WUH3
2.4.3 MIC MIC是评价抑菌物质抑菌能力的一个重要指标。本实验通过二倍稀释法测定了所得抗菌肽的MIC值。将抗菌肽溶液进行连续的2倍稀释后,使用稀释液进行抑菌实验,结果如图6所示,连续稀释5次后,抑菌效果依然明显,OD均为0。在大于5次的稀释倍数下,抗菌肽抑制效果减弱,指示菌strain B39浊度逐渐增加。通过BCA蛋白浓度试剂盒测定其MIC蛋白浓度为16 μg/mL。

图6 不同浓度的抗菌肽对B.subtilis strain B39的抑制作用Fig.6 Inhibition effect of the AMP with different concentrations on B.subtilis strain B39
2.4.4 时间杀菌曲线 抗菌肽作用方式通常包括抑菌和杀菌两种,为探究WUH3所产抗菌肽的作用机制,向枯草芽胞杆菌生长对数期培养液中加入抗菌肽,获得终浓度为 48 μg/mL(3 MIC)的混合溶液,以未添加抗菌肽培养液作为对照,分别测定两者的OD,并进行平板菌落活菌计数,其结果如图7所示。在strain B39生长至第3.5 h时加入抗菌肽,与对照组相比,可以明显观察到加入抗菌肽后,溶液的吸光度不再发生变化。通过菌体平板计数结果发现,加入抗菌肽后,活菌数骤减,且在第9 h时,在PCA计数板上已经观察不到任何strain B39菌体的生长。以上结果表明,该抗菌肽的作用方式为杀菌。

图7 时间杀菌曲线Fig.7 Time-killing curve
3 结论
乳酸菌作为一种公认的食品安全菌,其所生产的抗菌肽的抑菌能力得到了广泛的认可。本研究以农家泡菜样品作为原料,在排除有机酸和过氧化氢的影响后,采用双层琼脂扩散法筛选出1株对枯草芽胞杆菌有明显抗菌作用的乳酸菌菌株——WUH3。试验发现使用乙酸乙酯进行萃取可以获得最好的抗菌肽粗提效果,紫外全波长扫描结果显示该物质肽类特征吸收峰显著,其在菌体生长达到稳定期(18~24 h)时达到最大产量。进一步的研究表明,该抗菌肽的最小抑菌浓度MIC为16 μg/mL,且其在3 MIC条件下,对枯草芽孢杆菌具有杀菌作用。
综上所述,WUH3对常见腐败菌——枯草芽胞杆菌具有明显的抑制效果,具有成为新型的天然防腐剂的潜在价值。本试验研究了使用乳酸菌抗菌肽进行抑菌,为摒弃传统化学防腐剂抑菌方法,开发抑制枯草芽胞杆菌的新型防腐剂提供了一定的参考价值。
