基于人工神经网络耦联遗传算法(BP-GA)优化干酪乳杆菌LTL1361冻干保护剂配方
2022-10-27张曦予李锐定莫明规梅丽华刘玉萍朱雯君李全阳
张曦予,李锐定,莫明规,梅丽华,刘玉萍,朱雯君,李全阳,
(1.广西大学轻工与食品工程学院,广西南宁 500004;2.柳州市康小乐牛奶有限公司,广西柳州 545007;3.柳州市十二中学,广西柳州 545026)
益生菌是一类人体摄入后能够改善胃肠道功能、增强免疫力并且提高人体对食物营养吸收的活体微生物。干酪乳杆菌是一种重要的益生菌,在2001年就被国家卫生部公布为可食用菌株,风靡世界的养乐多代田株和张猛等的Zhang都是干酪乳杆菌。研究表明,干酪乳杆菌可以很好地定植于人体肠道上皮细胞并通过代谢产生短链脂肪酸等,使肠道环境pH降低,从而有效地抑制相关致病菌在肠道内的生长繁殖,因此与干酪乳杆菌相关的益生产品在市场上得到了广泛认可和应用。
真空冷冻干燥是在真空条件下,使水分直接气化而脱离物质,从而延长物料的贮藏期并保持其活性的一种技术,也是目前制备高质量乳酸菌制剂的重要方法之一。但在进行真空冷冻干燥过程中,由于多种因素变化而造成菌体细胞的损伤从而导致菌体活性降低甚至死亡,这就需要加入相应的冻干保护剂以此减缓冷冻干燥过程对菌体造成的损伤。冻干保护剂类型主要分为糖类、蛋白质类、醇类、氨基酸类以及抗氧化物类,醇类与糖类可以通过替代水在菌体表面形成氢键,以此来保护细胞膜的稳定,减少冻干过程造成的损害;氨基酸类保护剂通过进入细胞,抑制细胞内冰晶的生长以此来减缓冻干过程对细胞的损害;蛋白质类保护剂在细胞表面形成蛋白膜,降低加工过程对于菌体的影响。相关研究表明,依据不同类型的菌种进行不同的保护剂组合可以提高在真空冷冻过程中菌株的活性及存活率。
选择合适的冻干保护剂组合可以更好地提高菌种真空冷冻干燥后的存活率,但由于不同菌株在冷冻干燥过程中生理生化反应不同,并且复配保护剂成分复杂,与菌株的冻干存活率呈现非线性关系,传统的优化模型不能很好地完成此类冻干保护剂的筛选工作。而人工神经网络能很好地解决复杂非线性关系的问题,其中,误差反向传播神经网络(Error Back Propagation Neural Network,BPN)作为人工神经网络(Artificial Neural Network,ANN)中最具广泛性和代表性的一种模型,该模型可以在物理结构上对人体大脑进行模拟。通过输入数据即可进行自主学习训练与模拟,拟合程度高,在处理非线性关系时具有显著优势。遗传算法(Genetic Algorithms,GA)是基于Darwin自然选择学说以及Mendel遗传定律的全局寻优算法,可以不需要知道目标的具体数学模型而模拟出最优解。研究表明,利用BP神经网络与遗传算法相结合进行全局寻优,与传统的回归模型相比具有更高的准确性。郭慧慧利用BP神经网络遗传算法模型对苏云金芽胞杆菌发酵培养基进行优化,研究发现与响应面试验优化相比,BP-GA模型优化后的发酵培养基产孢量比响应面试验优化结果高出7.7%;王恒的研究发现,在优化马尾松树脂降解发酵培养基时,经过BP神经网络优化培养基的降解效率比响应面试验优化结果高出4.9%。目前,BP-GA已经广泛应用在发酵培养基优化方面,但对于乳酸菌的冻干保护剂配方优化方面应用较少。
为此,本试验以提高干酪乳杆菌LTL1361的冻干存活率为目标,探究单因素实验对菌株存活率的影响,通过Plackett-Burman试验设计找出主效应因子,采用BP-GA神经网络拟合出干酪乳杆菌LTL1361冻干保护剂的最优复配配方,探求具有高冻干存活率的干酪乳杆菌冻干制剂,以期为干酪乳杆菌LTL1361后续工业化生产提供基础与参考。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌LTL1361(LTL 1361) 由本团队分离筛选自广西巴马瑶族自治县健康百岁老人的粪便,已保藏于中国典型培养物保藏中心(保藏号:CCTCC NO:M2019018);MRS 液体培养基(大豆蛋白胨10 g/L,酵母浸提粉5 g/L,牛肉膏10 g/L,葡萄糖20 g/L,乙酸钠5 g/L,柠檬酸铵2 g/L,磷酸氢二钾 2 g/L,MgSO•7HO 0.58 g/L, MnSO•4HO 0.25 g/L,吐温80 1 g/L) 北京奥博星生物技术有限公司;MRS固体培养基(在MRS液体培养基的基础上添加15 g/L琼脂) 北京奥博星生物技术有限公司;蔗糖、海藻糖、麦芽糊精、葡萄糖、谷氨酸、半胱氨酸、抗坏血酸、山梨醇、甘油、甘露醇 标准品,广东康达生物科技有限公司;脱脂乳 内蒙古伊利实业集团股份有限公司;低聚异麦芽糖、低聚木糖、水苏糖、菊粉 山东齐鲁生物科技有限公司;其它试剂 均为国产分析纯。
Lyo Quest真空冷冻干燥机 南京新飞达光电科学技术有限公司;DHP-9272D电热恒温培养箱上海齐欣科学仪器有限公司;GR85DP立式自动压力蒸汽灭菌锅 致微(厦门)仪器有限公司;TG16W高速离心机 湖南湘仪试验室仪器开发有限公司。
1.2 实验方法
1.2.1 菌种活化 将保存于-80 ℃冰箱的干酪乳杆菌LTL1361冷冻菌株放置于无菌条件下,室温解冻,菌液划线培养于MRS固体培养基,并放置于37 ℃恒温培养箱进行24 h的活化培养。取平板上的单菌落接入MRS液体培养基中于37 ℃恒温培养12 h。
1.2.2 干酪乳杆菌LTL1361的真空冷冻干燥工艺流程 参考文献[19]进行干酪乳杆菌LTL1361菌株真空冷冻干燥处理。首先将干酪乳杆菌LTL1361经MRS固体培养基活化,并以2%的接种量接种于MRS液态培养基中。于37 ℃恒温培养12 h后,4000 r/min、4 ℃离心10 min,弃去上清液并以无菌的生理盐水洗涤两次,得到菌泥。将菌泥与冻干保护剂按照10:1的比例均匀混合后进行分装,并置于-80 ℃进行4 h的预冻,预冻结束后放入真空冷冻干燥机 24 h 的冻干(-50 ℃,真空度<15 Pa),得到呈现絮状干燥的冻干菌剂。
1.2.3 单因素实验 研究表明,脱脂乳作为单一保护剂或者复合保护剂都对菌株有较好的保护作用,因此将其作为本实验的基础冻干保护剂将有利于提高菌株的冻干存活率。按照1.2.2的方法制备冻干菌剂,以菌株的冻干存活率为指标探究不同浓度脱脂乳(0%、6%、8%、10%、12%、14%)对干酪乳杆菌LTL1361冻干后活力的影响。再以脱脂乳最佳浓度为固定条件,分别添加不同浓度的糖类(2%、4%、6%、8%、10%)、多元醇(1%、2%、3%、4%、5%)、益生元(2%、4%、6%、8%、10%)、氨基酸(0.4%、0.6%、0.8%、1.0%、1.2%)、抗坏血酸(0、0.5%、1.0%、1.5%、2.0%、2.5%)等,探索不同浓度种类保护剂对干酪乳杆菌LTL1361冻干存活率的影响,找出最适宜的保护剂浓度,同时设置只添加脱脂乳组作为空白对照组。
1.2.4 Plackett-Burman试验设计 将浓度为10%脱脂乳作为基础保护剂,同时根据2.1中的单因素实验结果,以干酪乳杆菌LTL1361的冻干存活率为响应值,评价海藻糖、谷氨酸、低聚木糖、抗坏血酸及甘露醇5个影响因素,筛选出影响冻干存活率的显著因素,每个因素取最低(-1)和最高(1)两个水平,共12组试验。试验因素和水平取值见表1。

表1 Plackett-Burman试验设计因素及水平Table 1 Factors and level of Plackett-Burman experimental design
1.2.5 Box-Behnken试验设计 依据Plackett-Burman试验所得结果,选择脱脂乳浓度(A)、海藻糖浓度(B)、谷氨酸浓度(C)以及甘露醇浓度(D)作为Box-Behnken试验的自变量,以干酪乳杆菌LTL1361冻干存活率为响应值进行试验设计。干酪乳杆菌LTL1361的Box-Behnken设计方案如表2所示。

表2 Box-Behnken试验设计因素与水平Table 2 Box-Behnken test design factors and level
1.2.6 冻干存活率的测定 将得到的冻干粉用无菌生理盐水与冻干前等体积复水,并充分振荡混匀,准确吸取100 μL菌悬液按合适的3个稀释倍数进行稀释并分别涂布在MRS固体培养基后计数。冻干存活率(Lyophilisation Survival Rate,LS,%)的计算公式如式(1)所示:

式中:LS表示冻干后的存活率,%;N表示冻干后的活菌数,CFU/mL;N表示冻干前的活菌数,CFU/mL。
1.2.7 BP神经网络构建 参考文献[21]中的方法并稍作修改,采用由输入层、隐藏层和输出层构建的三层BP神经网络模型。将通过单因素实验和Plackett-Burman试验确定的脱脂乳、海藻糖、谷氨酸以及甘露醇的浓度作为BP神经网络模型的输入层神经元,菌株的冻干存活率为输出层神经元,利用经验公式(2)计算出隐含层的节点数,从而构建4-m-1的网络结构,具体BP神经网络运行流程图如图1所示。选取80%的Box-Behnken数据用于训练,10%用于测试,10%用于验证,以完成BP人工神经网络的自我学习训练和预测。

图1 BP神经网络运行示意图Fig.1 Schematic diagram of BP neural network operation

式中:M表示隐含层节点数;N表示输入层节点数;L表示输出层节点数;a表示[1,10]的常数。
1.2.8 遗传算法(GA)进行冻干保护剂配方寻优 基于1.2.7所构建的BP神经网络,将其与GA结合构建BP-GA模型对干酪乳杆菌LTL1361的冻干保护剂配方寻优。设置最大遗传代数为100,变量的二进制位数为8,变异概率为0.01,交叉概率为0.8,代沟0.25,运行Matlab R2019b程序,得到每代种群平均适应度变化结果,以此寻找到函数的全局最优值。
1.2.9 响应面与BP-GA神经网络优化模型比较依据邹立飞等的研究方法,通过比较均方根误差(Root mean square error,RMSE)、平均绝对偏差(Mean Absolute Error,MAE)和决定系数()的大小来判断模型预测值与真实值差异性以及模型的可靠性,当RMSE以及MAE越小,越接近1时说明模型的可靠性以及拟合性更强。
1.3 数据处理
Design Expert V10.0.7软件分别进行Plackett-Burman试验和响应面试验设计以及结果分析;SPSS 25和Graphpad Prism 7.0软件用于显著性分析和作图;Matlab R2019b软件用于BP-GA神经网络构建的实现。为保证试验的准确性,每次试验进行三次平行试验并用其平均值进行分析运算。
2 结果与分析
2.1 单因素实验结果
2.1.1 脱脂乳粉添加量对干酪乳杆菌LTL1361冻干存活率的影响 由图2可以看出,添加了脱脂乳作为保护剂的菌株冻干存活率显著高于未添加保护剂组的菌株冻干存活率(<0.05)。且随着脱脂乳浓度的增加,干酪乳杆菌LTL1361的冻干存活率呈现先增大后减小的趋势。当脱脂乳浓度较低时,菌株进行冷冻干燥处理,由于脱脂乳不足以完全覆盖菌株细胞,导致细胞有一部分裸露在环境中,此时脱脂乳的保护效果不佳,菌株的冻干存活率较低。当脱脂乳浓度过量,导致体系渗透压升高,细胞结构被破坏,冻干存活率下降,过高或过低的脱脂乳含量都在一定程度上影响着菌株的冻干存活率。当脱脂乳浓度达到10%时,干酪乳杆菌LTL1361冻干存活率达到最大值43.33%±1.54%;因此,脱脂乳的最佳添加量为10%。
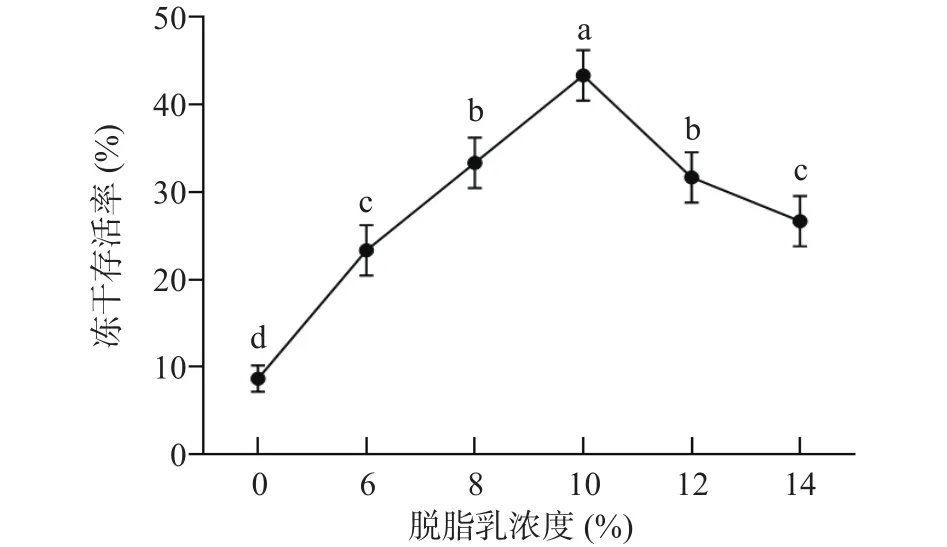
图2 脱脂乳粉添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.2 Effect of skim milk powder addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
2.1.2 不同糖类添加量对干酪乳杆菌LTL1361冻干存活率的影响 由图3可以看出,海藻糖对干酪乳杆菌LTL1361菌株的保护效果显著优于其他糖类物质(<0.05),并随着海藻糖浓度的不断增大,干酪乳杆菌LTL1361冻干存活率呈现先增大后减少的趋势,当海藻糖浓度为8%时,干酪乳杆菌LTL1361的冻干存活率达到最大值73.67%±2.34%,;过高浓度引起细胞内外渗透压失衡,导致细胞脱水,而过低的海藻糖浓度不能充分代替脱去的水分子与磷脂分子结合,降低了对细胞膜稳定性的维持效果,过高或过低浓度对菌株的冻干保护效果均不佳。当海藻糖浓度在6%~10%范围内时,海藻糖能很好地维持细胞膜的稳定性,此时冻干保护效果最佳,因此选择海藻糖浓度为6%~10%进行下一步实验。

图3 糖类物质添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.3 Effect of carbohydrate addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
2.1.3 不同醇类添加量对干酪乳杆菌LTL1361冻干存活率的影响 从图4可以看出,添加了多元醇作为冻干保护剂的菌株冻干存活率都显著高于对照组(<0.05),这可能是由于醇类物质作为渗透性保护剂能进入细胞抑制冰晶的生成,从而减缓了冷冻干燥过程对细胞的损伤。醇类物质的冻干存活率均上升到最大值后缓慢下降,这可能是由于醇类物质浓度过高时,导致胞内溶质过多,此时细胞内外渗透压失衡,细胞结构遭到破坏,菌株活力下降。醇类物质的冻干存活率均呈现先上升后逐步下降的变化趋势。对比发现甘露醇对干酪乳杆菌LTL1361的冻干保护效果显著高于其他醇类物质(0.05)且在添加量为3%时达到冻干存活率最大值68.4%。同时,当甘露醇浓度在2%和4%时对菌株的保护效果均明显高于其他浓度。综上所述,选择浓度范围在2%~4%甘露醇进行下一步实验。
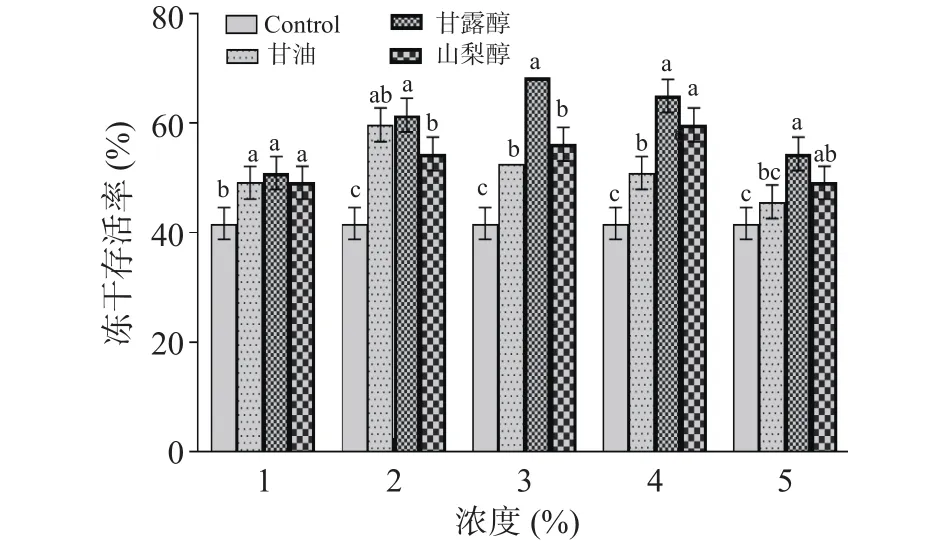
图4 醇类物质添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.4 Effects of alcohol addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
2.1.4 不同益生元类添加量对干酪乳杆菌LTL1361冻干存活率的影响 由图5可以看出,添加了益生元作为冻干保护剂的菌株冻干存活率都显著高于对照组(<0.05),这可能是由于益生元通过在菌株细胞膜表面形成覆盖层,在一定程度上能维持菌株细胞膜表面溶剂化,减少菌株在冷冻干燥过程中胞内水分外流的现象,保持了菌株活性。益生元浓度过高或过低都会影响菌株的冻干存活率,浓度过高时会引起细胞内外渗透压失衡,胞内水分向外渗透,菌株的存活率明显下降,而浓度过低时由于益生元不能很好地“包裹”细胞,造成细胞损伤、菌株死亡。因此,选择合适的浓度对提高菌株存活率有重要影响。通过对比可知,低聚木糖对于菌体的保护效果显著高于其他益生元(<0.05),在6%的浓度时冻干存活率达到最高64.67%±1.89%,低聚木糖浓度在4%和8%时对菌株的保护作用也较为明显。综上,选择浓度范围为4%~8%的低聚木糖进行下一步试验探究。
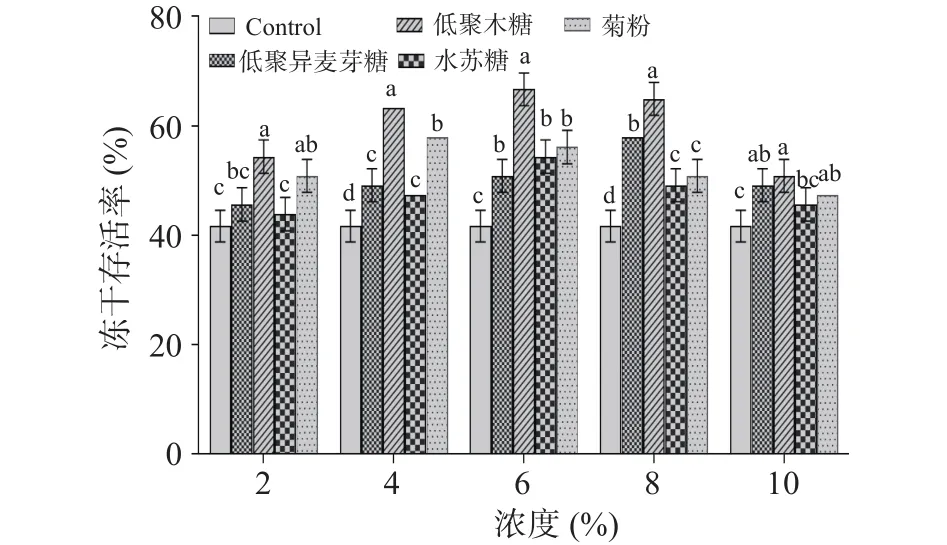
图5 益生元类物质添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.5 Effects of prebiotics addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
2.1.5 不同氨基酸类添加量对干酪乳杆菌LTL1361冻干存活率的影响 通过图6可知,添加氨基酸类物质作为保护剂的菌株存活率显著高于对照组菌株存活率(<0.05),这可能是由于氨基酸类物质能更好地与菌株细胞中的蛋白质相结合,当进行脱水处理时能较好地稳定蛋白质结构,避免因环境失水造成的蛋白质凝集现象,从而起到对菌株的保护作用。随着氨基酸浓度的上升,冻干存活率呈现先上升后下降的趋势,这可能是由于进入胞内的氨基酸类物质过多而造成细胞蛋白质结构遭到破坏,细胞稳定性下降,导致菌株死亡。相较谷氨酸与半胱氨酸,谷氨酸的冷冻保护效果显著高于(0.05)半胱氨酸并在0.8%浓度时保护效果最好,冻干存活率达到69.47%±0.76%。同时,当半胱氨酸浓度在0.6%和1.0%时对菌株保护效果也较好,综合选择0.6%~1.0%浓度的谷氨酸进行下一步实验。

图6 氨基酸类物质添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.6 Effect of amino acid addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
2.1.6 抗坏血酸不同添加量对干酪乳杆菌LTL1361冻干存活率的影响 由图7可以看出,添加了抗坏血酸作为保护剂的菌株冻干存活率显著高于对照组(<0.05),这可能是由于抗坏血酸属于渗透性小分子保护剂,同时具有抗氧化功能,能减少冷冻干燥过程对菌株造成的氧化损伤,维持菌株活性。随着抗坏血酸浓度不断上升,在1.0%浓度时达到最大的冻干存活率66.43%±1.67%,之后菌株冻干存活率有所下降,这是由于抗坏血酸浓度过高会影响菌株自身内部的代谢,从而影响菌株存活率。对比可知,当抗坏血酸浓度在0.5%和1.5%时,菌株的冻干存活率也较高,对菌株的保护效果较好。因此,选择0.5%~1.5%浓度范围的抗坏血酸作为冻干保护剂进行下一步试验。

图7 抗坏血酸不同添加量对干酪乳杆菌LTL1361冻干存活率的影响Fig.7 Effects of ascorbic acid addition on survival rate of Lactobacillus casei LTL1361 during lyophilization
综上所述,本试验选择海藻糖、抗坏血酸、甘露醇、谷氨酸以及低聚木糖进行下一步的优化试验。
2.2 影响干酪乳杆菌LTL1361冻干存活率的关键因素的确定
结合单因素实验结果,选定N=12的Plackett-Burman试验设计,其试验设计以及结果如表3所示。采用Design Expert V10.0.7软件对表3中的数据进行分析,得到以LTL1361冻干存活率为响应值的最优方程为式(3)。

表3 Plackett-Burman试验设计因素及水平Table 3 Factors and level of Plackett-Burman experimental design

式中:Y表示冻干存活率,%;X表示海藻糖浓度,%;X表示低聚木糖浓度,%;X表示谷氨酸浓度,%;X表示抗坏血酸浓度,%;X表示甘露醇浓度,%。
由表4可以看出,此模型的值小于0.01,表明该拟合模型极显著。通过显著性分析结果可知,海藻糖、谷氨酸以及甘露醇这三种物质的><0.01说明这三个因素对菌株冻干存活率的影响极显著,且对干酪乳杆菌LTL1361冻干存活率的影响大小排序为:海藻糖>谷氨酸>甘露醇,均为正向效应。因此,在响应面优化及人工神经网络优化试验中重点考察上述三个因素及基础保护剂(脱脂乳)之间的交互作用对干酪乳杆菌LTL1361菌株冻干存活率的影响。

表4 Plackett-Burman试验方差分析结果Table 4 Analysis of variance result of Plackett-Burman experimental
2.3 响应面试验优化
在Plackett-Burman试验的基础上进一步设计Box-Behnken试验,进行了N=29的四因素三水平的响应面分析试验,所得的试验设计和结果见表5与表6。以干酪乳杆菌LTL1361的冻干存活率为响应值,对试验所得的结果进行拟合分析,得到二元多次项回归方程如下:Y=84.67+0.47A+2.17B+0.38C+2.57D+5.57AB+1.64AC+2.29AD-0.27BC-2.28BD+0.07CD-7.75A-4.83B-6.54C-1.73D,式中Y表示冻干存活率。由表6可知模型的<0.01,说明模型中多元回归关系极显著,失拟项值为0.1472(>0.05)失拟不显著,说明方程拟合充分,实验误差小,可以较好的表现响应值与各因素间的关系。该模型=0.9148,说明回归方程与实验数据的拟合程度达到91.48%。综上所述,该回归方程可以用来确定冻干保护剂的最优配比。通过Design Expert V 10.0.7软件进行计算,得到最佳配比为脱脂乳10.529%、海藻糖8.212%、谷氨酸0.807%及甘露醇3.842%时,干酪乳杆菌LTL1361的冻干存活率到达最大为86.84%,验证条件为脱脂乳10.50%、海藻糖8.20%、谷氨酸0.80%和甘露醇3.8%,在此条件下进行三次试验验证,得到实际冻干存活率为85.93%±0.45%。

表5 Box-Behnken试验设计的因素及水平Table 5 Factors and levels of Box-Behnken experimental design

表6 Box-Behnken响应面试验的回归模型及方差分析Table 6 Regression model and variance analysis of Box-Behnken response surface test
2.4 BP神经网络构建与结果
2.4.1 BP神经网络构建 利用Matlab R2019b软件对Box-Behnken试验结果进行BP神经网络分析,以“tansig”、“purelin”函数分别作为输入层与隐含层的传递函数以及隐含层和输出层之间的传递函数,“trainlm”作为训练函数,构建三层BP神经网络模型。以脱脂乳、海藻糖、谷氨酸以及甘露醇的浓度作为4个输入神经元,中间一个隐藏层,以冻干存活率作为一个输出神经元。其中,隐藏层神经元数M由式(2)赋予其实际意义,得取值范围为[3,13]。经过10000次训练,训练步长为10,动量因子为0.1,训练到目标误差为0.0001时停止训练,得到隐藏层中含有12个神经元时测试集MSE最小和最大。由此得到本试验构建最佳的网络拓扑结构为4-12-1,如图8所示。

图8 BP神经网络拓扑结构Fig.8 BP neural network topology
2.4.2 BP神经网络构建结果 利用上述构建的BP神经网络对试验数据集进行训练,其中,相关系数值表示BP人工神经网路模型与输出结果的拟合度。在最佳神经网络模型的基础上,将试验的实际测试值与模型训练、验证值进行比较。由图9可以看出试验真实值与训练、验证值得拟合效果以及相关性系数,训练数据、验证数据、测试数据以及所有数据的相关系数分别为0.9980、0.9983、0.9446以及0.9874。上述四种样本的相关系数都达到0.90以上,说明构建的BP模型对于训练、验证、测试样本都具有很好的拟合能力。综上所述,构建的BP人工神经网络模型对于试验结果有良好的预测性,因此可以用此模型对干酪乳杆菌LTL1361冻干保护剂配方进行优化。
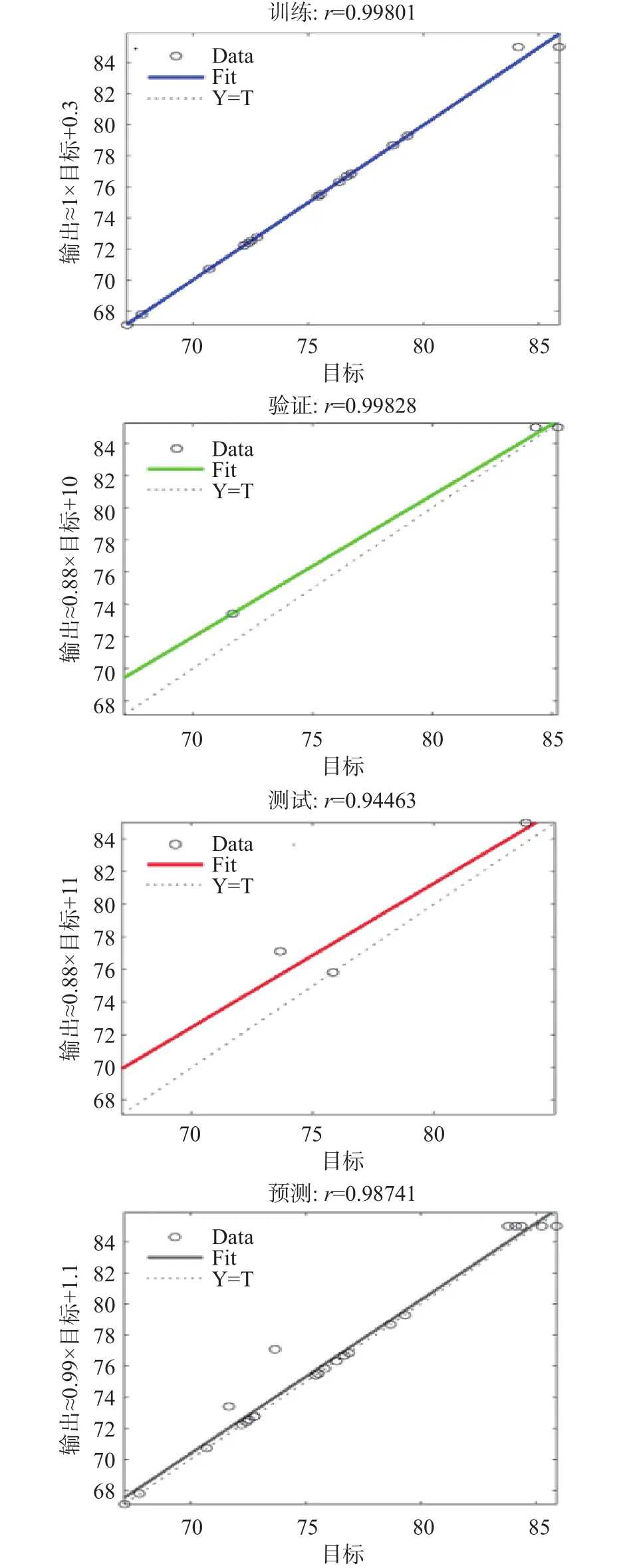
图9 训练、验证、测试以及所有数据与BP神经网络仿真输出值的拟合效果Fig.9 Training, validation, testing and fit of all data to the BP neural network simulation output values
2.5 遗传算法优化结果
在上述工作的基础上,利用BP神经网络调节函数的适应度,并以干酪乳杆菌LTL1361的冻干存活率作为输出值,将BP神经网络与遗传算法进行耦联对冻干保护剂配比进行全局寻优,依据试验方法1.2.8来设置遗传算法寻优过程的参数,寻优过程如图10,图中最优价值为冻干存活率(%)的倒数。从图中可知,进行遗传算法模拟生物在进化过程中所经历的自然选择压力,适应度曲线在遗传模拟进行近80代之后趋于平稳,得到最优价值为0.011252,经计算干酪乳杆菌LTL1361冻干存活率最大预测值88.87%。此时的最佳冻干保护剂配方为:脱脂乳10.32%、海藻糖6.73%、谷氨酸0.84%和甘露醇3.98%。验证试验选择保护剂浓度为10.3%、6.7%、0.8%以及4.0%,测得冻干存活率为89.56%±1.83%。
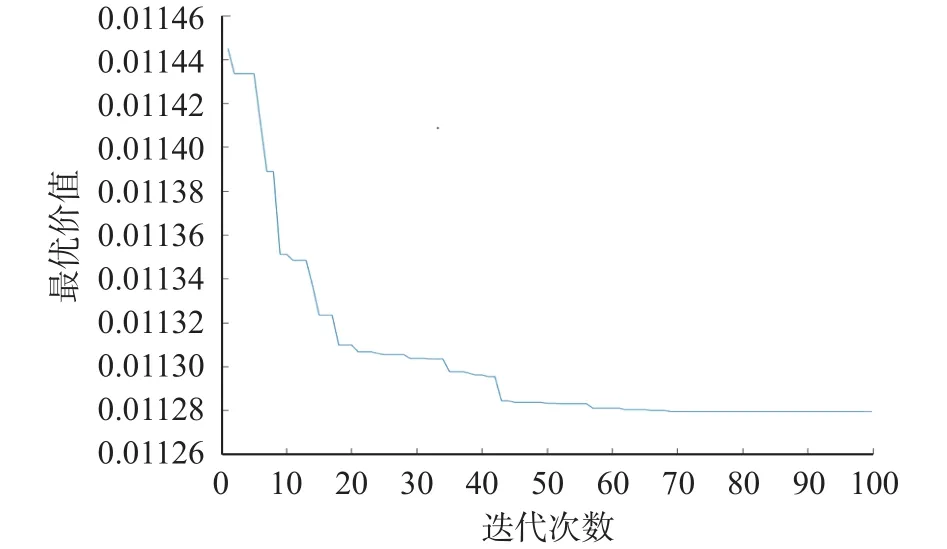
图10 遗传算法100次迭代寻优结果Fig.10 Results of optimization with 100 iterations of genetic algorithm
2.6 响应面与BP-GA神经网络优化模型比较
2.6.1 响应面法与BP-GA神经网络预测能力的比较通过表7可知,响应面的RMSE、MAE、分别为1.4489、1.1411、0.9148,神经网络的RMSE、MAE、分别为0.8565、0.6035、0.9650。模型中的RMSE、MAE以及能较好地反映模型的拟合程度,RMSE、MAE值越小、值越大时,模型的拟合效果越好,拟合误差越小。通过对比可知,BP-GA神经网络的RMSE以及MAE均明显小于响应面对应值,且神经网络模型的值高于响应面的值。因此,BPGA神经网络优化模型比响应面优化模型的拟合效果更好,预测结果更准确。该结果与人工神经网络、响应面法在不同领域应用结果类似。

表7 响应面法与BP-GA神经网络预测能力的比较Table 7 Comparison of prediction ability between response surface method and BP-GA neural network
2.6.2 响应面法与BP-GA神经网络预测值与实际值比较 由表8可知,BP-GA神经网络预测值与实际值分别比响应面优化模型对应值高出2.03%与3.63%,且BP-GA神经网络模型的相对误差明显低于响应面模型,这说明用神经网络模型优化保护剂配方结果比响应面优化模型结果更贴近实际值,BPGA模型的仿真性更高、试验更精确。
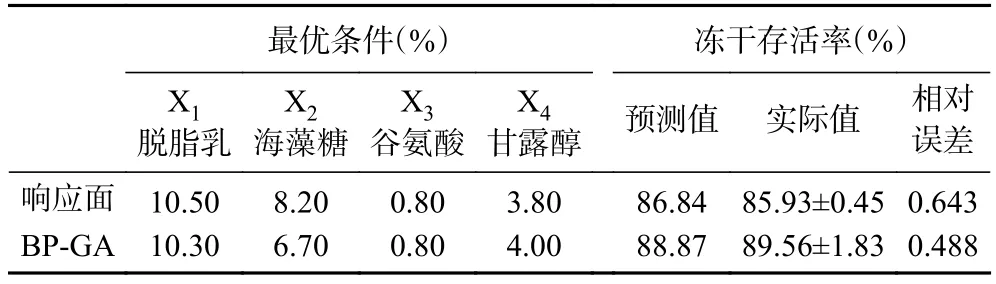
表8 人工神经网络结合遗传算法与响应面优化模型下的预测值和实际值比较Table 8 Comparison of the predicted and actual values of BPGA and RSM
综上所述,BP-GA人工神经网络模型与响应面优化模型相比更适用于干酪乳杆菌LTL1361的冻干保护剂配方优化试验。
3 结论
本试验创新性的采用BP-GA神经网络进行干酪乳杆菌LTL1361冻干保护剂配方的优化,通过29组BP人工神经网络训练数据使模型的拟合度达到0.90以上。与响应面模型作对比,利用BP人工网络耦联遗传算法优化的冻干存活率预测值以及实际值分别提高了2.03%和3.63%,使用BP-GA神经网络优化模型能有效减少仿真误差并提高菌株的冻干存活率。因此,本研究以提高干酪乳杆菌LTL1361的冻干存活率为目标,利用BP神经网络耦合遗传算法进行优化,得到最优的冻干保护剂配方为:脱脂乳10.3%、谷氨酸0.8%、海藻糖6.7%和甘露醇4.0%,此时的冻干存活率达到89.56%,较高程度地维持了菌株活性,提高干酪乳杆菌LTL1361在真空冷冻干燥过程中的存活率。综上所述,认为本试验运用到的理论与技术对乳酸菌冻干制剂工艺优化有一定的创新和借鉴价值。
