假肠膜明串珠菌HDL-3胞外多糖的分离纯化及结构性质分析
2022-10-27曹慧莹于连升杜仁鹏
赵 丹,曹慧莹,孙 梦,于连升,杜仁鹏,
(1.农业微生物技术教育部工程研究中心,黑龙江哈尔滨 150500;2.黑龙江大学生命科学学院,微生物省高校重点实验室,黑龙江哈尔滨 150080)
乳酸菌胞外多糖(Exopolysaccharides,EPS)是部分乳酸菌(lactic acid bacteria,LAB)在代谢生长过程中分泌到细胞外的多糖类化合物。能够产EPS的乳酸菌有肠膜明串株菌()、魏斯氏菌()、植物乳杆菌()、干酪乳杆菌()、鼠李糖乳杆菌()、嗜酸乳杆菌()和嗜热链球菌()等菌属。根据单糖组成不同,乳酸菌EPS可分为同型多糖和异型多糖。同型多糖仅有一种单糖组成,如葡萄糖、果糖,生物合成过程较简单;而异型多糖由2种以上的单糖组成,生物合成过程较复杂。
近年来,随着人们对健康的不断重视,乳酸菌作为益生菌逐渐成为关注焦点,乳酸菌EPS作为乳酸菌所产的有益代谢产物,不仅可以促进肠道多种益生菌的生长和定殖、减少便秘;还具有免疫调节、抗氧化、抗肿瘤、降血糖、降血压等作用;作为添加剂能够增强食品的持水性、流变性和稳定性,还可以优化食品的质地和口感,在食品、医药和化工等领域得到广泛应用。由于不同乳酸菌EPS的结构存在较大差异,其结构的差异必然导致生物活性的不同,EPS的分子质量、单糖组成以及糖苷键类型等均影响EPS的理化性质和生物学活性,其结构解析和构效关系研究已成为当前的热点和难点。此外,乳酸菌EPS的产量较低,限制其大规模生产及应用。目前,通过优良高产菌株的筛选、改良菌株和优化发酵条件等方法能在一定程度上提高乳酸菌EPS的产量。因此,分离筛选获得更多的新型产EPS的乳酸菌,探究EPS的结构和性质,开发乳酸菌EPS的功能特性是目前糖生物领域研究的重点。本研究利用微生物学方法从东北自然酸菜发酵液中分离筛选产EPS的乳酸菌,并对EPS进行分离纯化,研究其结构和性质,对比分析不同乳酸菌来源的EPS在结构和性质上的差异。本研究结果不仅丰富了产EPS的乳酸菌种质资源,还为EPS的构效关系研究提供理论依据,促进乳酸菌EPS的应用范围以及糖生物学的进一步发展。
1 材料与方法
1.1 材料与仪器
东北酸菜 取自黑龙江省大兴安岭地区新林镇家庭自制酸菜;葡聚糖凝胶G-100 上海源叶生物科技有限公司;细菌基因组DNA提取试剂盒 TIANGAN股份有限公司;葡萄糖、胰蛋白胨、NaNO、CaCO、三氯乙酸、溴化钾、苯酚、三氟乙酸等 分析纯,天津市科密欧化学试剂科技有限公司;MRS培养基:葡萄糖20 g/L、胰蛋白胨1 g/L、牛肉膏1 g/L、酵母提取物5 g/L、无水乙酸钠0.5 g/L、柠檬酸铵0.2 g/L、KHPO0.2 g/L、MgSO·7HO 0.058 g/L、MnSO·HO 0.025 g/L、吐温-80 0.1 mL/L,用于乳酸菌的活化及培养;产糖MRS-S培养基:用20 g/L蔗糖取代MRS培养基中的葡萄糖。
ABI9700 PCR仪 美国基因公司;Alpha-1900Plus紫外-可见分光光度计 上海谱元仪器有限公司;TDA305凝胶渗透色谱(gel permeation chromatography,GPC) 英国马尔文有限公司;利用高效液相色谱(high performance liquid chromatography,HPLC) 岛津国际贸易上海有限公司;IRAffinity-1S傅里叶变换红外光谱仪 株式会社岛津制作所;AVANCE III核磁共振谱仪 瑞士Bruker公司;S-4800场发射扫描电子电镜 日本日立公司。
1.2 实验方法
1.2.1 产EPS乳酸菌的分离 根据稀释倒平板法,将稀释后的酸菜发酵液涂布于含 1%(w/w)CaCO的MRS培养基上,30 ℃ 培养 48 h。利用接种环挑取产生钙溶圈的单菌落接种于 30 mL MRS-S 液体培养基中,30 ℃ 培养 36 h 后,以葡萄糖作为标准品,利用苯酚硫酸法,以葡萄糖含量(μg)为横坐标,吸光值OD为纵坐标绘制标准曲线,方程式为y=0.0089x-0.0034,=0.9992。用于分析发酵液中EPS 的含量,选取能够高产 EPS 的乳酸菌用于下一步试验。
1.2.2 高产EPS乳酸菌的16S rDNA鉴定 取菌株MRS发酵液2 mL,12000 r/min离心1 min,获得菌体沉淀。利用细菌基因组提取试剂盒提取菌株的基因组DNA。利用引物5’-TACGGYTACCTTGTTACG ACTT-3’和 5’-AGAGTTTGATCMTGGCTCAG-3’,进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳验证正确后,于上海生工生物公司测序,将序列与GenBank数据库中已有核苷酸序列进行同源比对,并提交至NCBI数据库。下载与获得的16S rDNA核苷酸序列同源性高的模式菌株核苷酸序列,构建系统发育树,根据同源性鉴定菌株的种属水平。
1.2.3 EPS的提取、纯化及纯度检测 以2%(v/v)的接种量将种子液接入到MRS-S产糖培养基中,30 ℃、120 r/min 培养 36 h,发酵液 4 ℃、12000 r/min离心30 min后,向其中加入80%(w/v)的三氯乙酸使其终浓度为 4%(w/v)。4 ℃静置过夜后,4 ℃、12000 r/min离心30 min去除蛋白,向上清液中加入三倍体积95%预冷乙醇,4 ℃静置过夜沉淀EPS,4 ℃、12000 r/min离心20 min获得沉淀,将沉淀溶于适量的去离子中,并装入截留分子量为8000~12000 Da的透析袋中,4 ℃透析2 d,每8 h换一次水,将透析后的EPS样品加入到Sephadex G-100凝胶过滤层析柱中,上样量为1~2 mL,利用蒸馏水为洗脱液,流速为0.2 mL/min。根据洗脱图上出峰时间接洗脱液,将收集到的洗脱液真空冷冻干燥,获得纯EPS。利用去离子水中配置成浓度为1 mg/mL的EPS溶液,经紫外分光光度计进行全波长扫描,检测纯度。
1.2.4 EPS的结构测定
1.2.4.1 分子量测定 将 2.0 mg EPS溶于 1 mL 0.1 mol/L NaNO溶液中,并以0.1 mol/L NaNO溶液作为洗脱剂,流速为0.5 mL/min,利用GPC测定EPS的分子量。以不同分子量的葡聚糖为标准品,上机检测,根据洗脱峰保留时间绘制标准曲线,方程式为 y=-0.201x+1.385,=0.993。
1.2.4.2 单糖组成测定 将2 mg的EPS样品溶于含1 mol/L HCl的无水甲醇中,80 ℃下水解16 h,加入2 mol/L三氟乙酸后于120 ℃下水解1 h,所得水解产物经丙二醇甲醚丙酸酯衍生后,利用LC-15C HPLC测定EPS的单糖组成。以葡萄糖、甘露糖、半乳糖及半乳糖醛酸等为标准品,经衍生化后上机检测,根据标准品的出峰时间进行比对。
1.2.4.3 官能团组成测定 将干燥的EPS与溴化钾混合并充分研磨后,压制成薄片,利用傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR),在分辨率4 cm,波数范围 400~4000 cm条件下,测定EPS的官能团组成。
1.2.4.4 键链接方式测定 取30 mg冻干的EPS充分溶解于重水(DO),在25 ℃条件下利用400 M核磁共振(Nuclear magnetic resonance spectroscopy,NMR)测定H-NMR、C-NMR谱图。
1.2.4.5 结晶构型测定 将干燥的EPS研磨后平铺于样品池中,利用X射线衍射仪(X-ray diffraction,XRD)测定结晶结构,测试速率为2°/min。
1.2.4.6 表面形态观察 将冻干的EPS样品固定在导电胶上,镀金后,利用扫描电镜(scanning electron microscopy,SEM)在电压为10 kV,放大倍数为400×条件下,观察EPS的表面结构。
1.2.5 EPS的性质测定
1.2.5.1 水溶性测定 取45 mg EPS样品充分溶解于0.5 mL去离子水中,12000 r/min离心40 min得到沉淀进行冻干,冻干样品称质量记为M(mg)。水溶性(Water solubility index,WSI)计算公式如下:
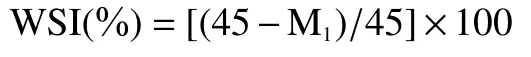
1.2.5.2 持水性测定 取45 mg烘干后的EPS充分溶解于0.5 mL去离子水中,12000 r/min离心40 min得到沉淀,用滤纸小心擦掉沉淀表面水分并称质量,记为W(mg),称量冷冻干燥后的沉淀质量,记为W(mg)。EPS 持水性(Water holding capacity,WHC)计算公式如下:

1.2.5.3 黏度稳定性测定 利用粘度计测定,pH自然、室温条件下,浓度(20、40、60 mg/mL)对 EPS 黏度的影响;pH 自然,不同温度(20、30、40 ℃)对 EPS(20 mg/mL)黏度的影响;室温条件下,不同 pH(4、6、8)对 EPS(20 mg/mL)溶液黏度的影响。
1.2.5.4 乳化性测定 分别取2.5 mL汽油、柴油、橄榄油、豆油、葵花籽油和苯与2.5 mL浓度为2 mg/mL的EPS溶液混匀,充分振荡5 min后,在24和48 h时测定混合液乳化层。计算公式如下:

1.2.5.5 抗氧化性能测定 DPPH自由基清除能力的测定:将2 mL(浓度范围0.5~5 mg/mL)EPS溶液与2 mL 0.2 mmol/L DPPH-乙醇溶液混匀,暗反应30 min后,以V为阳性对照,测定OD。DPPH自由基清除能力计算公式如下:
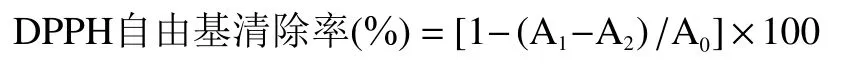
式中:A:水与 DPPH反应;A:样品与 DPPH反应;A:水与样品反应,以排除样品自身对试验的干扰。
ABTS自由基清除能力的测定:将2 mL(浓度范围0.5~5 mg/mL)EPS溶液与4 mL 7 mmol/L的ABTS工作液充分混匀,室温条件下反应6 min后,以V为阳性对照,测定OD。ABTS自由基清除能力计算公式如下:
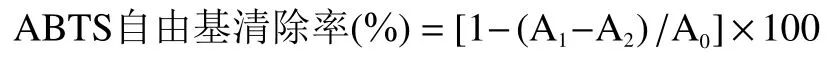
式中:A:水与 ABTS 反应;A:样品与 ABTS 反应;A:水与样品反应,以排除样品自身对试验的干扰。
1.3 数据处理
2 结果与分析
2.1 高产EPS乳酸菌的分离与鉴定
从酸菜发酵液中共分离得到4株产EPS的乳酸菌,其中菌株 HDL-3 能够产(60.94±2.01)g/L 的 EPS,明显高于其他3株菌。HDL-3在MRS平板上呈白色、圆形、不透明、表面光滑的菌落形态(图1A);在MRS-S平板上菌落较大,表面附着黏稠性液体(图1B),符合一般产EPS乳酸菌的菌落形态特征。16S rDNA序列分析表明,菌株HDL-3部分序列长1478 bp,NCBI数据库比对后发现,该菌株与多株基因序列的亲缘关系最近,其中与3818同源性达到99%(图1C)。因此,将HDL-3鉴定为,并命名为HDL-3。序列提交至NCBI,获得登录号为MZ959413。
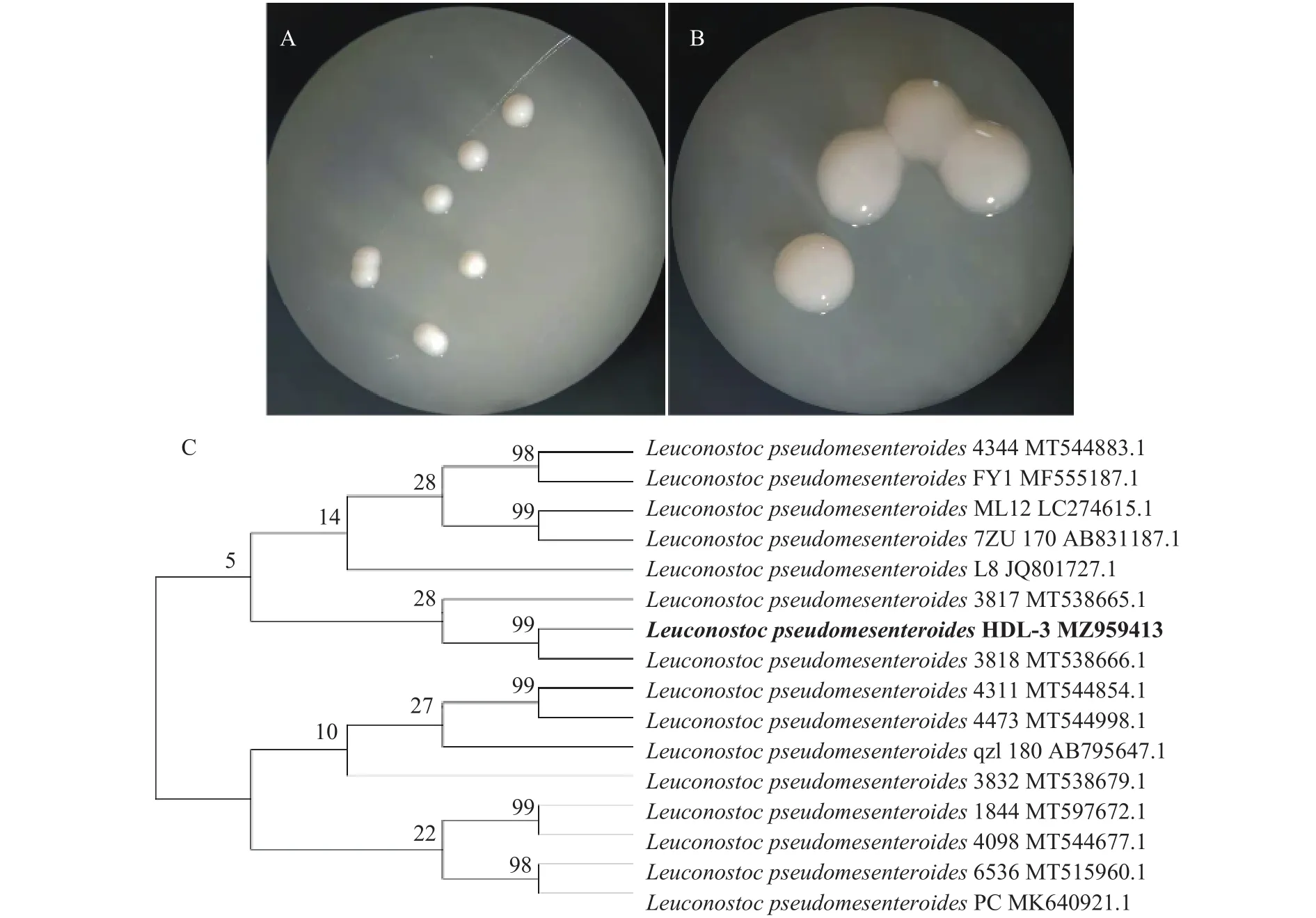
图1 菌株HDL-3菌落形态图及系统发育树Fig.1 Colony morphology of strain HDL-3 and phylogenetic tree
2.2 EPS的分离纯化及纯度分析
HDL-3发酵液经去菌体、除蛋白、沉淀EPS、凝胶过滤层析后,在检测器上呈现单一对称的洗脱峰,表明获得相对分子量相对均一的纯品EPS。EPS溶液经全波长扫描后,在260和280 nm处未出现吸收峰,表明EPS中无核酸和蛋白污染。纯化后,EPS的浓度为(50.73±1.84)g/L,高于XG5(35.5 g/L),但低于XG-3 EPS(97.5±1.1 g/L)。经冷冻干燥后,该EPS呈现白色棉花状固体。
2.3 EPS结构分析
2.3.1 EPS的分子量及单糖组成分析 GPC洗脱峰呈现单一对称峰(图2A),表明EPS样品纯度较高。根据标准曲线,计算得出EPS的分子量为1.581×10Da,与YF32 EPS(5.54×10Da)相符合,但是高于SJ14 EPS(7.12×10Da), 低 于DRP-5 EPS(6.23×10Da)。EPS 的分子质量与其理化特性及益生功能密切相关,低分子量的EPS具有较好的溶解性和相对舒展的糖链构象,具有更好的生物学活性。HPLC测定EPS的单糖组成,对比不同标准单糖的保留时间,表明HDL-3 EPS是由葡萄糖组成的同型多糖(图2B)。同样,XG-3 EPS和L2 EPS也是由葡萄糖组成的同型多糖。
2.3.2 FT-IR分析 FT-IR可以鉴别EPS中不同的单糖,确定糖苷键构型。如图2C所示,在3423.17 cm处有一较宽且强烈的特征吸收峰,这归因于O-H键的伸缩振动,在2923.12 cm处的吸收峰,则归因于C-H键的伸缩振动,这两个吸收峰是多糖类物质的特征峰。在1645.22和1356.49 cm处出现的特征信号峰则是由C=O伸缩振动引起的,在1015.23 cm处有一个较强的信号峰,是由C-O振动引起的。548.30 cm处的信号峰归因于-D-吡喃糖的存在。HDL-3 EPS是由葡萄糖组成葡聚糖,与单糖测定结果相一致。

图2 HDL-3 EPS的GPC(A)、HPLC(B)和 FT-IR(C)谱图Fig.2 GPC (A), HPLC (B)和 FT-IR (C) spectrum of HDL-3 EPS
2.3.3 NMR分析 NMR分析可以进一步揭示EPS的糖单元种类、糖苷键构型和连接方式。H NMR结果显示(图3),在4.89 ppm有一个明显的特征信号峰,表明 HDL-3 EPS 由-(1,6)糖苷键连接。C NMR谱 中 73.365、 71.385、 70.215、 69.496、65.416 ppm处出现的信号峰分别对应吡喃糖环上C3、C2、C5、C4和 C6的信号峰。此外,在 101和105 ppm之间无吸收峰,表明HDL-3 EPS的糖苷键类型为构型。因此,根据FT-IR和NMR分析表明,HDL-3 EPS是由-(1,6)糖苷键连接而成的线性葡聚糖。

图3 HDL-3 EPS 1H NMR和13C NMR光谱图Fig.3 1H NMR and 13C NMR chromatograms of the HDL-3 EPS
2.3.4 XRD分析 EPS的结晶结构与溶解性、膨胀性及一些物理特性息息相关,XRD技术可以有效的解析EPS的无定形或结晶特性。HDL-3 EPS呈现出一种无定形状态,只在2为20°时出现强衍射峰(图4),这是因为该EPS中含有大量的无定形区域,少量的结晶区隐藏在无定形区域内,整体上呈现出一种相对无定形的状态。此结果与XG-3 EPS和C19 EPS相符。

图4 HDL-3 EPS的XRD光谱图Fig.4 XRD chromatograms of HDL-3 EPS
2.3.5 SEM测定 SEM可用来观察EPS的形貌,已成为研究大分子生物多糖表观形貌的有力工具。结果如图5所示,HDL-3 EPS展现出表面光滑、有光泽且紧凑的片状结构。WLPL04 EPS也呈现紧凑的片状结构,而AR307 EPS呈现分支化状链结构。片状紧凑的结构使EPS具有良好的机械稳定性,光滑、有光泽的结构使EPS具备制成可塑性膜材料的潜力,应用于医药、化工及食品等领域。

图5 HDL-3 EPS的SEM显微形态(400×)Fig.5 Microscopic morphology under SEM of HDL-3 EPS (400×)
2.4 EPS性质分析
2.4.1 水溶性及持水性分析 HDL-3 EPS的溶解率和持水率分别为 98.63%1.03%、401.30%±4.92%,其中溶解性显著高于、持水性低于L2 EPS(分别为 91.90%±2.45% 和 509.45%±28.59%)。较高的溶解率是归因于EPS含有大量羟基的葡萄糖单元,可与氢键形成大量的水。HDL-3 EPS展现良好的亲水性和保水能力,可作为生物表面活性剂和稳定剂应用于化工及食品等领域。
2.4.2 粘度稳定性分析 HDL-3 EPS的粘度稳定性分析如图6所示,随转速的增加EPS溶液的粘度逐渐减小,即表现出非牛顿流体的剪切稀释特征。在室温条件下,EPS溶液粘度与浓度呈正相关。浓度的增加提高了多糖链之间的相互作用,使得部分EPS分子发生联结,聚合程度增加。在pH自然、不同温度条件下,EPS溶液粘度与温度呈负相关,这可能是因为温度升高,EPS分子运动加剧,分子间相互作用力不足以约束分子运动,致使粘度下降。此外,较高的pH会使EPS溶液粘度下降,这可能是因为碱性条件下EPS的组成及结构容易发生变化。因此,HDL-3 EPS可作为食品添加剂提高牛奶、酸奶、乳酪等食品的粘度,改善食品质地。

图6 浓度(A)、温度(B)、pH(C)对 HDL-3 EPS 流变学特性的影响Fig.6 Effect of concentration (A), temperature (B), pH (C) on the rheological properties of HDL-3 EPS
2.4.3 乳化性分析 乳化剂能够将两种不相溶解的液相体系保持稳定性,广泛应用在化学、食品、医药及石油等领域。HDL-3 EPS对不同油类及烃类物质的乳化能力如表1所示,整体的乳化趋势为:大豆油>苯>葵花籽油>汽油>柴油>橄榄油,其中对大豆油、葵花籽油和苯的乳化能力均超过60%此外,随着时间的延长,HDL-3 EPS对汽油和柴油的乳化能力呈现少量增强的趋势,而对橄榄油、大豆油、葵花籽油和苯的乳化能力呈现降低的趋势。此结果与H2 EPS相一致。可能是因为EPS与不同的油类和烃类发生特异性结合,使得EPS的分子质量、键合方式、氢键、糖残基、支化度和静电斥力等发生变化,从而导致不同的乳化能力。

表1 HDL-3 EPS对不同油类和烃类化合物的乳化能力Table 1 Emulsifying activity of HDL-3 EPS for different oils and hydrocarbons
2.4.4 抗氧化性分析 大多数乳酸菌EPS无论在体内还是体外均具有抗氧化功能,能够参与自由基清除,从而作为天然的安全抗氧化剂发挥作用。HDL-3 EPS对DPPH和ABTS自由基的清除能力如图7所示,随着EPS浓度的增加,清除能力呈现先增加后保持稳定的趋势,在5.0 mg/mL时,清除率最高,分别为 36.58%±1.04%和 34.21%±0.27%,高于Y3 EPS。EPS抗氧化活性与多种因素有关,包括分子质量、单糖组成、官能团类型及EPS提取方法等。研究发现,EPS的抗氧化能力与糖醛酸的含量有关,相较V,HDL-3 EPS不具备强的氧化能力,可能是因为其仅由葡萄糖组成。
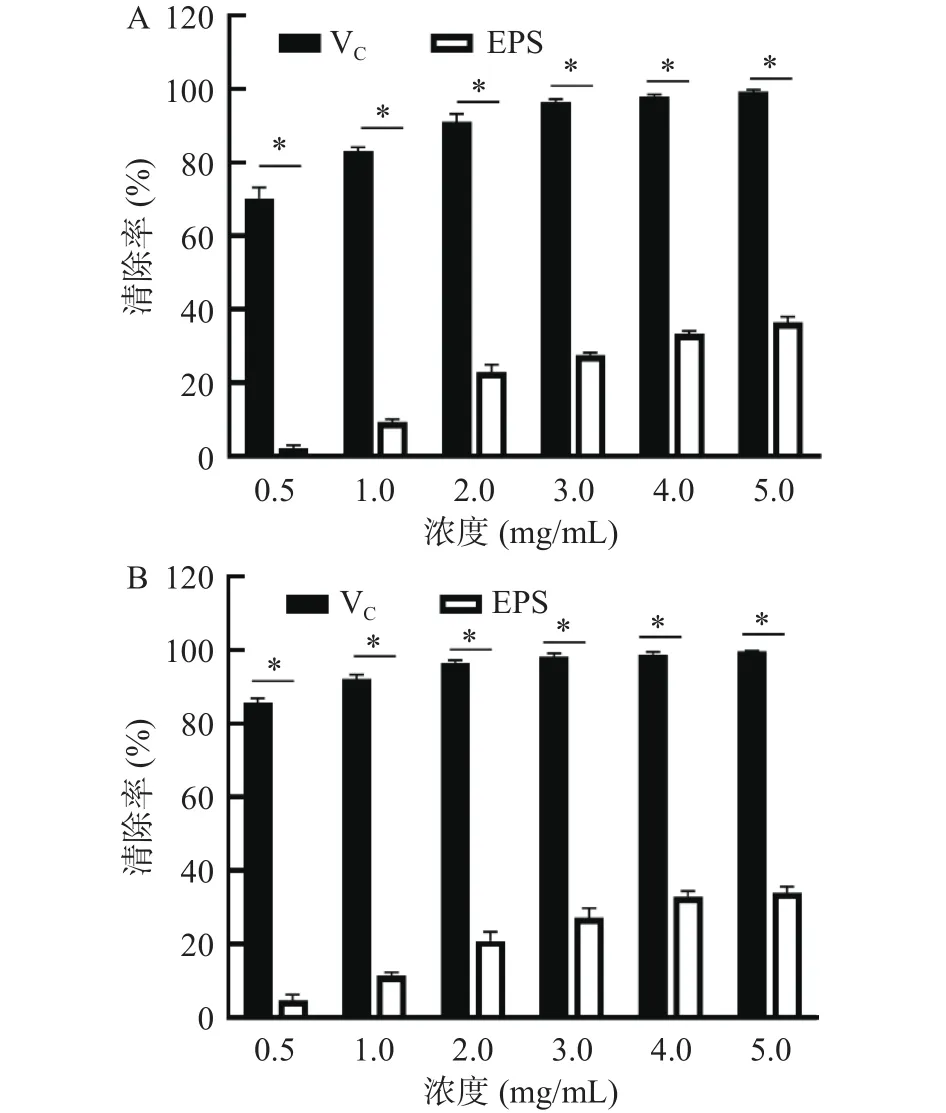
图7 HDL-3 EPS的DPPH(A)和ABTS(B)自由基清除能力Fig.7 The scavenging activity of DPPH (A) and ABTS (B) of HDL-3 EPS
3 结论
本研究从自然酸菜发酵液中分离得到一株产EPS的乳酸菌,经鉴定该菌株为,并命名为HDL-3。以该菌株为发酵剂发酵产EPS,并分离纯化,得到高纯度 EPS,其产量为(50.73±1.84)g/L。该 EPS 由葡萄糖构成,分子量为1.581×10Da。结构分析发现该EPS是由-(1,6)糖苷键连接而成的线性葡聚糖,呈表面光滑、有光泽且紧凑的片状结构。HDL-3 EPS溶解率和持水率分别为98.63%1.03%和401.30%±4.92%。该EPS的粘度随着温度和pH的升高而降低,对大豆油、葵花籽油和苯有良好的乳化能力,DPPH和ABTS自由基的清除能力可分别达到36.58%±1.04%和34.21±0.27%。因此,HDL-3 EPS可作为作为天然食品添加剂、增稠剂、乳化剂或抗氧化剂应用在食品及医药等领域。
