硒化绿豆抗性淀粉制备工艺优化及抗氧化活性分析
2022-10-26赵姝婷全志刚刘德志王一飞武云娇苏有韬王维浩曹龙奎
赵姝婷, 全志刚, 王 娟, 刘德志, 王一飞 武云娇, 苏有韬, 王维浩,2, 曹龙奎,2,3
(黑龙江八一农垦大学食品学院1,大庆 163319) (黑龙江八一农垦大学国家杂粮工程技术研究中心2,大庆 163319) (黑龙江省天然产物模拟移动床色谱分离技术创新中心3,大庆 163319)
本实验以绿豆抗性淀粉(MB-RS4)为原料,采用硝酸-亚硒酸钠法对MB-RS4进行硒化,得到硒化绿豆抗性淀粉[MB-RS4Se(Ⅳ)],并对硒化条件进行优化;通过光学显微镜、偏光十字显微镜和扫描电镜观察MB-RS4Se(IV)光学性质及表观形态,体外测定抗氧化活性及相关性分析,为开发以抗性淀粉为原料的功能性食品提供了参考。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
DGA-9080A电热恒温鼓风干燥箱,Aldpha1-2LD plus真空冷冻干燥机,透析袋(Mw:1 000 u);S-570扫描电子显微镜,NP-800TRF型偏光显微镜,N-800M光学显微镜,SPECTROstar Nano酶标仪,Specord 200紫外分光光度计。
1.3 方法
1.3.1 绿豆RS4的制备
根据李蒙娜等[13]的方法并作适当修改。将淀粉与柠檬酸按照干基比5∶2混合,加入适量蒸馏水搅拌均匀,用氢氧化钠调节混合体系pH至3.5左右,室温静置12 h,于40 ℃烘干。取出干燥样品粉碎过60目筛,取筛下物于150 ℃酯化4 h,反应产物用无水乙醇洗涤3次,37 ℃烘干至含水量为8%,即得MB-RS4。
根据王丽波等[14]的方法并作适当修改。用50 mL体积分数为0.5%的HNO3溶液溶解样品(1.0 g),在室温下搅拌30 min,加入1.0 gNa2SeO3和0.7 gBaCl2,将混合物在66 ℃搅拌反应3.5 h。冷却至室温滴加1 mol/L的NaOH溶液调节pH至7~8。加入0.5 gNa2SO4除去溶液中的杂质Ba2+,4 000 r/min离心15 min,取上清液后透析出反应产生的无机盐和多余的Na2SeO3、浓缩、醇沉,冻干即得MB-RS4Se(Ⅳ)。
(1)
式中:m1为绿豆RS4Se(Ⅳ)的质量/g;m为绿豆RS4的质量/g。
根据国家标准[15]选用分光光度法测MB-RS4Se(Ⅳ)中硒含量[16]。用移液管分别吸取0.1、0.2、0.4、0.8、1.6 mL的硒标准溶液至25 mL容量瓶,加入2 mL邻苯二胺(2%)用HCl定容并调节pH至2,避光反应1 h,最后用5 mL甲苯萃取,在334 nm处测定有机相吸光度,测得硒标准曲线方程y=19.380 21x-0.042 04,线性相关系数R2=0.995 7,其中:y为硒含量(mg),x为吸光度。
5 mg样品中加入2 mL HNO3,4 ℃放置过夜。将样品加热至烧杯中无橙黄色烟雾生成,冷却至室温加入6 mol/L的盐酸8 mL继续加热至无白色烟雾生成,转移至25 mL容量瓶,根据标准曲线测定方法测定样品溶液吸光度,并用式(2)计算样品中硒含量。

(2)
式中:ρ为有机相中硒的质量浓度/mg/mL,由标准曲线方程得出;V1为定容后待测溶液体积(25 mL);V2为有机相总体积(5 mL);V3为萃取前待测溶液体积(2 mL);m为MB-RS4Se(Ⅳ)质量(5 mg)。
1.3.5 MB-RS4·Se(Ⅳ)工艺条件研究1.3.5.1 MB-RS4·Se(Ⅳ)制备工艺单因素实验
将样品溶解于一定体积分数的HNO3(0.1、0.3、0.5、0.7、1%)中,并在室温下处理30 min,改变样品与Na2SeO3的物料比(1∶0.6、1∶0.8、1∶1.0、1∶1.2、1∶1.4),反应温度(40、50、60、70、80 ℃)和反应时间(2、3、4、5、6 h)进行实验。
以HNO3(A)、物料比(B)、反应温度(C)、反应时间(D)为自变量,通过Box-Behnken设计四因素三水平的响应面实验,再分别以硒含量和MB-RS4·Se(Ⅳ)得率为响应值,考察各因素对于响应值的影响程度,响应面实验因素水平见表1。

表1 Box-Behnken响应面实验设计因素与水平
1.3.6 光学特征及体外抗氧化性分析1.3.6.1 光学显微镜测定
将样品溶于30%甘油中,混合均匀后取一滴滴在载玻片上,盖上盖玻片无气泡后置于光学显微镜下观察,调整物镜倍数和焦距,直至能清晰看到颗粒形态和偏光十字即可,保存图片。
1.3.6.2 扫描电子显微镜(SEM)测定
根据Asad等[18]的方法并作适当修改对样品的形貌和微观结构进行研究。将样品置于双面胶带喷金,于50.0 kV收集图像。
1.3.6.3 羟基自由基清除能力
羟自由基通常以反应Fe2++H2O2=Fe3+OH-+·OH产生[19]。参照Huang等[20]的方法并作适当修改,测定样品对羟基自由基清除能力。按式(3)计算羟基自由基清除率。
(3)
式中:A0为空白对照在510 nm的吸光度;A1为待测样品在510 nm的吸光度。
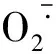

(4)
式中:A0为空白对照在330 nm的吸光度;A1为待测样品在330 nm的吸光度。
1.3.6.5 ABTS自由基清除能力
ABTS自由基清除能力参照Li等[22]的方法并作适当修改。按式(5)计算ABTS自由基清除率。
(5)
式中:A1为0.2 mL样品稀释液+1.2 mLABTS稀释液;A2为0.2 mL样品稀释液+1.2 mL无水甲醇;A0为0.2 mL无水甲醇+1.2 mLABTS稀释液。
1.3.6.6 总抗氧化能力测定
采用铁离子还原能力法测定样品的总抗氧化能力,参照Huang等[23]的方法并作适当修改,每个样品平行测定3次。
1.4 数据处理与分析
所有实验均设置3组平行,数据用平均值±标准差表示,采用SPSS Statistics 25和Excel 2020对数据进行显著性分析及相关性分析,采用Design Expert 11进行响应面分析,以P<0.05表示差异显著,使用Origin 2019b进行绘图。
2 结果与分析
2.1 单因素实验结果与分析
由图1知,4 h时得率达到最大值23.35%,硒含量为2.04 mg/g。随着反应时间的延长,得率降低。结果表明,合成MB-RS4Se(Ⅳ)与时间密切相关,时间短底物MB-RS4与Na2SeO3反应不充分,时间过长会促进MB-RS4降解,导致得率降低[25]。
图1中硝酸体积分数对产物得率及硒含量的影响较大,硝酸体积分数达到0.5%,得率及硒含量达到最大值;但硝酸体积分数超过0.5%,得率及硒含量呈下降趋势,是因为在较高浓度的硝酸存在下(硝酸属于强酸,可导致降解,不利于硒化反应),MB-RS4的羟基被氧化或者断链等因素有关[26]。因此选择硝酸体积分数为0.5%。
由图1知MB-RS4和亚硒酸钠的质量比从1∶0.6到1∶1.4过程中反应未饱和,随反应物的增加反应趋于正反应阶段,但当质量比达到1∶1后,反应底物MB-RS4完全转化,再加入过量的亚硒酸钠,反应则向逆反应方向进行,产物得率及硒含量则降低。这可能是由于饱和结合位点引起的非特异性摄取[25]。因此选择最佳物料比为1∶1。

图1 单因素实验结果
2.2 响应面实验结果与分析
2.2.1 硒化MB-RS4的Box-Behnken响应面实验结果

表2 Box-Behnken实验设计与结果
利用Design-Expert 11软件对实验数据进行多元回归拟合,得到二次多项回归方程:
Se含量=2-0.40A-0.021B-1.57C-1.63D-0.095AB+0.25AC+0.16AD-0.13BC+0.14BD+4.8CD-0.85A2-0.93B2+1.58C2+1.54D2
MB-RS4·Se(Ⅳ)得率=27.30+1.91A-1.37B-1.69C+0.35D-2.19AB+2.85AC-1.25AD-0.61BC+2.49BD+2.57CD-1.55A2-4.35B2-5.08C2-0.71D2
对回归方程进行方差分析,见表3。其中,F值可用来检验各变量对响应值影响的显著性的高低,F值越大,则相应变量的显著程度越高。当模型的显著性检验概率P<0.05时,认为该模型具有统计学意义。由表3知,2个模型的P值均小于0.01,表明模型对响应值有极显著影响,且失拟相P值均大于0.05(即不显著),表明2个模型都具有高度的拟合度,并且实验误差很小,能够准确描述各因素与响应值之间的关系,即可以用这2个模型对硒化的得率和硒含量进行分析和预判。

表3 响应Se含量及MB-RS4Se(IV)得率 拟合回归方程的方差分析结果

表3 响应Se含量及MB-RS4Se(IV)得率 拟合回归方程的方差分析结果
方差来源MB-RS4∙Se(IV)得率拟合Se含量拟合F值P值显著性F值P值显著性回归模型73.21<0.000 1∗∗4 028.64<0.000 1∗∗A97.50<0.000 1∗∗1 455.20<0.000 1∗∗B49.88<0.000 1∗∗328.33<0.000 1∗∗C76.22<0.000 1∗7.740.014 7∗D3.240.093 22 498.86<0.000 1∗∗AB42.44<0.000 1∗∗276 4.96<0.000 1∗∗AC72.17<0.000 1∗∗17 975.45<0.000 1∗∗AD13.910.002 2∗790 7.28<0.000 1∗∗BC3.270.091 9508 4.19<0.000 1∗∗BD55.10<0.000 1∗∗5 484.37<0.000 1∗∗CD58.70<0.000 1∗∗173 9.59<0.000 1∗∗A234.39<0.000 1∗∗231 0.74<0.000 1∗∗B2272.02<0.000 1∗∗9 540.82<0.000 1∗∗C2371.37<0.000 1∗∗3.900.068 3D27.230.017 7∗634.78<0.000 1∗∗失拟项0.200.982 80.820.640 5R20.986 50.998 9R2Adj0.973 10.999 5信噪比28.287220.951
实验数据的残差和响应面设计如图2a所示,图2b为不同水平条件MB-RS4·Se(Ⅳ)响应值的残差正态分布概率图, 29组响应值较为合理地分布于一条直线两侧,且其方差无偏差显示,本实验的实验值与预测值非常接近,表明本实验所建立的模型成功地加强了4个变量参数与响应之间的关系。通过建模拟合,对内部残差与29组实验运行数据进行分析,如图2c所示,所有数据点都位于极值之间,所有杠杆点都小于2,处于样本空间中心,表明实验模型中没有有效误差存在,如图2d所示,相反,由图2e知,Cook’D的值在确定的范围内,说明29组实验数据中没有影响模型的观察值,通过回归诊断分析,说明本实验建立的MB-RS4·Se(Ⅳ)改性工艺模型准确性较高,可以用于绿豆酯化淀粉的硒化改性制备。
实验数据的残差和响应面设计如图3所示,图3a为不同水平条件MB-RS4·Se(Ⅳ)响应值的残差正态分布概率图, 29组响应值较为合理地分布于一条直线两侧,且其方差无偏差显示,本实验的实验值与预测值非常接近,如图3b所示,表明本实验所建立的模型成功地加强了4个变量参数与响应之间的关系。通过建模拟合,对内部残差与29组实验运行数据进行分析,如图3c所示,所有数据点都位于极值之间,所有杠杆点都小于2,处于样本空间中心,表明实验模型中没有有效误差存在,如图3d所示,相反,由图3e知,Cook’D的值在确定的范围内,说明29组实验数据中没有影响模型的观察值,通过回归诊断分析,说明本实验建立的MB-RS4·Se(Ⅳ)改性工艺模型准确性较高,可以用于MB-RS4的硒化改性制备。
2.2.5 最优条件确定和验证
应用响应面最优分析方法对回归模型分析,确定最优工艺条件为:HNO3体积分数0.46%,物料比1∶0.98,反应温度66.56 ℃,反应时间3.5 h,Se含量为2.22 mg/g,MB-RS4Se(Ⅳ)得率为26.293 5%。为适应实际生产需求对工艺参数优化,在HNO3体积分数0.5%,物料比1∶1,反应温度66 ℃,反应时间3.5 h下进行反应,经3次重复实验得到Se含量为2.21 mg/g,MB-RS4Se(Ⅳ)得率为26.450 6%。
2.3 MB-RS4和MB-RS4Se(Ⅳ)光学特征及抗氧化分析
2.3.1 光学特征分析
由图4可知,绿豆淀粉中交替存在结晶区和非结晶区,偏光十字出现“马耳他十字”。绿豆淀粉颗粒大部分呈现椭圆形,少数为球形,表面光滑,有典型的偏光十字[30,31]。通过柠檬酸酯化处理绿豆淀粉后,绿豆淀粉分子链在酸热运动下,分子中心晃动,原子尺寸数量级的空穴增多并伴随着颗粒结构坍塌[29],通过光学显微镜和扫描电镜观察可以发现MB-RS4出现了不同程度的交联、抱团现象,形成了形状不规则、结晶结构破坏和偏光十字逐渐消失的MB-RS4。在此基础上对MB-RS4进行硒化改性得到MB-RS4·Se(Ⅳ),MB-RS4·Se(Ⅳ)颗粒结构破碎,呈现不规则的碎片状态,偏光十字完全消失,是由于引入Se4+时MB-RS4断链发生降解,导致MB-RS4形态碎片化严重。

图2 MB-RS4Se(Ⅳ)得率准确性分析

图3 MB-RS4Se(Ⅳ)硒含量准确性分析

注:光学显微镜放大倍数为目镜10×;物镜20×。图4 MBS (1)、MB-RS4 (2)、MB-RS4Se(Ⅳ)(3) 光学显微镜(a)、偏光十字显微镜(b)、扫描电镜(c)
2.3.2 抗氧化活性及相关性分析
硒化前后MB-RS4和VC的还原能力如图5d所示,硒化前的吸光度保持在0.1~0.2,硒化后吸光度随质量浓度升高而增加,当质量浓度达到10mg/mL时,吸光度值接近阳性对照VC。说明MB-RS4的还原能力几乎没有,硒化后的MB-RS4还原能力大幅度增加。




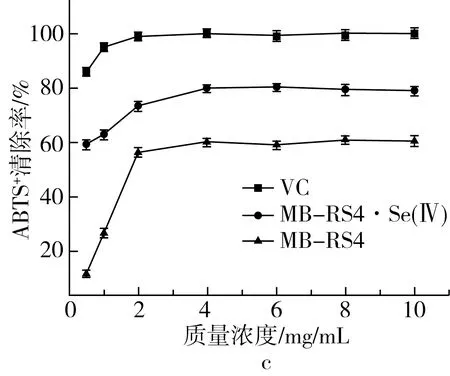

图5 MB-RS4、MB-RS4Se(Ⅳ)和VC对 ABTS+·清除能力及总还原能力
表4 MB-RS4、MB-RS4Se(Ⅳ)和VC IC50值及其相关性

表4 MB-RS4、MB-RS4Se(Ⅳ)和VC IC50值及其相关性
样品分类羟自由基/mg/mL超氧阴离子自由基/mg/mLABTS自由基/mg/mLFe2+还原能力(Abs)MB-RS4线性方程Y=39.381x+2.682Y=32.006x+2.063Y=-16.664x+6.887Y=0.095x+0.005R20.9210.9730.8670.854IC50/mg/mL2.441±0.760∗8.390±1.290∗4.046±1.040∗-MB-RS4·Se(Ⅳ)线性方程Y=36.138x+5.347Y=47.141x+1.302Y=-15.492x+6.915Y=0.836x+0.118 6R20.930.9130.8790.893IC50/mg/mL1.621±0.450∗∗1.434±0.190∗∗0.226±0.260∗∗-VC线性方程Y=97.981x+0.021Y=97.511x+0.265Y=-13.619x+6.717Y=2.66x+0.021R20.9160.9140.8680.907IC50/mg/mL0.002±0.0010.024±0.0130.088±0.020-
注:IC50值表示自由基清除率为50%的有效质量浓度,*为显著,**为极显著。
2.3.3 抗氧化能力表型分析

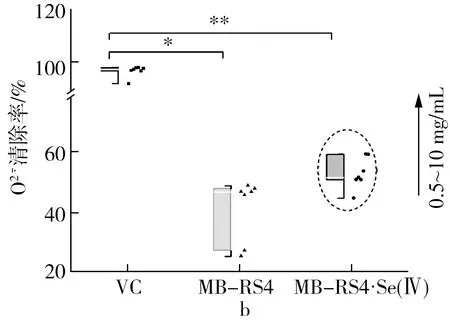
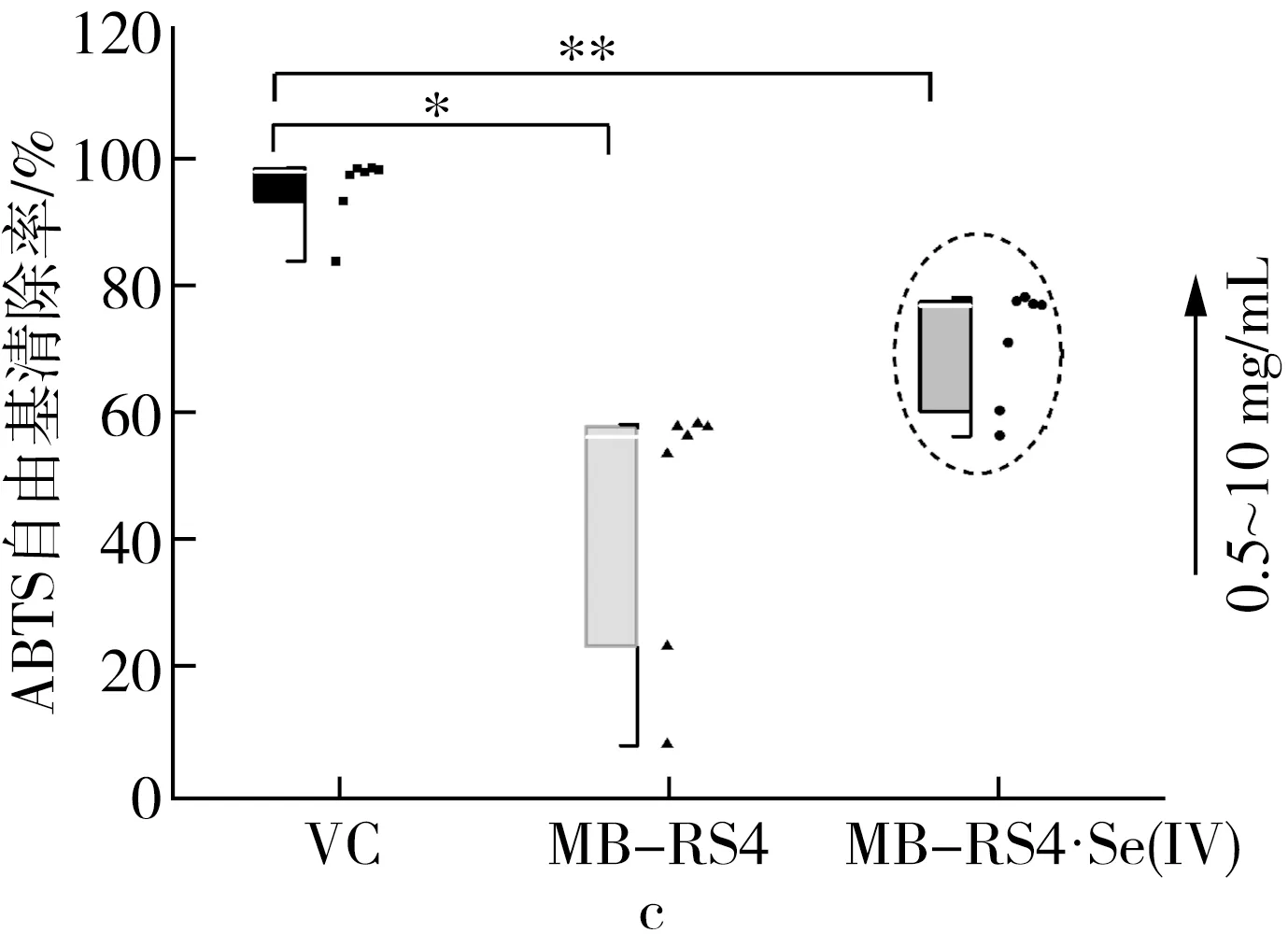
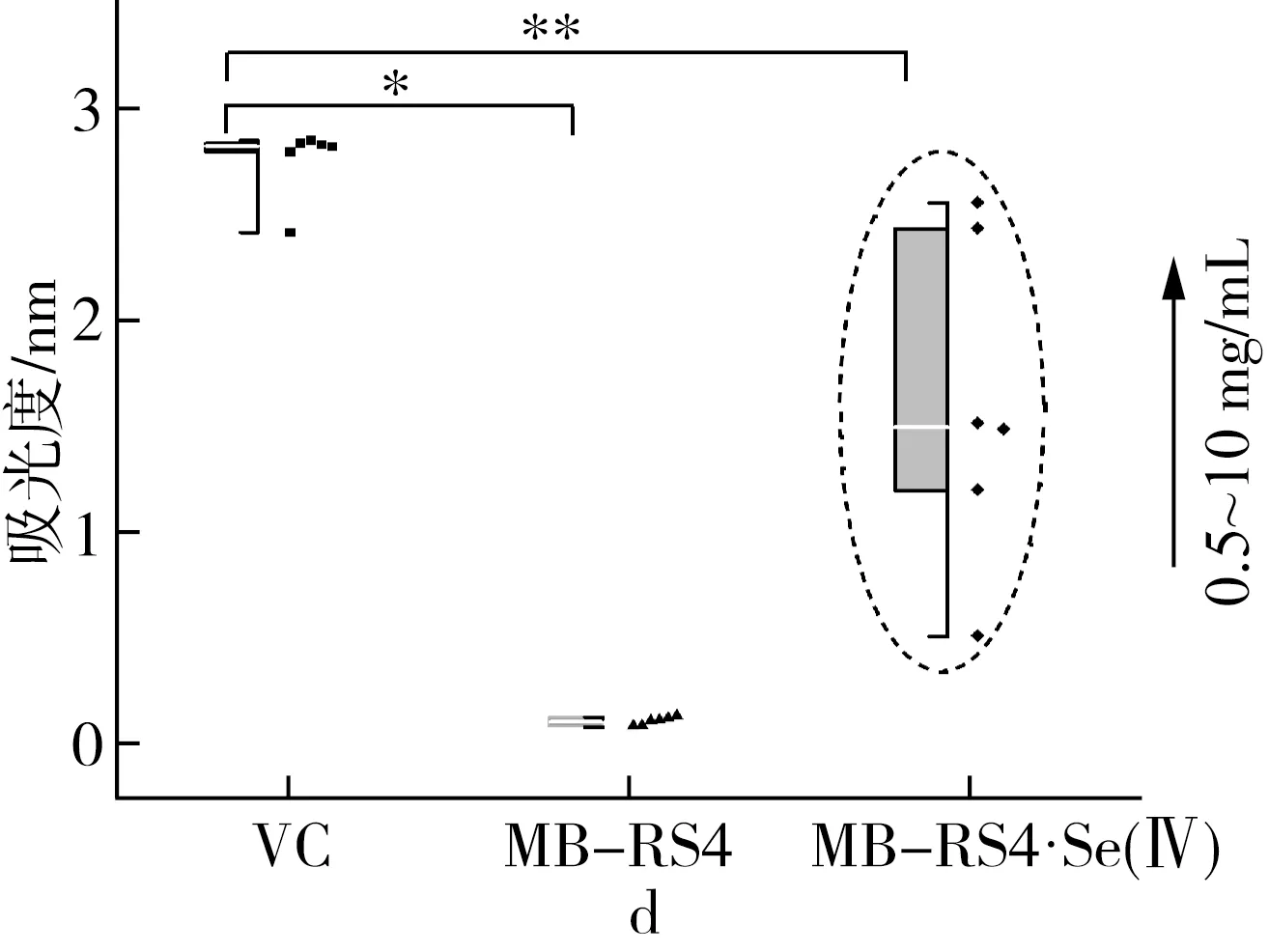
注:*为P≤0.05,**为P≤0.01。
