降糖消渴颗粒对糖尿病小鼠肝脏AMPKα/NF-κB信号通路的影响
2022-10-26赵丹丹莫芳芳高思华
张 毅,赵丹丹 ,莫芳芳,高思华
(1.北京开放大学,北京 100081; 2.北京中医药大学,北京 100029)
糖尿病(DM)是由于胰岛功能低下,无法分泌足够量的胰岛素,或胰岛素分泌正常,但机体对其敏感性下降所导致的一类内分泌代谢性疾病。 2 型糖尿病(T2DM)为后天获得型DM,受遗传因素影响,与生活方式和膳食结构密切相关。 T2DM 起病缓慢,初期以血糖升高为主要表现,可无明显症状,多由体检确诊,随着病程的推进可出现胰岛素抵抗并伴发多器官损伤和功能异常。肝脏是胰岛素的重要靶器官,也是脂质代谢的主要场所。正常情况下,机体在胰岛素作用下维持脂代谢平衡,肝脏的脂质合成和分解也处于动态平衡状态。 当T2DM 发生后,脂质代谢出现紊乱,过多的脂质沉积在肝脏内,导致非酒精性脂肪性肝病(NAFLD)的发生[1]。 一项 关 于DM 的流行病学研究显示,在DM 患者中,NAFLD的发病率逐年升高,两者具有复杂的双向关系[2]。在中国,NAFLD 与 T2DM 的流行趋势相平行[3],合并 NAFLD 的 T2DM 患者占 T2DM 患者总人数的90%[4]。 随着研究的不断深入,NAFLD 的发病机制从“二次打击”学说逐渐完善进化到“多重打击”学说[5]。 其中,胰岛素抵抗、慢性炎症、氧化应激等在T2DM 合并NAFLD 的发生发展中始终占有重要位置。 腺苷酸活化蛋白激酶(AMPK)在调节肝脏脂质代谢方面发挥着重要作用。 AMPK 经活化后,可通过调节脂肪代谢相关靶蛋白活性来维持肝脏脂质稳态[6]。 有研究表明,高脂饮食诱导的大鼠肝脏中磷酸化的 AMPK 表达量减少,核因子 κB(NF-κB)的表达量增多,AMPK 可能是通过调节NF-κB 的活性来减轻肝损伤的[7-8]。
高思华教授多年来致力于脏腑相关理论及中医药防治内分泌疾病的研究及实践,临床治疗T2DM经验丰富,效果显著。 高教授立足于《黄帝内经》,结合多年临证经验,分析、总结、归纳了临床大量T2DM患者的病因、病机特点,提出“肝脾肾三脏同调,辨证治疗T2DM”的观点[9-10],并在此基础上创制了降糖消渴颗粒等系列中药制剂。 前期实验证实降糖消渴颗粒具有降低T2DM 小鼠血糖、血脂,缓解胰岛素抵抗,改善肝脏糖脂代谢紊乱,降低氧化应激水平,减轻糖尿病肝损伤的作用[11-13]。 本研究拟在此基础上,观察降糖消渴颗粒对糖尿病小鼠肝脏AMPK 信号通路和NF-κB 炎症信号通路相关因子表达的影响,从炎症角度进一步探讨降糖消渴颗粒治疗糖尿病、改善糖尿病肝脏脂肪变性的可能作用机制。
1 材料
1.1 动物及饲料
雄性 KK-Ay 小鼠 40 只、C57BL/6J 小鼠 8 只,8周龄,购于北京华阜康生物科技有限公司[许可证号SCXK(京)2012-0001],北京中医药大学屏障环境动物实验室饲养[合格证号 SCXK(京)2011-0024]。 环境温度 22~24 ℃,相对湿度(40±10)%,12 h/12 h 光照明暗周期。 饲养期间,实验动物自由进食及饮水,高脂饲料(20.0%蔗糖、2.5%胆固醇、10.0%猪油、1.0%胆酸钠、66.5%基础饲料)及普通饲料均购自北京科澳协力饲料有限公司。
本动物实验经北京中医药大学医学与实验动物伦理委员会准许(伦理批号:BUCM-4-2016061701-3001)。
1.2 药物
降糖消渴颗粒由生地黄、山萸肉、生晒人参、茯苓、丹参、黄连等10 味药按照一定比例组成,根据制剂工艺设计的依据及处方中各药物有效成分的化学性质,选择适宜的提取方法[11-13],生药购自河北安国药材批发市场,经北京中医药大学中药学院中药科技发展部鉴定为正品,并制成颗粒,每克颗粒含5.01 g生药。 盐酸吡格列酮片(每片15 mg,北京太洋药业有限公司,批号140908)。 给药药品均保存于4 ℃条件下,用前去离子水配制成所需浓度混悬液,超声30 min 使其充分溶解。
1.3 主要仪器与试剂
Trizol 试剂(美国 Invitrogen 公司,批号 1382737)、SYBR Mix 试剂盒(美国 ABI 公司,批号 1501480)、PCR 引物设计合成(上海生工生物工程有限公司)、实时荧光定量聚合酶链反应(RT-qPCR)检测仪器(美国ABI 公司,型号 Step One PLUS)、电动匀浆器(德国IKA 仪器设备有限公司,型号T10BS25)、Merinton超微量紫外分光光度计[美林恒通(北京)仪器有限公司上海分公司,型号SMA 4000]、半裙边PCR 板(美国 ABI 公司,规格:96 孔)、封板膜(美国 ABI 公司,规格:142×78 mm)。
2 方法
2.1 动物模型制备
本实验所有小鼠适应性饲养1 周后,给予KK-Ay小鼠高脂饲料饲养造模,期间C57BL/6J 小鼠继续食用普通饲料。 4 周后,禁食不禁水12 h,检测各组小鼠空腹血糖水平,以空腹血糖≥13.9 mmol/L 为成模标准,均造模成功。
2.2 分组及给药方法
将诱导成模后的糖尿病小鼠随机分为模型组、吡格列酮组及降糖消渴颗粒低(1.75 g/kg)、中(3.50 g/kg)、高(7.00 g/kg)剂量组,每组 8 只。 8 只同周龄C57BL/6J 小鼠作为正常组,普通饲料喂养。 降糖消渴颗粒各组小鼠给予等体积(剂量不同,浓度有差异)中药混悬液灌胃;吡格列酮组小鼠予6.5 mg/kg吡格列酮灌胃治疗;模型组和正常组小鼠予等体积蒸馏水灌胃。 治疗周期为10 周,期间每日上午灌胃 1 次。
2.3 检测指标与方法
2.3.1 RT-qPCR 检测肝脏相关炎症因子mRNA 表达 治疗周期结束后,肝组织取材,4 ℃预冷的生理盐水冲洗干净,分装到提前标记好的EP 管中,液氮保存备用。 检测时,称取100 mg 肝组织,Trizol 法提取总RNA,检测纯度及浓度后,将提取的总RNA 稀释成0.1 μg/μL,按照反转录试剂盒操作说明,建立20 μL 反应体系,反转录成单链 cDNA。 进一步用DEPC 水 10 倍稀释 cDNA,以 SYBR Mix(10 μL)+c DNA 模板(2 μL)+ 上/下游引物(各 1 μL)+ 无核酸酶超纯水(6 μL),反应总体积为 20 μL 的反应体系,使用RT-qPCR 检测仪进行扩增反应。 反应条件如下:50 ℃,2 min;95 ℃,10 min;95 ℃,20 s;60 ℃,15 s。40 个循环,结束后 4 ℃保存。 每组取 4 个样本,各样本上样设2 个复孔。 扩增结果以CT 值表示,各样本mRNA 表达结果以样本中β 肌动蛋白(β-actin)的CT值为基准进行标准化计算,得到相对表达量,采用2-ΔΔCt计算。 ΔΔCt 计算公式如下:ΔΔCt=(Ct目的基因-Ctβ-actin)实验组- (Ct目的基因- Ctβ-actin)对照组。 引物序列见表 1。

表1 炎症因子相关指标引物序列
2.3.2 RT-qPCR 法检测胰岛素信号通路相关基因的表达 实验操作及结果计算方法同2.3.1,引物序列见表2。
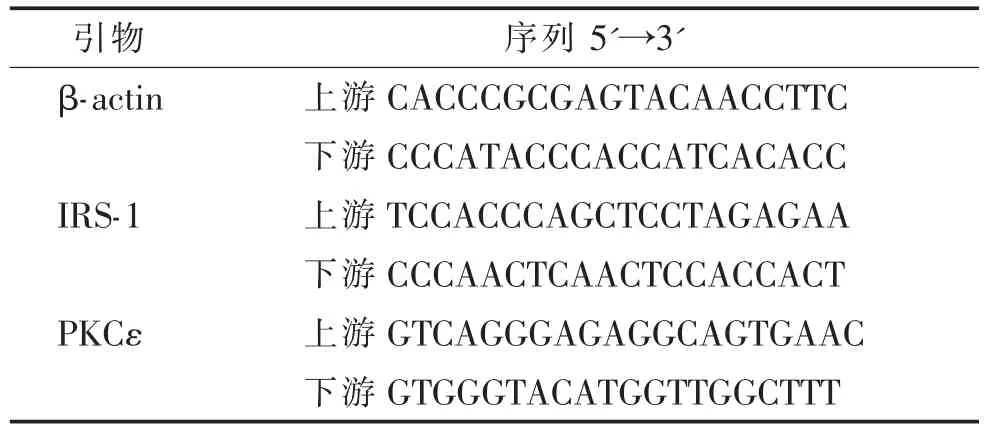
表2 胰岛素信号通路相关指标引物序列
2.3.3 RT-qPCR 法检测AMPK 信号通路相关基因的表达 实验操作及结果计算方法同2.3.1,引物序列见表3。

表3 AMPK 信号通路相关指标引物序列
2.4 统计学方法
实验结果的数据分析用SPSS 19.0 软件进行处理,计量资料以表示。 组间比较采用单因素方差分析。 取α=0.05 为检验水准。
3 结果
3.1 降糖消渴颗粒对T2DM 小鼠肝脏NF-κB、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)mRNA表达的影响
模型组小鼠肝组织中 NF-κB、TNF-α 的 mRNA 表达量较正常组显著上升,差异有统计学意义(P<0.01)。治疗后,降糖消渴颗粒中、低剂量组 NF-κB、TNF-α 的mRNA较模型组显著下降,差异有统计学意义(P<0.01,P<0.05)。 见表 4。
表4 各组小鼠肝脏 NF-κB、TNF-α、IL-1β 的 mRNA 表达()
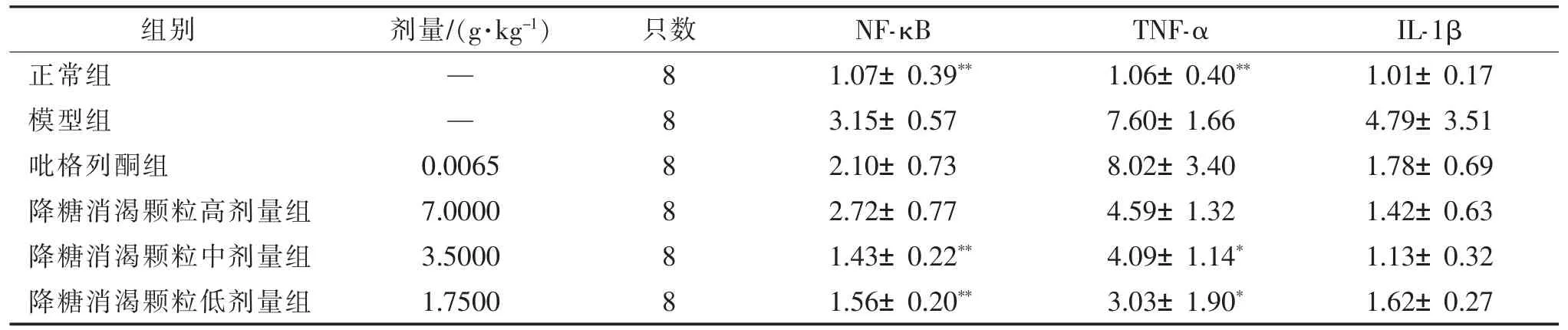
表4 各组小鼠肝脏 NF-κB、TNF-α、IL-1β 的 mRNA 表达()
注:NF-κB 为核因子 κB,TNF-α 为肿瘤坏死因子 -α,IL-1β 为白细胞介素-1β,RQ 为相对表达量。 与模型组比较,*P<0.05,**P<0.01。
组别 剂量/(g·kg-1) 只数 NF-κB TNF-α IL-1β正常组 — 8 1.07±0.39** 1.06±0.40** 1.01±0.17模型组 — 8 3.15±0.57 7.60±1.66 4.79±3.51吡格列酮组 0.0065 8 2.10±0.73 8.02±3.40 1.78±0.69降糖消渴颗粒高剂量组 7.0000 8 2.72±0.77 4.59±1.32 1.42±0.63降糖消渴颗粒中剂量组 3.5000 8 1.43±0.22** 4.09±1.14* 1.13±0.32降糖消渴颗粒低剂量组 1.7500 8 1.56±0.20** 3.03±1.90* 1.62±0.27
3.2 降糖消渴颗粒对T2DM 小鼠肝脏胰岛素信号通路相关基因表达的影响
模型组T2DM 小鼠肝组织胰岛素受体底物-1(IRS-1)的mRNA 表达量较正常组显著减少,差异有统计学意义(P<0.01)。 治疗后,吡格列酮组 IRS-1 mRNA 较模型组上升,差异有统计学意义(P<0.01);降糖消渴颗粒高剂量组蛋白激酶Cε(PKCε)mRNA较模型组降低,差异有统计学意义(P<0.01)。 见表5。
表5 各组小鼠肝脏IRS-1、PKCε 基因表达量比较()

表5 各组小鼠肝脏IRS-1、PKCε 基因表达量比较()
注:IRS-1 为胰岛素受体底物 1,PKCε 为蛋白激酶 Cε,RQ 为相对表达量。 与模型组比较,**P<0.01。
组别 剂量/(g·kg-1) 只数 IRS-1 PKCε正常组 — 8 1.07±0.43** 1.06±0.36模型组 — 8 0.30±0.15 1.50±0.14吡格列酮组 0.0065 8 0.76±0.16** 1.41±0.16降糖消渴颗粒高剂量组 7.0000 8 0.34±0.11 1.04±0.11**降糖消渴颗粒中剂量组 3.5000 8 0.53±0.16 1.44±0.24降糖消渴颗粒低剂量组 1.7500 8 0.60±0.21 1.39±0.22
3.3 降糖消渴颗粒对T2DM 小鼠肝脏AMPKα、过氧化物酶体增殖物激活受体α(PPARα)mRNA 表达的影响
模型组小鼠肝脏 AMPKα、PPARα 的 mRNA 较正常组小鼠均显著下降,差异有统计学意义(P<0.01)。治疗后,吡格列酮组AMPKα mRNA 较模型组显著上升,差异有统计学意义(P<0.01);降糖消渴颗粒高剂量组PPARα mRNA 较模型组显著上升,差异有统计学意义(P<0.01);降糖消渴颗粒中、低剂量组AMPKα mRNA 较模型组显著上升,差异有统计学意义(P<0.01,P<0.05)。 见表 6。
表6 各组小鼠肝脏AMPKα、PPARα 基因表达量比较()
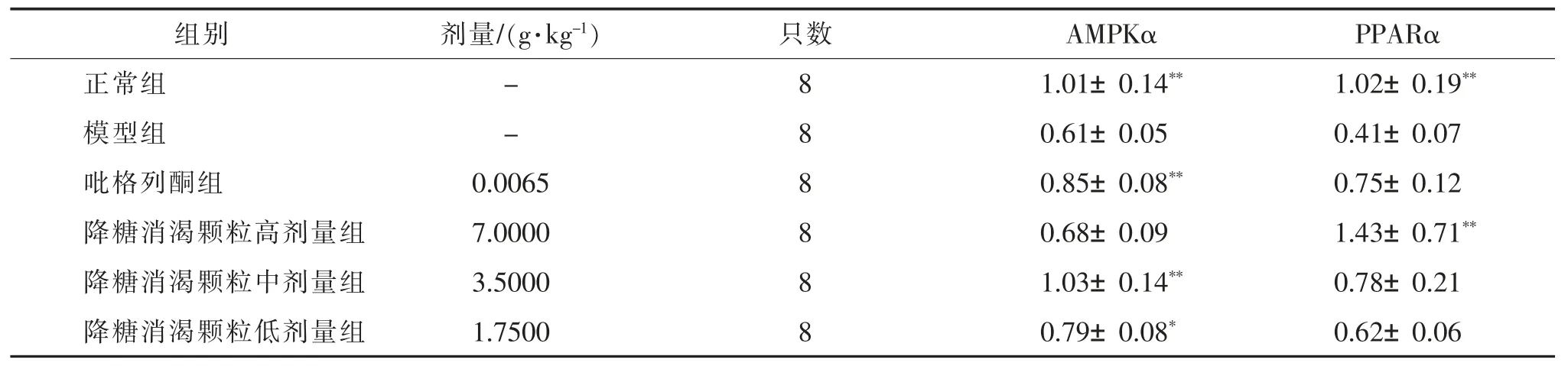
表6 各组小鼠肝脏AMPKα、PPARα 基因表达量比较()
注:AMPKα 为腺苷酸活化蛋白激酶α,PPARα 为过氧化物酶体增殖物激活受体α,RQ 为相对表达量。 与模型组比较,*P<0.05,**P<0.01。
组别 剂量/(g·kg-1) 只数 AMPKα PPARα正常组 - 8 1.01±0.14** 1.02±0.19**模型组 - 8 0.61±0.05 0.41±0.07吡格列酮组 0.0065 8 0.85±0.08** 0.75±0.12降糖消渴颗粒高剂量组 7.0000 8 0.68±0.09 1.43±0.71**降糖消渴颗粒中剂量组 3.5000 8 1.03±0.14** 0.78±0.21降糖消渴颗粒低剂量组 1.7500 8 0.79±0.08* 0.62±0.06
4 讨论
降糖消渴颗粒是基于高思华教授“肝脾肾三脏同调,辨证治疗T2DM”学术思想创立的系列复方之一,针对T2DM 最常见的“肝脾肾气阴两虚,挟热挟瘀”证型而设[11]。 中医学认为肝主疏泄,可通调全身气机,推动气血津液的正常运行;脾主运化,水谷精微在脾气散精作用下化生为气血,濡养四肢百骸,脾亦可统摄血液,使其在脉管内流动;而肾脏主藏先天之精,调控人体的生长、发育和生殖功能,并与脾胃生成的后天之精互相滋养、转化。 三脏协同作用,共同维持人体气血津精的生成、流通、输布、转化,任何一脏损伤,都会渐次波及其余两脏,导致三脏同病的局面,引发 DM[9]。 脾胃为后天之本,气血生化之源,肾精充足则肝、脾功能正常,气血生化有源,疏泄有常。 肾脏虚弱、脾胃功能失常或肝失疏泄,水谷精微失于正常输布转化,痰浊、瘀血丛生;若停留在肝脏中,则肝失调达,疏泄无能,气郁化热,进一步化生痰浊、瘀血,这一过程相当于现代医学的糖脂代谢紊乱状态。
胰岛素生理功能的正常发挥有赖于胰岛素信号的传导,胰岛素抵抗(IR)作为T2DM 的重要发病机制之一,贯穿T2DM 及其并发症发生发展的始终。 在不同的胰岛素受体底物(IRS)中,IRS-1 介导的胰岛素信号通路作用最为广泛,当其功能异常时,胰岛素的靶组织骨骼肌、肝脏、脂肪等均可发生 IR[14]。 PKCε是PKC 家族成员之一,在肝脏中高表达。 T2DM 状态下,脂肪被大量动员,分解作用增强,过多的脂质进入肝脏堆积,激活PKCε,抑制IRS-1 的活性,肝脏胰岛素信号通路传导失常,引发 IR[15-17]。 本实验中,模型组小鼠IRS-1 的mRNA 表达量较正常小鼠明显下调,说明经过高脂饮食诱导,实验小鼠出现了严重的IR。 吡格列酮上调了肝脏中IRS-1 mRNA 的表达,提示吡格列酮可改善肝脏IR。 降糖消渴颗粒对肝脏中IRS-1 mRNA 表达并未体现出明显作用,可能是因为实验小鼠所有胰岛素靶器官都存在严重的IR,并不仅仅局限于肝脏内,IRS-1 虽然在全身广泛分布,但肝脏并不是其特异性高表达部位。 从肝脏提取的总mRNA 中,IRS-1 mRNA 含量较少,在各组实际表达量相差不大的情况下不易进行统计学比较。 从表达趋势上可以分析,中、低剂量降糖消渴颗粒对IRS-1 mRNA 的表达量具有一定上调作用。本实验正常组小鼠PKCε mRNA 表达量组内差异太大,对照性不佳,但从表达趋势上可以看出糖尿病小鼠肝脏内的PKCε mRNA 表达上调,高剂量降糖消渴颗粒下调了肝脏PKCε mRNA 表达,与模型组比较差异有统计学意义。 吡格列酮可通过激活过氧化物酶体增殖物激活受体γ(PPARγ)受体,增强IR 状态下靶组织对胰岛素的敏感性。 由于PPARγ 在肝脏中表达较少,肝组织中PPARγ 的激活不足以大幅减轻肝脏的 IR,PKCε mRNA 表达变化不明显。 此处提示,高剂量降糖消渴颗粒下调PKCε mRNA 表达的作用可能不是通过激活PPARγ 受体来实现的,其作用途径尚需进一步研究。 此处mRNA 初筛结果不佳,因此未继续做相关蛋白表达量的检测。
NF-κB 是调节炎症反应的重要因子,也是氧化应激的重要靶点,受内环境中高糖、高脂的影响。T2DM 合并NAFLD,特别是非酒精性脂肪性肝炎状态下,肝脏中NF-κB 表达显著增加,且与疾病的严重程度呈正相关,NF-κB 也可能是饱和脂肪酸诱导肝细胞发生“脂毒性”和炎症反应的原因之一[18]。 在糖尿病肝损伤的发生过程中,NF-κB 可被活性氧(ROS)激活,促进 TNF-α、白细胞介素-1(IL-1)等炎症细胞因子表达,降低细胞对胰岛素的敏感性,阻碍胰岛素信号向胞内的传递,导致机体IR 发生,引发肝脏脂质代谢紊乱。 而肝脏脂质代谢紊乱产生的还原性代谢产物反过来加重肝脏氧化应激反应,进一步激活NF-κB 介导炎症反应[19]。 TNF-α、IL-1 和 NF-κB 互相促进分泌及合成,共同介导了炎症反应和IR 的发生。 AMPK 是治疗糖尿病脂质代谢紊乱的重要靶点,在肝脏的作用主要表现为抑制肝脏脂质合成,促进脂质氧化[20]。 PPARα 受体作为脂类感受器,受AMPK 调控,在机体肝脏中特异性高表达,可以调节肝脏脂质代谢的各个方面。 除此之外,AMPK 的激活可通过多种途径抑制NF-κB 信号通路的激活,减少炎症因子的表达[21]。 本实验中模型组小鼠肝脏中NF-κB、TNF-α 的基因表达较正常组小鼠显著上调,说明肝脏中发生了严重的炎症反应。 降糖消渴颗粒低、中剂量组显著下调了 NF-κB 和 TNF-α mRNA 的表达,提示降糖消渴颗粒具有良好的抗炎、减少炎症因子分泌的作用。 肝脏中 AMPKα、PPARα mRNA的表达明显下调,是DM 小鼠NAFLD 的重要原因之一。 降糖消渴颗粒低、中剂量组显著上调了肝脏中AMPKα mRNA 表达,且在3.50 g/kg 剂量范围内,其作用体现出了一定的剂量依赖性。 结合炎症相关指标的变化,推论降糖消渴颗粒的抗炎作用可能是通过AMPKα 的调节作用实现的。 基因表达量的变化只能反映AMPKα 生物合成的增强,而其发挥作用有赖于磷酸化激活,因此,后续实验应验证肝脏脂质代谢关键位点的蛋白,尤其是磷酸化蛋白表达量的变化,以进一步验证降糖消渴颗粒的作用。
综上所述,降糖消渴颗粒可能是通过AMPKα调节糖尿病小鼠肝脏NF-κB 信号通路以减轻炎症反应、缓解IR,从而改善T2DM 状态下肝脏脂代谢紊乱造成的肝损伤;其中低、中剂量降糖消渴颗粒综合作用较好。
