负载咪鲜胺介孔二氧化硅粒子的制备及性能与安全性评价
2022-10-25侯超群孟霄汉冯建国
侯超群, 陈 旺, 吕 泽, 韦 诺, 孙 利, 孟霄汉, 冯建国
(扬州大学 植物保护学院,江苏 扬州 225009)
咪鲜胺 (prochloraz,结构式见图式1) 属于麦角甾醇合成抑制类杀菌剂,可导致子囊菌和半枝菌菌体细胞结构与功能遭到损坏,从而防治多种果蔬、大田和经济作物病害[1-2]。由于咪鲜胺难溶于水,通常被加工成乳油使用,但乳油配方中有机溶剂用量多,易对生态环境产生污染,并且容易使咪鲜胺暴露在酸碱和强光环境中而分解[3],导致其使用范围受到限制。此外,咪鲜胺会导致雌性斑马鱼雄性化[4],并会造成男性胎儿类固醇物质合成减少[5]。因此,研发绿色高效农药新剂型将有利于解决咪鲜胺使用中存在的问题。

图式1 咪鲜胺化学结构式Scheme 1 Chemical structure of prochloraz
介孔二氧化硅粒子 (mesoporous silica nanoparticles,MSNs) 是医学和农业领域常见的药物缓控释载体之一,具有比表面积大、孔径可调、孔道均匀、表面易修饰以及生物相容性好等优点[6-7]。载药MSNs 不仅可以避免有效成分分解,减少农药使用量和使用频次,而且可以降低对非靶标生物的毒性,减轻环境压力[8-9]。同时,采用MSNs 作为载体还可以促进农作物对农药的吸收和利用[10],提高防治效果。近年来,利用MSNs 负载农药制备缓控释剂已成为国内外研究的热点,涉及吡唑醚菌酯[11]、丙硫菌唑[12]、阿维菌素[13]、氯虫苯甲酰胺[14]和2,4-D[15]等多个农药品种。目前,制备空白MSNs 的方法主要包括基于聚苯乙烯球的硬模板法[16]和基于胶束的软模板法[17],其中通过硬模板法获得的MSNs 呈中空结构且平均粒径较大。无论是硬模板法还是软模板法,MSNs 载药过程通常是先去除其中的模板,然后将MSNs 置于饱和的农药溶液中进行吸附,该方法存在操作相对复杂、制备周期长及载药量有限等缺点。将农药负载与MSNs 形成过程同步进行而制备载药MSNs的方法被称为“一锅法”,具有操作简单、周期短、载药量高的特点,已成为众多学者研究的焦点[18-19]。
当前,研究者通过修饰MSNs 成功制备了负载咪鲜胺的农药缓控释剂,能够实现有效成分对pH[20]、酶[21]或谷胱甘肽[22]的响应性控制释放,然而,现有文献主要考察了咪鲜胺控释剂对油菜菌核病菌的控制效果[22-23],且针对非靶标生物安全性的考察相对较少。因此,本研究采用“一锅法”制备了负载咪鲜胺的介孔二氧化硅载药粒子 (prochloraz@MSNs),通过扫描电镜 (SEM)、透射电镜 (TEM)、傅立叶红外光谱 (FTIR)、热重分析 (TGA)、Brunauer-Emmett-Teller (BET) 比表面积分析和X 射线衍射分析 (XRD) 等对载药粒子的理化性能进行了表征,探究了prochloraz@MSNs 在不同条件下的释放行为,并考察了载药粒子对稻瘟病菌Magnaporthe oryzae和小麦赤霉病菌Fusahum graminearum的防治效果以及对斑马鱼、蚯蚓和人体肺部BEAS-2B 细胞的毒性效应,以期为咪鲜胺的高效、安全使用提供新的思路与方法。
1 材料与方法
1.1 病原菌、药剂及主要仪器
稻瘟病菌M. oryzae、小麦赤霉病菌F. graminearum,由扬州大学植物保护学院植物病理学实验室提供。
95% 咪鲜胺 (prochloraz) 原药 (江苏辉丰生物农业股份有限公司);25%咪鲜胺乳油 (四川润尔科技有限公司);氨水、无水乙醇、十六烷基三甲基溴化铵 (CTAB)、正硅酸四乙酯 (TEOS) 均为分析纯 (国药集团化学试剂有限公司);PBS 缓冲液(北京索莱宝科技有限公司);Annexin-V-FITC/PI细胞凋亡检测试剂盒 (上海翌圣生物科技股份有限公司)。
场发射扫描电子显微镜 (S-4800,日本Hitachi公司);透射电子显微镜 (Tecnai 12,荷兰Philips公司);傅里叶红外光谱仪 (Agilent Cary630,美国Agilent 公司);热重分析仪 (STA 449 F5 Jupiter®,德国NETZSCH 公司);比表面分析仪 (ASAP 2460,德国Rubothem 公司);流式细胞仪(FACSAria SORP,美国BD 公司);电子天平 (BSA 423S-CW,德国Sartorius 公司);台式冷冻真空干燥箱 (DZF-6030,苏州纳美瑞电子科技有限公司);集热式恒温加热磁力搅拌器 (DF-101S,河南巩义予华仪器设备有限公司);高效液相色谱仪 (Waters e2695,美国Waters 公司)。
1.2 prochloraz@MSNs 的制备
参考Feng 等[24]的方法。首先用50 mL 无水乙醇将100 mg 咪鲜胺原药超声溶解,并添加一定量的TEOS 混合搅拌得到油相;然后将70 mL 去离子水和适量CTAB 超声混合,得到水相;将制备好的油相和水相充分混合搅拌,调节pH 至约9.5,搅拌10 h;反应结束后离心洗涤,冷冻干燥即得到负载咪鲜胺的载药粒子 (prochloraz@MSNs)。
1.3 prochloraz@MSNs 性能表征
1.3.1 外观形貌及内部结构观察 通过扫描电镜(SEM) 和透射电镜 (TEM) 观察研究MSNs 和prochloraz@MSNs 的外观形貌及内部结构。
1.3.2 傅立叶红外光谱分析 以KBr 为背景,分别对MSNs、prochloraz 和prochloraz@MSNs 从4 000~400 cm-1范围进行扫描。
1.3.3 载药量测定 在25~800 ℃内,以10 ℃/min 的加热速率在气流中对MSNs 与prochloraz@MSNs进行热重分析 (TGA),同时计算载药量[25]。
1.3.4 孔径分布和比表面积测定 采用比表面分析仪进行物理吸附特性分析,样品在120 ℃下脱气2 h,以氮气为分析气体测定饱和压力,通过测定不同吸附压力下的吸附体积,获得吸附-解吸附等温曲线。通过Brunauer-Emmett-Teller (BET) 法计算比表面积,采用Barrett-Joyner-Halenda (BJH)法测定孔径和孔体积分布。
1.3.5 X 射线衍射分析 在5~80°范围内,以2 °/min的速率对MSNs、prochloraz 和prochloraz@MSNs样品进行X 射线衍射分析 (XRD)。
1.4 释放行为
通过透析袋法[26]研究prochloraz@MSNs 的释放行为。将0.1 g 样品悬浮于装有10 mLV(乙醇) :V(水)=3 : 7 的释放介质的透析袋中,再将透析袋密封并浸入装有190 mL 释放介质的锥形瓶中,在25 ℃下以150 r/min 频率进行振荡。按预先设置好的时间间隔每次取样1 mL,并向锥形瓶中加入等量新鲜释放介质。取出的释放介质经过滤器过滤,通过高效液相色谱法测定其中咪鲜胺的浓度。色谱条件:Waters XTerra MS C18色谱柱(250 mm × 4.6 mm,5 μm);流动相为V(乙腈) :V(水) =75 : 25;流速1.0 mL/min;检测波长260 nm;进样量10 μL;柱温26 ℃。
分别采用零级动力学方程、一级动力学方程、Higuchi 动力学方程和Ritger-Peppas 动力学方程对prochloraz@MSNs 中咪鲜胺在不同释放条件下的累积释放曲线进行拟合。
1.5 生物活性测定
采用菌丝生长速率法[27]测定prochloraz@MSNs 对稻瘟病菌和小麦赤霉病菌的抑制活性。在无菌条件下,从预培养好的PDA 培养基上打取直径6 mm 的菌丝盘,分别接种至含不同浓度梯度prochloraz@MSNs 及对照药剂咪鲜胺乳油的培养基中央,以清水处理的接种培养基为对照。每处理3 个重复,置于26 ℃生化培养箱中培养,采用十字交叉法测量菌落直径,根据公式 (1) 计算抑制率。

式中,I:菌丝生长抑制率,%;DCK:对照组菌落直径,mm;DT:处理组菌落直径,mm。
1.6 安全性评价
1.6.1 对斑马鱼的安全性评价 遵循GB/T 31270.12-2014[28]中的标准方法。通过预试验确定浓度范围后,分别设置5 个不同梯度浓度,每浓度3 个重复,每重复10 条斑马鱼,并设空白对照。试验在23 ℃ ± 2 ℃下进行,于开始后24、48、72 和96 h记录斑马鱼的死亡数量,计算LC50值。
1.6.2 对蚯蚓的安全性评价 同样遵循GB/T 31270.15-2014[29]中的标准方法。通过预试验确定药剂浓度范围后,分别设置5 个梯度浓度,每浓度3 个重复,每重复10 条蚯蚓,并设空白对照。置于培养箱 (20 ℃ ± 2 ℃,相对湿度80% ± 5%) 中培养7 和14 d 后,记录蚯蚓死亡数量,计算LC50值。
1.7 细胞凋亡测定
采用Annexin-V-FITC/PI 双染试验[30]检测prochloraz@MSNs 对BEAS-2B 细胞凋亡的影响。分别设药物组和阴性对照组,培养24 h 后,药物组给予25 mg/L 的prochloraz@MSNs 和咪鲜胺乳油,同时以在无血清培养基中培养、未经处理的细胞作为阴性对照组。培养24 h 后,取贴壁细胞用胰蛋白酶消化30 s,于1 000 r/min 下离心5 min,加入2 mL PBS 使细胞重悬;重复2~3 次。分别向每个试管中添加5 μL Annexin-V-FITC 和10 μL PI,对细胞悬浮液进行暗染色,孵育15 min 后,使用流式细胞仪检测并通过FlowJo-V10 对数据进行分析。
1.8 数据统计分析
本研究所有数据均采用SPSS 22.0 软件进行处理,通过Duncan’s 多极差检验进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 理化性能
2.1.1 外观形貌及粒径 MSNs 和prochloraz@MSNs 的SEM 和TEM 观测结果如图1 所示。其中,MSNs 球形结构均匀,内部孔隙有序,平均粒径约为180 nm (图1a 和图1c);与MSNs 相比,prochloraz@MSNs 表面更粗糙,颗粒更大,平均粒径达到240 nm,蠕虫孔消失 (图1b 和图1d),表明原药已进入MSNs 孔道中,咪鲜胺被成功负载。载药后粒径变大的原因可能是由于在反应过程中咪鲜胺占据了MSNs 的孔道位置,同时prochloraz@MSNs 继续聚合生长,从而导致粒径变大[31]。

图1 MSNs 和prochloraz@MSNs 的SEM 照片 (a、b) 及TEM 照片 (c、d)Fig. 1 SEM photos (a, b) and TEM photos (c, d) of MSNs and prochloraz@MSNs
2.1.2 傅立叶红外光谱分析 MSNs、咪鲜胺和prochloraz@MSNs 的FTIR 光谱见图2。其中,咪鲜胺中的C=O 键伸缩振动吸收峰出现在1 679.94 cm-1处,C-H 键振动引起的吸收峰出现在661.55、759.52 与1 129.30 cm-1处[32-33];MSNs 和prochloraz@MSNs 均在1 064.67 cm-1和1 070.45 cm-1处出现了Si-O-Si 键的振动吸收峰,同时prochloraz@MSNs的光谱中1 232.47 cm-1和1 697.29 cm-1处出现了咪鲜胺的特征峰[34]。所得结果证明咪鲜胺已被MSNs 成功包覆。

图2 MSNs、咪鲜胺和prochloraz@MSNs 的傅立叶红外光谱Fig. 2 The fourier transform infrared spectroscopy spectra of MSNs, prochloraz and prochloraz@MSNs
2.1.3 载药量 MSNs 和prochloraz@MSNs 在氮气环境中的热重分析结果见图3。从30 ℃到125 ℃,MSNs 和prochloraz@MSNs 的失重率分别约为7.5%和3.8%,这部分失重推测是由于样品中水分蒸发所致。prochloraz@MSNs 从125 ℃到800 ℃的失重则可能是由原药咪鲜胺的分解造成,失重率为43.0%;而在此温度区间,MSNs 的失重率为2.4%;同时,由失重差可知,prochloraz@MSNs的载药量为40.6%。

图3 MSNs 和prochloraz@MSNs 的热重分析Fig. 3 Thermogravimetric analysis of MSNs and prochloraz@MSNs
2.1.4 孔径分布和比表面积 MSNs 和prochloraz@MSNs 的氮气吸附-脱附曲线和孔径分布如图4 所示。在相对压力区域P/P0<0.4 时,N2吸附量随着P/P0的增大而逐渐增大,且在P/P0为0.2~0.3 处N2吸附量急剧上升,曲线为典型的IV 型吸附等温线,说明所制备样品具有介孔结构[35]。MSNs 和prochloraz@MSNs 的孔隙结构测试结果见表1。从中可看出,与空白MSNs 相比,负载咪鲜胺后,prochloraz@MSNs 的比表面积和总孔隙体积均显著减小,表明咪鲜胺已被成功负载到MSNs 中。

表1 MSNs 和prochloraz@MSNs 的N2 吸附分析Table 1 N2 adsorption analysis of MSNs and prochloraz@MSNs

图4 MSNs 和prochloraz@MSNs 的N2 吸附-脱附曲线(a)和孔径分布(b)Fig. 4 N2 adsorption-desorption curves (a) and pore size distribution (b) of MSNs and prochloraz@MSNs
2.1.5 X 射线衍射分析 MSNs、咪鲜胺原药和prochloraz@MSNs 的X 射线衍射分析结果见图5。其中,咪鲜胺在多个入射角度出现了尖锐清晰的衍射峰,表明其结晶度高,晶体与晶面结构良好;而MSNs 和prochloraz@MSNs 的XRD 图谱在10°至40°间出现了一个宽峰,表明两者的非晶体结构没有发生改变[36]。载药前后,MSNs 的衍射峰位置无明显变化,说明咪鲜胺载入MSNs 中后并未影响孔道结构的有序性,粒子的骨架结构未发生变化[37]。

图5 咪鲜胺、MSNs 和prochloraz@MSNs 的X 射线衍射图Fig. 5 X-ray diffraction patterns of prochloraz, MSNs and prochloraz@MSNs
2.2 释放行为
通过透析袋法对载药prochloraz@MSNs 的释放行为进行考察,测定了不同pH 值和温度条件下prochloraz@MSNs 中咪鲜胺的释放规律 (图6)。在pH 值为5.0 时,24 h 内prochloraz@MSNs 中咪鲜胺的累计释放率为54%;在pH 值为7.0 时,96 h内累计释放率为50%;在pH 值为9.0 时,48 h 内累计释放率为50%。图6a 中结果表明,酸性和碱性条件有利于咪鲜胺的释放。其原因可能是在酸性和碱性条件下,由于MSNs 中主要骨架成分硅氧烷键 (≡Si—O—Si≡) 被水解破坏,导致其微观结构分解而加速了咪鲜胺的释放[38-40]。图6b 中结果表明,在45 ℃时,8 h 内prochloraz@MSNs 中咪鲜胺的累计释放率为51%;35 ℃时,24 h 内累计释放率为50%。高温下释放较快的原因可能是由于温度升高有利于咪鲜胺在释放介质中的扩散[41]。
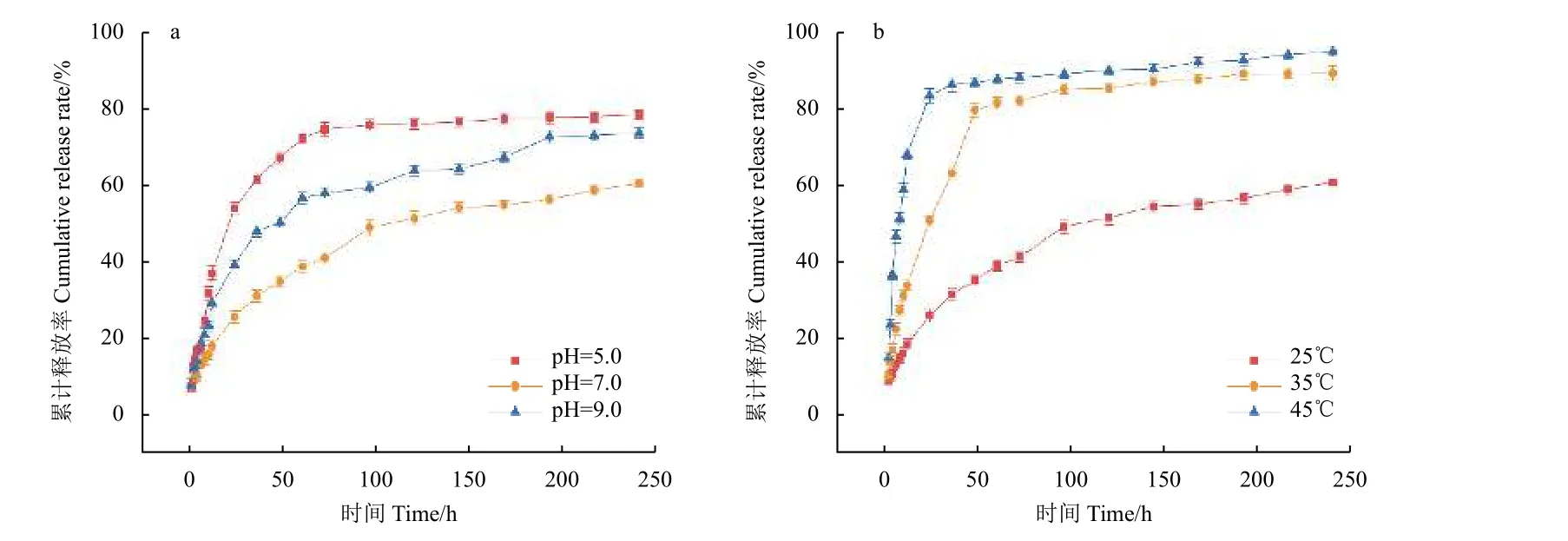
图6 prochloraz@MSNs 在不同pH 值 (a) 和不同温度 (b) 下的释放曲线Fig. 6 The release curve of prochloraz@MSNs at different pH (a) and different temperature (b)
采用4 种动力学模型拟合分析prochloraz@MSNs 的释放曲线 (图7),拟合结果 (表2) 表明:prochloraz@MSNs 在不同pH 值 (25 ℃) 与不同温度 (pH=7.0) 条件下的释放动力学拟合均符合一级动力学方程,表现为释放速率快速下降的简单扩散。此外,对prochloraz@MSNs 的释放行为进行Ritger-Peppas 动力学方程拟合后,方程的扩散指数 (K2) 均低于0.43,表明不同pH 值与温度下咪鲜胺的释放均属于Fickian 扩散[42]。

表2 不同pH 值和温度下咪鲜胺的释放动力学模型拟合结果Table 2 Fitting results of models for the release kinetics of prochloraz at different pH and temperature
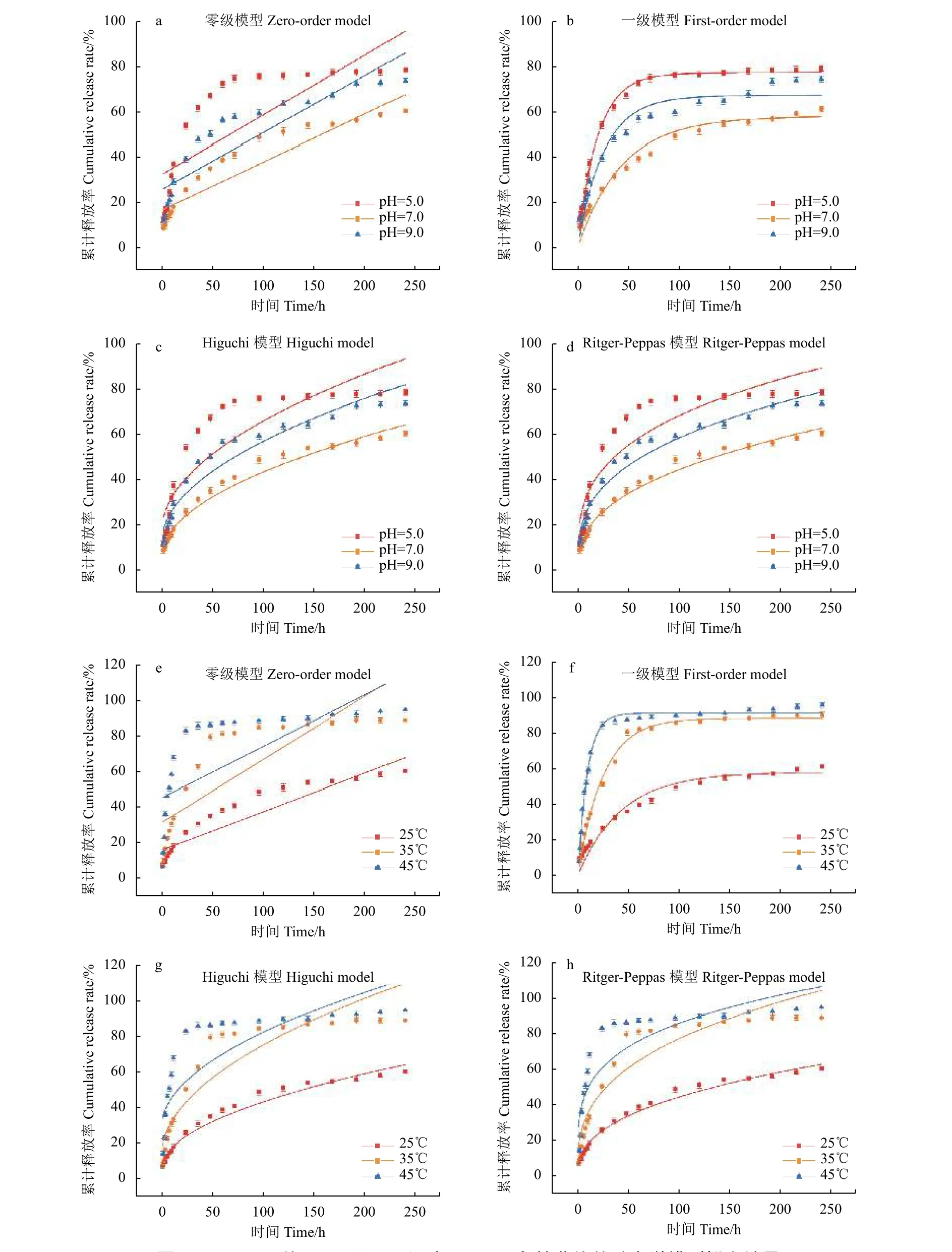
图7 不同pH 值 (a~d) 和不同温度 (e~h) 下释放曲线的动力学模型拟合结果Fig. 7 Fitting results of the kinetic model of the release curve at different pH (a-d) and temperature (e-h)
2.3 生物活性
从图8A 中可看出,无菌水处理的空白对照组稻瘟病菌在192 h 时已基本长满整个培养基。在相同生长时间内,10 mg/L prochloraz@MSNs 处理组菌落大小与生长速率始终小于对照药剂咪鲜胺乳油处理组。从图8B 中可看出,在相同浓度下,prochloraz@MSNs 对菌丝生长的抑制率明显高于咪鲜胺乳油,且抑制率随处理浓度的增大而增大。采用质量浓度10 mg/L 处理后192 h,prochloraz@MSNs 和咪鲜胺乳油对稻瘟病菌菌丝生长的抑制率分别为57.35%和27.45%。从图8C中可看出,培养192 h 后,prochloraz@MSNs 和咪鲜胺乳油对稻瘟病菌的EC50值分别为5.13 和188.52 mg/L。研究表明,prochloraz@MSNs 对稻瘟病菌的抑制活性远高于对照药剂咪鲜胺乳油。
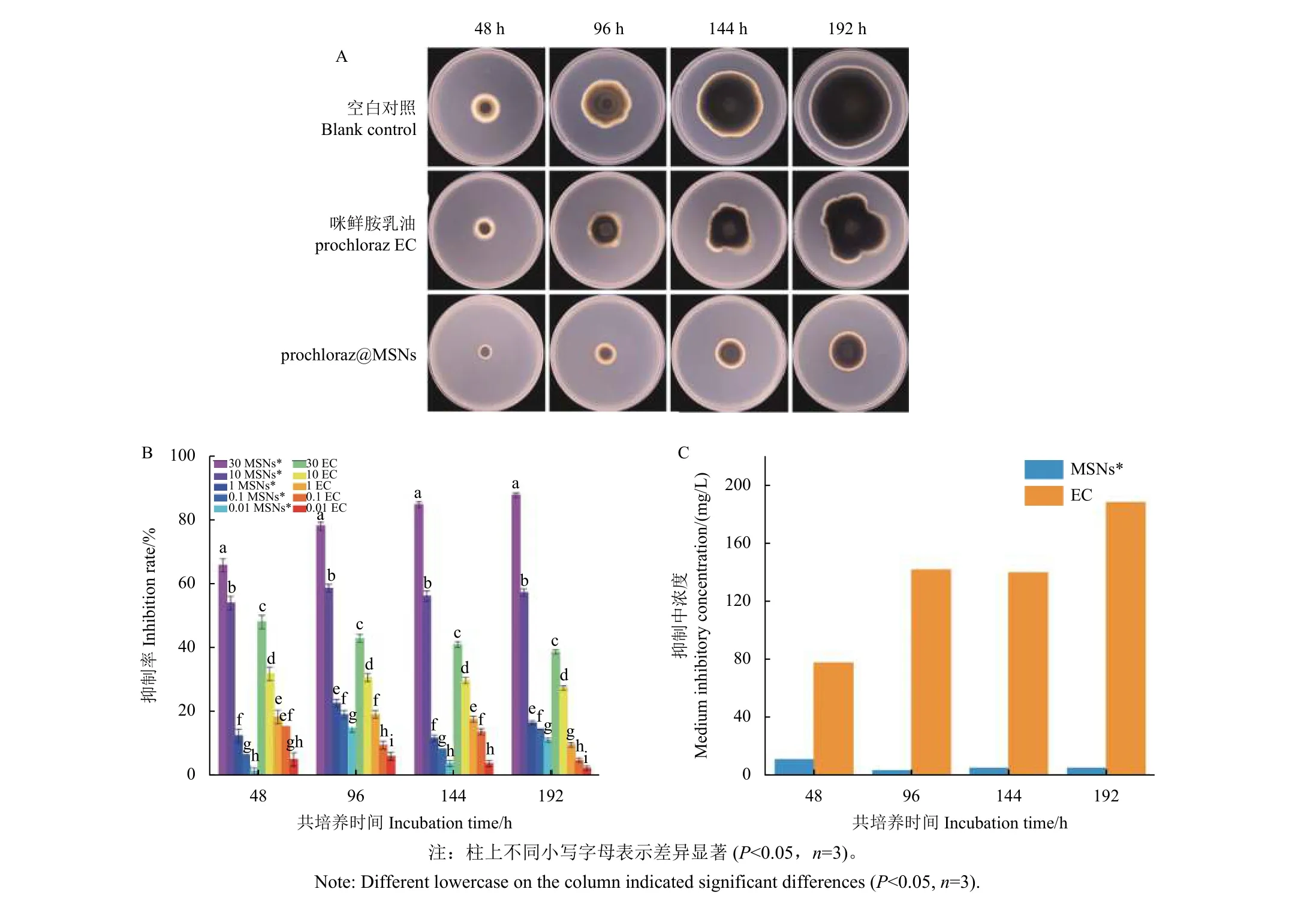
图8 prochloraz@MSNs (MSNs*) 与咪鲜胺乳油 (EC) 对稻瘟病菌的抑制活性 (A)、菌丝生长抑制率 (B) 和抑制中浓度 (C)Fig. 8 Antifungal activity (A), inhibition rate (B) and inhibitory concentration (C) of prochloraz@MSNs (MSNs*) and prochloraz EC against M. oryzae
从图9A 中可看出,无菌水处理的小麦赤霉病菌在96 h 时已长满整个培养基。在相同生长时间,prochloraz@MSNs (10 mg/L) 处理的菌落大小与生长速率始终小于对照药剂咪鲜胺乳油处理。同样,从图9B 中可看出,prochloraz@MSNs 对小麦赤霉病菌菌丝生长的抑制率明显高于咪鲜胺乳油,且处理浓度越大,抑制率越大。10 mg/L 质量浓度下处理后96 h,prochloraz@MSNs 与咪鲜胺乳油对小麦赤霉病菌菌丝生长的抑制率分别为82.43%和32.88%。从图9C 中可看出,菌丝生长96 h后,prochloraz@MSNs 和咪鲜胺乳油对小麦赤霉病菌的EC50值分别为1.97 和54.95 mg/L。随着时间推移,两种药剂的EC50值逐渐降低,与随时间逐渐增加的抑制率对应。这进一步说明prochloraz@MSNs 对小麦赤霉病菌的防治效果优于对照药剂咪鲜胺乳油,且持效期较长。
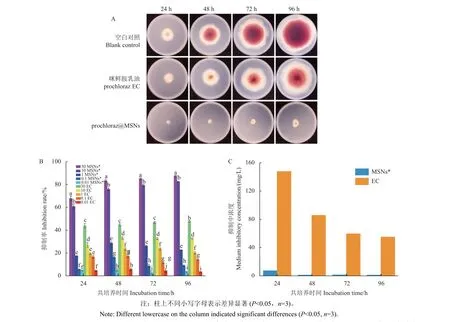
图9 prochloraz@MSNs (MSNs*) 与咪鲜胺乳油 (EC) 对小麦赤霉病菌的抑制活性 (A)、菌丝抑制率 (B) 和抑制中浓度 (C)Fig. 9 Antifungal activity (A), inhibition rate (B) and inhibitory concentration (C) of prochloraz@MSNs (MSNs*) and prochloraz EC against F. graminearum
2.4 安全性
农药在施用过程中因喷雾漂移或雨水冲刷等原因而进入到生态环境中,会对水体与土壤中的生物产生负面影响[43],因此,测定prochloraz@MSNs 对水体中斑马鱼和土壤中蚯蚓的急性毒性是考察其安全性的重要途径。不同暴露时间下,prochloraz@MSNs 对斑马鱼的急性毒性试验结果如表3 所示。根据农药对鱼类的毒性等级划分标准[28]:96 h-LC50<0.1 mg/L 表示剧毒;96 h-LC50值在0.1~1.0 mg/L 之间表示高毒;96 h-LC50值在1.0~10.0 mg/L 之间表示中毒;96 h-LC50>10.0 mg/L表示低毒。本研究中乳油制剂表现为高毒性,而prochloraz@MSNs 则属于低毒。

表3 prochloraz@MSNs 和咪鲜胺乳油对斑马鱼的致死中浓度Table 3 LC50 of prochloraz@MSNs and prochloraz EC for zebrafishs
不同暴露时间下,prochloraz@MSNs 对蚯蚓的急性毒性试验结果如表4 所示。根据农药对蚯蚓的毒性等级划分标准[29]:14 d-LC50值 (有效成分,其余同)<0.1 mg/kg (土壤) 表示剧毒;14 d-LC50值在0.1~1.0 mg/kg (土壤) 表示高毒;14 d-LC50值在1.0~10.0 mg/kg (土壤) 表示中毒;14 d-LC50值>10.0 mg/kg (土壤)表示低毒。结果表明,prochloraz@MSNs 对蚯蚓表现为低毒性。

表4 prochloraz@MSNs 和咪鲜胺乳油对蚯蚓的致死中浓度Table 4 LC50 of prochloraz@MSNs and prochloraz EC for earthworms
2.5 细胞毒性
农药在施用过程中容易通过呼吸系统等进入操作者体内,因此,本研究选择正常人肺部的上皮细胞 (BEAS-2B) 作为细胞毒性评价的对象[44],考察了prochloraz@MSNs 对人体的安全性,以空白和对照药剂咪鲜胺乳油处理为对照。结果显示,空白对照和prochloraz@MSNs 处理组BEAS-2B 细胞的总凋亡水平分别为3.16%和3.61%,两者之间未观察到显著差异,而咪鲜胺乳油处理组BEAS-2B 细胞的总凋亡水平较高,为5.87%,与空白对照和prochloraz@MSNs 处理组差异显著(图10)。研究表明,所制备的prochloraz@MSN对BEAS-2B 细胞的毒性较低。

图10 prochloraz@MSNs 和对照药剂咪鲜胺乳油对人体肺部BEAS-2B 细胞的影响Fig. 10 Effects of prochloraz@MSNs and prochloraz EC on human lung BEAS-2B cells
3 结论
采用介孔二氧化硅粒子 (MSNs) 制备的农药缓控释剂不仅可以保护有效成分免受外界因素破坏,延长持效期,降低农药使用量,而且可减少对有益生物的影响。本研究采用“一锅法”制备了负载咪鲜胺的介孔二氧化硅载药粒子 (prochloraz@MSNs),该载药粒子尺寸均一、分散性好,粒径在240 nm 左右,载药量为40.6%,释放速率与pH 值和温度相关,酸性、碱性及高温条件有利于其中咪鲜胺的释放。所制备的prochloraz@MSNs增强了咪鲜胺对稻瘟病菌和小麦赤霉病菌菌丝生长的抑制作用,并显示出持续的控制效果,且对水环境、土壤环境和人体细胞相对友好。当前,利用MSNs 负载农药已成为农药缓控释剂的重要研究方向之一,但主要集中于通过配方优化获得较高的载药量,而针对载药MSNs 在作物叶面沉积以及在靶标体内传导性能等的研究相对较少,后续可通过引入聚多巴胺和量子点等材料对载体加以修饰,以期提高载药粒子在靶标表面的粘附性和实现载药粒子在靶标体内传导的可视化。此外,关于载药粒子对有益生物的影响以及环境归趋等也将成为相关领域研究的重点。基于MSNs 的农药载体不仅可以为实现农药减量增效提供思路,且对促进农药产业良性健康发展具有重要意义,而如何在现有研究基础上获得智能化、性能优和成本低的农药缓控释剂,并将其产业化和推广应用,仍是科研人员亟需解决的问题。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

侯超群,男,硕士研究生。2022年毕业于扬州大学植物保护学院获植物保护专业学士学位,现就读于扬州大学植物保护学院资源利用与植物保护专业,研究方向为农药剂型加工原理与使用技术。

冯建国,男,副教授,硕士生导师。2013 年毕业于中国农业大学,获农药学专业博士学位。2013 年7 月至今,先后为扬州大学植物保护学院讲师、副教授。主要从事农药剂型加工原理与使用技术研究,先后主持江苏省自然科学基金、江苏省农业自主创新资金等多个项目,以第一或通讯作者发表论文60 余篇,其中SCI 论文20 余篇,主编论著1 部,副主编论著2 部,参编英文论著1 部,授权发明专利2 项,获江苏省科学技术奖三等奖1 项,排名5/5,现任中国农药制剂与助剂专业委员会委员,《农药学学报》青年编委。
