新型吡唑-喹唑啉二酮类对羟基苯丙酮酸双加氧酶抑制剂的设计、合成及生物活性
2022-10-25严耀超王亚楠曲仁渝南甲戌林红艳杨光富
严耀超, 王亚楠, 何 波, 曲仁渝, 南甲戌, 林红艳, 杨光富
(华中师范大学 化学学院 农药与化学生物学教育部重点实验室,武汉 430079)
对羟基苯丙酮酸双加氧酶 (4-hydroxyphenylpyruvate dioxygenase, HPPD) 是一种普遍存在于微生物、植物和哺乳动物等需氧生物体中的依赖Fe(II)的非血红素加氧酶,属于α-酮酸依赖型加氧酶(αKAO) 家族中的重要一员,其在酪氨酸分解代谢途径中起着重要的调控作用[1-2]。HPPD 参与催化酪氨酸分解代谢的第2 步,可将酪氨酸分解产生的对羟基苯丙酮酸 (4-hydroxyphenylpyruvic acid,HPPA) 转化为尿黑酸 (homogentisic acid,HGA),虽然在不同生物体内尿黑酸的进一步代谢产物迥然不同,但其代谢过程对维持生物体正常运转具有至关重要的作用[3]。在植物体内,经HPPD 催化过程得到的尿黑酸是合成植物光合作用所需的质体醌 (plastoquinone) 和生育酚 (tocopherol) 的关键前体。当植物体内HPPD 被抑制时,HPPA 转化为尿黑酸的过程就会受阻,致使质体醌和生育酚无法正常合成,进一步导致植物的光合作用受到影响,最终植物出现白化症状直至死亡[4-6]。因此,HPPD 可以作为一种具有发展潜力的除草剂靶标,而HPPD 抑制类除草剂近年来已成为除草剂领域的研究热点之一。
目前商品化HPPD 抑制剂多达20 多种,结构类型主要可以划分为三酮类、吡唑类和异噁唑类[7]。其中,以吡唑为药效团的商品化HPPD 抑制剂近年来发展迅猛[8]。目前,已经开发上市的吡唑类HPPD 除草剂的结构如图式1 所示。其中,我国农药企业在该类HPPD 抑制剂的创制工作中取得了优异成果:环吡氟草酮可用于小麦田杂草的防治,特别是对抗性及多抗性看麦娘、日本看麦娘具有优异的防效。双唑草酮则可用于防除小麦田播娘蒿、猪殃殃等多种抗性阔叶杂草[9]。苯唑氟草酮可用于玉米田中马唐、稗草、反枝苋和马齿苋等杂草的防治,对玉米安全,并具有良好的后茬作物安全性。三唑磺草酮是全球首个水稻田苗后茎叶处理防治禾本科杂草的HPPD 除草剂,对水稻田中难以防治的稗草、千金子等杂草具有优异防效,且对水稻高度安全[10]。

图式1 已上市的吡唑类HPPD 抑制剂Scheme 1 Commercialized pyrazole-derived HPPD inhibitors
本课题组长期从事于新型HPPD 抑制剂的创制工作,前期通过基于药效团连接碎片的虚拟筛选方法[11],成功筛选出了一类以喹唑啉二酮为骨架的新型HPPD 抑制剂[12]。通过不断的结构修饰,得到了全球第一个高粱专用超高效HPPD 除草剂喹草酮,该除草剂解决了高粱田中野糜子等“超级杂草”无药可治的技术难题,并已于2020 年获得正式登记[13-14]。为了进一步挖掘喹唑啉二酮骨架的优势,得到可应用于更多作物田的HPPD 抑制剂类除草剂,本课题组前期采用药效团替换的方法,将三酮片段替换成了吡唑结构,得到了吡唑-喹唑啉二酮类HPPD 抑制剂 (图式2,系列A)。结果表明,部分系列A 化合物在有效成分150 g/hm2下对所测试的禾本科和阔叶杂草展现出一定的抑制活性,但与喹草酮相比仍有一定差距[15]。基于此,系列A 仍然有结构改造空间。
本课题组前期在对喹草酮进行结构优化的过程中,发现了一类以甲基喹草酮为代表的新型5-甲基喹唑啉二酮类化合物,该类化合物展现出了优异的除草活性[13,16]。基于这个改造思路,在系列A 结构的基础上,将甲基引入到了喹唑啉二酮的5 号位,设计了如图式2 所示的新型吡唑-喹唑啉二酮类HPPD 抑制剂 (系列B) (设计策略见图式2,合成路线见图式3)。所有化合物均经过核磁共振氢谱(1H NMR)、碳谱(13C NMR) 和高分辨质谱(HRMS)的确证。同时,根据酶水平活性测试结果,对系列B 进行了详细的构效关系分析。对所有化合物均进行了温室除草活性测试。最后,培养了代表性化合物9-28 与拟南芥HPPD (AtHPPD)的复合物晶体结构,这为了解该系列化合物与靶标的结合模式起到了至关重要的作用。
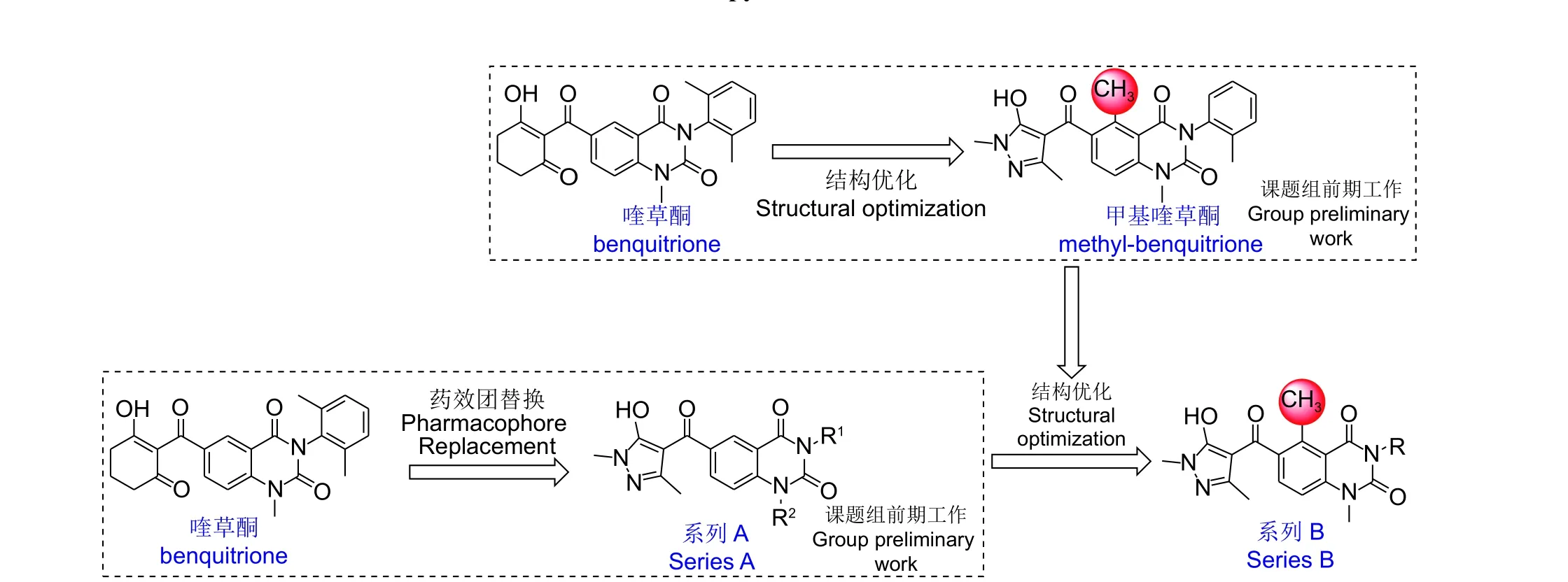
图式2 目标化合物的设计思路Scheme 2 Design strategy of the target compounds

图式3 目标化合物的合成路线Scheme 3 Synthetic route of the target compounds
1 实验部分
1.1 仪器、试剂及材料
Sartoruis BSA223S-CW 电子天平 (德国赛多利斯公司);Heidolph MR Hei-Tec 磁力搅拌器 (德国海道夫公司);Büchi R-200 和R-300 旋转蒸发仪(瑞士布奇公司);Bruker NMR 400 MHz (德国布鲁克公司) 或Varian VNMR 600 MHz 核磁共振仪 (美国瓦里安公司) (均使用氘代氯仿 (CDCl3) 为溶剂,以四甲基硅烷 (TMS) 为内标);Agilent Technologies Santa Clara CA 6224 TOF LC/MS 高分辨质谱仪 (美国安捷伦科技公司);Büchi M-545 数字熔点仪 (瑞士布奇公司);DLSB-5/20 低温冷却循环泵 (武汉德力祥仪器设备有限公司);SHB-(III)循环水式真空泵 (武汉德力祥仪器设备有限公司);ZF-20D 暗箱式紫外分析仪 (武汉德力祥仪器设备有限公司)。
柱层析所用硅胶 (200~300 目,筛孔径:0.048~0.075 mm),由青岛海洋化工厂提供;薄层硅胶板,烟台江友硅胶开发有限公司;所用石油醚的沸程为60~90 ℃,反应所使用的试剂均为国产或进口分析纯,其他溶剂或试剂若无特殊说明均为分析纯或化学纯。98.6%喹草酮(benquitrione)粉剂(本实验室合成[13])。
供试杂草为禾本科杂草:稗草Echinochloa crus-galli、狗尾草Setaria viridis、马唐Digitaria sanguinalis及阔叶杂草:苋菜Amaranthus retroflexus、藜Chenopodium serotinum、苘麻Abutilon theophrasti(山东先达农化股份有限公司提供)。
1.2 目标化合物的合成
1.2.1 化合物1~7 的合成 根据文献中报道的方法[16]合成。
1.2.2 目标化合物9-1~9-30 的合成[17]将中间体7 (3 mmol) 加入到100 mL 史莱克管中,分别加入1,3-二甲基-5-吡唑酮 (8,6 mmol)、4,5-双(二苯基膦)-9,9-二甲基氧杂蒽 (xantphos) (0.15 mmol)、氯化钯 (PdCl2) (0.15 mmol) 和碳酸钾 (6 mmol)。密封后抽真空、充氮气,重复操作3 次,最后一次呈真空状态,充入一氧化碳气体并密封体系。搅拌下加入20 mL 超干乙腈,最后加入三乙胺 (6 mmol),将反应体系升温至80 ℃反应22~24 h,薄层色谱(TLC,V(石油醚) :V(丙酮) = 3 : 1) 监测反应进程。待原料反应完毕后停止升温,加入15 mL 1 mol/L 的盐酸酸化,用二氯甲烷 (3 × 20 mL) 萃取。合并有机相,干燥,垫硅藻土抽滤,减压蒸干溶剂得到黄色油状物,用甲醇重结晶得到白色固体,即为目标化合物,收率为65%左右。
1.3 酶水平活性测试
采用已经报道的偶联法[18]测定目标化合物9-1~9-30 对AtHPPD 的抑制活性,其主要原理为:在酪氨酸代谢过程中,HPPD 可以将HPPA催化转化为HGA,但由于HPPA 和HGA 的紫外吸收峰分别是275 nm 和288 nm,两者比较接近,难以运用紫外分光光度计区分,而HGA 在尿黑酸双加氧酶 (HGD) 催化下可转化为马来酰乙酰乙酸 (MAA),其紫外吸收峰在318 nm 处,因此可以通过引入HGD,将HGA 转化为MAA 后运用紫外分光光度计监测MAA 的含量,从而间接测定HPPD 的催化反应速率和定量评价HPPD 的活性水平,实现化合物酶水平抑制活性的测定。关于AtHPPD 的预处理和测试过程根据文献方法[19-20]进行。
1.4 温室除草活性测试
由山东先达农化股份有限公司完成。采用盆栽法[21]测试,化合物的普筛试验剂量为有效成分150 g/hm2。以98.6%喹草酮粉剂作为对照药剂。准确称取一定量的待测化合物 (精确至0.000 1 g),用含体积分数1% 吐温-80 的N,N-二甲基甲酰胺(DMF) 溶解,配制成质量分数为0.5%~1%的母液,然后用蒸馏水稀释备用。播种杂草,待长至4~5 叶期备用。采用自动喷雾塔喷施新化合物和对照药剂喹草酮,待作物叶面药液晾干后移入温室培养,30 d 后调查结果[22-23]。生长抑制情况设为0~100%:A 代表抑制率为100%,B 代表抑制率≥80%,C 代表抑制率≥60%,D 代表抑制率≥40%,E 代表抑制率≥20%,F 代表抑制率<20%。
1.5 晶体学研究
首先在上海同步辐射光源收集了复合物AtHPPD-9-28 的晶体结构衍射图片,随后利用HKL2000[24]对衍射图片进行缩减、合并和缩放处理。此外,通过将AtHPPD-喹草酮 (PDB 代码:5YY6) 的晶体结构定义为标准模型,使用CCP4[25]进行分子置换。然后,使用PHENIX[26]和Coot[27]调整标准模型。最后,利用Pymol 1.3 (DeLano Scientific, Palo Alto, CA)使晶体结构可视化。
2 结果与分析
2.1 化学合成部分
以2-甲基-6-硝基苯甲酸甲酯为起始原料,经过还原、碘化反应得到中间体3,随后利用三光气生成了异氰酸酯4。通过与不同的胺进行反应,得到了脲类化合物5-1~5-30。在甲醇钠作碱的条件下,化合物5 发生分子内环化,接着甲基化得到了关键碘代物7-1~7-30。最后,以CO 为羰基源,xantphos 为配体,PdCl2为催化剂,通过插羰反应得到了目标化合物9-1~9-30,其结构表征如下。
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,3,5-三甲基-1,2,3,4-四氢喹唑啉-2,4-二酮9-1:白色固体,产率61%,m.p. 214.2~216.1 ℃;1H NMR (400 MHz, CDCl3),δ: 7.47 (d,J= 8.8 Hz, 1H), 7.18 (d,J= 8.8 Hz, 1H), 3.65 (s, 3H), 3.64 (s,3H), 3.47 (s, 3H), 2.78 (s, 3H), 1.71 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.4, 162.1, 159.5, 150.9, 147.3, 142.6,140.1, 135.6, 131.6, 114.1, 111.7, 103.6, 32.5, 31.4, 28.5, 19.3,14.0. HRMS (ESI): C17H18N4O4[M + Na]+, 计算值365.122 0,测量值365.123 2.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-乙基-1,2,3,4-四氢喹唑啉-2,4-二酮9-2:白色固体,产率62%,m.p. 191.3~192.8 ℃;1H NMR (400 MHz, CDCl3),δ:7.45 (d,J= 8.4 Hz, 1H), 7.16 (d,J= 8.4 Hz, 1H), 4.12 (q,J=6.8 Hz, 2H), 3.63 (s, 3H), 3.62 (s, 3H), 2.77 (s, 3H), 1.70 (s,3H), 1.28 (t,J= 6.8 Hz, 3H).13C NMR (100 MHz, CDCl3),δ:193.4, 161.6, 159.6, 150.5, 147.3, 142.7, 140.1, 135.6, 131.6,114.3, 111.6, 103.6, 37.2, 32.5, 31.3, 19.3, 14.1, 12.9. HRMS(ESI): C18H20N4O4[M + Na]+, 计算值379.137 7, 测量值379.137 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-丙基-1,2,3,4-四氢喹唑啉-2,4-二酮9-3:白色固体,产率65%,m.p. 162.2~163.9 ℃;1H NMR (400 MHz, CDCl3),δ:7.46 (d,J= 8.8 Hz, 1H), 7.16 (d,J= 8.8 Hz, 1H), 4.06~3.99(m, 2H), 3.64 (s, 3H), 3.62 (s, 3H), 2.77 (s, 3H), 1.80~1.64 (m,5H), 0.99 (t,J= 7.2 Hz, 3H).13C NMR (100 MHz, CDCl3),δ:193.4, 161.8, 159.6, 150.7, 147.3, 142.7, 140.2, 135.6, 131.6,114.3, 111.6, 103.7, 43.6, 32.5, 31.4, 21.0, 19.4, 14.1, 11.3.HRMS (ESI): C19H22N4O4[M + H]+, 计算值371.171 4, 测量值371.172 8.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-丁基-1,2,3,4-四氢喹唑啉-2,4-二酮9-4:白色固体,产率66%,m.p. 174.9~175.8 ℃;1H NMR (400 MHz, CDCl3),δ:7.45 (d,J= 8.8 Hz, 1H), 7.16 (d,J= 8.8 Hz, 1H), 4.05 (t,J=7.2 Hz, 2H), 3.64 (s, 3H), 3.62 (s, 3H), 2.77 (s, 3H), 1.71 (s,3H), 1.69~1.62 (m, 2H), 1.46~1.36 (m, 2H), 0.96 (t,J= 7.2 Hz, 3H).13C NMR (100 MHz, CDCl3),δ: 193.5, 161.8, 159.6,150.6, 147.3, 142.7, 140.1, 135.6, 131.6, 114.3, 111.6, 103.7,42.0, 32.6, 31.4, 29.8, 20.3, 19.4, 14.1, 13.8. HRMS (ESI):C20H24N4O4[M + Na]+, 计算值407.169 0, 测量值407.1687.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(丙-2-基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-5:白色固体,产率63%,m.p. 153.1~154.5 ℃;1H NMR (400 MHz, CDCl3),δ: 7.43 (d,J= 8.4 Hz, 1H), 7.13 (d,J= 8.4 Hz, 1H), 5.37~5.23(m, 1H), 3.64 (s, 3H), 3.58 (s, 3H), 2.75 (s, 3H), 1.71 (s, 3H),1.52 (d,J= 6.8 Hz, 6H).13C NMR (100 MHz, CDCl3),δ:193.5, 162.3, 159.7, 150.5, 147.3, 142.8, 140.1, 135.5, 131.4,114.8, 111.5, 103.7, 46.6, 32.5, 31.2, 19.5, 19.4, 14.1. HRMS(ESI): C19H22N4O4[M + Na]+, 计算值393.153 3, 测量值393.154 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(丁-2-基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-6:白色固体,产率65%,m.p. 142.3~143.9 ℃;1H NMR (400 MHz, CDCl3),δ: 7.44 (d,J= 8.4 Hz, 1H), 7.13 (d,J= 8.4 Hz, 1H), 5.11~5.00(m, 1H), 3.64 (s, 3H), 3.59 (s, 3H), 2.75 (s, 3H), 2.14~1.86 (m,2H), 1.72 (s, 3H), 1.50 (d,J= 6.8 Hz, 3H), 0.88 (t,J= 7.6 Hz,3H).13C NMR (100 MHz, CDCl3),δ: 193.4, 162.4, 159.6,150.6, 147.3, 142.8, 140.0, 135.4, 131.4, 114.6, 111.4, 103.6,52.5, 32.5, 31.2, 26.2, 19.4, 17.6, 14.1, 11.4. HRMS (ESI):C20H24N4O4[M + Na]+, 计算值407.169 0, 测量值407.168 5.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(2-氟乙基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-7:白色固体,产率68%,m.p. 119.2~120.7 ℃;1H NMR (400 MHz,CDCl3),δ: 7.48 (d,J= 8.4 Hz, 1H), 7.18 (d,J= 8.4 Hz, 1H),4.72 (dt,J= 47.2, 5.2 Hz, 2H), 4.46 (dt,J= 23.6, 5.2 Hz, 2H),3.64 (s, 3H), 3.63 (s, 3H), 2.77 (s, 3H), 1.71 (s, 3H).13C NMR(100 MHz, CDCl3),δ: 193.3, 161.8, 159.5, 150.7, 147.3, 142.7,140.3, 135.8, 131.9, 114.1, 111.8, 103.6, 80.8 (d,JC-F= 170 Hz), 41.7 (d,JC-F= 22 Hz), 32.6, 31.5, 19.4, 14.1. HRMS(ESI): C18H19FN4O4[M + Na]+, 计算值397.128 3, 测量值397.128 4.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(2,2-二氟乙基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-8:白色固体,产率69%,m.p. 208.9~10.2 ℃;1H NMR (400 MHz,CDCl3),δ: 7.50 (d,J= 8.8 Hz, 1H), 7.20 (d,J= 8.8 Hz, 1H),6.13 (td,J= 56.8, 28.4 Hz, 1H), 4.49 (td,J= 13.2, 4.8 Hz,2H), 3.61 (s, 3H), 3.60 (s, 3H), 2.76 (s, 3H), 1.70 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.1, 161.6, 159.5, 150.5, 147.2,142.7, 140.5, 136.0, 132.2, 113.2 (t,JC-F= 102 Hz), 111.9,110.4, 103.6, 43.1 (t,JC-F= 30 Hz), 32.6, 31.6, 19.4, 14.1.HRMS (ESI): C18H18F2N4O4[M + Na]+, 计算值415.118 8, 测量值415.118 4.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(2,2,2-三氟乙基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-9:白色固体,产率69%,m.p. 187.0~188.4 ℃;1H NMR (400 MHz,CDCl3),δ: 7.51 (d,J= 8.8 Hz, 1H), 7.21 (d,J= 8.8 Hz, 1H),4.87~4.75 (m, 2H), 3.65 (s, 3H), 3.64 (s, 3H), 2.76 (s, 3H),1.71 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 192.9, 161.0,159.6, 150.2, 147.2, 142.6, 140.8, 136.2, 132.4, 123.8 (q,JC-F=280 Hz), 113.8, 111.9, 103.6, 41.6 (q,JC-F= 36 Hz), 32.5,31.8, 19.3, 14.1. HRMS (ESI): C18H17F3N4O4[M + Na]+, 计算值433.109 4, 测量值433.109 8.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3-氟丙基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-10:白色固体,产率70%,m.p. 139.2~140.9 ℃;1H NMR (400 MHz,CDCl3),δ: 7.47 (d,J= 8.4 Hz, 1H), 7.17 (d,J= 8.4 Hz, 1H),4.56 (dt,J= 47.2, 6.0 Hz, 2H), 4.23 (t,J= 7.2 Hz, 2H), 3.63 (s,3H), 3.63 (s, 3H), 2.77 (s, 3H), 2.20~2.05 (m, 2H), 1.70 (s,3H).13C NMR (100 MHz, CDCl3),δ: 193.2, 161.7, 159.6,150.6, 147.2, 142.7, 140.2, 135.7, 131.7, 114.2, 111.7, 103.6,82.1 (d,JC-F= 166 Hz), 38.8 (d,JC-F= 6 Hz), 32.5, 31.4, 28.9(d,JC-F= 20 Hz), 19.3, 14.1. HRMS (ESI): C19H21FN4O4[M +Na]+, 计算值411.143 9, 测量值411.143 4.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3,3,3-三氟丙基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-11:白色固体,产率63%,m.p. 181.4~183.2 ℃;1H NMR (400 MHz,CDCl3),δ: 7.47 (d,J= 8.8 Hz, 1H), 7.18 (d,J= 8.8 Hz, 1H),4.39~4.28 (m, 2H), 3.62 (s, 6H), 2.75 (s, 3H), 2.60~2.46 (m,2H), 1.69 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.1,161.5, 159.6, 150.3, 147.2, 142.6, 140.3, 135.9, 132.0, 125.9(q,JC-F= 276 Hz), 114.0, 111.8, 103.6, 35.3 (q,JC-F= 4 Hz),32.5, 32.3 (q,JC-F= 36 Hz), 31.4, 19.3, 14.0. HRMS (ESI):C19H19F3N4O4[M + Na]+, 计算值447.125 1, 测量值447.124 5.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-3-(2-甲氧基乙基)-1,5-二甲基-1,2,3,4-四氢喹唑啉-2,4-二酮9-12:白色固体,产率63%,m.p. 141.8~143.4 ℃;1H NMR (400 MHz,CDCl3),δ: 7.45 (d,J= 8.8 Hz, 1H), 7.16 (d,J= 8.8 Hz, 1H),4.31 (t,J= 5.2 Hz, 2H), 3.68 (t,J= 5.2 Hz, 2H), 3.63 (s, 3H),3.62 (s, 3H), 3.37 (s, 3H), 2.76 (s, 3H), 1.70 (s, 3H).13C NMR(100 MHz, CDCl3),δ: 193.4, 161.9, 159.7, 150.8, 147.3, 142.8,140.3, 135.7, 131.7, 114.3, 111.7, 103.67, 69.4, 58.7, 40.8,32.5, 31.5, 19.4, 14.1. HRMS (ESI): C19H22N4O5[M + Na]+,计算值409.148 2, 测量值409.148 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(丙-2-烯基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-13:白色固体,产率62%,m.p. 156.8~158.3 ℃;1H NMR (400 MHz,CDCl3),δ: 7.46 (d,J= 8.4 Hz, 1H), 7.17 (d,J= 8.4 Hz, 1H),6.01~5.89 (m, 1H), 5.26 (dd,J= 38.4, 13.6 Hz, 2H), 4.68 (d,J=5.6 Hz, 2H), 3.63 (s, 3H), 3.62 (s, 3H), 2.77 (s, 3H), 1.70 (s,3H).13C NMR (100 MHz, CDCl3),δ: 193.3, 161.5, 159.6,150.5, 147.3, 142.7, 140.3, 135.7, 131.9, 131.7, 117.9, 114.3,111.7, 103.7, 44.0, 32.5, 31.4, 19.3, 14.1. HRMS (ESI):C19H20N4O4[M + Na]+, 计算值391.137 7, 测量值391.1383.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(丙-2-炔基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-14:白色固体,产率62%,m.p. 205.1~206.9 ℃;1H NMR (400 MHz,CDCl3),δ: 7.48 (d,J= 8.4 Hz, 1H), 7.19 (d,J= 8.4 Hz, 1H),4.84 (d,J= 2.0 Hz, 2H), 3.65 (s, 3H), 3.63 (s, 3H), 2.78 (s,3H), 2.21 (t,J= 2.0 Hz, 1H), 1.70 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.2, 161.0, 159.5, 150.0, 147.3, 142.6,140.5, 135.9, 132.0, 114.1, 111.8, 103.6, 78.3, 70.6, 32.5, 31.5,31.1, 19.3, 14.1. HRMS (ESI): C19H18N4O4[M + Na]+, 计算值389.122 0, 测量值389.122 2.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3-甲基丁-2-烯基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-15:白色固体,产率70%,m.p. 172.1~173.8 ℃;1H NMR (400 MHz,CDCl3),δ: 7.45 (d,J= 8.8 Hz, 1H), 7.15 (d,J= 8.8 Hz, 1H),5.36~5.24 (m, 1H), 4.66 (d,J= 6.8 Hz, 2H), 3.63 (s, 3H), 3.61(s, 3H), 2.78 (s, 3H), 1.85 (s, 3H), 1.72 (s, 3H), 1.70 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.4, 161.6, 159.6, 150.6,147.3, 142.7, 140.2, 136.8, 135.5, 131.5, 118.7, 114.4, 111.6,103.7, 40.2, 32.5, 31.4, 25.7, 19.4, 18.1, 14.1. HRMS (ESI):C21H24N4O4[M + Na]+, 计算值419.169 0, 测量值419.169 8.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-环丙基-1,2,3,4-四氢喹唑啉-2,4-二酮9-16:白色固体,产率59%,m.p. 119.2~120.7 ℃;1H NMR (400 MHz, CDCl3),δ: 7.44 (d,J= 8.4 Hz, 1H), 7.14 (d,J= 8.4 Hz, 1H), 3.65 (s,3H), 3.60 (s, 3H), 2.78 (q,J= 3.6 Hz, 1H), 2.75 (s, 3H), 1.72(s, 3H), 1.19 (t,J= 6.8 Hz, 2H), 0.87~0.71 (m, 2H).13C NMR(100 MHz, CDCl3),δ: 193.4, 163.2, 159.6, 151.5, 147.3, 142.8,139.9, 135.5, 131.5, 114.9, 111.6, 103.6, 45.9, 32.5, 31.3, 25.5,19.2, 14.1, 8.9. HRMS (ESI): C19H20N4O4[M + Na]+, 计算值391.137 7, 测量值391.1370.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-环丁基-1,2,3,4-四氢喹唑啉-2,4-二酮9-17:白色固体,产率69%,m.p. 134.5~136.2 ℃;1H NMR (400 MHz, CDCl3),δ: 7.43 (d,J= 8.4 Hz, 1H), 7.12 (d,J= 8.4 Hz, 1H), 5.32~5.18(m, 1H), 3.63 (s, 3H), 3.58 (s, 3H), 2.91~2.79 (m, 2H), 2.73 (s,3H), 2.37~2.31 (m, 2H), 1.95~1.73 (m, 2H), 1.70 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.4, 162.4, 159.6, 150.7, 147.3,142.7, 139.9, 135.4, 131.4, 114.9, 111.5, 103.6, 49.0, 32.5,31.1, 28.0, 19.3, 15.2, 14.1. HRMS (ESI): C20H22N4O4[M +Na]+, 计算值405.153 3, 测量值405.153 6.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-环戊基-1,2,3,4-四氢喹唑啉-2,4-二酮9-18:白色固体,产率69%,m.p. 188.1~189.9 ℃;1H NMR (400 MHz, CDCl3),δ: 7.43 (d,J= 8.4 Hz, 1H), 7.13 (d,J= 8.4 Hz, 1H), 5.48~5.38(m, 1H), 3.63 (s, 3H), 3.59 (s, 3H), 2.76 (s, 3H), 2.21~2.11 (m,2H), 2.05~1.95 (m, 2H), 1.93~1.83 (m, 2H), 1.71 (s, 3H),1.68~1.58 (m, 2H).13C NMR (100 MHz, CDCl3),δ: 193.5,162.3, 159.6, 150.5, 147.3, 142.6, 140.0, 135.5, 131.4, 114.7,111.5, 103.6, 54.1, 32.5, 31.2, 28.3, 25.8, 19.4, 14.1. HRMS(ESI): C21H24N4O4[M + Na]+, 计算值419.169 0, 测量值419.168 8.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-环己基-1,2,3,4-四氢喹唑啉-2,4-二酮9-19:白色固体,产率59%,m.p. 234.9~236.8 ℃;1H NMR (400 MHz, CDCl3),δ: 7.43 (d,J= 8.4 Hz, 1H), 7.12 (d,J= 8.4 Hz, 1H), 4.93~4.84(m, 1H), 3.64 (s, 3H), 3.58 (s, 3H), 2.75 (s, 3H), 2.53~2.40 (m,2H), 1.91~1.82 (m, 2H), 1.71 (s, 3H), 1.70~1.64 (m, 3H),1.46~1.25 (m, 3H).13C NMR (100 MHz, CDCl3),δ: 193.5,162.4, 159.6, 150.6, 147.3, 142.7, 140.0, 135.4, 131.4, 114.7,111.5, 103.6, 55.1, 32.5, 31.2, 28.8, 26.4, 25.3, 19.5, 14.1.HRMS (ESI): C22H26N4O4[M + Na]+, 计算值433.184 6, 测量值433.184 6.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(四氢呋喃-3-基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-20:白色固体,产率63%,m.p. 183.1~184.7 ℃;1H NMR (400 MHz,CDCl3),δ: 7.46 (d,J= 8.4 Hz, 1H), 7.15 (d,J= 8.4 Hz, 1H),5.79~5.69 (m, 1H), 4.30 (q,J= 7.6 Hz, 1H), 4.06~3.92 (m,3H), 3.64 (s, 3H), 3.61 (s, 3H), 2.75 (s, 3H), 2.44~2.14 (m,2H), 1.70 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.3,162.0, 159.5, 150.3, 147.2, 142.5, 140.2, 135.7, 131.7, 114.4,111.6, 103.6, 68.8, 68.2, 52.3, 32.5, 31.3, 29.0, 19.4, 14.1.HRMS (ESI): C20H22N4O5[M + Na]+, 计算值421.148 2, 测量值421.150 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3,4,5,6-四氢-2H-吡喃-4-基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-21:白色固体,产率59%,m.p. 238.3~240.0 ℃;1H NMR(400 MHz, CDCl3),δ: 7.45 (d,J= 8.8 Hz, 1H), 7.14 (d,J= 8.8 Hz, 1H), 5.20~5.10 (m, 1H), 4.12~4.05 (m, 2H), 3.64 (s, 3H),3.59 (s, 3H), 3.51 (t,J= 11.6 Hz, 2H), 2.92~2.80 (m, 2H), 2.74(s, 3H), 1.71 (s, 3H), 1.64~1.55 (m, 2H).13C NMR (100 MHz,CDCl3),δ: 193.3, 162.2, 159.5, 150.4, 147.2, 142.7, 140.1,135.6, 131.6, 114.5, 111.6, 103.6, 68.0, 51.9, 32.5, 31.2, 29.0,19.4, 14.1. HRMS (ESI): C21H24N4O5[M + Na]+, 计算值435.163 9,测量值435.164 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(环丙基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-22:白色固体,产率63%,m.p. 109.4~111.6 ℃;1H NMR (400 MHz,CDCl3),δ: 7.46 (d,J= 8.8 Hz, 1H), 7.17 (d,J= 8.8 Hz, 1H),3.97 (d,J= 7.2 Hz, 2H), 3.63 (s, 3H), 3.63 (s, 3H), 2.77 (s,3H), 1.71 (s, 3H), 1.36~1.27 (m, 1H), 0.52~0.46 (m, 2H),0.46~0.40 (m, 2H).13C NMR (100 MHz, CDCl3),δ: 193.4,162.0, 159.6, 150.9, 147.3, 142.8, 140.2, 135.5, 131.6, 114.4,111.6, 103.6, 46.3, 32.5, 31.4, 19.4, 14.1, 9.9, 3.8. HRMS(ESI): C20H22N4O4[M + Na]+, 计算值405.153 3, 测量值405.153 3.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(环丁基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-23:白色固体,产率65%,m.p. 149.0~150.9 ℃;1H NMR (400 MHz,CDCl3),δ: 7.45 (d,J= 8.8 Hz, 1H), 7.16 (d,J= 8.8 Hz, 1H),4.14 (d,J= 7.2 Hz, 2H), 3.65 (s, 3H), 3.62 (s, 3H), 2.79~2.75(m, 4H), 2.07~1.97 (m, 2H), 1.87~1.75 (m, 4H), 1.72 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.4, 161.9, 159.5, 150.9,147.3, 142.6, 140.1, 135.5, 131.5, 114.3, 111.6, 103.6, 46.5,34.3, 32.5, 31.4, 26.3, 19.4, 18.2, 14.1. HRMS (ESI):C21H24N4O4[M + Na]+, 计算值419.169 0, 测量值419.1695.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(环戊基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-24:白色固体,产率68%,m.p. 139.2~141.1 ℃;1H NMR (400 MHz,CDCl3),δ: 7.46 (d,J= 8.8 Hz, 1H), 7.17 (d,J= 8.8 Hz, 1H),4.06 (d,J= 7.6 Hz, 2H), 3.64 (s, 3H), 3.62 (s, 3H), 2.77 (s,3H), 2.45~2.32 (m, 1H), 1.75~1.63 (m, 7H), 1.57~1.47 (m,2H), 1.40~1.29 (m, 2H).13C NMR (100 MHz, CDCl3),δ:193.3, 162.0, 159.5, 150.9, 147.2, 142.6, 140.1, 135.5, 131.5,114.2, 111.6, 103.6, 46.1, 38.6, 32.5, 31.4, 30.3, 24.8, 19.4,14.1. HRMS (ESI): C22H26N4O4[M + Na]+, 计算值433.184 6,测量值433.185 6.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(环己基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-25:白色固体,产率62%,m.p. 163.9~165.4 ℃;1H NMR (400 MHz,CDCl3),δ: 7.45 (d,J= 8.8 Hz, 1H), 7.16 (d,J= 8.8 Hz, 1H),3.94 (d,J= 7.2 Hz, 2H), 3.64 (s, 3H), 3.62 (s, 3H), 2.77 (s,3H), 1.90~1.79 (m, 1H), 1.73~1.62 (m, 8H), 1.23~1.03 (m,5H).13C NMR (100 MHz, CDCl3),δ: 193.4, 162.0, 159.5,151.0, 147.3, 142.7, 140.2, 135.5, 131.5, 114.2, 111.6, 103.6,47.6, 36.3, 32.5, 31.4, 30.8, 26.3, 25.8, 19.4, 14.1. HRMS(ESI): C23H28N4O4[M + Na]+, 计算值447.200 3, 测量值447.199 3.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(四氢呋喃-3-基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-26:白色固体,产率57%,m.p. 151.1~152.0 ℃;1H NMR (400 MHz, CDCl3),δ: 7.47 (d,J= 8.4 Hz, 1H), 7.18 (d,J= 8.4 Hz,1H), 4.22~4.15 (m, 1H), 4.12~3.90 (m, 2H), 3.87~3.74 (m,2H), 3.66~3.59 (m, 7H), 2.80~2.72 (m, 4H), 2.05~1.74 (m,2H), 1.71 (s, 3H).13C NMR (100 MHz, CDCl3),δ: 193.2,162.4, 159.3, 150.1, 147.3, 142.9, 140.1, 135.2, 131.3, 114.3,109.1, 102.1, 71.2, 68.0, 44.7, 39.3, 32.6, 31.0, 30.6, 16.2,14.8. HRMS (ESI): C21H24N4O5[M + H]+, 计算值413.181 9,测量值413.182 7.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3,4,5,6-四氢-2H-吡喃-4-基甲基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-27:白色固体,产率69%,m.p. 169.0~170.5 ℃;1H NMR (400 MHz, CDCl3),δ: 7.47 (d,J= 8.8 Hz, 1H), 7.17 (d,J= 8.8 Hz, 1H), 4.00 (d,J= 7.2 Hz, 2H), 3.99~3.93 (m, 2H),3.64 (s, 3H), 3.62 (s, 3H), 3.39~3.31 (m, 2H), 2.77 (s, 3H),2.15~2.05 (m, 1H), 1.71 (s, 3H), 1.62~1.55 (m, 2H), 1.54~1.45(m, 2H).13C NMR (100 MHz, CDCl3),δ: 193.2, 162.0, 159.5,150.9, 147.2, 142.6, 140.2, 135.7, 131.7, 114.1, 111.6, 103.6,67.5, 47.0, 34.0, 32.5, 31.5, 30.7, 19.4, 14.1. HRMS (ESI):C22H26N4O5[M + Na]+, 计算值449.179 5, 测量值449.179 9.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(2-甲基苯基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-28:白色固体,产率69%,m.p. 160~162 ℃;1H NMR (600 MHz,CDCl3),δ: 7.54 (d,J= 8.4 Hz, 1H), 7.37 (dt,J= 3.6, 1.2Hz,2H), 7.36 -7.32 (m, 2H), 7.17 (d,J= 7.2 Hz, 1H), 3.68 (s, 3H),3.66 (s, 3H), 2.76 (s, 3H), 2.18 (s, 3H), 1.79 (s, 3H). 13C NMR(150 MHz, CDCl3),δ: 193.2, 161.6, 159.6, 150.3, 147.3, 143.2,140.8, 135.9, 135.6, 134.8, 132.1, 131.1, 129.1, 128.2, 127.2,114.4, 111.9, 103.6, 32.6, 31.5, 19.3, 17.5, 14.2. HRMS (ESI):C23H23N4O4[M + H]+, 计算值419.171 4, 测量值419.172 0.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(3-甲基苯基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-29:白色固体,产率60%,m.p. 245~247 ℃;1H NMR (600 MHz,CDCl3),δ: 7.46 (d,J= 8.4 Hz, 1H), 7.35 (t,J= 7.7 Hz, 1H),7.20 (s, 1H), 7.18 (s, 1H), 7.01 (d,J= 12.0 Hz, 2H), 3.60 (s,3H), 3.57 (s, 3H), 2.67 (s, 3H), 2.34 (s, 3H), 1.68 (s, 3H).13C NMR (150 MHz, CDCl3),δ: 193.3, 162.1, 159.5, 150.8, 147.3,143.0, 140.7, 139.6, 135.8, 135.5, 132.0, 129.7, 129.3, 128.7,125.1, 114.5, 112.0, 103.6, 32.5, 31.5, 21.4, 19.4, 14.1. HRMS(ESI): C23H23N4O4[M + H]+, 计算值419.171 4, 测量值419.170 4.
6-[(5-羟基-1,3-二甲基吡唑-4-基)羰基]-1,5-二甲基-3-(4-甲基苯基)-1,2,3,4-四氢喹唑啉-2,4-二酮9-30:白色固体,产率63%,m.p. 275~277 ℃;1H NMR (400 MHz,CDCl3),δ: 7.52 (d,J= 8.4 Hz, 1H), 7.33 (d,J= 8.0 Hz, 2H),7.24 (d,J= 8.4 Hz, 1H), 7.15 (d,J= 8.0 Hz, 2H), 3.67 (s, 3H),3.65 (s, 3H), 2.74 (s, 3H), 2.41 (s, 3H), 1.76 (s, 3H).13C NMR(150 MHz, CDCl3),δ: 193.3, 162.1, 159.4, 150.8, 147.3, 143.0,140.6, 138.7, 135.7, 132.9, 132.0, 130.2, 127.9, 114.4, 111.9,103.6, 32.5, 31.5, 21.2, 19.4, 14.1. HRMS (ESI): C23H23N4O4[M + H]+, 计算值419.171 4, 测量值419.171 6.
2.2 酶水平活性测试和构效关系分析
为了得到活性优异的HPPD 抑制剂,在母体结构的R 位点引入了不同类型的取代基,例如:直链烷基、环烷基、含杂原子或不饱和键的烷基以及具有强疏水性的芳基结构。目标化合物9-1~9-30 对AtHPPD 的抑制活性测定结果如表1 所示。总的来看,该系列大部分化合物的酶抑制活性均优于对照药剂喹草酮 (IC50= (0.375 ± 0.012)μmol/L)。接下来,将分别讨论不同类别的取代基对化合物活性的影响。
首先,合成了简单直链烷基取代的吡唑-喹唑啉二酮衍生物9-1~9-30,发现R 位置的烷基链类型与它们对应的IC50值有着一定的关联性 (表1),表现为碳链的长度显著影响了分子的酶抑制活性。与甲基取代的化合物 (9-1) 相比 (IC50= (0.295 ±0.002) μmol/L),乙基和丙基取代的化合物9-2和9-3 (IC50值分别为 (0.227 ± 0.022) μmol/L 和(0.208 ± 0.010) μmol/L) 对AtHPPD 拥有更优的抑制活性。当继续延长分子侧链的碳链长度,发现正丁基取代并未进一步提高酶抑制活性 (化合物9-4,IC50= (0.311 ± 0.009) μmol/L)。产生这种现象的原因可能是因为R 部分引入链长较长的基团,会使小分子的末端伸出AtHPPD 的活性空腔,从而引起酶抑制活性的降低。根据上述的活性数据可以总结出一个简要的构效关系 (SAR) 信息:正丙基 (9-3) >乙基 (9-2) > 甲基 (9-1) > 正丁基 (9-4),这表明:R 位置中等长度烷基链 (C2~C3) 的引入更能提高抑制剂与靶标的结合力。基于此,尝试在保持侧链为2~3 个碳原子烷基取代的同时,在α 位引入甲基,以此来进一步研究构效关系。结果表明,化合物9-5 和9-6 的酶抑制活性 (IC50值分别为 (0.183 ± 0.009) μmol/L 和 (0.172 ± 0.014)μmol/L) 相比于其母体化合物有了一定的提升,这说明适当增加α处的位阻有利于酶抑制活性的提高。

表1 目标化合物9-1~9-30 的温室除草活性 (150 g/hm2) 和对AtHPPD 的IC50 值Table 1 Greenhouse herbicidal activities of compounds 9-1-9-30 at 150 g/hm2 and IC50 values against AtHPPD
接下来,讨论了在优势烷基链上引入杂原子,并研究其对分子酶抑制活性的影响。结果表明,当R 为CH2CH2F 时,所得到的化合物9-7对AtHPPD 活性的抑制水平 (IC50= (0.254 ± 0.018)μmol/L) 不如其母体化合物9-2。当继续在其末端增加氟原子时,导致相应化合物9-8 和9-9 的酶抑制活性显著降低 (IC50值分别为 (0.274 ± 0.018)μmol/L 和 (0.336 ± 0.033) μmol/L),这种现象在以化合物9-3 为母体时同样存在。例如,当R 分别为CH2CH2CH2F和CH2CH2CF3时,化合物9-10和9-11 的酶抑制活性 (IC50值分别为 (0.228 ±0.007) μmol/L 和 (0.294 ± 0.014) μmol/L) 与9-3 相比有了部分程度的降低,这说明吸电子基团的引入不利于提高化合物的酶抑制活性。进一步的,在化合物9-3 的支链烷基侧链中插入一个氧原子来增加分子的柔性,结果表明,对应化合物9-12的酶抑制活性也有所降低 (IC50= (0.253 ± 0.017)μmol/L)。由于AtHPPD 活性空腔的末端由多个疏水性氨基酸残基组成,而氧原子和氟原子属于极性基团,因此这些杂原子的引入不利于化合物与AtHPPD 的结合。紧接着,在R 位置引入不饱和取代基,发现对应化合物 (9-13~9-15) 的酶抑制活性有了一定程度的提升 (IC50值在0.176~0.190 μmol/L 之间)。
在随后的分子优化中,继续合成了R 位置为环烷基取代的衍生物,用于探究这些强疏水基团的类型对靶标酶抑制能力的影响。首先,当引入环丙基时,相应化合物的酶抑制活性 (化合物9-16,IC50= (0.463 ± 0.015) μmol/L) 不及对照药剂喹草酮。随后,通过扩大环的尺寸,分别引入了环丁基、环戊基和环己基,R 位置被各种环烷基取代的化合物对AtHPPD 的亲和力顺序可以总结为:环戊基 (9-18,IC50= (0.157 ± 0.008) μmol/L) >环己基 (9-19,IC50= (0.169 ± 0.002) μmol/L) > 环丁基 (9-17,IC50= (0.238 ± 0.005) μmol/L) > 环丙基 (9-16,IC50= (0.463 ± 0.015) μmol/L),这说明环烷基的张力过大不利于化合物与靶标的结合。此外,用四氢呋喃-3-基 (9-20) 和四氢-2H-吡喃-4-基(9-21) 代替环戊基和环己基部分使分子的AtHPPD抑制作用下降 (IC50值分别为 (0.172 ± 0.011) μmol/L和 (0.208 ± 0.010) μmol/L)。进一步对表1 数据分析发现,通过在环烷基和喹唑啉二酮环之间添加一个亚甲基将会提高分子的酶抑制活性,对应化合物9-22 至9-27 的IC50值介于0.136~0.332 μmol/L 之间。在该子系列衍生物中,上述有关环张力的构效关系规律也适用于插入亚甲基桥链的衍生物中。由以上构效关系可以看出,在R 处引入具有强疏水作用的基团,将会与AtHPPD 活性空腔末端的疏水性氨基酸残基形成相互作用,从而有利于化合物酶抑制活性的提升,基于此,在R 处引入了甲基取代的苯基,得到了化合物9-28~9-30。结果表明,3-甲基苯基取代的化合物 (9-29,IC50= (0.199 ± 0.010) μmol/L) 的酶抑制活性优于4-甲基苯基取代 (9-30,IC50= (0.247 ± 0.013)μmol/L) 和2-甲基苯基取代 (9-28,IC50= (0.370 ±0.026) μmol/L) 的化合物。
2.3 除草活性
目标化合物的温室除草活性测试结果 (表1)表明,大部分吡唑-喹唑啉二酮衍生物对6 种靶标杂草 (稗草、狗尾草、马唐、苋菜、藜、苘麻) 表现出一定的防治效果 (调查时间30 d)。具体而言,在有效成分150 g/hm2的剂量下,饱和直链烷基取代的化合物9-1、9-2 和9-3 在对6 种测试杂草进行苗后处理后,对除苋菜之外的5 种杂草表现出了60%以上的生长抑制作用,而正丁基取代的化合物9-4 的除草活性相比于其他直链烷基有了明显降低。对于α位有甲基取代的化合物9-5 和9-6,其对阔叶杂草的防效优于对禾本科杂草,两个化合物对苋菜、藜和苘麻的防效均达到了80%以上。当烷基侧链带有单个或多个氟原子时,化合物9-7 至9-11 能够以80%以上的除草抑制率控制所测试禾本科杂草狗尾草和马唐的生长。在烯基和炔基系列化合物中,当不饱和键末端不连接任何取代基时,相应化合物9-13 和9-14 对除马唐之外的测试杂草的抑制率均有80%以上,当不饱和键末端连接甲基时,相应化合物9-15 对6 种杂草的除草活性除藜外均有不同程度的下降。该结果表明,尽管化合物9-15 与AtHPPD具有较好的亲和力,但是在不饱和烷基中引入额外的疏水基团则不利于其活体活性的提高。
在环烷基取代的衍生物中,R 为环丙基取代的化合物9-16对狗尾草的活性达到了80%以上,但是对于其他供试杂草的活性并不理想。当将环烷基的体积扩大时,相应化合物9-17至9-19的除草活性有了大幅度的提升,特别是化合物9-19,在150 g /hm2下对供试的5 种杂草具有80%以上的防效,对稗草和藜具有完全的防效。当在环烷基上引入杂原子时 (化合物9-20和9-21),将不利于除草活性的维持。而当在环烷基与喹唑啉二酮之间增加一个亚甲基时,尽管相应化合物 (9-22~9-27) 的离体活性相比于不带亚甲基的衍生物有一定的提高,但除草活性并不理想,对狗尾草和马唐的活性几乎丧失,可能是由于亚甲基的存在降低了化合物的稳定性,从而影响了除草活性。当R 为甲基取代的苯基时,其整体的除草活性优于烷基取代,这可能是由于芳基的引入有利于化合物在植物体内的吸收传导代谢,特别是R 为2-甲基苯基取代时,对应化合物9-28在150 g/hm2的剂量下对6 种供试杂草具有80%以上的防效,并且对稗草和马唐的防效达到了100%,具有进一步研究的潜力。
2.4 代表性化合物9-28 与AtHPPD 的复合物晶体结构
为了更好地了解化合物与靶标酶的作用模式,利用已报道的方法[20]获得了代表性化合物9-28与AtHPPD 的复合物晶体结构 (图1),分辨率为1.886 Å (0.188 6 nm) (PDB 编号:7EZQ)。从图1A中可以看到,化合物9-28的双羰基与AtHPPD 活性空腔的金属离子形成了配位作用。除此之外,金属离子还与His226、His308、Glu394 和一个水分子也形成了配位作用。从活性空腔中的小分子电子云密度分布 (图1B) 可以看出,其轮廓与化合物9-28的结构相一致,这说明了复合物晶体结构的正确性。图1C 显示了化合物9-28与AtHPPD活性空腔的相互作用。可以看出,除了化合物9-28的双羰基与金属离子之间的螯合作用之外,小分子的喹唑啉二酮部分与酶活性空腔中的Phe381和Phe424 形成了π-π 堆积作用,并且R 处的邻甲基苯基处在由Gln293、Phe424、Leu427、Leu368、Met335 和Phe381 组成的疏水空腔中,形成了疏水相互作用。同时,观察了AtHPPD-9-28与AtHPPD-喹草酮的叠合图,从图1D 中可以看到,化合物9-28与喹草酮在活性空腔中的构象大致相同,两者均与活性空腔形成了螯合作用和π-π 堆积作用。与喹草酮末端的2,6-二甲基苯基相比,化合物9-28末端的邻甲基苯基更加接近于靶标酶的疏水空腔。
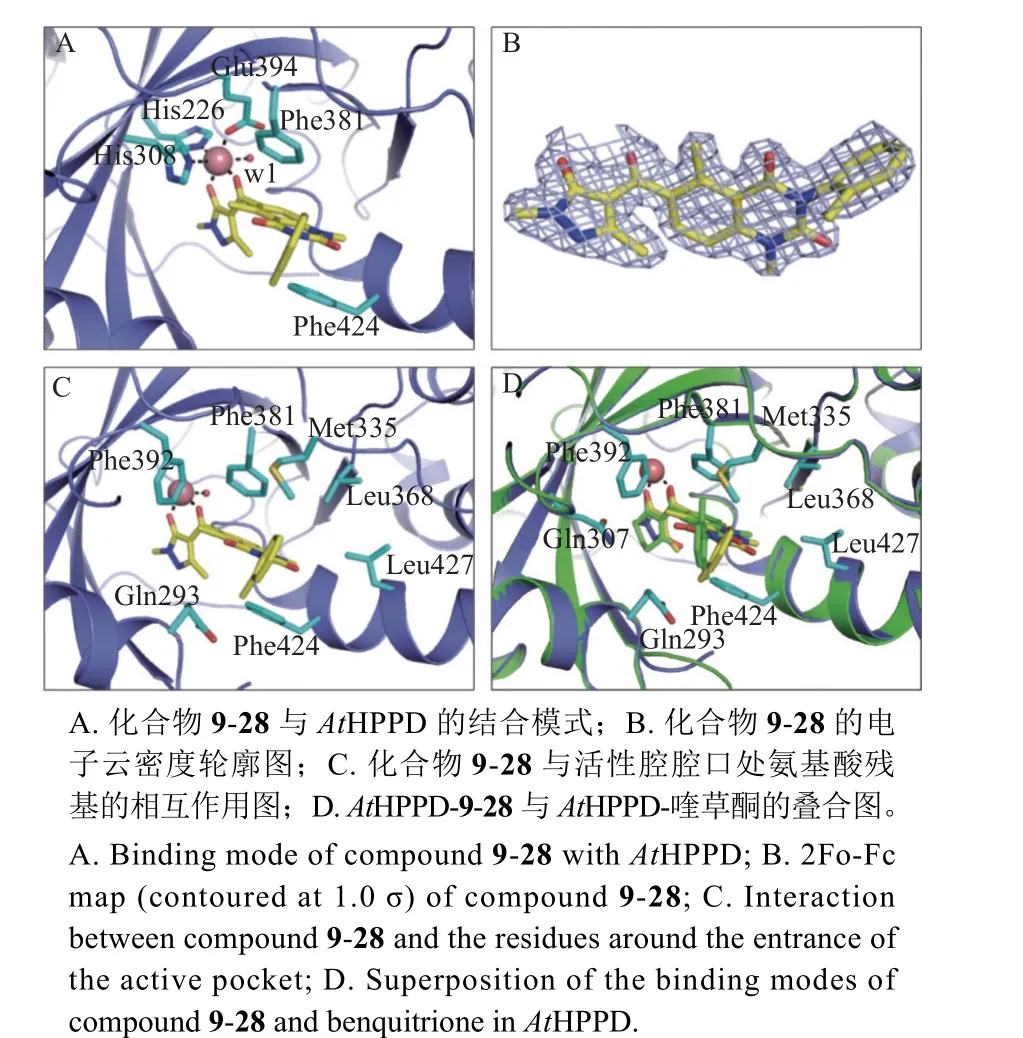
图1 目标化合物9-28 与AtHPPD 的复合物晶体结构Fig. 1 Co-crystal structure of AtHPPD-9-28
3 结论
本研究以喹草酮为先导化合物,根据前期的构效关系,将其中的药效团三酮替换成了吡唑,并在喹唑啉二酮的5 号位引入了甲基,设计并合成了30 个新型吡唑-喹唑啉二酮类HPPD 抑制剂。在离体活性测试中,大部分化合物的酶水平抑制活性优于对照药剂喹草酮。在温室除草活性测试中,化合物9-28在有效成分150 g/hm2的剂量下对狗尾草、苋菜、藜和苘麻均有80%以上的防效,对稗草和马唐的防效达到了100%,优于对照药剂喹草酮。复合物晶体结构研究表明,化合物9-28与AtHPPD 之间拥有经典的鳌合作用和π-π 堆积作用,这与对照药剂喹草酮与AtHPPD 的结合模式相类似。上述结果表明,化合物9-28可作为新的苗头化合物进行更加深入的结构改造,具有进一步研究的价值。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

严耀超,男,2017 年毕业于湖北师范大学化学化工学院,获理学学士学位;2020 年毕业于华中师范大学化学学院,获理学硕士学位;2020 年9 月于华中师范大学化学学院继续攻读博士学位,研究方向为靶向对羟基苯丙酮酸双加氧酶抑制剂的设计与合成。

王亚楠,女,2018 年毕业于郑州师范学院化学化工学院,获理学学士学位;2021 年毕业于华中师范大学化学学院,获理学硕士学位。

何波,男,2020 年毕业于华中师范大学化学学院,获理学博士学位;博士期间创制出可用于水稻田杂草防控的新型化合物吡唑喹草酯,目前正在进行新农药登记。现任职于南京农业大学植物保护学院,研究方向为基于结构的绿色农药分子合理设计与合成,以及靶向抑制剂分子的类农药性优化及活性评估。

林红艳,女,2017 年毕业于华中师范大学化学学院,获理学博士学位;博士期间获得并解析了多个抑制剂与拟南芥对羟基苯丙酮酸双加氧酶复合物的晶体结构,为深入理解酶催化反应机制奠定了良好的基础。现任职于华中师范大学化学学院,研究方向为农药化学生物学,结构生物学,以及基于靶标结构的新型药物分子的合理设计。

杨光富,男,1997 年毕业于南开大学元素有机化学研究所,获理学博士学位。2004—2005 年赴美国肯塔基大学药学院高级访问学者,2012 年8 月赴加拿大麦克马斯特大学高级访问学者。现任华中师范大学教授、农药与化学生物学教育部重点实验室主任、校学术委员会副主任及《农药学学报》副主编。长期从事农药创制研究,在农药分子设计研究方面取得系统性研究成果,创制出喹草酮、吡唑喹草酯和氟苯醚酰胺等6 个农药候选新品种。2009 年获国家杰出青年科学基金资助,2016 年入选“万人计划”科技创新领军人才。曾获教育部自然科学一等奖、湖北省自然科学一等奖及药明康德生命化学研究奖各1 项。先后被授予全国模范教师、全国优秀科技工作者等荣誉称号。所指导的博士学位论文中,获全国百篇优秀博士学位论文奖1 项、提名奖2 项。
