氩氦刀冷冻消融与微波消融治疗原发性肝细胞癌近期疗效及对免疫功能的影响
2022-10-25谭业栋张永涛张立成刘宏云孙文俏胡效坤
谭业栋,张永涛,张立成,刘宏云,孙文俏,胡效坤
(1.青岛大学附属医院西海岸院区介入医学中心,山东 青岛 266000;2.山东大学附属威海市立医院肿瘤微创介入科,山东 威海 264200)
原发性肝癌是消化系统常见恶性肿瘤,其中90%以上为肝细胞癌(hepatocellular carcinoma, HCC)[1]。近年来,消融广泛应用于早期pHCC(primary hepatocellular carcinoma, pHCC)根治术及姑息性中晚期pHCC减瘤术。晚期pHCC患者常存在免疫功能抑制及调节紊乱[2]。本研究对比观察CT引导下氩氦刀冷冻消融与微波消融治疗pHCC近期疗效及对患者免疫功能的影响。
1 资料与方法
1.1 一般资料 回顾性分析2019年7月—2021年1月52例于山东大学附属威海市立医院接受消融治疗的pHCC患者,其中24例接受CT引导下氩氦刀冷冻消融(冷冻组), 男14例、女10例,年龄38~72岁、平均(58.9±8.2)岁,17例单发、7例多发病变(病灶数1~3个);28例接受CT引导下微波消融(微波组),男18例、女10例,年龄37~73岁、平均(59.6±7.9)岁,19例单发、9例多发病变(病灶数1~3个)。纳入标准:①术前经肝穿刺活检病理确诊HCC,根据原发性肝癌诊疗规范(2019年版)[3]标准均诊断为pHCC,符合米兰标准早期肝癌标准;②肝功能Child-Pugh分级A、B级;③首次接受针对肝脏病灶的消融治疗;④无凝血功能障碍;⑤患者拒绝手术。排除标准:①临床资料不完整;②HCC晚期、恶病质,预计生存期小于3个月;③肝功能Child-Pugh分级C级;④6个月内接受免疫抑制治疗;⑤合并其他恶性肿瘤、多脏器功能损害及自身免疫性疾病;⑥既往曾接受针对肝脏病灶的TACE、射频消融等介入治疗及放射治疗。本研究经院伦理委员会批准,术前患者均签署知情同意书。
1.2 仪器与方法 采用Philips Brilliance CT机为引导设备。消融后1个月仅予患者对症支持治疗。
1.2.1 氩氦刀冷冻消融 采用Endocare氩氦刀靶向冷冻手术系统对冷冻组行氩氦刀冷冻消融。先行CT定位扫描,根据CT所示病灶位置、大小、数量及其与周围组织的关系,必要时行三维重建,结合腹部增强MRI或CT拟定治疗计划。常规消毒、铺巾,以1%利多卡因20 ml逐层麻醉,在CT引导下将氩氦刀穿刺至预定病灶位置,经CT扫描确认无误后启动冷冻键开始冷冻,使温度迅速下降至约-140℃并维持15~30 min后给予氦气复温,待温度上升至15℃时再次启动氩气超低温手术系统再次施行冷冻消融,时间同首次循环;对多发病灶患者以多刀组合方法同时进行冻融循环。每例冻融次数均≥2次,冻融结束后行CT扫描观察消融范围,确保其超出病灶边界至少0.5 cm,并观察有无出血等并发症。确认患者无异常后启动加热系统,待温度上升至约20℃、氩氦刀可拔动时退刀,以明胶海绵颗粒填塞针道止血。见图1。
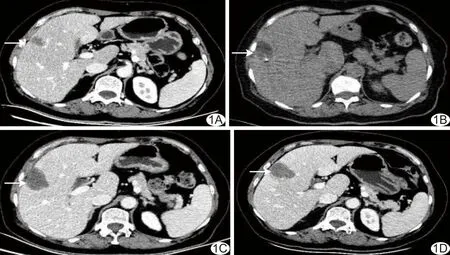
图1 患者男,65岁,pHCC,接受CT引导下氩氦刀冷冻消融 A.消融前腹部轴位增强CT图示病灶(箭); B.消融中轴位平扫CT图示氩氦刀尖周围形成冰球(箭); C.消融后1日腹部轴位增强CT图示冰球范围完全覆盖病灶(箭); D.消融后1个月,腹部轴位增强CT图示消融部位冰球范围较前缩小,无强化(箭)
1.2.2 微波消融 采用ECO-100多功能微波治疗仪(南京亿高公司)、14G水冷循环微波针对微波组行微波消融。先行CT扫描定位,根据肝脏病灶大小、数目及其与周围组织的关系拟定手术计划,选择单针或多针组合消融方法。常规消毒后,以1%利多卡因注射液20~30 ml逐层浸润麻醉,在CT引导下将微波消融针缓慢刺入拟定病灶位置,经CT扫描确认针尖位置无误后以卵圆钳固定消融针;对多发病灶采用多针组合消融,依次重复上述步骤;确认无误后启动微波治疗系统同时消融,设置功率为50~60 W,消融时间5~10 min,直至消融范围超出病灶边界至少0.5 cm。见图2。

图2 患者男,62岁,pHCC,接受CT引导下微波消融术 A.消融前腹部轴位增强CT图示病灶(箭); B.消融中轴位平扫CT图示针尖穿过病灶(箭); C.消融后1日腹部轴位增强CT图示消融范围完全覆盖病灶(箭); D.消融后1个月腹部轴位增强CT图示消融部位范围较前缩小,无强化(箭)
1.3 观察指标
1.3.1 疗效 消融后1个月复查腹部平扫、增强CT或MRI,观察病灶影像学表现及有无新发病灶等;存在多个病灶时,以消融前最大径最长者为靶病灶,根据改良实体瘤反应评估标准(modified response evaluation criteria in solid tumours, mRECIST)评估疗效[4],即完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、病情稳定(stable disease, SD)或疾病进展(progressive disease, PD);计算客观缓解率(objective remission rate, ORR),ORR=(CR+PR)/总例数×100%。
1.3.2 免疫功能 分别于消融前1日及消融后4周抽取全部患者空腹外周静脉血置于抗凝试管,以流式细胞仪(Beckman Couter公司)检测CD4+、CD8+T淋巴细胞占比及CD4+/CD8+。
1.4 统计学分析 采用SPSS 20.0统计分析软件。以±s表示计量资料,组间行t检验。采用χ2检验比较计数资料,以秩和检验比较等级资料。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 2组患者一般资料差异均无统计学意义(P均>0.05)。见表1。

表1 52例pHCC患者一般资料比较
2.2 疗效 消融后1个月,冷冻组16例CR、5例PR、2例SD、1例PD,微波组18例CR、6例PR、2例SD、2例PD,组间病灶CR、PR、SD及PD差异无统计学意义(P=0.827);冷冻组ORR为87.50%(21/24),微波组为85.71%(24/28),组间差异无统计学意义(χ2=0.044,P=0.833)。
2.3 免疫功能比较 消融前1日,组间外周血CD4+、CD8+T淋巴细胞占比及CD4+/CD8+差异均无统计学意义(P均>0.05);消融后4周,组间外周血CD4+、CD8+T淋巴细胞占比及CD4+/CD8+差异均有统计学意义(P均<0.05)。相比消融前1日,消融4周后患者外周血CD4+T淋巴细胞占比及CD4+/CD8+均明显升高、CD8+T淋巴细胞占比均明显降低(P均<0.001)。见表2。
表2 消融治疗前后52例pHCC患者免疫功能比较(±s)

表2 消融治疗前后52例pHCC患者免疫功能比较(±s)
组别消融前1日CD4+(%)CD8+(%)CD4+/CD8+消融后4周CD4+(%)CD8+(%)CD4+/CD8+冷冻组(n=24)38.52±4.6226.74±3.211.48±0.2345.23±3.81∗20.52±3.43∗2.26±0.47∗微波组(n=28)38.33±4.3425.25±2.451.53±0.2242.35±5.22∗22.81±2.54∗1.87±0.33∗t值0.0881.786-1.1442.266-4.8213.478P值0.9290.0810.2580.028<0.001<0.001
注:*:与同组消融前日比较,P<0.001
3 讨论
既往研究[5]表明,微波消融与氩氦刀冷冻消融治疗HCC疗效近似。本研究微波组消融后1个月ORR为85.71%(24/28),2例病灶达PD;冷冻组消融后1个月ORR[87.50%(21/24)]与微波组差异无统计学意义,但1例出现肝外转移。氩氦刀冷冻消融能形成更大消融范围,CT显示冰球边界清楚,可有效减少病灶残留。对于靠近血管、肝门等重要脏器的HCC进行消融治疗时,首选冷冻消融可有效避免“热池效应”,更彻底地消融肿瘤[6]。
消融过程中,抗原提呈细胞加工和呈递肿瘤组织坏死释放的抗原,可增强或诱导抗肿瘤T细胞反应[7]。微波消融靶组织损伤机制为组织蛋白质变性、破坏细胞器、影响DNA及RNA合成和破坏肿瘤微血管,加速肿瘤凝固坏死[8];坏死的肿瘤细胞虽丧失活力,但仍保留抗原而形成瘤苗,可诱导T细胞增殖、分化,增强机体细胞免疫反应,即微波消融用于治疗HCC具有免疫原性抗肿瘤作用[9];且微波消融后中性粒细胞、单核细胞和NK细胞增加,能诱导先天免疫反应,减少免疫抑制淋巴细胞,使其后3~14天成为免疫治疗HCC的窗口期[10]。
氩氦刀冷冻消融能增强体液及细胞免疫反应。冷冻消融对肿瘤靶组织的损伤机制[8]包括细胞内外冰晶形成、细胞脱水、皱缩、细胞膜脂蛋白成分变性、微血管破坏及微血栓形成,组织细胞重复冻融导致细胞破裂、细胞膜溶解,使细胞内部分泌隐蔽抗原并在消融后仍留于体内;同时,坏死的肿瘤组织释放损伤相关模式分子(damage associated molecular pattern molecule, DAMP),通过树突状细胞(dendritic cell, DC)激活各种免疫刺激途径并吞噬DAMP,称为体内DC疫苗[10]。消融治疗可诱导荷瘤小鼠产生以CD8+T淋巴细胞浸润为主的抗肿瘤免疫[11];冷冻消融产生的DC在体内作用较弱,而在体外显示出较强的抗肿瘤免疫作用[12]。
本研究结果显示,消融后4周,2组患者外周血CD4+T淋巴细胞占比及CD4+/CD8+较消融前日明显增高,而CD8+T淋巴细胞占比明显降低,证实CT引导下微波及冷冻消融治疗pHCC均可调节机体免疫功能,但冷冻组免疫功能指标高于微波组。动物实验研究[13]结果亦显示,冷冻消融增强机体免疫力效果优于微波消融,可能与2种消融方式的原理不同有关。在冷冻消融区外周带,低温致细胞损伤并延迟凋亡,凋亡细胞尚未被完全吞噬时释放隐蔽抗原,对于机体的免疫刺激更为强烈;同时,冷冻消融后瘤体裂解物能为DC提供足够的肿瘤抗原,增强DC抗原提呈能力,进一步激活CD8+T淋巴细胞[14];肿瘤原位坏死诱导热休克蛋白70(heat shock proteins 70, HSP70)释放上调,缓解免疫抑制,激活强烈的全身抗肿瘤免疫反应[15]。而HSP70主要存在于消融区边缘,热消融并不能使之释放,故冷冻消融对增强机体免疫反应具有优势。
综上所述,氩氦刀冷冻消融与微波消融治疗pHCC近期疗效确切且相当,均有助于增强患者免疫功能,且前者提高免疫功能效果更佳。但本研究样本量少、随访时间短,有待积累病例进行前瞻性研究深入观察。